一种检测人类CYP2C19基因多态性的方法及试剂盒与流程
本发明涉及一种基因多态性检测方法,尤其是一种检测人类cyp2c19基因多态性的方法及试剂盒。
背景技术:
1.cyp2c19基因简介
细胞色素p450酶系(cytochomep450,cyp450)是一组结构和功能相关的超家族基因编码的同工酶家族,是一组含亚铁血红素的酶。主要参与药物i的相关代谢,80%药物代谢与之有关。其中cyp2是最大的家族,有15个亚家族(cyp2a-2q),大约20%的临床代谢药物经其代谢,cyp2c19是cyp2家族中最重要的药物代谢酶之一,许多内源性底物,以及临床上大约2%的药物都由其催化代谢。
cyp2c19基因定位于人10号染色体q24.1-q24.3区带上,其全部顺序包含9个外显子,编码490个氨基酸。cyp2c19酶又称为s-美芬妥英羟化酶,现已发现其至少存在14种突变基因,28种等位基因型。其中编码正常酶活性的基因是cyp2c19*1,cyp2c19等位基因主要是*1,*2,*3......*17。而cyp2c19*2和cyp2c19*3等位基因占东方人弱代谢表型(pm)的99%以上。*2,*3等位基因编码的酶无活性,cyp2c19*2等位基因变异的外显子5第681位处的碱基发生变异(g/a)形成了一个异常剪接点,使得cyp2c19酶丧失了催化活性,由此导致的慢代谢在中国人中的发生率约为30%。cyp2c19*3等位基因是在外显子4第636位发生g/a突变,产生了提前的终止密码,蛋白合成终止,使cyp2c19酶活性丧失。
研究表明,cyp2c19*2和cyp2c19*3两种突变可解释99%的东方人弱代谢者及88%的白种人弱代谢者的表型。经cyp2c19代谢的药物主要包括以下几类:质子泵抑制剂、抗癫痫、镇静药及抗抑郁药、抗凝药等。因此当cyp2c19成为以上药物的主要代谢酶时,不用基因型个体的药动学参数将受到不同的影响。一般情况,快代谢型代谢药物比较快。不易产生不良反应,而慢代谢型代谢药物缓慢,容易导致不良反应的产生。因此对于快代谢患者应适量的加大药量以达到有效血药浓度,而对于慢代谢患者来说应适当的减少药量以防止药物的不良反应。
因此,需要通过检测cyp2c19基因多态性对相关药物血药浓度的影响合理调整药物的剂量,从而使临床上相关药物的应用真正走向个体化,以提高临床疗效,减少不良反应。
2.cyp2c19基因多态性检测方法简介
目前对于检测snp突变检测的方法很多,主要运用的方法包括:直接测序法、arms-pcr法、酶切(pcr-rlfr)法、dna芯片法、taqman-mgb探针分型法等。
这些方法在推广上都或多或少存在如试剂检测成本高,操作复杂,易产生污染,产生一定假阴性和假阳性等缺陷。
如:1)直接测序法,该检测方法需要对欲检测片段进行pcr扩增,然后用dna测序仪测序,是snp检测的金标准。纯合型snp位点的测序峰为单一峰型,而杂合型snp位点的测序峰为套峰,因而很容易将其区分开来。缺点是反应过程需要开盖处理产物,容易造成气溶胶污染,且整个反应流程耗时,并不经济。
2)arms-pcr法,等位基因特异性扩增法,也称扩增阻碍突变系统,用于对已知突变基因进行检测。该法通过设计两个5’端引物,一个与正常dna互补,一个与突变dna互补,对于纯合性突变,分别加入这两种引物及3’端引物进行两个平行pcr,只有突变dna完互补的引物才可延伸并得到pcr扩增产物,由于错配位于引物的3`端则导致pcr不能延伸,则称为arms。该方法通过采用pcr反应结束后进行电泳,从有无放映条带来判断结果,这种方法虽然不需要昂贵的仪器,但电泳操作,增加了pcr污染的机会,而且耗时费力。
3)酶切(pcr-rlfr)法,利用限制性内切酶的酶切位点的特异性,用两种或两种以上的限制性内切酶作用于同一经过pcr扩增富集的dna片断,如果存在snp位点,酶切片断的长度和数量则会出现差异,根据电泳的结果就可以判断是否snp位点。但该技术应用限制性因素是snp的位点必须含有该限制内切酶的识别位点,且方法也较为繁琐。
4)基因芯片杂交法,目前市面上已有通过cfda认证的成型的检测试剂盒,上海百傲生物科技股份有限公司的“cyp2c19基因型检测试剂盒(dna微阵列芯片法)”,该试剂盒采用pcr-基因芯片杂交法进行检测,经聚合酶链式反应(pcr)技术扩增相应的cyp2c19基因片段,并与芯片上特异性核酸探针杂交,以区分确定cyp2c19的基因型。该检测方法,仍然存在操作复杂,开管操作,易造成污染的问题,另外杂交芯片制作复杂,需要载玻片等耗材,大大提高了检测成本。整个检测周期需要3-4个小时,效率不高。
5)pcr-taqmanmgb探针分型法,因其操作简单,分型准确,全程闭管操作,检测周期短等特点,是目前比较主流的snp分型方法。目前市面上也已有通过cfda认证的成型检测试剂盒,如武汉友芝友生物科技有限公司的“人类cyp2c19基因多态性检测试剂盒(pcr-荧光探针法)”,然而其需要两条taqman-mgb探针,而mgb探针的合成价格是普通taqman探针的几倍,大大增加了检测成本,且mgb探针是属于美国life公司专利技术,会在原材料上受到较多限制。
因此,如何解决检测cyp2c19基因多态性过程中存在的问题,推行一种简单易行,物美价廉,没有特殊昂贵仪器限制的检测方法,成为亟待解决的问题。
技术实现要素:
鉴于此,本发明提供一种新的检测人类cyp2c19基因多态性的方法及试剂盒,以解决以往检测技术和成品检测试剂盒存在的检测仪器价格高,操作复杂,易污染,检测成本高,临床应用推广难等问题。
本发明为解决上述技术问题,提供的一种全新的检测方法技术方案,新的检测技术方法设计包括如下步骤:
(1)根据cyp2c19基因目的snp位点,对应等位基因,分别设计arms引物,所述arms引物的3’末端为突变位点,并将位于突变位点上游第1-3位核苷酸中的任一位错义突变;
(2)所述针对每个snp设计等位基因arms引物后,分别在两个特异性的arms引物的5’端引入一段与人类基因序列无同源的人工核苷酸序列,形成含有一段通用序列标签的snp位点特异性arms引物序列;针对一个snp位点的两个等位基因特异性arms引物,5’端引入的序列标签是不同的,特异性的;
(3)根据所述引入的通用人工序列,设计一条与通用序列中间片段序列完全互补配对的taqman探针,特异性识别arms引物扩增的特异性片段。所述taqman探针,对应不同等位基因位点的特异性片段,分别被标记了不同的荧光发光基团,如一条taqman探针5’端被标记fam基团,3’端标记对应猝灭基团bhq1,则另一条探针则5’端被标记hex基团,3’端被探针对应猝灭基团bhq1。
(4)提取样本dna,利用步骤2中设计的引物对和步骤3中设计的探针进行荧光定量pcr扩增,根据荧光信号判定检测位点基因型。
优选的,所述步骤(1)中,针对cyp2c19基因c.681位点gg等位基因型设计的arms引物为倒数第二位进行错义突变,针对cyp2c19基因c.681位点aa等位基因型设计的arms引物为倒数第三位进行错义突变;针对cyp2c19基因c.636位点gg等位基因型设计的arms引物为倒数第三位进行错义突变,针对cyp2c19基因c.636位点aa等位基因型设计的arms引物为倒数第二位进行错义突变。
优选的,所述步骤(2)中,针对cyp2c19基因c.681位点gg等位基因型设计的arms引物引入通用序列后形成的通用-特异嵌合引物的序列如seqno.1所示;针对cyp2c19基因c.681位点aa等位基因型设计的arms引物引入通用序列后形成的通用-特异嵌合引物的序列如seqno.2所示;针对cyp2c19基因c.636位点gg等位基因型设计的arms引物引入通用序列后的序列如seqno.3所示;针对cyp2c19基因c.636位点aa等位基因型设计的arms引物引入通用序列后的序列如seqno.4所示。
更进一步的优选,c.681位点野生型扩增arms引物seqno.1和c.636位点野生型扩增arms引物seqno.3,所引物的通用序列是完全一样的,序列如seqno.5所示;c.681位点突变型扩增arms引物seqno.2和c.636位点突变型扩增arms引物seqno.4,所引物的通用序列是完全一样的,序列如seqno.6所示;
优选的,所述步骤(3)中,设计的特异性识别c.681位点gg等位基因型扩增片段的taqman探针序列和特异性识别c.636位点gg等位基因型扩增片段的taqman探针序列完全一致,都如seqno.7所示;设计的特异性识别c.681位点aa等位基因型扩增片段的taqman探针序列和特异性识别c.636位点aa等位基因型扩增片段的taqman探针序列完全一致如seqno.8所示。
更进一步的优选,taqman探针seqno.7,5’端被标记了fam荧光素,3’端被标记了bhq1猝灭基团;taqman探针seqno.8,5’端被标记了hex荧光素,3’端被标记了bhq1猝灭基团。
更进一步的优选,上述两条特异性探针,属于和通用序列中间片段完全互补配对的通用检测探针,可适用于其他任何想利用此方法的snp位点的检测,探针为普通taqman探针。
本发明的为解决上述技术问题提出的另一种技术方案是提供一种基于上述方法的人类cyp2c19基因多态性检测试剂盒。
所述试剂盒包括pcr扩增反应液,c.681位点扩增引物探针混合液,c.636位点扩增引物探针混合液,阳性对照液,阴性对照液。
所述pcr扩增反应液包括pcr缓冲液、dntps、hotstarttaqdna聚合酶。
所述c.681位点扩增引物探针混合液包括c.681位点野生型(g)的特异性上游引物如seqno.1所示和针对突变型的(a)特异性上游arms引物如seqno.2所示,以及c.681位点野生型(g)的特异性上游引物和突变型的(a)特异性上游引物共用的下游引物如seqno.9所示;针对c.681位点gg等位基因型扩增片段的taqman探针序列如seqno.5所示,针对c.681位点aa等位基因型扩增片段的taqman探针序列如seqno.6所示。
所述c.636位点扩增引物探针混合液包括c.636位点野生型(g)的特异性上游引物如seqno.3所示和针对突变型的(a)特异性上游arms引物如seqno.4所示,以及c.636位点野生型(g)的特异性上游引物和突变型的(a)特异性上游引物共用的下游引物如seqno.10所示;针对c.636位点gg等位基因型扩增片段的taqman探针序列如seqno.5所示,针对c.636位点aa等位基因型扩增片段的taqman探针序列如seqno.6所示。
上述引物探针序列如下表1:
上述技术方案的进一步优选,c.681位点野生型(g)的特异性上游引物seqno.1终浓度与针对突变型的(a)特异性上游arms引物seqno.2终浓度,以及c.681位点野生型(g)的特异性上游引物和突变型的(a)特异性上游引物共用的下游引物seqno.7终浓度以及c.681位点gg等位基因型扩增片段的taqman探针seqno.5终浓度与c.681位点aa等位基因型扩增片段的taqman探针序列seqno.6终浓度比值2∶2∶4∶1∶1。
上述技术方案中的进一步优选,所述c.636位点的对应引物和探针终浓度比值与c.681一致。
上述试剂盒中阳性对照液是含所述c.681g>a位点野生型质粒和突变型质粒及所述c.636g>a位点野生型质粒和突变型质粒混合液。
上述阴性对照液为纯水。
上述技术方案的一种优选为,所述人类cyp2c19基因多态性的检测试剂盒的组成成分和浓度如表2所示:
本发明的有益效果在于:
(1)本发明提供的一种新的检测人类cyp2c19基因多态性的方法和试剂盒,相比传统的taqman-mgb探针法检测snp位点,此发明将arms法与taqman探针有机结合进行检测,利用arms引物进行等位基因的特异性区分扩增,能够大大增加等位基因特异性引物区分不同等位基因的能力;同时针对同一检测位点的两个特异arms引物5’端分别引入一段人工核苷酸序列,作为taqman探针的特异性识别的位点。因此针对不同的snp位点分型检测,两条taqman探针都可以随意引入,可作为snp分型检测通用探针,同时用普通taqman探针相比taqman-mgb探针,大大降低了snp分型的研发和检测成本。
(2)本发明的一种新的检测人类cyp2c19基因多态性的方法和试剂盒,克服了现有的检测技术中,繁琐操作,费时,及成本问题,只需传统的荧光染料,不涉及任何高成本检测试剂,大大节省了成本,提高了效率。
(3)本发明的一种新的检测人类cyp2c19基因多态性的方法和试剂盒,全程闭管进行,减少了污染产生的可能性,同时引入了完善的质控系统,保证检测结果的准确性。
(4)本发明的一种新的检测人类cyp2c19基因多态性的方法和试剂盒研发简单,操作方便,使用条件低廉,适用于大规模的临床推广应用。
本发明的这些目的,特点,和优点将会在下面的具体实施方式,附图,和权利要求中详细的揭露。
附图说明
图1为根据本发明实施例的新的检测人类cyp2c19基因多态性方法的检测原理图
图2为样本1c.681位点检测结果(野生型)。
图3为样本1c.636位点检测结果(纯合突变型)。
图4为样本2c.681位点检测结果(纯合突变型)。
图5为样本2c.636位点检测结果(野生型)。
图6为样本3c.681位点检测结果(杂合突变型)。
图7为样本3c.636位点检测结果(杂合突变型)。
具体实施方式
下面通过实施例对本发明进行具体的描述,有必要在此指出的是以下实施例只用于对本发明进行进一步说明,不能理解为对本发明保护范围的限制,该领域的技术人员可以根据上述本发明内容对本发明作出一些非本质的改进和调整。文中未注明具体条件的方法,通常按照常规条件如j.萨姆布鲁克等编著的科学出版社2002年版的《分子克隆实验指南》一书中所述的条件,或者制造商所建议的条件。除非另行定义,文中所使用的所有专业与科学用于与本技术领域技术人员所熟悉的意义相同。此外,任何与所记载内容相似或均等的方法及材料皆可以应用于本发明中。
实施例1
本实施例的用于检测人类apoe基因多态性的试剂盒的具体检测步骤如下:
1、dna提取。
采用血样dna提取试剂盒提取样本1,2,3(样本1,2,3全是edta抗凝全血),具体的操作参见dna试剂盒抽提产品说明书。
2、样本dna质量检测。
获得样本dna后,通过测定浓度和od260/od280的比值控制样本质量,最终加入反应体系中的样本,od260/od280的比值在1.7~2.0之间的可获得最优反应结果,浓度为5~20ng/μl较为合适。
3、pcr反应。
1)配制20μlpcr反应体系:
计算针对c.681位点检测所需pcr反应管数(pcr反应管数=样本数+阳性对照+阴性对照),即检测3个样本的c.681位点,需要5个pcr反应管。
分别取5个荧光pcr管,向其中分别都加入10μl的pcr扩增反应液、2μl的c.681位点扩增引物探针混合液和6μl的pcr级纯水,每个管18μl;分别取2μl待测样本dna,3阳性对照液2μl,阴性对照液2μl,加入到对应pcr管中,盖好pcr管盖,根据所加模板进行标记。
同样的方法,配制c.636位点检测所需的5管检测反应液,盖好pcr管盖,根据所加模板进行标记。
2)进行pcr反应
pcr扩增程序如表3所示。
以上pcr反应在宏石slan-48p荧光定量pcr仪上进行。
4、结果分析和判读。
1、试剂盒有效性判定:
1)阳性对照:fam、vic通道ct值≤32,扩增曲线有明显指数增长期。
2)阴性对照:fam、vic通道无扩增曲线,或者扩增曲线为直线或轻微斜线,无明显指数增长期,无ct值或ct值≥38。
2、样本位点基因型的判定
根据1判定检测结果有效后,对样品检测管的结果进行判定,根据公式“δct值=famct值-hex值”计算有效检测样本的δct值,并按照以下步骤和表5对样本检测结果进行判读,确定样本的基因型。
表5:结果判定
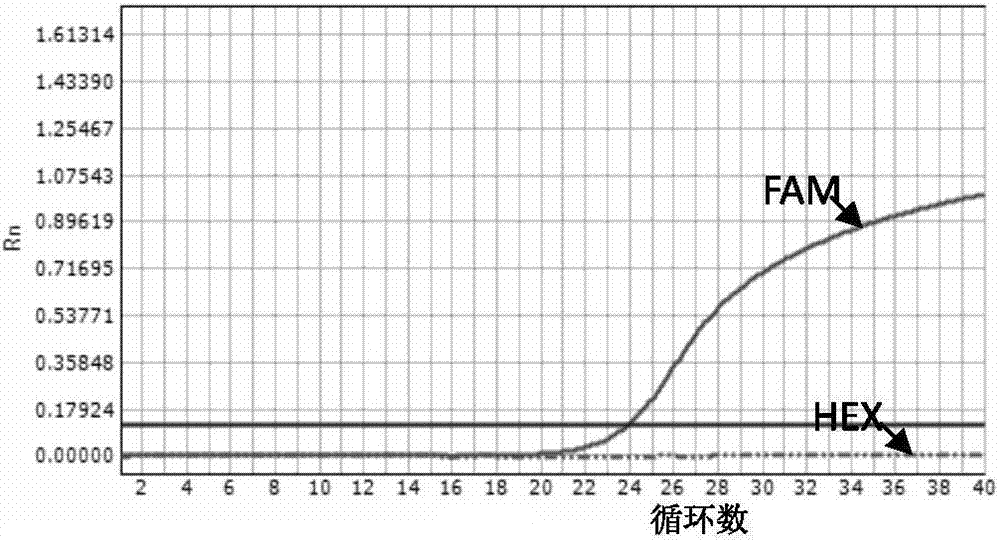
样本1cyp2c19基因c.681位点检测结果见图2(681位点野生型),cyp2c19基因c.636位点检测结果见图3(636位点纯合突变型),根据判定标准,样本1cyp2c19基因属于*3/*3型。
样本2cyp2c19基因c.681位点检测结果见图4(681位点纯合突变型),cyp2c19基因c.636位点检测结果见图5(636位点野生型);根据判定标准,样本2cyp2c19基因属于*2/*2型。
样本3cyp2c19基因c.681位点检测结果见图6(681位点杂合突变型),cyp2c19基因c.636位点检测结果见图7(636位点杂合突变型),根据判定标准,样本3cyp2c19基因属于*2/*3型。
显然,上述实施例仅仅是为清楚地说明本发明所作的举例,而并非是对本发明的实施方式的限定。对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其它不同形式的变化或变动。这里无需也无法对所有的实施方式予以穷举。而这些属于本发明的精神所引伸出的显而易见的变化或变动仍处于本发明的保护范围之中。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种基于HRM检测基因多态性的引物组合物的应用的制作方法与工艺
- MDR1基因多态性检测体系及其试剂盒的制作方法与工艺
- GSTP1基因多态性检测体系及其试剂盒的制作方法与工艺
- 一种检测MTHFR基因rs1801131多态位点基因型的方法及试剂盒与流程
- 检测10个位点耳聋基因多态性的SNaPshot试剂盒的制造方法与工艺
- 一种检测人类CYP2C19基因多态性的方法及试剂盒与流程
- CDA基因多态性检测体系及其试剂盒的制造方法与工艺
- 检测22个位点耳聋基因多态性的SNaPshot试剂的应用的制造方法与工艺
- 检测22个位点耳聋基因多态性的SNaPshot试剂盒的制造方法与工艺
- DHFR基因多态性检测体系及其试剂盒的制造方法与工艺
- ERCC1基因多态性检测体系及其试剂盒的制造方法与工艺
- 用于检测CYP2C19基因多态性的引物、探针及检测试剂盒的制造方法与工艺
- 高脂血症风险关联基因多态性检测方法与制造工艺
- 用于检测AGTR1基因的A1166C多态性位点的核酸、试剂盒及方法与制造工艺
- 一种检测与结直肠癌靶向用药西妥昔单抗治疗敏感性相关基因的多态性的试剂盒及其应用的制造方法与工艺
- 线粒体基因组9bp序列基因多态性在评价苯中毒风险中的应用的制造方法与工艺
- 一种rs12979860基因分型双色荧光PCR快速检测试剂盒的制造方法与工艺
- CYP2C19基因多态性检测引物、探针及试剂盒的制造方法与工艺
- 检测CYP2C9和VKORC1基因多态性的引物、探针和试剂盒的制造方法与工艺
- 一种检测CYP2C9基因多态性的ARMS引物的制造方法与工艺
- HaeIII检测食管癌易感基因PTEN多态性方法与流程
- 用于检测人类ADRB1基因 G1165C多态性的核酸、试剂盒及方法与流程
- 一种用于检测CYP2C9和VKORC1基因多态性的组合物及其应用的制作方法与工艺
- 一种用于检测CYP2C19基因多态性的组合物及其应用的制作方法与工艺
- 一种CYP2C19基因多态性检测试剂盒及检测方法与流程
- ERCC1基因突变检测特异性引物和液相芯片试剂盒的制作方法与工艺
- 一种IL28B基因多态性检测试剂盒的制造方法与工艺
- 检测10个位点耳聋基因多态性的SNaPshot试剂盒的制造方法与工艺
- 一种检测人类CYP2C19基因多态性的方法及试剂盒与流程
- 检测22个位点耳聋基因多态性的SNaPshot试剂的应用的制造方法与工艺