大肠杆菌O111和大肠杆菌O157的检测引物组、试剂盒及双重PCR检测方法与流程
本发明属于食品安全领域,涉及双重PCR技术,具体涉及大肠杆菌O111和大肠杆菌O157检测用引物组、试剂盒及检测方法。
背景技术:
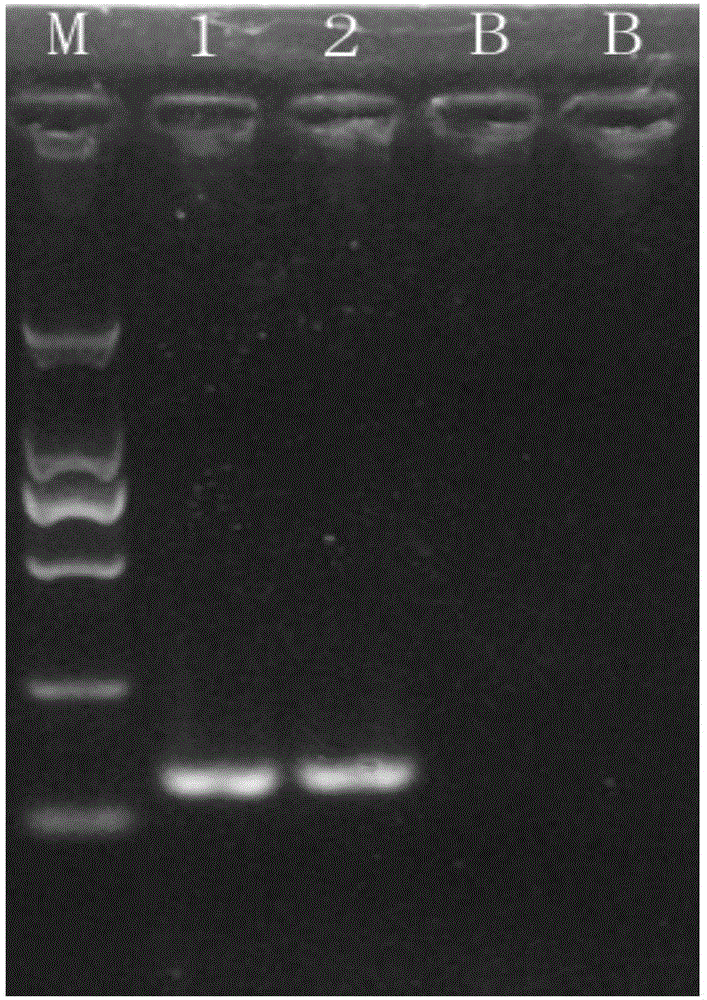
:大肠杆菌(Escherichiacoli)是一种在人和温血动物肠道内常见的细菌。大多数大肠杆菌菌株无害。然而,有些大肠杆菌可引起食源性疾病。大肠杆菌的抗原成分复杂,可分为菌体抗原(O)、鞭毛抗原(H)和表面抗原(K),根据菌体抗原的不同,可将大肠杆菌分为二百多个型,其中有些血清型有致病性,可引起腹泻,统称为致泻性大肠杆菌。根据生物学特性的不同可将致泻性大肠杆菌分为5大类:肠致病性大肠杆菌、肠产毒素性大肠杆菌、肠侵袭性大肠杆菌、肠粘附性大肠杆菌和肠出血性大肠杆菌(EHEC)。肠出血性大肠杆菌可产生志贺样毒素因而也被称产志贺毒素大肠杆菌为(STEC)。肠出血性大肠杆菌曾在多个国家暴发流行,成为了全球性的公共卫生问题。肠出血性大肠杆菌感染主要导致腹泻,可引起严重的食源性疾病,它主要通过食用被污染的食品传染给人类,如生的或未煮熟的碎肉制品、生鲜奶和被污染的生蔬菜和芽苗菜。大肠杆菌O157:H7是与公共卫生有关的最重要的肠出血性大肠杆菌的血清类型;另外大肠杆菌O111血清型也是较常见的肠出血性大肠杆菌血清型之一,不常见的的肠出血性大肠杆菌血清型有大约40种。大肠杆菌O111和大肠杆菌O157的传统检验方法与其它病原微生物的检测一样需要在微生物增殖、生化鉴定的基础上进行血清学鉴定,虽然可靠、但却很耗时、费力,需要4~7天才能完成,因此,在需要及时、快速评价食品中微生物的安全性时,通常不被采用。因此非常有必要建立一种快速、敏感的、能同时检测大肠杆菌O111和大肠杆菌O157的方法。技术实现要素:本发明的目的在于提供一种大肠杆菌O111和大肠杆菌O157的检测引物组、试剂盒及双重PCR检测方法。本发明所采取的技术方案是:大肠杆菌O111和大肠杆菌O157的双重PCR检测引物组,其中,用于检测大肠杆菌O111的引物对的核苷酸序列如下所示:F1:3’-TTAGTTTGTTTGATAGGCTC-5’(SEQIDNO.1);R1:3’-AAAAAGAATAACGCAAGACA-5’(SEQIDNO.2)。用于检测大肠杆菌O157的引物对的核苷酸序列如下所示:F2:3’-CCCAGCCTATCGAATGAGCA-5’(SEQIDNO.3);R2:3’-CACCGCCCCACTCGTAAAA-5’(SEQIDNO.4)。大肠杆菌O111和大肠杆菌O157的双重PCR检测试剂盒,其包括上述的引物组。大肠杆菌O111和大肠杆菌O157的双重PCR检测方法,包括以下步骤:(1)提取待检样品DNA;(2)利用上述的引物组进行双重PCR扩增反应;(3)根据PCR产品判断待检样品中是否含有大肠杆菌O111和/或大肠杆菌O157。双重PCR扩增反应体系的组成如下:双重PCR扩增反应的程序为:94℃预变性5min;94℃变性20s,60℃退火1min,45个循环;4℃保存产物。本发明的有益效果是:本发明的检测方法具有特异性强、灵敏度高、检测快速可靠、操作简便的优点,为大肠杆菌O111和大肠杆菌O157的同步检测提供了一种有效的手段。附图说明图1-图3为实施例一大肠杆菌O111和大肠杆菌O157双重PCR的扩增结果电泳图;图4为实施例二大肠杆菌O111和大肠杆菌O157双重PCR的特异性实验结果电泳图;图5为实施例三大肠杆菌O111灵敏度实验结果电泳图;图6为实施例三大肠杆菌O157灵敏度实验结果电泳图。具体实施方式下面结合实施例对本发明作进一步的说明,但并不局限于此。以下实施例中所采用的分子生物学实验技术包括PCR扩增、质粒提取、质粒转化、DNA片段连接、酶切、凝胶电泳等,如无特殊说明,通常按照常规方法操作,具体可参见《分子克隆实验指南》(第三版)(SambrookJ,RussellDW,JanssenK,ArgentineJ.黄培堂等译,2002,北京:科学出版社),或按照制造厂商所建议的条件。实施例1大肠杆菌O111和大肠杆菌O157的双重PCR检测方法的建立1、引物设计设计用于检测大肠杆菌O111和大肠杆菌O157的特异性引物对,其中,用于检测大肠杆菌O111的引物对的核苷酸序列如下所示:F1:3’-TTAGTTTGTTTGATAGGCTC-5’(SEQIDNO.1);R1:3’-AAAAAGAATAACGCAAGACA-5’(SEQIDNO.2)。用于检测大肠杆菌O157的引物对的核苷酸序列如下所示:F2:3’-CCCAGCCTATCGAATGAGCA-5’(SEQIDNO.3);R2:3’-CACCGCCCCACTCGTAAAA-5’(SEQIDNO.4)。2、双重PCR扩增反应(1)提取待检样品DNA;(2)双重PCR扩增反应体系及程序:配置总体积为50μL的双重PCR的反应体系,具体组成如表1所示:表1组分工作液浓度加样量(μL)F110μmol/L2R110μmol/L2F210μmol/L2R210μmol/L2dNTPs10mmol/L2PCR缓冲液10×5Taq聚合酶5U/μL1待检模板DNA/2去离子水/32反应程序:将双重PCR反应体系置于PCR仪中按下述反应条件进行双重PCR反应:反应条件:94℃预变性5min;94℃变性20s,60℃退火1min,45个循环;4℃保存产物。3、扩增产物凝胶电泳4、结果判断:肠杆菌O111和大肠杆菌O157扩增产物长度分别为238bp、139bp,根据扩增产物电泳有无预期大小的条带,判断PCR扩增结果。扩增产物电泳出现238bp的条带则可判定该样品为大肠杆菌O111阳性;扩增产物电泳出现139bp的条带可判定样品大肠杆菌O157结果阳性;扩增产物电泳出现238bp和139bp的两条条带可判定样品大肠杆菌O111和大肠杆菌O157均为阳性;否则可判定样品大肠杆菌O111和大肠杆菌O157为阴性。选择上述引物组进行双重PCR检测,以大肠杆菌O111和大肠杆菌O157的标准DNA溶液代替待检模板DNA,以去离子水代替待检模板DNA作为阴性对照,另外进行上述步骤;双重PCR检测结果见图1-图3。图1中M为DNAMarkerDL2000,B对应去离子水代替待检模板DNA作为阴性对照,1和2对应大肠杆菌ATCC43887的标准DNA溶液代替待检模板DNA。图2中M为DNAMarkerDL2000,B对应去离子水代替待检模板DNA作为阴性对照,1和2对应大肠杆菌ATCC35150的标准DNA溶液代替待检模板DNA。图3中M为DNAMarkerDL2000,B对应去离子水代替待检模板DNA作为阴性对照,1对应大肠杆菌ATCC43887的标准DNA溶液代替待检模板DNA,2对应大肠杆菌ATCC35150的标准DNA溶液代替待检模板DNA。3对应大肠杆菌ATCC43887的标准DNA溶液和大肠杆菌ATCC35150的标准DNA溶液各1μL代替待检模板DNA。实施例2特异性实验在本实例中,主要对实施例一提供的引物组进行特异性实验,具体步骤为:用表2中的大肠杆菌菌株的DNA分别取代待检模板DNA,以去离子水作为阴性对照。表2实验结果为:上表中三株大肠杆菌O111菌株和七株大肠杆菌O157菌株分别扩增出长度分别为238bp、139bp的产物片段,与阳性对照和预期结果完全一致,其它菌株均无非特异性扩增为阴性,部分菌株的扩增电泳图见图4。图4中M为DNAMarkerDL2000,B对应去离子水代替待检模板DNA作为阴性对照,1对应大肠杆菌ATCC43887的标准DNA溶液和大肠杆菌ATCC35150的标准DNA溶液各1μL代替待检模板DNA,2对应大肠杆菌ATCC43887的标准DNA溶液代替待检模板DNA,3对应大肠杆菌ATCC29552的标准DNA溶液代替待检模板DNA,4对应大肠杆菌ATCC33780的标准DNA溶液代替待检模板DNA,5对应大肠杆菌ATCC35150的标准DNA溶液代替待检模板DNA,6对应大肠杆菌CCTCCAB200051的标准DNA溶液代替待检模板DNA,7对应大肠杆菌EHECStx1的标准DNA溶液代替待检模板DNA,8对应大肠杆菌EHECStx2的标准DNA溶液代替待检模板DNA,9对应大肠杆菌NCTC12900的标准DNA溶液代替待检模板DNA,10对应大肠杆菌ECO-13-01的标准DNA溶液代替待检模板DNA,11对应大肠杆菌ECO-14-01的标准DNA溶液代替待检模板DNA,12对应大肠杆菌ATCC12795的标准DNA溶液代替待检模板DNA,13对应大肠杆菌ATCCBAA-2469的标准DNA溶液代替待检模板DNA,;14对应大肠杆菌ATCC23982的标准DNA溶液代替待检模板DNA,15对应大肠杆菌ECO104的标准DNA溶液代替待检模板DNA,16对应大肠杆菌ATCCBAA-2190的标准DNA溶液代替待检模板DNA,17对应大肠杆菌ATCCBAA-2216的标准DNA溶液代替待检模板DNA,18对应大肠杆菌ECO4的标准DNA溶液代替待检模板DNA,19对应大肠杆菌ETECO8的标准DNA溶液代替待检模板DNA,20对应大肠杆菌的标准DNA溶液代替待检模板DNA,21对应大肠杆菌ETECO78的标准DNA溶液代替待检模板DNA。由图可见,上述引物组对大肠杆菌O111和大肠杆菌O157具有特异性,因此,上述引物组的特异性强,因此,在此前提下,本发明提供的检测方法非常可靠。实施例3灵敏度实验在本实例主要对实施例一提供的引物组进行灵敏度实验,具体步骤为:将大肠杆菌ATCC43887的标准DNA溶液2μL,使用核酸蛋白分析仪测量获得DNA溶液浓度为35ng/μL。溶液用去离子水10倍递增分别稀释至浓度3.5ng/μL、350pg/μL、35pg/μL、3.5pg/μL、0.35pg/μL、0.035pg/μL、0.0035pg/μL,均取代待检模板DNA另外操作实施例一中所述的步骤2。实验结果见图5,在图中M为DNAMarkerDL2000,图中1到9依次分别对应浓度为35ng/μL、3.5ng/μL、350pg/μL、35pg/μL、3.5pg/μL、0.35pg/μL、0.035pg/μL、0.0035pg/μL、0.00035pg/μL的大肠杆菌ATCC43887的标准DNA溶液的扩增曲线,因此,可判断该双重PCR检测大肠杆菌O111灵敏度高,其检测灵敏度可达0.7pg/反应,大肠杆菌基因组大小为0.004pg,灵敏度折算成拷贝数即为175拷贝/反应。将大肠杆菌ATCC35150的标准DNA溶液2μL,使用核酸蛋白分析仪测量获得DNA溶液浓度为30ng/μL;溶液用去离子水10倍递增分别稀释至3ng/μL、300pg/μL、30pg/μL、3pg/μL、0.3pg/μL、0.03pg/μL、0.003pg/μL和0.0003pg/μL,均取代待检模板DNA另外操作实施例一中所述的步骤2。实验结果见图5,在图中M为DNAMarkerDL2000,图中1到9依次分别对应浓度为30ng/μL、3ng/μL、300pg/μL、30pg/μL、3pg/μL、0.3pg/μL、0.03pg/μL、0.003pg/μL和0.0003pg/μL的标准DNA溶液的扩增曲线;因此,可判断该双重PCR检测大肠杆菌O157灵敏度高,其检测灵敏度可达6pg/反应,大肠杆菌基因组大小为0.004pg,灵敏度折算成拷贝数即为1500拷贝/反应。实施例4食品样品加标试验将新鲜培养的目标菌制成约0.35McF浓度的菌悬液,十倍递增稀释至10-7稀释度,此时样品菌悬液浓度为101CFU/mL的菌悬液用于样品加标试验。按照表3分别无菌取25g食品样品至225mLEC肉汤,分别的将表中对应目标菌株101CFU/mL的菌悬液1mL加至食品样品肉汤制备成高101CFU/25g的加标样品,拍击式均质器均质2min。将上述EC肉汤置36℃增菌24h,分别采用双重普通PCR检测相应大肠杆菌O111和大肠杆菌O157。各浓度添加样品试验结果见表7和表8,由表三可知本方法用于样品检测结果与预期一致,其检测灵敏度可达101CFU/25g。表3食品加标样品多重PCR扩增结果实施例5在本实例主要对实施例一提供的引物组进行样品污染调查,具体步骤为:从市场上采购和收集生猪肉、生牛肉样品共196份,本单位日常受理检验的鲜、冻禽产品43份,鲜、冻水产品46份,可生食蔬菜54份,共计检验339份样品。所有样品均无菌称取25g至225mLEC肉汤,拍击式均质器均质2min,将上述EC肉汤置36℃增菌24h,热裂解法提取核酸,分别采用双重普通PCR法检测,样品检测结果见表4。表4食品样品中大肠杆菌O111和大肠杆菌O157双重PCR检测结果由表4可知,339份食品样品检出大肠杆菌O111共16份,占5.3%,检出5大肠杆菌O157共7份,占2.1%,表明该检测方法可有效应用于食品样品的大肠杆菌O111和大肠杆菌O157的检测。本发明不局限于上述实施例,基于上述实施例的、未做出创造性劳动的简单替换,应当属于本发明揭露的范围。SEQUENCELISTING<110>珠海出入境检验检疫局检验检疫技术中心<120>大肠杆菌O111和大肠杆菌O157的检测引物组、试剂盒及双重PCR检测方法<130><160>4<170>PatentInversion3.5<210>1<211>20<212>DNA<213>人工序列<400>1ttagtttgtttgataggctc20<210>2<211>20<212>DNA<213>人工序列<400>2aaaaagaataacgcaagaca20<210>3<211>20<212>DNA<213>人工序列<400>3cccagcctatcgaatgagca20<210>4<211>19<212>DNA<213>人工序列<400>4caccgccccactcgtaaaa19当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1