iolT1和iolT2蛋白在木糖转运中的应用的制作方法
本发明属于基因工程技术领域,具体涉及肌醇转运蛋白iolt1和iolt2在木糖转运中的新应用的专利申请。
背景技术:
种类繁多的木质纤维素资源年产量巨大,其中包括大量农林加工剩余物,其综合利用既可带来经济效益,又能够减少因焚烧等不当处理引起的环境污染。在木质纤维素原料中木糖组分含量达18~30%,仅次于葡萄糖组分,因此对其进行综合利用可以显著提高原料利用率。
现有对于木质纤维素原料利用方式之一,即是利用微生物发酵技术对其中的木糖或者葡萄糖组分进行发酵生产。其主要技术原理是:在细菌中,木糖经过木糖异构酶(xyloseisomerase,xi)催化形成木酮糖,随后在木酮糖激酶(xylulokinase,xk)的作用下形成木酮糖-5-磷酸,进入戊糖磷酸途径。
谷氨酸棒状杆菌是一种多种氨基酸的生产菌株,其具有鲁棒性强、代谢旺盛以及食品安全等特性。在微生物发酵生产中具有广泛的用途,但就木质纤维素原料利用而已,谷氨酸棒状杆菌自身并不能直接利用木糖,但由于其基因组上存在xk编码基因,因而通过基因工程手段,在谷氨酸棒状杆菌中过表达xi,从而赋予谷氨酸棒状杆菌将木糖转化为木酮糖的能力,进而通过相关代谢途径及的酶的优化表达,获得能够将木糖转化为各种目标产品的细胞工厂。
谷氨酸棒状杆菌发酵利用木糖的过程中,木糖向谷氨酸棒状杆菌细胞内的运输是其被利用的第一步,因而高水平表达糖转运蛋白可以促进谷氨酸棒状杆菌对木糖的吸收。但已有研究表明,谷氨酸棒状杆菌没有专门的木糖转运蛋白,因而推测其对木糖的吸收主要依赖于己糖转运蛋白。
已有报道提出:谷氨酸棒状杆菌中转运葡萄糖的pts系统具有转运木糖的能力,而pts系统在环境中同时存在葡萄糖和木糖的时候,木糖的转运明显会受到葡萄糖转运的竞争性抑制(wang等,investigationofptsggeneinresponsetoxyloseutilizationincorynebacteriumglutamicum,2014,journalofindustrialmicrobiologyandbiotechnology)。因此要实现谷氨酸棒状杆菌同时利用葡萄糖和木糖两种碳源,需要寻找其他能够转运木糖且不受葡萄糖抑制的蛋白。长期以来,研究人员推测认为:在谷氨酸棒状杆菌中,木糖的运输是通过mfs家族的糖/质子同向转运蛋白来完成的。然而,迄今为止该方面的研究并没有取得实质性进展。
其他有关研究中,日本科学家ikeda等(identificationandapplicationofadifferentglucoseuptakesystemthatfunctionsasanalternativetothephosphotransferasesystemincorynebacteriumglutamicum,2011,appliedmicrobiologyandbiotechnology)首次发现:谷氨酸棒状杆菌中肌醇转运蛋白iolt1和iolt2具备葡萄糖转运功能,但其表达需要移码突变失活阻遏蛋白iolr的编码基因。随后,德国科学家lindner等(phosphotransferasesystem-independentglucoseutilizationincorynebacteriumglutamicumbyinositolpermeasesandglucokinases,2011,appliedandenvironmentalmicrobiology)也报道了类似的结果。但是关于肌醇转运蛋白iolt1和iolt2是否具有木糖转运能力,及是否可以提高谷氨酸棒状杆菌对于木质纤维素原料的利用效率,尚缺乏进一步的应用报道。
技术实现要素:
本发明通过谷氨酸棒状杆菌中特定基因敲除和pts系統失活菌株构建,目的在于验证肌醇转运蛋白iolt1和iolt2与木糖转运之间的关系,从而为木质纤维素原料的开发利用奠定理论和应用基础。
本申请的技术方案详述如下。
iolt1和iolt2蛋白在木糖转运中的应用,在谷氨酸棒状杆菌中,肌醇转运蛋白iolt1和iolt2,能够转运肌醇和葡萄糖,同时具有转运木糖的能力;该转运能力与谷氨酸棒状杆菌中的pts系统(ptsg)的木糖转运能力相当,且与pts系统对木糖的转运具有互补的作用,并且其对木糖的转运不受葡萄糖转运的抑制。
一种同步利用木糖和葡萄糖的微生物发酵方法,具体包括如下步骤:
(1)以普通谷氨酸棒状杆菌为菌株基础,对其基因组中的iolr基因进行敲除,获得谷氨酸棒状杆菌的基因敲除菌株δiolr;
所述谷氨酸棒状杆菌,具体例如c.glutamicumatcc13032菌株;
(2)对步骤(1)中基因敲除菌株,导入过表达重组质粒pxmj19-xyla以过表达木糖异构酶xi,从而使基因敲除菌株具有利用木糖的能力;
(3)利用含有木糖和葡萄糖的发酵培养基进行微生物发酵,即可充分利用培养基中木糖底物,从而实现对木质纤维素原料的开发利用。
前期研究基础上,通过蛋白序列比对,发明人发现,iolt1/iolt2和大肠杆菌木糖转运蛋白xyle具有较高同源性。因此,对这两个蛋白是否具有木糖运输能力,发明人进行了进一步的实验研究。
本申请中,通过对δptsg(pts系统失活)、δptsgδiolr(pts系统失活与iolr基因敲除)和δptsgδiolrδiolt1δiolt2(pts系统失活、iolr基因与iolt1和iolt2基因同时敲除)等菌株系统构建,对肌醇转运蛋白iolt1和iolt2与木糖转运间的关系进行了充分研究。研究结果表明,在谷氨酸棒状杆菌中,iolt1和iolt2蛋白具有转运木糖的能力,能够实现葡萄糖和木糖的同步转运和代谢,且ptsg对低浓度木糖转运是必需的。
总体而言,本申请通过基因工程技术手段证明了:谷氨酸棒状杆菌中,肌醇转运蛋白iolt1和iolt2具有转运木糖的功能,该发现将有利于高效利用木糖的谷氨酸棒状杆菌工程菌株的构建,尤其有益于构建同步利用葡萄糖和木糖的工程菌株。具体操作方面,利用基因工程技术,通过敲除缺失谷氨酸棒状杆菌的ptsg,而利用这两个蛋白(iolt1和iolt2)同时转运葡萄糖和木糖,可实现木糖和葡萄糖的同步利用。这将为开发高效利用木质纤维素水解液等原料的基因工程菌株奠定了良好的基础,具有较好的开发利用前景。
附图说明
图1为不同基因缺失谷氨酸棒状杆菌菌株在基本培养基cgxii(木糖为唯一碳源)中的生长曲线;
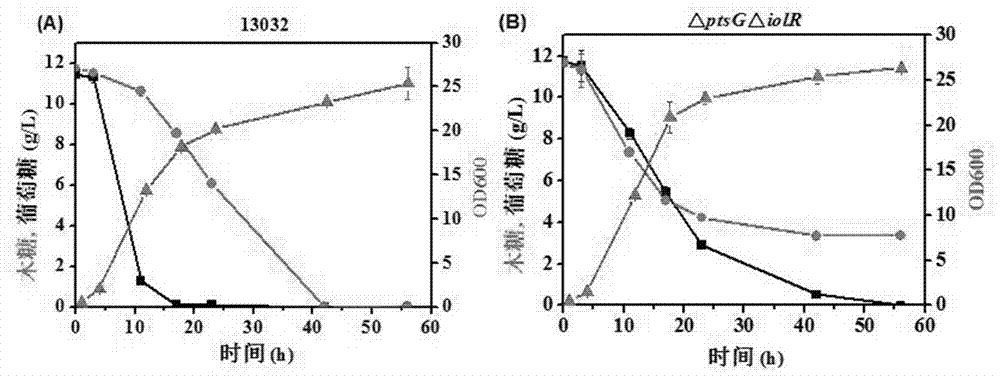
图2为13032(图a)和δptsgδiolr(图b)菌株在基本培养基cgxii(木糖和葡萄糖为碳源)中的葡萄糖和木糖生长和耗糖曲线,图中:▲代表od值,■代表葡萄糖浓度,●代表木糖浓度。
具体实施方式
下面结合实施例对本申请做进一步的解释说明,在介绍具体实施例前,就下述实施例中部分生物材料情况简要介绍如下。
生物材料:
谷氨酸棒状杆菌(c.glutamicum)atcc13032,来源于美国模式菌种收集中心(americantypeculturecollection,atcc);
引物序列合成及相关测序工作,由金唯智公司完成提供。
实施例1
由于相关菌株构建是本发明中最为重要的操作步骤,因而本实施例就谷氨酸棒状杆菌(c.glutamicum)13032/pxt01-xyla菌株(以下简称ptsg/pxt01-xyla,正常菌株转化有pxt01-xyla质粒)、δptsg/pxt01-xyla菌株(ptsg系统失活,且转化有pxt01-xyla质粒)、δptsgδiolr/pxt01-xyla菌株(ptsg系统失活,iolr基因敲除,且转化有pxt01-xyla质粒)、δptsgδiolrδiolt1δiolt2/pxt01-xyla菌株(ptsg系统失活,iolr基因敲除,iolt1和iolt2基因也被敲除,且转化有pxt01-xyla质粒)的构建过程简要介绍如下。
一、ptsg、iolr、iolt1和iolt2基因的敲除
(1)c.glutamicum13032基因组dna的提取,
将单菌落接种于lb摇管中,32℃过夜培养12h后,按2%接种量接入30ml的lb培养基中进行摇瓶培养过夜;ctab法提取,具体提取过程参考如下操作过程:
a、将菌液13000rpm离心2min,去上清液,收集到1.5ml的ep管中;
加600μlph=8.0的tebuffer悬浮菌体,13000rpm离心2min,弃上清液;
b、加600μlte重新悬浮菌体,加入6μl的rnaase(10μg/ml),30μl的溶菌酶(50μg/ml)混匀,37℃保温30min;
加30μl的10%sds和10μl的蛋白酶k,混匀,65℃保温15min;
加入100μl的5mol/lnacl溶液混匀后,再加入80μlctab/nacl溶液,颠倒混匀50次,65℃水浴10min;
c、加入750μl的酚:氯仿:异戊醇(25:24:1)抽提,颠倒混匀50次,13000rpm离心15min;
将上清液吸入新的1.5mlep管中,加入等体积的酚:氯仿:异戊醇(25:24:1)抽提,颠倒混匀50次,13000rpm离心15min;
将上清液吸入新的1.5ml的ep管中,加1倍体积异丙醇,颠倒混合,-80℃冷激15min,13000rpm离心10min,弃上清;
d、加入70%乙醇,轻弹重悬,静置6min,13000rpm离心5min,去上清;
烘箱干燥(37℃)后,加入50μl去离子水,溶解dna,测dna浓度,-20℃保存备用。
(2)目的基因的扩增,根据genbank公布的谷氨酸棒状杆菌atcc13032中基因ptsg(geneid:1021001)、iolr(geneid:3342760)、iolt1(geneid:3342760)和iolt2的序列(geneid:1021001),以及它们的上下游序列,设计特异性引物(5’-3’)如下表所示:
以步骤(1)中所提取的c.glutamicum13032基因组dna为模板,以ptsg上游同源臂上游引物(iolt1-up-s)和下游引物(iolt1-up-a)为引物,进行pcr扩增,获得ptsg的上游同源臂约500bp片段,同时以ptsg下游同源臂上游引物(iolt1-down-s)和下游引物(ptsg-down-a)为引物,pcr扩增获得ptsg的下游同源臂约500bp片段;
pcr反应条件为:95℃预变性5min;98℃变性10s,55℃退火5s,72℃延伸30s,30个循环;72℃最后延伸10min(高保真primestarhs聚合酶)。
反应结束后取3μl扩增产物,进行1%的琼脂糖凝胶电泳检测扩增片段大小。
回收(采用cyclepurekit,omega)pcr扩增产物,以回收的上下游同源臂为模板(添加量为摩尔比1:1),同时以ptsg-up-s和ptsg-down-a为引物,进行重叠pcr,扩增上下游同源臂的重叠片段。
iolt2、iolr和ptsg的上下游同源臂的重叠片段的扩增方法同上。
(3)回收pcr产物,并与载体pk18mobsacb进行连接,对步骤(2)中的pcr扩增产物进行回收,并进行双酶切,同时对pk18mobsacb载体进行对应的双酶切,回收酶切产物,并进行连接;
双酶切时:
iolt1上下游重叠片段双酶切位点为:hindiii和sphi;
iolt2上下游重叠片段双酶切位点为:ecori和sphi;
iolr上下游重叠片段双酶切位点为:sphi和psti;
ptsg上下游重叠片段双酶切位点为:xbai和ecori;
50μl的双酶切体系参考设计如下:
质粒(pk18mobsacb载体)或目的片段(pcr扩增产物),3000~5000ng;
q.cut1(酶切位点用酶),1.5μl;
q.cut2(酶切位点用酶),1.5μl;
10×q.cutbuffer,5μl;
去离子水,加至50μl。
酶切产物回收后,10μl连接体系设计如下:目的片段(酶切后pcr产物片段)与载体(酶切后载体片段)摩尔比为3~9:1之间,solutioni连接酶5μl,其余用去离子水补齐;16℃连接4h。
(4)转化与鉴定重组质粒,利用cacl2法,将步骤(3)中的重组质粒(连接产物)转化入大肠杆菌dh5α感受态细胞;然后涂布lb固体培养基,挑选阳性转化子进行摇管培养后,采用碱裂解法,提取质粒dna,进行重组质粒的pcr鉴定和酶切鉴定。
将鉴定正确的质粒送进行测序,各片段的测序结果用dnaman软件与genbank中序列进行比对,以验证基因ptsg、iolr、iolt1和iolt2重叠片段构建的正确性,也即,重组质粒构建正确。
(5)制备谷氨酸棒状杆菌感受态细胞,具体可参考如下操作步骤:
a、从-80℃甘油保菌管中用接种针挑取l-谷氨酸棒状杆菌,在lb平板培养基上三区划线,32℃培养箱中培养过夜;
b、在步骤①的划线平板培养基上挑取单菌落,接种到5ml的bhis培养基试管中,30℃、200r/min培养12h;
按1%接种量转接到装液量为100ml的bhis培养基(含150μltween80和2.5g甘氨酸)的500ml圆底瓶中,18℃、160rpm培养18h,测定od600值;
bhis培养基(g/l):脑心浸提物(brain-heartinfusion)37,山梨醇(sorbitol)91,ph7.0~7.2,培养基115℃高压蒸汽灭菌15min;
c、将步骤b中od600=0.6左右的培养液冰上静置20min;
然后在超净台中,将菌液收集到50ml的离心管中,4℃、6500rpm离心10min,弃上清;
d、用50ml预冷的10%甘油重悬洗菌,4℃、6500rpm离心10min,弃上清,重复此步骤三次(即,重复洗三次);
用2ml预冷的10%甘油将菌体重悬,用预冷的ep管,100μl/管分装,-80℃保存备用。
(6)电转化,将步骤(4)中测序鉴定正确重组质粒电转化步骤(5)中所制备感受态细胞,具体转化步骤参考如下:
a、在超净工作台内,用无水乙醇将电转杯吹洗干净后,将其倒置于干净的滤纸上,大约20min后,将其置于冰上约预冷20min;
b、从-80℃冰箱取出保存的谷氨酸棒状杆菌感受态细胞(步骤(5)中所制备),置于冰上融化5min左右;
将构建成功的重组质粒(步骤(4)中所制备)加入感受态细胞,轻弹混匀后置于步骤a的预冷后电转杯中;放置冰中预冷20min左右;
c、用滤纸擦干电转杯两侧,迅速放入电转仪内,2500v条件下电击后迅速加入1ml预热的bhis复苏液,轻轻吹打均匀后,转移至离心管中,置于46℃水浴中热击6min;
热击结束后,32℃、200r/min复苏约2h,然后进行进一步的菌株筛选和培养。
(7)筛选和鉴定基因敲除的谷氨酸棒状杆菌重组菌株,对步骤(6)中电转化复苏后菌体,参考如下培养步骤进行菌株筛选:
a、复苏完成以后,8000rpm/min离心2min以富集菌体,将所富集菌体涂布含卡那霉素的lb抗性平板(kmr,10μg/ml),32℃培养48h;
将平板上长出的单菌落分别对点到质量含量15%蔗糖的lb平板和含卡那霉素的lb抗性平板(kmr,10μg/ml)上,32℃培养18h;
b、挑选出在lb抗性平板上生长,但在15%蔗糖lb平板不生长的菌落,转接lb培养基,32℃、200rpm/min培养18h,提取菌落的基因组,以kana-n和kana-c为引物(引物序列如seqidno.1、seqidno.2所示,具体为:kana-n:aagggactggctgctattggg,kana-c:gcccattcgccgccaagctc;扩增长度447bp),进行kana抗性基因的pcr检测,验证发生第一次重组的重组子,对验证正确的重组子保菌。
(c、将步骤b中验证正确的重组菌在含有15%蔗糖的摇管中传代两次(由于在15%蔗糖存在情况下,sacb基因的表达对宿主菌具有致死效应,因此可用来筛选发生第二次同源重组的菌株);
d、将步骤c中传代培养后菌体,稀释后涂布到15%蔗糖的平板上,32℃培养36h,将长出的单菌落分别对点到15%蔗糖平板和含卡那霉素的lb抗性平板(kmr,10μg/ml)上,32℃培养18h,筛选出在15%蔗糖平板生长、但是在含卡那霉素的lb平板上不生长的单菌落;
将表型正确的单菌落转接到lb摇管中,32℃、200rpm/min过夜培养;
提取过夜培养后菌落基因组,以基因组dna为模板,以设计的同源重组引物进行pcr扩增(引物序列参考前述步骤(2)),pcr扩增中,72℃最后延伸后,补加0.5μlextaq酶以加polya尾。
回收pcr扩增产物,并将所回收dna片段连接到pmd18-t-simple载体上,10μl的连接体系参考设计如下:
所回收的pcr扩增产物,4.5μl;
pmd18-t-simple载体,0.5μl;
solutioni,5μl;
16℃连接过夜。
采用cacl2法,将连接产物转化入大肠杆菌dh5α感受态细胞;采用碱裂解法,提取质粒dna,进行pcr鉴定和酶切鉴定;将鉴定正确的质粒进行测序分析,确定各基因成功敲除,即,基因缺失菌株构建正确。
经过筛选、鉴定,最终构建获得δptsg菌株(ptsg系统失活)、δptsgδiolr菌株(ptsg系统失活,iolr基因敲除)、δptsgδiolrδiolt1δiolt2菌株(ptsg系统失活,iolr基因敲除,iolt1和iolt2基因也被敲除)。
二、构建木糖异构酶表达载体pxt01-xyla,参考现有技术,构建木糖异构酶表达载体pxt01-xyla。
三、电转化,将步骤1中所构建的基因缺失菌株(δptsg菌株、δptsgδiolr菌株、δptsgδiolrδiolt1δiolt2菌株),以及c.glutamicum13032菌株分别制备感受态细胞,采用电转化法,将步骤2中所构建的木糖异构酶表达载体pxt01-xyla分别转化上述感受态细胞,经过筛选,最终获得木糖异构酶过表达的不同基因敲除重组菌株,即获得:
谷氨酸棒状杆菌(c.glutamicum)13032/pxt01-xyla菌株(以下简称ptsg/pxt01-xyla,正常菌株转化有pxt01-xyla质粒),
δptsg/pxt01-xyla菌株(ptsg系统失活,且转化有pxt01-xyla质粒),
δptsgδiolr/pxt01-xyla菌株(ptsg系统失活,iolr基因敲除,且转化有pxt01-xyla质粒),
δptsgδiolrδiolt1δiolt2/pxt01-xyla菌株(ptsg系统失活,iolr基因敲除,iolt1和iolt2基因也被敲除,且转化有pxt01-xyla质粒)。
需要解释的是,上述操作中未详述实验操作参考现有技术或实施例中其他有关步骤描述即可进行,文本简要期间,不再过于重复描述。
实施例2
在实施例1所构建的重组菌株基础上,发明人对不同的谷氨酸棒状杆菌重组菌株均木糖和葡萄糖的生长利用情况进行了检测分析,相关实验过程简要介绍如下。
蛋白iolt1和iolt2对pts系统的取代实验
已有研究认为:谷氨酸棒状杆菌中转运葡萄糖的pts系统具有转运木糖的能力,而pts系统在环境中同时存在葡萄糖和木糖的时候,木糖的转运明显会受到葡萄糖转运的竞争性抑制。为此,发明人以实施例1中所构建的δptsgδiolr/pxt01-xyla菌株(ptsg基因敲除,因此pts系统缺失,iolr基因敲除,解除了对iolt1和iolt2基因抑制,从而使得iolt1和iolt2蛋白得以表达)作为实验菌株,以正常的(c.glutamicum)13032/pxt01-xyla菌株作为对照,考察了以iolt1和iolt2蛋白取代pts系统时,iolt1和iolt2蛋白对木糖和葡萄糖的转运能力(以菌株的耗糖情况作为评价依据)。具体培养过程介绍如下。
(1)菌种活化
将实施例1中所构建菌株进行活化培养,以恢复菌株活力,活化培养时,培养温度为32℃,培养基可参考使用活化培养基,具体配方为:
活化培养基(g/l):蛋白胨10,牛肉膏10,酵母粉5,nacl2.5,玉米浆15ml/l,琼脂25,ph7.0~7.2,灭菌条件:121℃、20min。
(2)种子培养
将步骤(1)中活化后菌株接入种子培养基中,32℃、200rpm培养时间12h左右,培养至od600=10±2左右;种子培养基参考设计如下:
种子培养基(g/l):葡萄糖10,脑心浸液37,ph7.0~7.2,灭菌条件:121℃、20min。
(3)摇瓶发酵培养
按4%体积比的接种量,将步骤(2)中的种子培养液接种发酵培养基,32℃、200rpm条件下进行培养;发酵培养基设计如下:
发酵培养基(cgxii)(g/l):木糖20(或木糖12,葡萄糖12),(nh4)2so420,k2hpo41,kh2po41,mgso40.25,尿素5,mops42,0.1m的cacl21ml,0.2g/l的生物素200μl,ph7.0~7.2,灭菌条件:121℃,20min。
实验结果:
实验结果包括对不同菌株发酵生长速度测定和发酵液中木糖、葡萄糖消耗量两个方面的测定情况,具体介绍如下。
菌体浓度的测定
发酵过程中,定时取样,将菌液样品稀释后,600nm处(v1200紫外分光光度计)测定样品吸光度,以对发酵过程中菌体生长速度有所判定。
以木糖为唯一碳源的菌株生长过程的od600生长曲线如图1所示,图1中,atcc13032为出发菌株;δptsg为ptsg敲除菌株;δptsgδiolr为同时敲除ptsg和阻遏蛋白基因iolr的菌株;δptsgδiolrδiolt1δiolt2为4个基因敲除菌株。
从图1可以看出,敲除pts系统后,重组菌株的od值下降了80%左右,表明pts系统去除后,无法有效利用培养基中糖分,因而生长效果发生了明显降低;这一结果为专门研究mfs家族的iolt1/iolt2对木糖的转运作用做了最好的参考对照。
发酵液中葡萄糖、木糖消耗量的测定
发酵过程中,定时取样,将菌液样品12000rpm离心5min,取上清液稀释10倍后,过0.22μm膜,对滤液中糖(木糖、葡萄糖)采用hplc测定,测定时:
采用agilent1200高效液相色谱仪进行测定,
色谱柱:aminexhpx-87h(300×7.8mm,bio-rad);
检测器:示差检测器;
流动相:5mm硫酸;
流速0.6ml/min。
根据hplc检测结果绘制葡萄糖和木糖消耗曲线,绘制结果如图2所示(培养过程中,培养基中同时含有相同浓度(均为12g/l)的木糖和葡萄糖,即同时以木糖和葡萄糖为碳源)。
由图2(a)可知,c.glutamicum13032发酵10h时,葡萄糖消耗至1g/l左右,木糖才开始被快速消耗,到42h时木糖消耗完毕。由此可见,原始出发菌株菌株是优先利用葡萄糖的。而由图2(b)可知,δptsgδiolr菌株具备同步代谢木糖和葡萄糖的能力,然而培养40h以后培养基中始终残留约3.6g/l木糖,可见ptsg对低浓度木糖转运是必需的。
结合图1、图2,分析可以看出,在敲除ptsg的基础上再通过敲除iolr激活iolt1和iolt2的表达后,菌株在木糖基本培养基上生长的最终od增加了2.5倍。这说明iolt1和iolt2肌醇转运蛋白具有转运木糖的能力。
进一步地,参考上述培养过程,发明人对δptsgδiolrδiolt1δiolt2重组菌株进行了培养,其最终od与仅敲除ptsg且未激活iolt1和iolt2表达的菌株相当(od600生长曲线如图1所示)。
综上结果可以看出:在谷氨酸棒状杆菌中,iolt1和iolt2蛋白具有转运木糖的能力。失活阻遏蛋白iolr后,iolt1和iolt2蛋白得以表达,这两个蛋白对木糖的转运能力与谷氨酸棒状杆菌中的pts系统(ptsg)的木糖转运能力是相当的,在pts系统失活时,可替代pts系统对木糖的转运功能的发挥。基于此特性,利用重组菌株发酵时,可为木质纤维素原料中木糖、葡萄糖成分的同步利用奠定了必要的应用基础。
sequencelisting
<110>莲花健康产业集团股份有限公司
天津科技大学
<120>iolt1和iolt2蛋白在木糖转运中的应用
<130>none
<160>2
<170>patentinversion3.5
<210>1
<211>21
<212>dna
<213>人工设计
<400>1
aagggactggctgctattggg21
<210>2
<211>20
<212>dna
<213>人工设计
<400>2
gcccattcgccgccaagctc20
- 还没有人留言评论。精彩留言会获得点赞!