一种能够阻断耐药细菌密度感应系统的多肽及其应用的制作方法
本发明涉及生物医学技术领域,具体涉及一种能够阻断耐药细菌密度感应系统的多肽及其应用。
背景技术:
使用抗生素可以追溯到远古时代,在埃及的罗马时期的古苏丹(公元350 年)的人类骨骼中发现四环素类化合物。1928年,亚历山大· 弗莱明发现了青霉素,标志着抗生素工业化的开始。作为医学上的重大突破,青霉素挽救了受疾病折磨的人,给他们带来了希望。抗生素等抗菌药物在传染性疾病治疗方面有着不可磨灭的功劳,除此之外,种植业、畜牧业、水产养殖业中传染病的预防以及治疗也离不开抗生素的使用。饲用抗生素在全球畜牧业的发展过程中发挥了至关重要的作用。近年来为了追求更大的经济效益,动物生产中抗生素的滥用现象日趋严重这不仅造成了动物性食品中的兽药残留问题还导致了耐药菌株的产生,给畜牧业的可持续发展带来了严重的困扰。人畜间广泛使用抗菌药物认为是耐药性和耐药菌株产生并蔓延的重要推手。因此,食物链被认为是人畜间出现和扩散耐药性的重要途径。例如人畜共患细菌,如沙门菌和弯曲杆菌可具有耐药性的动物宿主,耐药菌可通过食物转移到人类,在人类中引起感染并影响治疗效果。因此,迫切需要开发新的不会引起耐药性产生的“抗菌物质”。
密度感应( quorum sensing,QS)是指微生物群体在其生长过程中,由于群体密度的增加,导致其生理和生化特性的变化,显示出少量菌体或单个菌体所不具备的特征(Fuqua WC, Winans SC, Greenberg EP (1994) Quorum sensing in bacteria: the LuxR-LuxI family of cell density-responsive transcriptional regulators. J Bacteriol 176: 269-275)。它是细菌彼此之间传递信号的一种特殊机制,利用一种激素样的化合物作为信号分子( autoinducer,AI)来调节细菌基因的表达(Lerat E, Moran NA (2004) The evolutionary history of quorum-sensing systems in bacteria. Mol Biol Evol 21: 903-913)。随着细菌密度的增加,信号分子浓度也随之增加,当信号分子的浓度也达到一定的水平,通过包括受体蛋白在内相关蛋白的信号传递,诱导或抑制信号最终传递到胞内,影响特定基因的表达,调控微生物群体的生理特征,如生物发光、抗生素合成、生物被膜形成等。
由于使用抗生素所带来的种种弊端,迫切需要寻找一种替代方法来控制致病菌。抗菌活性肽是一种很有潜力的新型抗菌药物来源,特别是既具有抗菌肽活性,由能通过干扰致病菌的QS系统来达到抗菌是一种行之有效的新手段。因此QS已成为农业、医学和环境领域的研究热点之一。由于QS控制细菌许多病基因的表达, 因此任何能够阻止QS信号分子集聚或受体识别信号分子的过程都可以阻断依赖细菌QS的毒力基因表达。由于QS介导的是微生物病原性,干扰QS体系不会对病原菌产生选择压力,因此,这使得对QS猝灭剂和抑制机制的研究具有潜在的意义。与传统抗生素相比具有分子量小、抗菌谱广、抗菌机理独特、不会产生耐药性等优点,兼具抗菌肽和阻断QS信号达到抑菌的目的。
技术实现要素:
本发明目的在于提供一种能够阻断耐药细菌密度感应系统的多肽及其编码基因,该阻断多肽具有抗耐药性细菌感染的用途。
本发明采取的技术方案是:一种能够阻断耐药细菌密度感应系统的多肽及其应用,所述多肽具有用序列号1表示的氨基酸序列,序列号1表示的序列为:HSIRTNTMTLFFRV。
所述的多肽用于在体外阻断密度感应系统中的信号分子AI-2分子的产生,从而抑制耐药细菌的生长。
本发明的抗菌多肽采用固相化学合成法即可得到,大大解决了抗菌肽的生产成本过高的问题,有利用该新型多肽在治疗耐药细菌感染方面的应用。
针对耐药细菌密度感应系统阻断蛋白的表达:将质粒pCDNA3.1用HindIII/EcoRI双酶切后与寡聚核苷酸P (5-AAGCTTCACCCAATCCGCACCAACCGCATGACCCCGTTCTTCAGAGCAGAATTC-3)用T4DNA连接酶连接,将连接产物转化入大肠杆菌DH5α中,得到携带有序列表SEQ ID 1中氨基酸序列质粒的工程菌。
有益效果
本发明的阻断多肽是通过特异性干扰和抑制LuxS/AI2密度感应系统中的信号分子AI-2的产生,从而调控细菌生长,显著的抑制多种耐药细菌的生长,并起到显著降低耐药细菌感染实验动物的作用。由于人和动物没有相关的密度感应系统,因而对人和动物个体没有副作用。作用机理为特异性阻断信号分子产生,因而也不会有耐药性的产生。该阻断因子是一种蛋白质,可以人工合成,也可以通过真核表达高效获得,因而生产方便,成本较低。
附图说明
图1为所述阻断多肽对青霉素耐药的金黄色葡萄球菌的生长抑制曲线;
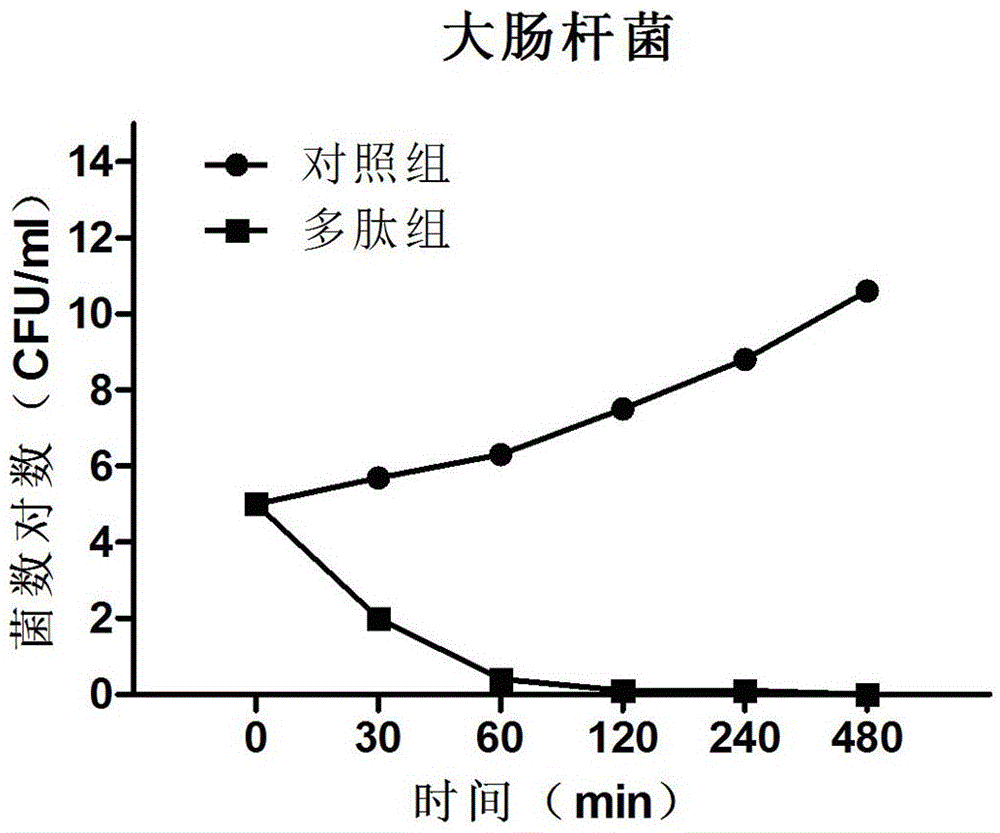
图2为所述阻断多肽对青霉素耐药的大肠杆菌的生长抑制曲线;
图3为所述阻断多肽对青霉素耐药的沙门菌的生长抑制曲线。
具体实施方式
下面对本发明的实施例做详细说明:本实施例在以本发明技术方案为前提下进行实施,给出了详细的实施方式和具体的操作过程,但本发明的保护范围不限于下述的实施例。
下述实施例中,如无特殊说明,均为常规方法。
载体pCDNA3.1(+)购自invitrogen公司;限制性内切酶、连接酶等试剂购自TAKARA公司;S腺苷同型半胱氨酸(SAM)购自sigma公司。质粒提取、DAN纯化、DNA回收试剂盒购自天根生物科技有限公司。
实施例1:
一种阻断耐药细菌密度感应系统的新型多肽,其氨基酸序列为SEQ ID1。
阻断多肽的构建方法:表达阻断多肽的质粒pCDNA-P构建:将质粒pCDNA3.1用HindIII/XhoI双酶切后与寡聚核苷酸P(5- AGCTT ACCACCATGCACCCAATCCGCACCGACCGCCACGACC-3)用T4DNA连接酶室温连接2-4小时,将连接产物转化入大肠杆菌DH5α中,并涂布于含有氨苄青霉素(100g/ml)的LB固体培养基上培养30小时,挑取转化子,提取质粒,即为质粒pCDNA-P,具有序列表SEQ ID 1中氨基酸序列。
实施例2:
多肽抑制多种耐药细菌信号分子AI2实验
SRH的制备:SRH的体外合成参照Schauder(Schauder S,Shokat K,Surette M G,etal.The LuxS family of bacterial autoinducers:biosynthesis of a novel quorum-sensing signal molecule.Mol Microbiol,2001,41:463-476)等建立的方法进行,1 mg/ml纯化的Pfs重组蛋白与1 mM SAM在10 mM磷酸钠(sodium phosphate buffer, pH 7.5)缓冲液中,37°C作用1小时,反应液用Millpore(10,000 Da cutoff)的超滤膜,进行超滤,去除反应液中的蛋白。滤液即为SRH,滤液冻存于-80°C。
将人工合成的多肽溶于10mM磷酸钠缓冲液中,同时加入纯化的重组蛋白LuxS,37℃作用1小时,加入1mM SRH, 37℃作用1小时,反应液用Millpore(100000Da cutoff)的超滤膜,进行超滤,去除反应液中的蛋白。取适量滤液用100mM磷酸钠,0.1mM EDTA,pH 7.2缓冲液作20倍稀释。取200ul上述稀释液,加入100ul的5mM Ellman’s试剂(DTNB,溶于100mM磷酸钠,0.1mM EDTA,pH 7.2缓冲液),37°C作用15min,在412nm的波长下测光吸收值。
实验结果:由表1结果表明,多肽能显著抑制LuxS催化SRH生成AI-2,加入多肽后,AI-2的浓度从200μmol降低到75μmol,抑制效率为62.5%(LuxS中不加多肽催化SRH形成AI-2的能力设定为100%)。
表1:多肽抑制性实验
符号“-” 表示在酶和底物SAH或者SRH作用时没有加入合成多肽。
符号“+”表示加入合成多肽到LuxS和SRH到反应体系中。
实施例3:
阻断多肽对青霉素耐药细菌的最小抑菌浓度
阻断多肽在治疗青霉素耐药细菌的应用中,首先将实验用菌挑单菌落37℃过夜培养后,在1:100接种新鲜的培养基,37℃培养到OD600=1.0左右,用培养液稀释成105CFU/ml的细菌悬液。并将多肽配置成浓度为100g/ml,0.22m无菌过滤,分装。用无菌培养液将多肽倍比稀释成100、10、1、0.1g/ml。另设不含药物作为对照。37℃培养培养16-20小时后,观察抗菌效果。确定阻断多肽的10倍稀释的最低抑制浓度后,将最低抑制浓度进行2倍等比稀释,重复上述实验,最终确定阻断多肽对耐药细菌的最低抑制浓度。同时确定抗菌药物青霉素对耐药细菌的最小抑菌浓度。
抗菌结果表明阻断多肽对耐青霉素的金黄色葡萄球菌、大肠杆菌和沙门菌都有高效的抗菌作用,其最小抑菌浓度MIC均为6g/ml,而青霉素对它们的最小抑菌浓度MIC超过了100g/ml,抗菌多肽能显著抑制细菌生长。
实施例4:阻断多肽对青霉素耐药的细菌的生长抑制曲线
采用5倍的MIC的药物浓度,混合于制备好的菌悬液中,使其终浓度为105CFU/ml左右,在0min、30 min、1h、2h、4h、6h和8h时,吸取培养物系列稀释,进行活菌计数,每个稀释度做三个平行实验,求平均值。以细菌浓度对数为纵坐标,培养时间为横坐标,绘制抑菌曲线同时做空白对照和阳性对照组。结果见附图1-3.
采用5倍MIC的药物浓度测定阻断多肽对金黄色葡萄球菌、大肠杆菌和沙门菌的杀菌曲线。由图可以看出,阻断多肽对金黄色葡萄球菌杀菌和抑菌效果明显,在2小时后基本上能够杀死大部分细菌。由图可知 阻断多肽对大肠杆菌和沙门菌都有较强的杀菌效果,1小时基本上能够杀死大部分的细菌。体外的杀菌实验表明,阻断多肽具有显著的杀灭耐药细菌的作用,可用来制备抗耐药性细菌感染的有效药物,所述的耐药细菌主要指金黄色葡萄球菌、大肠杆菌和沙门菌。
实施例5:阻断密度感应系统多肽的应用
耐药细菌菌悬液的制备。在TSB培养基(Oxioid)中培养耐药细菌至OD600为0.8,然后离心(5000g,4℃)10min。收集菌体,将其悬浮于PBS中至终浓度为1×106 cfu/ml,即为耐药细菌菌悬液。
将20只清洁型昆明系小鼠随机分为6组,每组5只,分布命名为1-6组。将1-3组的每只小鼠肌肉注射200l含有15-20g混有实施例1中的质粒pCDNA-P的PBS。将4-6组的每只小鼠同样肌肉注射200l含有15-20g的质粒pCDNA3.1的PBS。7天后将1、4组,2、5组和3、6组分别每只腹腔注射200l上述步骤1)获得的耐药细菌菌悬液(大肠杆菌、葡萄球菌和沙门菌),48小时后取肝脏、脾脏和血液做倍比稀释后涂布于TSB固体培养基上培养32-48小时,菌落计数。结果如表2。
表2:
以耐药细菌注射pCDNA3.1组后,各组织脏器中细菌的数量作为100%。
由表2可知,耐药细菌在各提前注射了阻断密度感应多肽的小鼠中,各组织脏器细菌数量都有显著的下降。结果表明各耐药细菌在表达LuxS/-AI2密度感应系统阻断因子的小鼠体内的感染能力显著下降。
SEQUENCE LISTING
<110> 洛阳师范学院
<120> 一种能够阻断耐药细菌密度感应系统的多肽及其应用
<130> 1
<160> 1
<170> PatentIn version 3.3
<210> 1
<211> 14
<212> PRT
<213> 人工序列
<400> 1
His Ser Ile Arg Thr Asn Thr Met Thr Leu Phe Phe Arg Val
1 5 10
- 还没有人留言评论。精彩留言会获得点赞!