吲哚酮螺四氢硫代吡喃类化合物及其盐、制备方法和应用与流程
本发明属于医药技术领域,具体涉及吲哚酮螺四氢硫代吡喃类化合物及其盐、制备方法和应用。
背景技术:
螺吲哚酮骨架作为天然产物和活性分子的优势骨架,受到了有机合成和药物化学研究人员的广泛关注。目前,已经报道了多样性的螺吲哚酮类化合物,并发现具有广泛的药理活性,如孕激素受体调节剂(jaye.wrobeletal,design,synthesis,andsarofnewpyrrole-oxindoleprogesteronereceptormodulatorsleadingto5-(7-fluoro-3,3-dimethyl-2-oxo-2,3-dihydro-1h-indol-5-yl)-1-methyl-1h-pyrrole-2-carbonitrile(way-255348),j.med.chem.2008,51:1861-1873)、抗艾滋病(singhrk.etal,rhodium(ii)acetate-catalyzedstereoselectivesynthesis,sarandanti-hivactivityofnoveloxindolesbearingcyclopropanering,eur.j.med.chem.2011,46:1181-1188)、抗肿瘤(wo2008055812a1)、抗结核病(waldmann,h.etal,identificationofthiazolidinonesspiro-fusedtoindolin-2-onesaspotentandselectiveinhibitorsofthemycobacteriumtuberculosisproteintyrosinephosphataseb,angew.chem.int.ed.engl.2010,49:5902-5905)、抗疟疾(diagana,t.t.etal,spiroindolones,apotentcompoundclassforthetreatmentofmalaria,science2010,329:1175-1180)和mdm2抑制剂(wang,s.etal,structure-baseddesignofpotentnon-peptidemdm2inhibitors,j.am.chem.soc.2005,127:10130-10131)等。
发明人在前期工作中,构建了两类新型吲哚酮螺四氢硫代吡喃类衍生物,并发现其具有很好的体外抗肿瘤活性(公布号:cn103992334a、cn106565742a)。在此研究基础上,为了进一步对吲哚酮螺四氢硫代吡喃类衍生物做更深的入的研究和发现更好的抗肿瘤化合物,发明人进一步构建了一类新型吲哚酮螺四氢硫代吡喃类化合物。
技术实现要素:
本发明的目的在于提供一种吲哚酮螺四氢硫代吡喃类化合物及其盐、制备方法和应用。此类化合物具有全新的骨架结构和较强的抗肿瘤活性,能够在制备抗肿瘤药物中应用。
本发明是通过以下技术方案来实现:
一种吲哚酮螺四氢硫代吡喃类化合物,包括其消旋体、d-型或l-型异构体,该化合物的结构如通式i所示:
其中r1表示苯环上的取代基,其中苯环上的取代基是单取代或多取代,取代基表示氢、卤素、低级卤代烷基、低级烷基、羟基、低级羟基烷基、低级烷氧基、氨基、低级烷基氨基、低级卤代烷基氨基、低级环烷基氨基、低级链炔基氨基、硝基、低级硝基烷基、氰基、低级氰基烷基、酰胺基、低级环烷基酰胺基、低级酰胺基烷基;
r2表示芳环取代基团,芳环为苯环、取代苯环或杂芳环;取代苯环上的取代基为卤素、低级烷基、羟基、低级烷氧基、氨基、低级烷基氨基、低级环烷基氨基、硝基、酰胺基或低级环烷基酰胺基;杂芳环为吡咯、呋喃、噻吩或吡啶;
r3表示芳环取代基团或低级烷基侧链,芳环为苯环、取代苯环或者杂芳环;取代苯环上的取代基为卤素、低级烷基、羟基、低级烷氧基、氨基、低级烷基氨基、低级环烷基氨基、硝基、酰胺基或低级环烷基酰胺基;杂芳环为呋喃、噻吩、吡咯或吡啶;
r4表示氢、低级烷基或低级羰基侧链;
x表示:硫原子、亚砜基团或砜基团;
所述的“低级环烷基”是指含3至7个碳的环,所述的“低级链炔基氨基”是指相应的炔链的碳原子数量为3至6个,其它所述的“低级”取代基是指相应的脂肪烃基是直链或支链的、饱和的、并且含1至6个碳原子。
优选地,在r1表示的取代基中,所述卤素为氟、氯或溴,所述低级烷基为甲基。
优选地,在r2表示的芳环取代基团中,取代苯环取代基团为4-溴苯基、4-甲氧基苯基、3,4-二氯苯基;芳杂环取代基团为呋喃-2基。
优选地,在r3表示的芳环取代基团中取代苯环取代基团为:4-氯苯基、4-氟苯基、4-溴苯基、4-硝基苯基、4-甲氧基苯基或2-甲氧基苯基;r3表示的低级烷基侧链为正丙基。
优选地,该化合物为如下表1所示的化合物1~21中的任一个,其结构如通式i(编号1到21),其中r1、r2、r3、r4、x的组合如下:
表1:优选化合物中r1、r2、r3、r4、x的组合方式
一种吲哚酮螺四氢硫代吡喃类化合物的制备方法,其特征在于,反应流程如下:
具体步骤为:
a、目标化合物viii的制备:
a)取代的(e)-1-溴-2-(2-硝基乙烯基)苯的制备:将硝基甲烷、取代的苯甲醛i和醋酸铵加入到乙酸中,并在90~110℃下反应,反应完全后,蒸干溶剂,残留物柱层析纯化,得到取代的(e)-1-溴-2-(2-硝基乙烯基)苯;优选地,按照摩尔量计,硝基甲烷:取代的苯甲醛=1:(1.5~1.8);
b)中间体iii的制备:在二氯甲烷中,加入取代的(e)-1-溴-2-(2-硝基乙烯基)苯、乙酰氯和无水三氯化铁,20~30℃下反应,反应完全后,蒸干溶剂,残留物柱层析纯化得到中间体iii;优选地,按照摩尔量计,取代的(e)-1-溴-2-(2-硝基乙烯基)苯:乙酰氯:无水三氯化铁=1:(2~2.2):(1.8~2.1);
c)中间体v的制备:在氮气保护下,将中间体iii、中间体iv、三乙胺加入到二氯甲烷中,并20~30℃搅拌反应,反应完全后,蒸干溶剂,柱层析纯化,得到中间体v;优选地,按照摩尔量计,中间体iii:中间体iv=1:(1.1~1.5);
d)目标化合物viii的制备:在二氯甲烷中,依次加入催化剂vii、中间体v、中间体vi,20~30℃下搅拌,反应完全后,蒸干溶剂,残留物经柱层析纯化,得到目标化合物viii;所述的催化剂vii为l-脯氨酸,用量为中间体v摩尔量的10%优选地,按照摩尔量计,中间体v:中间体vi=1:(1.1~1.4);
b、目标化合物ix的制备:
在二氯甲烷中,加入化合物viii、取代试剂和4-二甲胺基吡啶,反应完全后,柱层析纯化,得到目标产物ix;
其中,所述取代试剂为酸酐或溴代烷烃;
c、目标化合物x的制备:
在二氯甲烷中,加入化合物viii、间氯过氧苯甲酸,在20~30℃下反应完全后,柱层析纯化,得到硫原子氧化为亚砜基团的目标产物x;其中,按照摩尔量计算,化合物viii:间氯过氧苯甲酸=1:(1.3~1.8);
在二氯甲烷中,加入化合物viii、间氯过氧苯甲酸,在20~30℃下反应完全后,柱层析纯化,得到硫原子氧化为砜基团的目标产物x;其中,按照摩尔量计算,化合物viii:间氯过氧苯甲酸=1:(4~6);
d、目标化合物xi的制备:
在二氯甲烷中,加入化合物ix、间氯过氧苯甲酸,在20~30℃下反应完全后,柱层析纯化,得到硫原子氧化为亚砜基团的目标产物xi;其中,按照摩尔量计算,化合物ix:间氯过氧苯甲酸=1:(1.3~1.8);
在二氯甲烷中,加入化合物ix、间氯过氧苯甲酸,在20~30℃下反应完全后,柱层析纯化,得到硫原子氧化为砜基团的目标产物xi;其中,按照摩尔量计算,化合物ix:间氯过氧苯甲酸=1:(4~6);
所述的吲哚酮螺四氢硫代吡喃类化合物的可药用盐。
所述的吲哚酮螺四氢硫代吡喃类化合物或其可药用盐在制备抗肿瘤药物中的应用。
优选地,所述的肿瘤为肺癌、肠癌、乳腺癌或肝癌。
与现有技术相比,本发明提供具有以下有益的效果:
本发明提供的吲哚酮螺四氢硫代吡喃类化合物,对a549(人肺癌细胞)、mcf-7(人乳腺癌细胞)和肠癌hct116均产生了较为明显的增殖抑制作用,部分化合物的抗肿瘤活性强于阳性对照药nutlin-3。如化合物13对三种细胞的ic50分别为2.3μm、11.3μm和7.4μm,化合物23对三种细胞的ic50分别为1.5μm、8.8μm和5.9μm,nutlin-3对三种细胞的ic50分别为10.9μm、21.9μm和17.7μm。本发明提供的化合物具有全新的骨架结构,含有羟基、氨基等基团,有利于进一步地快速衍生化;较前期研究成果相比,这些化合物具有全新的骨架结构;而且这类化合物具有较强的抗肿瘤活性,可以进行抗肿瘤药物的开发。
本发明提供的合成方法,合成路线简单,合成原料易得、合成方法容易实现。
本发明提供的吲哚酮螺四氢硫代吡喃类化合物或其可药用盐在制备抗癌药物制剂中的应用,能够为临床治疗提供更多的选择。
附图说明
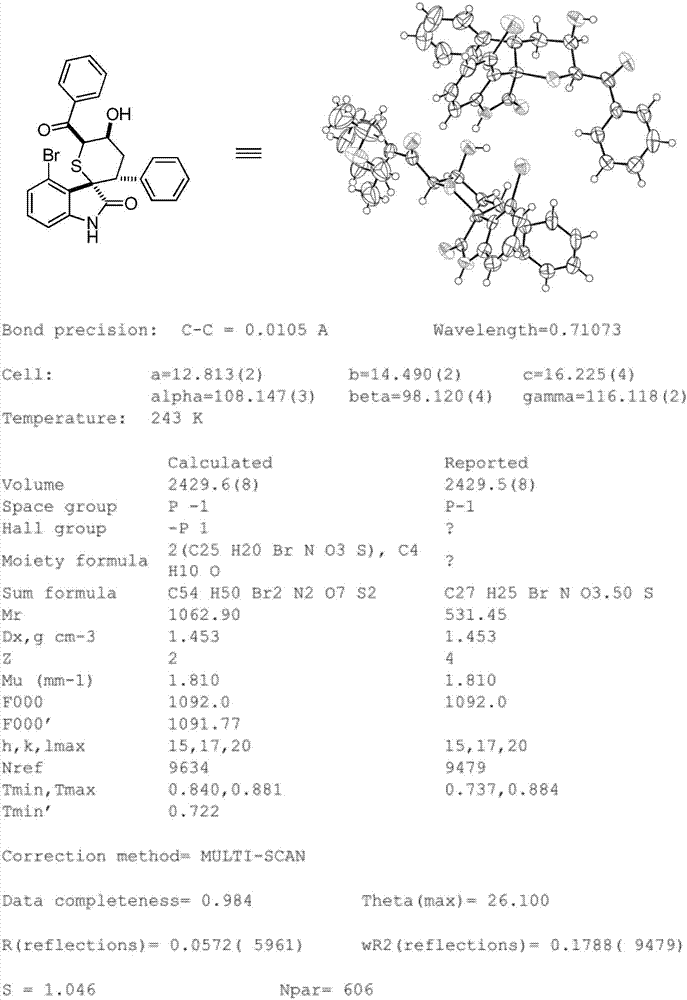
图1:为化合物1的x单晶衍射数据。单晶解析时,化合物1为消旋体形式。
图2为实施例1.2制备的化合物1的ee测定分析图,其中,测定结果显示,其ee值为30%。
图3为实施例1.1中采用l-脯氨酸制备的化合物1的ee测定分析图,其中,测定结果显示,其ee值为-7%。
具体实施方式
现结合实施例和附图,对本发明作详细描述,但本发明的实施不仅限于此。本发明所用试剂和原料均市售可得或可按文献方法制备。
下列实施例中未注明具体条件的实验方法,通常按照常规条件,或按照制造厂商所建议的条件。
以下实施例所涉化合物对应通式ⅰ的化学结构式、1h-nmr、13c-nmr和hrms数据详见表2,其中编号1~21分别对应表1中的化合物1~21、表3中的化合物1~21、实施例1~21。
表2本发明部分优选化合物的1h-nmr,13c-nmr和hrms数据
实施例1:化合物1的合成
a中间体(e)-1-溴-2-(2-硝基乙烯基)苯的制备(中间体ii)
参照文献报道的方法(advancedsynthesis&catalysis2013,355:829-835)。将硝基甲烷(7.2ml,0.134mol)、2-溴苯甲醛(4.0g,0.022mol)和醋酸铵(0.20g,2.6mmol)加入到80ml的乙酸中,并在100℃下反应10h。反应完全后,蒸干溶剂,残留物柱层析纯化(石油醚:乙酸乙酯=100:3),得到(e)-1-溴-2-(2-硝基乙烯基)苯为黄色固体4.21g,收率为85.4%。
b中间体4-溴-3-氯吲哚-2-酮的制备(中间体iii)
参照文献报道的方法(advancedsynthesis&catalysis2013,355:829-835)。在50ml的二氯甲烷中,加入(e)-1-溴-2-(2-硝基乙烯基)苯(3.2g,14.0mmol)、乙酰氯(2.1ml,29.6mmol)和无水三氯化铁(4.64g,28.6mmol),室温下反应3h。反应完全后,蒸干溶剂,残留物柱层析纯化(dcm:meoh=100:1),得到4-溴-3-氯吲哚-2-酮为黄白色固体2.25g,收率为65.6%。
c中间体4-溴-3-((2-氧代-2-苯乙基)硫)吲哚-2-酮的制备(中间体v)
在20ml的二氯甲烷中,加入4-溴-3-氯吲哚-2-酮(0.3g,1.22mmol)、2-巯基-1-苯乙酮(0.24g,1.59mmol)和0.1ml的三乙胺,氮气保护下室温反应过夜。反应完全后,蒸干溶剂,残留物柱层析纯化(dcm:meoh=100:1),得到中间体v为黄白色固体0.27g,收率为62%。1hnmr(400mhz,cdcl3)δ4.11(d,j=15.5hz,1h),4.34(d,j=15.5hz,1h),4.48(s,1h),6.82(d,j=7.4hz,1h),7.10-7.17(m,2h),7.46(t,j=7.7hz,2h),7.59(t,j=7.4hz,1h),7.93(d,j=8.0hz,2h),8.37(s,1h).13cnmr(100mhz,cdcl3)δ36.13,45.49,108.95,120.63,124.97,126.57,128.60(2c),128.68(2c),130.84,133.52,135.55,142.76,175.76,194.37.hrms(esi+)m/zcalculatedforc16h13brno2s(m+h):361.9850,found361.9848.
d目标化合物1的制备
在2ml的dcm中,依次加入催化剂vii(0.01mmol)、中间体v(0.10mmol)和vi(0.12mmol),室温下搅拌反应3d。反应完全后,蒸干溶剂。残留物经柱层析纯化(dcm)得到主产物为目标化合物1白色固体(32mg),收率为64%。所用催化剂vii为l-脯氨酸。
本发明的化合物可通过采用不同构型和不同种类的催化剂vii制备目标化合物viii的不同异构体。可以选用的催化剂如下所示:
例如:
实施例1.1:催化剂vii为l-脯氨酸,得到的化合物1的ee值为-7%(如图3所示)。
实施例1.2:催化剂vii为
在测定化合物1的ee值时,所选用的hplc的条件为chiralpakoz,0.46cmi.d.×25cml×5μm,25℃,异丙醇/正己烷=15:85,流速0.8ml/min,λ=254nm。
化合物2-18的合成参照化合物1的合成方法。
实施例2:化合物2的合成
参照实施例1。中间体4-溴-3-((2-氧代-2-苯乙基)硫)吲哚-2-酮(0.10mmol)与4-氯肉桂醛(0.12mmol)反应,制备化合物2为白色固体(31mg),收率58%。
实施例3:化合物3的合成
参照实施例1。中间体4-溴-3-((2-氧代-2-苯乙基)硫)吲哚-2-酮(0.10mmol)与4-溴肉桂醛(0.12mmol)反应,制备化合物3为白色固体(31mg),收率54%。
实施例4:化合物4的合成
参照实施例1。中间体4-溴-3-((2-氧代-2-苯乙基)硫)吲哚-2-酮(0.10mmol)与4-氟肉桂醛(0.12mmol)反应,得到化合物4为白色固体(29mg),收率56%。
实施例5:化合物5的合成
参照实施例1。中间体4-溴-3-((2-氧代-2-苯乙基)硫)吲哚-2-酮(0.10mmol)与4-硝基肉桂醛(0.12mmol)反应,得到化合物5为黄色固体(36mg),收率66%。
实施例6:化合物6的合成
参照实施例1。中间体4-溴-3-((2-氧代-2-苯乙基)硫)吲哚-2-酮(0.10mmol)与4-甲氧基肉桂醛(0.12mmol)反应,制备化合物6为白色固体(30mg),收率57%。
实施例7:化合物7的合成
参照实施例1。中间体4-溴-3-((2-氧代-2-苯乙基)硫)吲哚-2-酮(0.10mmol)与2-甲氧基肉桂醛(0.12mmol)反应,制备化合物7为白色固体(28mg),收率53%。
实施例8:化合物8的合成
参照实施例1。中间体4-溴-3-((2-氧代-2-苯乙基)硫)吲哚-2-酮(0.10mmol)与2-呋喃丙烯醛(0.12mmol)反应,制备化合物8为白色固体(30mg),收率62%。
实施例9:化合物9的合成
参照实施例1。中间体4-氯-3-((2-氧代-2-苯乙基)硫)吲哚-2-酮(0.10mmol)与肉桂醛(0.12mmol)反应,制备化合物9为白色固体(30mg),收率66%。
实施例10:化合物10的合成
参照实施例1。中间体5-氟-3-((2-(4-甲氧基苯基)-2-氧代乙基)硫)吲哚-2-酮(0.10mmol)与肉桂醛(0.12mmol)反应,制备化合物10为白色固体(27mg),收率62%。
实施例11:化合物11的合成
参照实施例1。中间体6-甲基-3-((2-(4-甲氧基苯基)-2-氧代乙基)硫)吲哚-2-酮(0.10mmol)与肉桂醛(0.12mmol)反应,得到化合物11为白色固体(26mg),收率60%。
实施例12:化合物12的合成
参照实施例1。中间体3-((2-(4-溴苯基)-2-氧代乙基)硫)吲哚-2-酮(0.10mmol)与肉桂醛(0.12mmol)反应,得到化合物12为白色固体(27mg),收率64%。
实施例13:化合物13的合成
参照实施例1。中间体4-溴-3-((2-(4-溴苯基)-2-氧代乙基)硫)吲哚-2-酮(0.10mmol)与肉桂醛(0.12mmol)反应,制备化合物13为白色固体(34mg),收率59%。
实施例14:化合物14的合成
参照实施例1。中间体4-溴-3-((2-(4-溴苯基)-2-氧代乙基)硫)吲哚-2-酮(0.10mmol)与4-溴肉桂醛(0.12mmol)反应,得到化合物14为白色固体(40mg),收率61%。
实施例15:化合物15的合成
参照实例1。中间体4-溴-3-((2-(4-甲氧基苯基)-2-氧代乙基)硫)吲哚-2-酮(0.10mmol)与肉桂醛(0.12mmol)反应,得到化合物15为白色固体(35mg),收率66%。
实施例16:化合物16的合成
参照实施例1。中间体4-溴-3-((2-(3,4-二氯苯基)-2-氧代乙基)硫)吲哚-2-酮(0.10mmol)与肉桂醛(0.12mmol)反应,得到化合物16为白色固体(34mg),收率60%。
实施例17:化合物17的合成
参照实例1。中间体4-溴-3-((2-(呋喃-2-基)-2-氧代乙基)硫)吲哚-2-酮(0.10mmol)与肉桂醛(0.12mmol)反应,得到化合物17为白色固体(30mg),收率62%。
实施例18:化合物18的合成
参照实例1。中间体4-溴-3-((2-氧代-2-苯乙基)硫)吲哚-2-酮(0.10mmol)与反式-2-己烯醛(0.12mmol)反应,得到化合物18为白色固体(32mg),收率70%。
实施例19:化合物19的合成
在5ml二氯甲烷中,加入化合物1(30mg,0.061mmol)、乙酸酐(15mg,0.15mmol)和4-二甲胺基吡啶(3mg),在常温下反应完全后,柱层析纯化,洗脱剂为pe:etoac=5:1,得到化合物19为白色固体(31mg),收率为95%。
实施例20:化合物20的合成
在5ml二氯甲烷中,加入化合物1(30mg,0.061mmol)、间氯过氧苯甲酸(17mg,0.10mmol),在常温下反应完全后,柱层析纯化,洗脱剂为二氯甲烷:甲醇=100:1,得到化合物20为白色固体(28mg),收率为90%。
实施例21:化合物21的合成
在5ml二氯甲烷中,加入化合物1(30mg,0.061mmol)、间氯过氧苯甲酸(57mg,0.31mmol),在常温下反应完全后,柱层析纯化,洗脱剂为二氯甲烷:甲醇=100:1,得到化合物20为白色固体(30mg),收率为93%。
实施例22:合成方法探讨
为了进一步探讨不同反应条件对合成结果,如收率、ee值、产物等的影响,发明人测试了不同的催化剂以及实验条件,实验结果展示在表3中。
其中,采用的反应为:
向2.0ml溶剂加入中4-溴-3-((2-氧代-2-苯乙基)硫)吲哚-2-酮(0.10mmol)、肉桂醛(0.20mmol)、催化剂(20mol%),室温反应。其中,在部分反应中,反应体系中还具有添加剂。
实验所用到的催化剂为:
实验条件和实验结果如下:
表3:实验条件和结果
其中,所述的收率,是经过柱色谱分离后的分离产品的收率。
其中,dr是通过1hnmr分析测定的。
其中,ee是通过手性hplc分析测定的。
其中,n.r.表示不反应。
其中,n.d.表示未测量。
实施例23:本发明化合物的抗肿瘤活性试验
对本发明的化合物进行了肿瘤细胞增殖抑制试验,试验方法采用常规的mtt法(如吕秋军主编《新药药理学研究方法》,2007:242-243)。
细胞株选用肺癌a549、乳腺癌mcf-7,肠癌hct116,均购自上海市医药工业研究院。我们首先测试了化合物在单浓度10μm条件下,对肿瘤细胞的抑制率,若抑制率大于50%,则进行浓度梯度实验,计算半数抑制浓度ic50。
培养液为dmem+15%nbs+双抗。
样品液配制:用dmso(merck)溶解后,加入pbs(-)配成100μg/ml的溶液或均匀的混悬液,然后用dmso的pbs(-)稀释,最终浓度分别为10μg/ml、1μg/ml、0.1μg/ml、0.01μg/ml、0.001μg/ml、0.0001μg/ml。
将抗肿瘤化合物nutlin-3以同样的条件配成对照品溶液。
96孔板每孔加入浓度为3×104个/ml的细胞悬液100μl,即3000个细胞/孔,置37℃、5%co2培养箱内。24小时后,分别加入样品液和对照品液,10μl/孔,37℃作用72小时。每孔加入5mg/ml的mtt(3-(4,5-二甲基噻唑-2-基)-2,5-二苯基四唑翁溴化物)溶液20μl,作用4小时后加入溶解液dmso,100μl/孔,置培养箱内,次日用mk-2全自动酶标仪测570nmod值,计算半数抑制浓度ic50。
部分优选化合物的抗肿瘤活性详见表3,其中,样品1~21是指相应实施例中制备的吲哚酮螺四氢硫代吡喃类化合物,如化合物1表示在实施例1中所得到的化合物,同理类推。其中化合物22为专利cn201610924937.7中活性最优的化合物,化合物23为专利cn201410233972.5中活性最优的化合物,结构如表4所示。其中化合物21未进行活性测试。
表4本发明部分化合物对肿瘤细胞的半数抑制浓度ic50(单位:μm)
10μm(%)为在化合物浓度为10μm条件下对肿瘤细胞的抑制率,若大于50%,则进一步通过浓度梯度测试其ic50;cpt为喜树碱。
结果显示,本专利申请的化合物总体表现出广谱、中等的抗肿瘤活性,部分化合物的活性要优于对照化合物22和23。其中化合物7,9,11,13,16对肺癌a549的半数抑制浓度ic50低于5μm,优于对照药22,23和nutlin-3。化合物13总体表现广谱、较强的抗肿瘤活性,对三种肿瘤细胞株的ic50都低于12μm,明显优于对照药nutlin-3,可作为抗肿瘤的先导结构进行更加深入的研究。此外,本专利申请的化合物含有羟基、氨基等易于衍生化的基团,便于快速衍生化,发现活性优良的抗肿瘤先导化合物。
- 还没有人留言评论。精彩留言会获得点赞!