SETD1B蛋白及其编码基因在肝癌诊断治疗中的应用的制作方法
本发明涉及生物医药领域,具体涉及一种setd1b蛋白及其编码基因在肝癌诊断治疗中的应用。
背景技术:
肝细胞癌是目前临床上最常见的恶性肿瘤之一,据统计,在全球范围内,每年大约有74万新增肝癌病例,同时又有70万肝癌死亡病例,这其中大约一半发生在中国。由于肝癌的高发病率和高死亡率,肝癌在世界范围内都尤为重视,而我国的肝癌发病率及死亡率也呈逐年上升趋势,肝癌高居各种恶性肿瘤相关死亡原因的总体第2位,严重危害人类健康,已成为全球性的、严峻的公共卫生问题。肝癌的发生和发展是一个复杂的生物学过程。除了病人自身易感的遗传因素之外,各种细胞外因素可导致肝干细胞的异常增殖和分化,并最终导致肝癌的发生和发展。快速增殖与转移是肝癌重要的生物学特点之一,肝癌的快速增殖与转移是导致许多肝癌患者预后较差,5年生存率低的重要因素之一。因此,研究导致肝癌快速增殖与转移的原因,揭示肝癌发病的分子机制对提高肝癌患者预后有着极其重要的作用。
setd1b基因(nm_001353345)位于人类12号染色体q24.31,含有18个外显子。setd1b蛋白是组蛋白甲基转移酶复合体(histonemethyltransferasecomplex,hmt)的一个组分,hmtc负责组蛋白第三亚基四号赖氨酸的三甲基化(h3k4me3),在表观遗传研究中,h3k4me3是作为一个组蛋白密码,或者组蛋白标识来识别基因启动子。在细胞中,h3k4me3组蛋白修饰被发现呈现很高的丰度,并且在转录起始位点附近h3k4me3富集在激活的启动子上。h3k4me3对细胞功能的维持至关重要,它不仅是相关基因的正调控的标记因子,更是细胞维持分化及增殖的身份标记。setd1b作为hmt的一部分,其分子研究进展仍接近空白。
技术实现要素:
本发明的目的是提供一种setd1b蛋白及其编码基因在肝癌诊断治疗中的应用。
本发明首先保护用于检测setd1b基因的产品在制备试剂盒中的应用;所述试剂盒的用途为诊断肿瘤。
本发明还保护用于检测setd1b蛋白的产品在制备试剂盒中的应用;所述试剂盒的用途为诊断肿瘤。
本发明还保护一种试剂盒,包括用于检测setd1b基因的产品;所述试剂盒的用途为诊断肿瘤。
本发明还保护一种试剂盒,包括用于检测setd1b蛋白的产品;所述试剂盒的用途为诊断肿瘤。
以上任一所述“用于检测setd1b基因的产品”为用于检测setd1b基因表达水平的产品。以上任一所述“用于检测setd1b蛋白的产品”为用于检测表达量和/或活性的产品。所述用于检测setd1b基因表达水平的产品可为检测待测样本中所述setd1b基因表达水平的引物、探针、芯片、核酸膜条、制剂或试剂盒。所述产品具体可为特异引物对,由引物f和引物r组成;
所述引物f为如下(e1)或(e2):
(e1)序列表的序列3所示的单链dna分子;
(e2)将序列3经过一个或几个核苷酸的取代和/或缺失和/或添加且与序列3具有相同功能的dna分子;
所述引物r为如下(e3)或(e4):
(e3)序列表的序列4所示的单链dna分子;
(e4)将序列4经过一个或几个核苷酸的取代和/或缺失和/或添加且与序列4具有相同功能的dna分子。
所述待测样本可为人源样本。所述待测样本可为细胞、组织、脏器、体液(血液、淋巴液)、消化液、咳痰、肺胞支气管清洗液、尿或粪便。
本发明还保护用于诊断肿瘤的系统,为系统a或系统b或系统c或系统d。
所述系统a包括用于检测setd1b基因的表达水平的物质和数据处理装置;所述数据处理装置内设模块1和模块2,所述模块1具有如下(a1)所示功能,所述模块2具有如下(a2)所示功能:
(a1)分别比较取自待测者和健康对照者的离体样本中所述setd1b基因的表达水平;
(a2)根据(a1)的比较结果按照如下确定所述待测者是否为肿瘤患者:若与所述健康对照者相比,所述待测者的离体样本中所述setd1b基因的表达水平上调,则所述待测者为或候选为肿瘤患者;反之,则所述待测者不为或候选不为肿瘤患者。
所述系统b包括用于检测setd1b蛋白的表达量和/或活性的物质和数据处理装置;所述数据处理装置内设模块3和模块4,所述模块3具有如下(b1)所示功能,所述模块4具有如下(b2)所示功能:
(b1)分别比较取自待测者和健康对照者的离体样本中所述setd1b蛋白的表达量和/或活性;
(b2)根据(b1)的比较结果按照如下确定所述待测者是否为肿瘤患者:若与所述健康对照者相比,所述待测者的离体样本中所述setd1b蛋白的表达量和/或活性上调,则所述待测者为或候选为肿瘤患者;反之,则所述待测者不为或候选不为肿瘤患者。
所述系统c包括用于检测setd1b基因的表达水平的物质和数据处理装置;所述数据处理装置内设模块5和模块6,所述模块5具有如下(c1)所示功能,所述模块6具有如下(c2)所示功能:
(c1)分别比较取自待测者疑似肿瘤组织和该组织以外的其他正常组织的离体样本中所述setd1b基因的表达水平;
(c2)根据(c1)的比较结果按照如下确定所述待测者是否为肿瘤患者:若与所述正常组织相比,所述待测者的疑似肿瘤组织中所述setd1b基因的表达水平上调,则所述待测者为或候选为肿瘤患者;反之,则所述待测者不为或候选不为肿瘤患者。
所述系统d包括用于检测setd1b蛋白的表达量和/或活性的物质和数据处理装置;所述数据处理装置内设模块7和模块8,所述模块7具有如下(d1)所示功能,所述模块8具有如下(d2)所示功能:
(d1)分别比较取自待测者疑似肿瘤组织和该组织以外的其他正常组织的离体样本中所述setd1b蛋白的表达量和/或活性;
(d2)根据(d1)的比较结果按照如下确定所述待测者是否为肿瘤患者:若与所述正常组织相比,所述待测者的疑似肿瘤组织中所述setd1b蛋白的表达量和/或活性上调,则所述待测者为或候选为肿瘤患者;反之,则所述待测者不为或候选不为肿瘤患者。
所述离体样本可为细胞、组织、脏器、体液(血液、淋巴液)、消化液、咳痰、肺胞支气管清洗液、尿或粪便。
以上任一所述“用于检测setd1b基因的产品”或所述“用于检测setd1b蛋白的产品”或所述“用于诊断肿瘤的系统”可以单独用于诊断肿瘤,也可以与“用于检测肿瘤标志物甲胎蛋白(afp)的产品”结合用于诊断肿瘤,增加诊断结果的准确性。
所述特异引物对也属于本发明的保护范围。
本发明还保护setd1b蛋白或setd1b基因作为靶点在诊断肿瘤和/或肿瘤靶向治疗和/或筛选肿瘤药物中的应用。
所述肿瘤药物为预防和/或治疗肿瘤的药物。
所述筛选肿瘤药物的方法包括如下步骤:(1)采用候选物质处理表达和/或含有所述setd1b基因的体系;设置不采用候选物质处理的平行对照;(2)完成步骤(1)后,检测体系中所述setd1b基因的表达水平;与平行对照相比,如果采用候选物质处理的体系中所述setd1b基因的表达量显著降低(降低20%以上,较加降低50以上,更加降低80%以上)、所述候选物质可作为候选的肿瘤药物。
所述筛选肿瘤药物的方法包括如下步骤:(1)采用候选物质处理表达和/或含有所述setd1b蛋白的体系;设置不采用候选物质处理的平行对照;(2)完成步骤(1)后,检测体系中所述setd1b蛋白的表达量和/或活性;与平行对照相比,如果采用候选物质处理的体系中所述setd1b蛋白的表达量和/或活性显著降低(降低20%以上,较加降低50以上,更加降低80%以上)、所述候选物质可作为候选的肿瘤药物。
所述体系可为细胞体系、亚细胞体系、溶液体系、组织体系、器官体系或动物体系。
本发明还保护用于抑制setd1b蛋白表达量和/或活性的物质,或,用于抑制setd1b基因表达的物质在制备产品中的应用;所述产品的用途为如下(f1)-(f7)中的至少一种:
(f1)抑制癌细胞增殖;
(f2)促进癌细胞凋亡;
(f3)抑制癌细胞转移;
(f4)抑制癌细胞扩散;
(f5)抑制肿瘤转移;
(f6)抑制肿瘤扩散;
(f7)治疗肿瘤。
本发明还保护一种产品(产品甲),其活性成分为用于抑制setd1b蛋白表达量和/或活性的物质,或,用于抑制setd1b基因表达的物质;所述产品的用途为如下(f1)-(f7)中的至少一种:
(f1)抑制癌细胞增殖;
(f2)促进癌细胞凋亡;
(f3)抑制癌细胞转移;
(f4)抑制癌细胞扩散;
(f5)抑制肿瘤转移;
(f6)抑制肿瘤扩散;
(f7)治疗肿瘤。
以上任一所述“抑制setd1b蛋白表达量和/或活性的物质”或“用于抑制setd1b基因表达的物质”可为以所述setd1b基因或其转录本为靶序列且能够抑制所述dna表达或转录的干扰分子,具体可包括shrna(小发夹rna)、小干扰rna(sirna),dsrna、微小rna、反义核酸,或,能表达或形成所述shrna、小干扰rna,dsrna、微小rna、反义核酸的构建物。
所述“抑制setd1b蛋白表达量和/或活性的物质”或“用于抑制setd1b基因表达的物质”可为化合物或化疗剂。所述化疗剂可包括微管激活剂、烷化剂、抗赘生抗代谢物、铂类化合物、dna一烷化剂、抗肿瘤抗生素剂、抗代谢剂、微管蛋白稳定剂、微管蛋白去稳定剂、激素拮抗剂、拓扑异构酶抑制剂、蛋白激酶抑制剂、hmg-coa抑制剂、cdk抑制剂、细胞周期蛋白抑制剂、肌天蛋白酶抑制剂、金属蛋白酶抑制剂、反义核酸、三链螺旋dna、核酸适体或分子修饰的病毒、细菌和外毒素试剂。
所述“抑制setd1b蛋白表达量和/或活性的物质”或“用于抑制setd1b基因表达的物质”具体可为sirna,为sirna1或sirna2。
所述sirna1由正义链1和反义链1组成;所述正义链1如序列表的序列5所示;所述反义链1由序列表的序列6所示。
所述sirna2由正义链2和反义链2组成;所述正义链2如序列表的序列7所示;所述反义链2由序列表的序列8所示。
以上任一所述产品(产品甲)可为药物组合物。
所述药物组合物包括以上任一所述“抑制setd1b蛋白表达量和/或活性的物质”或“用于抑制setd1b基因表达的物质”。
所述药物组合物还可包括药学上可接受的载体。所述药学上可接受的载体可为缓冲剂、乳化剂、悬浮剂、稳定剂、防腐剂、生理食盐、赋形剂、填充剂、凝结剂与调和剂、界面活性剂、扩散剂或消泡剂。
所述药物组合物还可包括可药用载体。所述可药用载体可为病毒、微囊、脂质体、纳米颗粒或聚合物及其任意组合。所述可药用载体的递送载剂可为脂质体、生物相容性聚合物(包括天然聚合物和合成聚合物)、脂蛋白、多肤、多糖、脂多糖、人工病毒包膜、无机(包括金属)颗粒、以及细菌或病毒(例如杆状病毒、腺病毒和逆转录病毒)、噬菌体、黏粒或质粒载体。
所述药物组合物还可与其他治疗肿瘤的药物联用,其他治疗性化合物可以与主要的活性成分同时给药,甚至在同一组合物中同时给药。
所述药物组合物还可以以单独的组合物或与主要的活性成分不同的剂量形式单独给予其它治疗性化合物。主要成分的部分剂量可以与其它治疗性化合物同时给药,而其它剂量可以单独给药。在治疗过程中,可以根据症状的严重程度、复发的频率和治疗方案的生理应答,调整本发明药物组合物的剂量。
所述sirna1或sirna2也属于本发明的保护范围。
以上任一所述setd1b蛋白是如下(g1)或(g2):
(g1)由序列表中序列1所示的氨基酸序列组成的蛋白质;
(g2)将序列1的氨基酸序列经过一个或几个氨基酸残基的取代和/或缺失和/或添加且具有相同功能的由序列1衍生的蛋白质。
以上任一所述setd1b基因为如下(h1)或(h2)或(h3):
(h1)编码区如序列表的序列2自5’端第15-5915位所示的dna分子;
(h2)序列表的序列2所示的dna分子;
(h3)与(h1)或(h2)限定的dna序列具有90%以上同源性且编码setd1b蛋白的dna分子。
以上任一所述肿瘤可为实体肿瘤或血液肿瘤。所述肿瘤具体可为肝癌、肺癌、结肠癌、大肠癌、乳腺癌、卵巢癌、宫颈癌、胃癌、肾癌、胰腺癌、前列腺癌、淋巴瘤、神经胶质瘤或黑色素瘤。
以上任一所述癌细胞可为肝癌细胞。所述肝癌细胞具体可为人肝癌细胞株mhcc-97l、lm3或smmc-7721。
本发明的发明人经过大量研究发现,setd1b蛋白及其编码基因在肝癌患者肿瘤组织和血浆中高表达,这一发现提示通过研究setd1b蛋白及其编码基因的生物学功能及其在疾病中的调控机制,能够更全面的理解肝癌的发生机理,寻找新的肝癌诊断标志物以及治疗靶点,本发明为肝癌的个性化治疗提供了新途径。
附图说明
图1为利用qpcr检测setd1b基因在肝癌患者中的表达情况图。
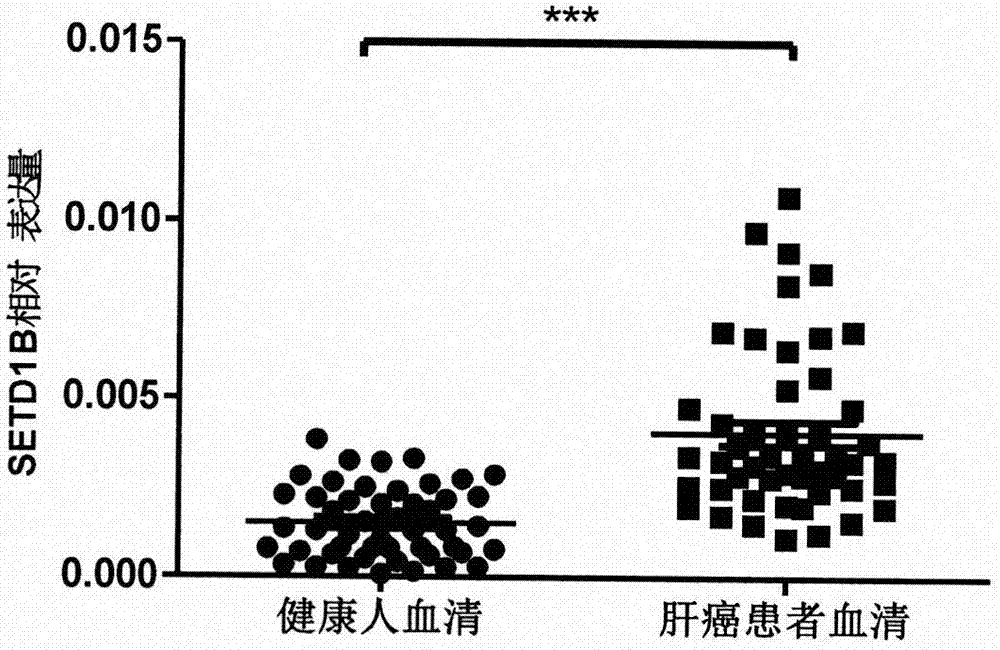
图2为setd1b基因在健康人血浆和肝癌患者血浆中的表达情况。
图3为setd1b基因在肝癌患者中的roc曲线图。
图4为setd1b蛋白和setd1b基因在肝癌细胞中的表达情况图;其中,图a为setd1b基因在肝癌细胞中的表达情况,图b为setd1b蛋白在肝癌细胞中的表达情况。
图5为检测转染sirna对肝癌细胞中setd1b基因的表达影响图。
图6为利用cck8检测setd1b基因对细胞增殖的影响图。
图7为检测setd1b基因对细胞的克隆形成集落的影响图。
图8为检测setd1b基因对肝癌细胞凋亡的影响图。
图9为transwell小室检测setd1b基因对肝癌细胞迁移和侵袭的影响图;其中,图a为setd1b基因对肝癌细胞迁移的影响图,图b为setd1b基因对肝癌细胞侵袭的影响图。
具体实施方式
以下的实施例便于更好地理解本发明,但并不限定本发明。下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的试验材料,如无特殊说明,均为自常规生化试剂商店购买得到的。在本发明的具体实施例中,实验都是按照至少重复3次来完成的,结果数据都是以平均值±标准差的方式来表示,采用spss20.0统计软件来进行统计分析的,两者之间的差异采用t检验,认为当p<0.05时具有统计学意义。
实施例1、肝癌标志物的筛选
收集10例肝癌患者的癌组织及配对癌旁组织(患者均知情同意,上述所有标本的取得均通过组织伦理委员会的同意),通过二代测序分析,发现一个基因setd1b,setd1b基因在肝癌组织中的表达水平显著高于癌旁组织。
setd1b基因全长如序列表的序列2所示(编码区如序列2自5’端第15-5915位所示)。setd1b基因编码的蛋白质(setd1b蛋白)如序列表的序列1所示。
实施例2、setd1b基因差异表达验证
1、收集76例肝癌患者的癌组织及癌旁组织,患者均知情同意,上述所有标本的取得均通过组织伦理委员会的同意。
2、提取步骤1各样本的组织rna,并反转录为cdna。
3、以步骤2得到的各样本cdna为模板,采用qpcr的方法检测setd1b基因的表达情况(内参基因为gapdh基因)。采用引物f1和r1检测setd1b基因的表达,采用引物f2和r2检测gapdh基因的表达。
f1:5’-ctgggtctaccatccctcca-3’(序列表的序列3);
r1:5’-cttccggaacttgagctggt-3’(序列表的序列4);
f2:5’-ggtggtctcctctgacttcaaca-3’;
r2:5’-gttgctgtagccaaattcgttgt-3’。
结果如图1所示。结果表明,与癌旁组织相比,setd1b基因在肝癌组织中表达水平上调,差异具有统计学意义(p<0.001)。
实施例3、setd1b基因在肝癌患者血浆中的表达水平
1、收集49例健康人血浆标本、56例肝癌患者的血浆标本,患者均知情同意,上述所有标本的取得均通过组织伦理委员会的同意。
2、提取步骤1各样本的rna,并反转录为cdna。
3、以步骤2得到的各样本cdna为模板,采用qpcr的方法检测setd1b基因的表达情况(内参基因为gapdh基因)。采用引物f1和r1检测setd1b基因的表达,采用引物f2和r2检测gapdh基因的表达。
f1:5’-ctgggtctaccatccctcca-3’(序列表的序列3);
r1:5’-cttccggaacttgagctggt-3’(序列表的序列4);
f2:5’-ggtggtctcctctgacttcaaca-3’;
r2:5’-gttgctgtagccaaattcgttgt-3’。
结果如图2所示。结果表明,与健康人血浆中的表达水平相比,setd1b基因在肝癌患者血浆中表达水平上调,差异具有统计学意义(p<0.001)。
实施例4、setd1b基因在患者癌组织和癌旁组织的roc曲线分析
使用r语言中的proc包分析setd1b基因的受试者工作特征,计算二项精确置信空间,绘制roc曲线。
结果如图3所示。setd1b基因的auc值为0.839,且具有较好的特异性和敏感性,说明setd1b基因应用于肝癌的诊断具有较高的准确性。
实施例5、setd1b基因在肝癌细胞系中的差异表达
待测细胞:正常肝细胞系lo2(北京协和细胞库,资源编号:3131c0001000200006)、人肝癌细胞株mhcc-97l北京协和细胞资源中心。货号:3142c0001000000804)、lm3(北京协和细胞资源中心。货号:3142c0001000001033)和smmc-7721(北京协和细胞库,资源编号:3111c0001ccc000087)。
1、提取待测细胞的总rna,并反转录为cdna,以cdna为模板,进行qpcr检测setd1b基因的表达情况(内参基因为gapdh基因)。采用引物f1和r1检测setd1b基因的表达,采用引物f2和r2检测gapdh基因的表达。
f1:5’-ctgggtctaccatccctcca-3’(序列表的序列3);
r1:5’-cttccggaacttgagctggt-3’(序列表的序列4);
f2:5’-ggtggtctcctctgacttcaaca-3’;
r2:5’-gttgctgtagccaaattcgttgt-3’。
2、提取待测细胞的总蛋白,通过westernblot检测setd1b蛋白的表达情况(采用β-actin作为内参)。
setd1b一抗:abcam,货号:ab113984;β-actin一抗:cellsignalingtechnology,货号:#8457;二抗:cellsignalingtechnology,货号:#7074。
结果如图4所示。结果表明,与正常肝细胞系lo2相比,setd1b基因在人肝癌细胞株mhcc-97l、lm3和smmc-7721中表达均上调,差异具有统计学意义(p<0.001),setd1b蛋白的表达也有显著升高。
实施例6、setd1b基因的沉默
1、针对setd1b基因设计三组sirna,具体如下所示:
(1)阴性对照sirna序列(sirnanc):
正义链:5′-uucuccgaacgugucacgu-3′;
反义链:5’-acgugacacguucggagaa-3′;
(2)sirna1:
正义链:5’-uugaggaccccgaggaugau-3′(序列表的序列5);
反义链:5’-aucauccucgggguccucaa-3′(序列表的序列6);
(3)sirna2:
正义链:5’-gugguuaacacugggcacga-3′(序列表的序列7);
反义链:5’-ucgugcccaguguuaaccac-3′(序列表的序列8)。
2、将人肝癌细胞株smmc-7721按2×105个细胞/孔接种到六孔细胞培养板中,在37℃,5%co2培养箱中细胞培养24h;分别将步骤1的三组sirna(浓度为20nm/孔)采用脂质体转染试剂3000(invitrogen公司)转染smmc-7721细胞(转染方法参照体转染试剂试剂说明书),48h后收集细胞,提取总rna,并反转录为cdna,以cdna为模板,进行qpcr检测setd1b基因的表达情况(内参基因为gapdh基因)。采用引物f1和r1检测setd1b基因的表达,采用引物f2和r2检测gapdh基因的表达。
f1:5’-ctgggtctaccatccctcca-3’(序列表的序列3);
r1:5’-cttccggaacttgagctggt-3’(序列表的序列4);
f2:5’-ggtggtctcctctgacttcaaca-3’;
r2:5’-gttgctgtagccaaattcgttgt-3’。
结果如图5所示。结果表明,相比阴性对照sirna组,sirna1组和sirna2均能够显著降低setd1b基因的表达,差异具有统计学意义(p<0.05)。
实施例7、cck8检测细胞增殖实验
1、将对数增殖期的人肝癌细胞株smmc-7721接种于96孔板,每孔2×103个细胞,在37℃,5%co2培养箱中细胞培养24h。
2、取步骤1的96孔板,分别将实施例6设计的sirnanc、sirna1和sirna2转染smmc-7721细胞(转染方法参照体转染试剂试剂说明书),分别在转染24h、48h、72h和96h后加入10μl/孔cck8试剂;加入cck8后2h后使用酶标仪检测a450nm的吸光值。
结果如图6所示。结果表明,相比转染空载sirnanc,sirna1和sirna2组的细胞生长速度明显低对照组的细胞生长速度,差异具有统计学意义(p<0.05),上述结果表明setd1b基因的表达能够促进肝癌细胞的生长。
实施例8、软琼脂克隆形成实验
1、将对数增殖期的人肝癌细胞株smmc-7721接种于6孔板,每孔1.5×105个细胞,在37℃,5%co2培养箱中培养24h。
2、分别将实施例6设计的sirnanc、sirna1和sirna2转染smmc-7721细胞(转染方法参照体转染试剂试剂说明书),在转染24h后收集细胞,采用含20%胎牛血清的dmem培养基调整细胞浓度为5×103个细胞/ml,得到细胞悬液。
3、制备两个浓度分别为1.2%(质量百分含量)和0.7%(质量百分含量)的低溶点琼脂糖液,高压灭菌后,维持在40℃水浴中。
4、取1体积份步骤3中的1.2%(质量百分含量)低溶点琼脂糖液与1体积份的2×dmem培养基混合后,加入2×庆大霉素(100μg/ml)和20%(体积百分比)的小牛血清,得到混合液。取3ml混合液注入直径6cm平皿中放置5min冷却凝固,作为底层琼脂置于温箱中备用。
5、取1体积份步骤3中的0.7%(质量百分含量)低溶点琼脂糖液与1体积份的2×dmem培养基混合后,加入0.2ml步骤1得到的细胞悬液,充分混匀后注入步骤3制备的直径6cm平皿中,形成双琼脂层,每个实验组重复4个样本。待上层琼脂凝固后,将平皿置入37℃,5%co2温箱中培养,每3天加dmem培养基1.5ml,共培养14天。
6、取出步骤4的平皿,用1ml浓度为0.005%的龙胆紫染色90min。把平皿放置在倒置显微镜下观察,每组细胞随机选取10个低倍视野,镜下计算形成的细胞克隆数。
结果如图7所示。结果表明,相比转染空载sirnanc,sirna1和sirna2组的细胞组单细胞克隆集落形成数显著降低。
实施例9、setd1b基因对肝癌细胞凋亡的影响
1、将对数增殖期的人肝癌细胞株smmc-7721接种于12孔板,每孔1.0×105个细胞,在37℃,5%co2培养箱中培养24h。
2、分别将实施例6设计的sirnanc、sirna1和sirna2转染smmc-7721细胞(转染方法参照体转染试剂试剂说明书),在转染24h后收集细胞,annexin/fitc染色检测细胞凋亡。
结果如图8所示。结果表明,实验组与对照组相比,细胞凋亡率升高(p<0.05),该结果说明,setd1b基因的表达抑制肝癌细胞的凋亡。
实施例10、细胞迁移及侵袭实验
1、无菌条件下matrigel冰浴融化,用pbs进行20倍稀释,以50μl/孔的体积铺在transwell小室的聚碳酸醋膜上。37℃放置4h,待matrigel胶聚合成凝胶后取出,轻轻吸出上层析出液。每孔中加入50μl的含bsa的无血清培养液对基底膜进行水化处理,37℃放置30min。
2、将对数增殖期的人肝癌细胞株smmc-7721细胞接种于24孔板,每孔5×104个细胞,在37℃,5%co2培养箱中培养24h。
3、分别将实施例6设计的sirnanc、sirna1和sirna2转染smmc-7721细胞(转染方法参照体转染试剂试剂说明书),在转染24h后,更换无血清dmem培养基培养12h,收集细胞,采用无血清dmem培养基调整细胞浓度为5×105个细胞/ml,得到细胞悬液。
4、取步骤3制备的细胞悬液200μl(迁移实验为100μl,侵袭实验为200μl)加入到transwell小室中。在24孔板下室加入500μl含fbs的1640培养基。把细胞放入细胞培养箱中培养24h。
5、完成步骤4后,把小室细胞先用pbs漂洗2遍,放入dapi工作液中室温染色5-20min。用pbs漂洗2遍,放入荧光显微镜下观察并计数。
结果如图9所示。结果表明,在肝癌细胞转染干扰rna之后,与对照组相比,实验组的迁移及侵袭能力均有明显下降,结果说明setd1b基因能够促进肝癌细胞的迁移及侵袭。
- 还没有人留言评论。精彩留言会获得点赞!
- 降低种子重量的白桦AP2基因及其编码蛋白的制造方法与工艺
- 可编码ArtRD蛋白基因及其蛋白和应用的制造方法与工艺
- 蝎神经毒素AaIT及其编码基因与应用的制造方法与工艺
- 腈水解酶突变体及其编码基因和应用的制造方法与工艺
- 植物抗旱相关蛋白AsTMK1及其编码基因和应用的制造方法与工艺
- 植物抗旱相关蛋白EtSnRK2.2及其编码基因和应用的制造方法与工艺
- OsSAPK7蛋白及其编码基因在提高水稻白叶枯病抗性中的应用的制造方法与工艺
- 一种抗除草剂抗虫融合基因、编码蛋白及应用的制造方法与工艺
- 毛果杨PtrZFP103基因及其编码蛋白和应用的制造方法与工艺
- 大豆bHLH转录因子基因GmFER及其编码蛋白和应用的制造方法与工艺
- 一种抗草甘膦融合基因、编码蛋白及其应用的制作方法与工艺
- 一种水稻粒型基因DSS及其编码蛋白质和应用的制作方法与工艺
- 抗逆相关蛋白IbCPK28及其编码基因与应用的制作方法与工艺
- 抗逆相关蛋白RtKCO1及其编码基因与应用的制作方法与工艺
- OsSGT1蛋白及其编码基因在调控植物耐盐抗性中的应用的制作方法与工艺
- 植物抗逆性相关蛋白GhMYB4及编码基因与应用的制作方法与工艺
- 一种玉米籽粒发育相关蛋白、编码基因及应用的制作方法与工艺
- 黄瓜CsERF004基因及其编码蛋白和应用的制作方法与工艺
- 大豆辅助分子伴侣蛋白编码基因GmHSP40在调控植物开花上的应用的制作方法与工艺
- 白桦BpSPL9基因及其编码蛋白和应用的制作方法与工艺
- 腈水解酶突变体及其编码基因和应用的制造方法与工艺
- 植物抗旱相关蛋白AsTMK1及其编码基因和应用的制造方法与工艺
- 植物抗旱相关蛋白EtSnRK2.2及其编码基因和应用的制造方法与工艺
- OsSAPK7蛋白及其编码基因在提高水稻白叶枯病抗性中的应用的制造方法与工艺
- 一种抗除草剂抗虫融合基因、编码蛋白及应用的制造方法与工艺
- 毛果杨PtrZFP103基因及其编码蛋白和应用的制造方法与工艺
- 大豆bHLH转录因子基因GmFER及其编码蛋白和应用的制造方法与工艺
- 一种花狭口蛙的基因及其编码的多肽和该多肽的用途的制造方法与工艺
- 一种泽陆蛙基因及其编码的多肽和该多肽的用途的制造方法与工艺
- 一种水稻MIT1基因、其编码蛋白及应用的制造方法与工艺