一种比率双光子及近红外检测HClO的荧光探针、制备及应用的制作方法
本发明属于合成与检测技术领域,具体涉及一种比率双光子及近红外检测hclo的荧光探针、制备及应用。
背景技术
次氯酸(hclo)在生理过程中可作为消毒剂和氧化剂发挥作用,内源性的hclo通常是免疫细胞在炎症反应时分泌的髓过氧化物酶(mpo)催化氯离子与过氧化氢发生氧化反应生成的。另外,越来越多的研究结果表明,除了吞噬小体能够在病原体的刺激下产生hclo,非吞噬体也可以在多种可溶性刺激物诱导下生成hclo。正常含量的hclo能够对生物体起到保护作用,hclo的失调,尤其是过量的hclo生成会氧化破坏核酸、蛋白质、胆固醇以及脂质体等多种生物功能分子,进而造成严重的组织损伤、器官功能紊乱和各种疾病的发生(肝脏缺血再灌注损伤、肺组织损伤及神经元退行性病变等)。
因此,能够在活体水平上快速、高灵敏、高选择性的可视化hclo对于疾病的早期诊断、监测炎症等疾病的动态变化以及研究其生理及病理学机理具有非常重要的意义。
《次氯酸荧光探针的合成及应用研究》中涉及一种二甲胺基硫代甲酰基与4二乙氨基水杨醛,二甲胺基硫代甲酰基作为羟基的保护基团,并且作为次氯酸的识别位点。没有实现hclo浓度检测的比率双光子及近红外检测的特点。
技术实现要素:
针对上述现有技术中存在的问题,本发明的一个目的是提供一种比率双光子及近红外检测hclo的荧光探针、制备及应用。该探针能够与hclo反应并呈现出比率型、双光子及近红外的荧光信号变化。因此,该探针基于sharpless烯合成反应的设计可以用来检测hclo,探针结构简单,具有高选择性、高灵敏及瞬时响应等优点。
为了解决以上技术问题,本发明的技术方案为:
一种比率双光子及近红外检测hclo的荧光探针,其结构式如下:
其中-seph为
上述荧光探针的制备路线如下:
本发明的第二个目的是提供上述荧光探针的制备方法,具体步骤如下:
1)化合物cou-1的合成:
4-(二乙胺基)水杨醛溶于无水乙醇,与乙酰乙酸乙酯、哌啶进行回流反应,静置,冷却,减压抽滤,洗涤沉淀,重结晶得到cou-1;
2)化合物cou-2的合成:
将步骤1)得到的cou-1和4–二乙氨基苯甲醛溶于污水乙醇,得到溶液a,在溶液a中加入催化剂哌啶,进行回流反应,将得到反应液旋干,分离提纯,得到cou-2;
3)化合物cou-3的合成:
将步骤2)得到的cou-2溶于无水乙醇,得到溶液b,在溶液b中依次加入催化剂pd/c,环己烯,进行回流反应,将反应的溶液过滤,旋干后,进行分离提纯得到cou-3;
4)化合物cou-4的合成:
将二异丙基氨基锂(lda)、cou-3、苯基溴化硒分别溶于四氢呋喃溶液中,将cou-3溶液加入lda中进行反应,将苯基溴化硒溶液加入反应后的溶液中,反应结束后在反应后的液体中加入水进行猝灭,将得到的反应液旋干、分离提纯得到探针cou-4。
优选的,所述步骤1)中4-(二乙胺基)水杨醛在无水乙醇中的浓度为0.8-1.2mmol/ml,4-(二乙胺基)水杨醛与乙酰乙酸乙酯、哌啶的摩尔比为8-12:8-12:1;步骤1)中的回流反应的温度为80℃,惰性气体保护下进行,回流时间为4.5-5.5h。
进一步优选的,所述步骤1)中4-(二乙胺基)水杨醛在无水乙醇中的浓度为0.9-1.1mmol/ml,4-(二乙胺基)水杨醛与乙酰乙酸乙酯、哌啶的摩尔比为9-11:9-11:1;步骤1)中的回流反应的温度为80℃,回流时间为4.5-5.5h。
优选的,所述步骤2)中cou-1和4–二乙氨基苯甲醛的摩尔比为0.8-1.2:1,溶液a与催化剂哌啶的体积比为190-215:1,分离提纯的试剂为乙酸乙酯:石油醚的混合物。
进一步优选的,所述步骤2)中溶液a与催化剂哌啶的体积比为195-210:1,cou-1和4–二乙氨基苯甲醛的摩尔比为0.9:1.1。
优选的,所述步骤2)中回流反应在惰性气体保护下进行,乙酸乙酯与石油醚的体积为1:8-12,回流反应的条件为80℃,回流的时间为9.5-10.5h。
进一步优选的,所述步骤2)中乙酸乙酯与石油醚的体积比为1:9-11,回流反应的条件为80℃。
优选的,所述步骤3)中cou-2在无水乙醇中的浓度为0.04-0.06mmol/ml,cou-2与环己烯的摩尔比为1:1.3-1.6;cou-2与催化剂pd/c的质量比为18-23:1。
进一步优选的,所述步骤3)中cou-2与环己烯的摩尔比为1:1.4-1.5,cou-2与催化剂pd/c的质量比为19-21:1。
优选的,所述步骤3)中回流反应的温度为80℃,回流时间为4.5-5.5h,分离提纯的试剂为二氯甲烷和石油醚的混合物,二氯甲烷与石油醚的摩尔比为1.5-2.5:1。
进一步优选的,所述步骤3)中回流反应的温度为80℃,回流时间为4.5-5.5h,二氯甲烷与石油醚的摩尔比为1.8-2.3:1。
优选的,所述步骤4)中二异丙基氨基锂的溶液的浓度为0.07-0.08mol/l,cou-3溶液的浓度为0.03-0.07mmol/ml,苯基溴化硒的浓度为0.03-0.07mmol/ml,猝灭的水的体积与反应后的液体的体积比为1:2710-2720。
进一步优选的,所述步骤4)中cou-3溶液的浓度为0.04-0.06mmol/ml,苯基溴化硒的浓度为0.04-0.06mmol/ml,猝灭的水的体积与反应后的液体的体积比为1:2713-2716。
优选的,所述步骤4)中反应在温度为-78℃,惰性气体保护下进行,二异丙基氨基锂与cou-3反应的时间为25-35min,苯基溴化硒加入后反应的时间为1.5-2.5h,分离提纯的试剂为乙酸乙酯和石油醚的混合物,乙酸乙酯和石油醚的体积比为1:1。
进一步优选的,所述步骤4)中二异丙基氨基锂与cou-3反应的时间为25-35min,苯基溴化硒加入后反应的时间为1.5-2.5h。
上述探针在检测hclo中的应用。
本发明设计的机理为:
本发明基于sharpless烯合成反应机理,设计合成了一种有机硒醚结构的探针,该探针不仅能够高灵敏、高选择性以及瞬时响应hclo,而且其比率、双光子和近红外的性能也成功应用于体外及体内的hclo检测。与具有波长蓝移(多基于共轭结构被打断)、红移波长较短(多基于ict、esipt等)、双荧光母体(多基于内标型、fret等)以及两种波长均在可见光区等特点的传统比率型探针不同的是,该探针结构简单,通过与离去基团结合破坏共轭体系,探针在与hclo反应之前共轭体系较小,与hclo反应后生成烯键,共轭结构增大,导致波长红移,形成了短波长荧光强度降低,同时长波长荧光强度增强的比率型荧光变化。这种设计方法也为设计检测生物体内的其它活性物质或疾病标志物的光学探针提供了一种新的思路,即同时结合比率、双光子和近红外等更加适用于生物体系中的检测性质。
本发明的有益效果:
1)探针结构简单、选择性好、灵敏度高、瞬时响应。
2)探针在与hclo反应之前共轭体系较小,与hclo反应后生成烯键,共轭结构增大,导致波长红移,形成了短波长荧光强度降低,同时长波长荧光强度增强的比率型荧光变化。比率型变化有效提高了信噪比。
3)比率检测信号不受探针浓度变化、光源变化以及在体微环境的影响,可以更好的反映真实的生物样本情况。
4)双光子和近红外检测:探针的双光子激发、近红外发射穿透深度大,更适用于活体检测。
附图说明
构成本申请的一部分的说明书附图用来提供对本申请的进一步理解,本申请的示意性实施例及其说明用于解释本申请,并不构成对本申请的不当限定。
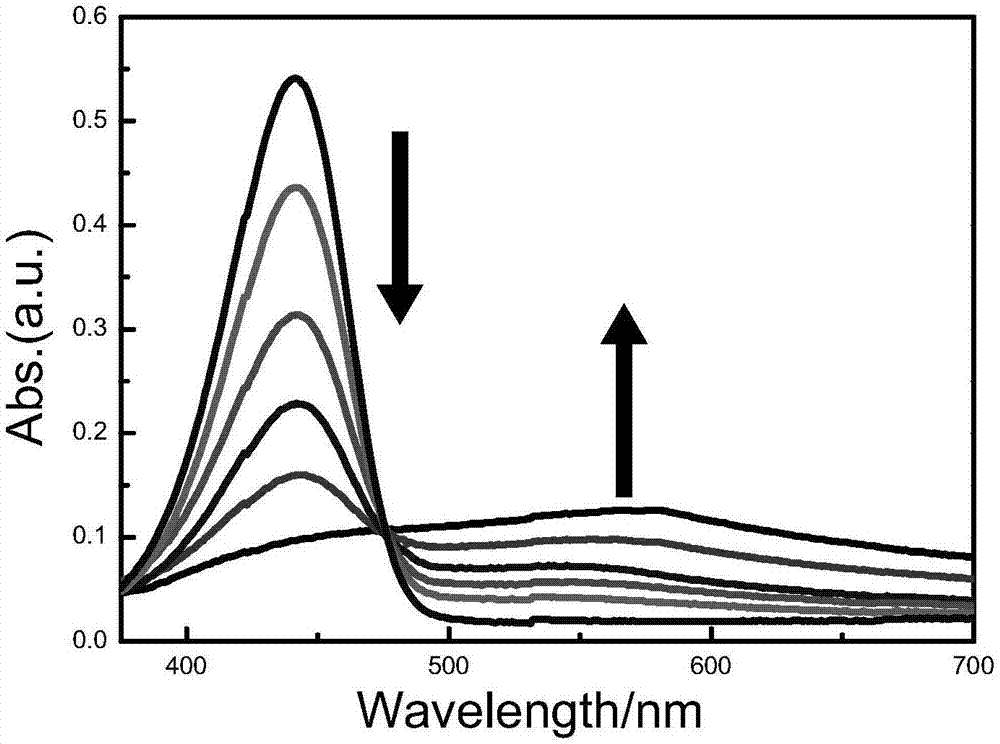
图1是本发明小分子荧光探针与hclo反应时的吸收光谱谱图。横坐标为波长(nm),纵坐标为吸光度。
图2是本发明小分子荧光探针对不同浓度的hclo的荧光响应光谱图。探针的激发波长为475nm,横坐标为波长(nm),纵坐标为荧光强度。
图3是本发明小分子荧光探针对不同浓度hclo线性关系。探针的激发波长为475nm,横坐标为波长(nm),纵坐标为618nm波长处的荧光强度与495nm波长处的荧光强度比值。
图4是本发明小分子荧光探针在不同ph环境中对hclo的响应。探针的激发波长为475nm,横坐标为ph值,纵坐标为618nm波长处的荧光强度与495nm波长处的荧光强度比值。
图5是本发明小分子荧光探针与hclo响应的动力学实验。探针的激发波长为475nm,横坐标为时间,纵坐标为荧光强度。
图6是本发明小分子荧光探针对hclo的选择性实验。探针的激发波长为475nm,横坐标为干扰物、待测物及探针空白,纵坐标为618nm波长处的荧光强度与495nm波长处的荧光强度比值。
图7是本发明小分子荧光探针对hclo的选择性实验。探针的激发波长为475nm,横坐标为干扰物和待测物,纵坐标为618nm波长处的荧光强度与495nm波长处的荧光强度比值。
图8是本发明小分子荧光探针与hclo反应机理的质谱表征。
图9是本发明小分子荧光探针与hclo反应机理的高效液相色谱表征。横坐标为保留时间。
图10是本发明小分子荧光探针与hclo反应的机理示意图。
图11是本发明小分子荧光探针检测巨噬细胞外源性hclo的双光子共聚焦成像图。
图12是本发明小分子荧光探针检测巨噬细胞内源性hclo的双光子共聚焦成像图。
具体实施方式
应该指出,以下详细说明都是例示性的,旨在对本申请提供进一步的说明。除非另有指明,本文使用的所有技术和科学术语具有与本申请所属技术领域的普通技术人员通常理解的相同含义。
需要注意的是,这里所使用的术语仅是为了描述具体实施方式,而非意图限制根据本申请的示例性实施方式。如在这里所使用的,除非上下文另外明确指出,否则单数形式也意图包括复数形式,此外,还应当理解的是,当在本说明书中使用术语“包含”和/或“包括”时,其指明存在特征、步骤、操作、器件、组件和/或它们的组合。
下面结合实施例对本发明进一步说明
实施例1
1)化合物cou-1的合成:
氩气保护下,在50ml两口烧瓶中,将4-(二乙胺基)水杨醛(3.86g,20mmol)溶于20ml无水乙醇,然后向反应液中依次加入乙酰乙酸乙酯(2.50ml,20mmol),哌啶(200μl,2mmol),升温至80℃回流4.5-5.5h,反应完毕得到橘黄色溶液,静置,冷却,有黄色晶体析出,减压抽滤,冰乙醇洗涤沉淀,得到亮黄色固体,无水乙醇重结晶两次,得到化合物cou-1纯品3.28g,转化率为63.32%。
2)化合物cou-2的合成:
将化合物cou-1(259.30mg,1mmol)和4–二乙氨基苯甲醛(177mg,1mmol)溶于8ml无水乙醇,滴加催化量哌啶,80℃回流过夜,得暗红色反应液。将反应混合液旋干后,通过硅胶柱层析的方法分离提纯产品,淋洗剂为乙酸乙酯:石油醚=1:10,得到红色固体cou-2,158.89mg,转化率为38.01%。
3)化合物cou-3的合成:
氩气保护下将化合物cou-2(418.5mg,1mmol)溶于20ml无水乙醇,依次加入催化量pd/c,环己烯(123mg,1.5mmol),80℃回流4.5-5.5h的黄绿色溶液。将pd/c残渣过滤,反应液旋干后,通过柱层析的方法分离提纯,淋洗剂为二氯甲烷:石油醚=2:1,得到黄色固体cou-3,382.3mg,转化率为91%。
4)化合物cou-4的合成:
在氩气保护、-78℃的条件下,将二异丙基氨基锂(lda,2mol/l,1.5ml)溶于40ml四氢呋喃溶液中,然后将同样溶于20ml四氢呋喃溶液的化合物cou-3(420mg,1mmol)滴加入lda溶液中,反应25-35min后,将溶于20ml四氢呋喃溶液的苯基溴化硒(236mg,1mmol),滴加进反应液中,继续搅拌1.5-2.5h,反应结束后滴加30μl水猝灭反应。将反应液旋干,通过硅胶柱层析的方法分离最终的化合物,淋洗剂为乙酸乙酯:石油醚=1:1,得到黄色固体cou-4,49mg,转化率为8.5%。
实施例1得到的探针cou-4的质谱及核磁表征:
hrms-esi(m/z):calcdforc32h36n2o3se[m+h]+577.1966;found577.1982。
1hnmr(400mhz,dmso):δ8.56(s,1h),7.67(d,j=9.04,1h),4.31(m,5h),6.93(d,j=8.52,2h),6.80(d,j=9.04,1h),6.58(s,1h),6.51(d,j=8.60,2h),3.47(q,j=6.80,4h),3.22(q,j=7.00,4h),3.06(d,j=5.48,2h),2.79(t,j=9.68,1h),1.13(t,j=7.04,6h),1.01(t,j=7.00,6h).
13cnmr(101mhz,cdcl3)δ191.48,160.60,158.67,152.90,148.51,147.97,136.76,131.79,131.56,130.12,129.36,128.74,128.62,112.34,109.75,108.62,108.28,96.60,45.13,44.45,35.19,29.26,12.61,12.46.
实施例2
1)化合物cou-1的合成:
氩气保护下,在50ml两口烧瓶中,将4-(二乙胺基)水杨醛(3.86g,20mmol)溶于20ml无水乙醇,然后向反应液中依次加入乙酰乙酸乙酯(2.50ml,20mmol),哌啶(200μl,2mmol),升温至80℃回流4.5-5.5h,反应完毕得到橘黄色溶液,静置,冷却,有黄色晶体析出,减压抽滤,冰乙醇洗涤沉淀,得到亮黄色固体,无水乙醇重结晶两次,得到化合物cou-1纯品质量为3.28g,转化率为63.32%。
2)化合物cou-2的合成:
将化合物cou-1(259.30mg,1mmol)和4–二乙氨基苯甲醛(177mg,1mmol)溶于8ml无水乙醇,滴加催化量哌啶,80℃回流过夜,得暗红色反应液。将反应混合液旋干后,通过硅胶柱层析的方法分离提纯产品,淋洗剂为乙酸乙酯:石油醚=1:10,得到红色固体cou-2质量为158.89mg,转化率为38.01%。
3)化合物cou-3的合成:
氩气保护下将化合物cou-2(418.5mg,1mmol)溶于20ml无水乙醇,依次加入催化量pd/c,环己烯(123mg,1.5mmol),80℃回流4.5-5.5h的黄绿色溶液。将pd/c残渣过滤,反应液旋干后,通过柱层析的方法分离提纯,淋洗剂为二氯甲烷:石油醚=2:1,得到黄色固体cou-3质量为382.3mg,转化率为91%。
4)化合物cou-4的合成:
在氩气保护、-78℃的条件下,将二异丙基氨基锂(lda,2mol/l,1.5ml)溶于40ml四氢呋喃溶液中,然后将同样溶于20ml四氢呋喃溶液的化合物cou-3(420mg,1mmol)滴加入lda溶液中,反应25-35min后,将溶于20ml四氢呋喃溶液的苯基溴化硒(236mg,1mmol),滴加进反应液中,继续搅拌1.5-2.5h,反应结束后滴加30μl水猝灭反应。将反应液旋干,通过硅胶柱层析的方法分离最终的化合物,淋洗剂为乙酸乙酯:石油醚=1:1,得到黄色固体cou-4质量为49mg,转化率为8.5%。
实施例3和实施例4所用探针cou-4由实施例1制备得到。
实施例3
探针对hclo的响应实验:
首先,研究了探针的吸收变化。cou-4(10μm)在pbs缓冲溶液(0.05m,ph=7.4)中测定了与系列浓度hclo(0-50μm)响应时的吸收光谱变化,实验结果如图1所示:随着向cou-4(10μm)中加入的hclo浓度增加,450nm处的吸收峰逐渐降低,580nm处的吸收峰逐渐增强,并且在475nm出现等吸收点。
然后,研究了探针对hclo的荧光响应。cou-4(10μm)在pbs缓冲溶液(0.05m,ph=7.4)中测定了与系列浓度hclo(0-50μm)响应时的荧光光谱变化,激发波长为475nm。实验结果如图2、图3所示:随着向cou-4(10μm)中加入的hclo浓度增加,495nm处的荧光峰逐渐降低,618nm处的荧光峰逐渐增强,618nm处荧光强度与495nm处荧光强度的比值(i618nm/i495nm)增强了241倍。当hclo浓度在2.5μm-20μm范围时,两个波长处的荧光强度比值(i618nm/i495nm)和hclo的浓度之间具有良好的线性关系,线性方程为:y=0.0109x+0.0388,线性相关系数为:r2=0.9968,检测限为4.62nm。
接着,研究了探针在不同ph环境中对hclo的响应。实验结果如图4所示:cou-4(10μm),加入的hclo浓度为50μm,激发波长为475nm,纵坐标为618nm与495nm两个波长处的荧光强度比值,横坐标为ph值。本身在ph=4.0-10.0之间具有良好的稳定性,而且在ph=7.0-8.0之间cou-4(10μm)对hclo(50μm)的响应具有良好的稳定性,因此可以证明探针cou-4可以在生理环境下检测hclo。
之后,研究了探针与hclo的反应动力学。测定了cou-4(10μm,ph=7.4,0.05mpbs)在加入hclo前后不同波长处荧光强度的变化,加入的hclo浓度为50μm,激发波长为475nm。实验结果如图5所示:可以看出在200s内cou-4本身在两个波长处荧光强度没有明显变化,说明cou-4本身具有良好的稳定性,当在200s时加入hclo(50μm)后,495nm处的荧光强度瞬时降低,618nm处的荧光强度瞬时增强,呈现出非常明显的荧光变化,并在之后的时间里两个波长处的荧光强度维持稳定。
另外,研究了探针对hclo的选择性。实验条件为探针浓度为10.0μm,pbs50mm,ph7.4,选取onoo-、h2o2、1o2、o2-、no、·oh、tbhp、h2s、arsh、so32-、cys、hcy、gsh、na+、k+、ca2+、mg2+、zn2+、co2+、cu2+、fe3+、fe2+、no3-、no2-、ch3coo-、po43-、co32-、so32-、so42-、f-作为干扰物,其中,图6对应的gsh、cys的浓度为5mm,hclo的浓度为50μm,其余干扰物的浓度均为100μm。激发波长为475nm,纵坐标为618nm与495nm两个波长处的荧光强度比值。图7对应的hclo的浓度为50μm,其余干扰物的浓度均为100μm。激发波长为475nm,纵坐标为618nm与495nm两个波长处的荧光强度比值。测定了cou-4对它们的选择性。实验结果如图6、7所示,表明cou-4能够高选择性的识别hclo。
最后,研究了探针与hclo的反应机理。通过高分辨质谱谱图和高效液相色谱谱图的联合表征,实验结果如图8、9、10所示,证明了探针经过氧化消去之后生成了化合物cou-2。其中图8为本发明制备的探针与hclo反应机理的质谱表征。实验条件为:在2mlep管里加入1mlpbs缓冲液(0.1m,ph=7.4),再加入cou-4(20μl,1mm)和hclo(10μl,5mm),再用二次水定容至2ml,并取20μl该样品用超纯水/色谱甲醇(v:v=1:1)稀释至2ml,然后进行质谱检测。
图9为本发明制备的探针与hclo反应机理的高效液相色谱表征。实验条件为:探针浓度为100μm(a图),探针与hclo混合物中探针浓度为100μm,hclo浓度为250μm(b图),化合物cou-2的浓度为100μm(c图)。
图10为本专利探针与hclo反应的机理示意图。
实施例4
探针在细胞中荧光成像实验:
为了研究探针在细胞中的荧光成像,我们选用巨噬细胞为实验研究对象。细胞先用pbs清洗后加入cou-4(10.0μm)在37℃下孵育25-35min作为实验对照组。其它组巨噬细胞加入不同物质处理细胞,然后加入cou-4(10.0μm)在37℃下孵育30min。最后在共聚焦显微镜下进行细胞成像。
外源性hclo的检测:实验结果如图11所示,(a,b,c,d)巨噬细胞与10μm探针孵育30min;(e-p)巨噬细胞与10μm探针孵育30min后,再与hclo(25μm:e,f,g,h;50μm:i,j,k,l;100μm:m,n,o,p)孵育10min。激发波长为800nm,绿色通道波长收集范围为480至550nm,红色通道的波长收集范围为600至660nm。比例尺:20μm。其中绿色通道的巨噬细胞为绿色,红色通道的巨噬细胞为红色,brightfield通道为无色,merge的d图巨噬细胞为绿色,merge的h图巨噬细胞为黄绿色,merge的l图巨噬细胞为橙色,merge的p图巨噬细胞为橙红色。
图11中,在800nm双光子激发下,巨噬细胞与10μm探针孵育30min,绿色通道显示出强荧光,而红色通道几乎没有荧光;当细胞与10μm探针孵育30min,生理pbs缓冲溶液清洗细胞三次,再分别与不同浓度的hclo孵育30min时,可以看出随着外加hclo浓度的增加,绿色通道荧光明显减弱,而红色通道荧光明显逐渐增强,说明探针cou-4能够在细胞水平上检测到外源性的hclo。
内源性hclo的检测:实验结果如图12所示,(a,b,c,d)巨噬细胞与10μm探针孵育30min;(e,f,g,h)先用lps(1.0μg/ml)孵育巨噬细胞11-13h,然后用pma(1.0μg/ml)孵育巨噬细胞1h,最后加入探针cou-4(10.0μm)孵育30min;(i,j,k,l)先用abah(100.0μm)孵育巨噬细胞3h,然后依次用lps、pma和探针cou-4孵育巨噬细胞。激发波长为800nm,绿色通道波长收集范围为480至550nm,红色通道的波长收集范围为600至660nm。比例尺:20μm,其中绿色通道的巨噬细胞为绿色,红色通道的巨噬细胞为红色,brightfield通道为无色,d图巨噬细胞为绿色,merge的h图巨噬细胞为橙红色,merge的l图巨噬细胞为黄绿色。
图12中,同样在800nm双光子激发下,巨噬细胞与10μm探针孵育30min,绿色通道显示出强荧光,而红色通道几乎没有荧光;而用脂多糖(lps)预孵育巨噬细胞11-13h,然后用丙二醇甲醚醋酸酯(pma)预孵育1h,生理pbs缓冲溶液清洗细胞三次,再加入10μm探针后,可以明显观察到绿色通道的荧光显著降低,红色通道的荧光显著增强;当用4-氨基苯甲酰肼(髓过氧化物酶mpo的特异性抑制剂,abah)预孵育细胞3h之后,再用lps、pma和探针依次孵育细胞时,可以看出绿色通道的荧光降低与红色通道的荧光增强均受到明显抑制,说明探针能够检测到细胞内源性hclo的动态变化。
以上所述仅为本申请的优选实施例而已,并不用于限制本申请,对于本领域的技术人员来说,本申请可以有各种更改和变化。凡在本申请的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本申请的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!