一种用于肿瘤治疗的多聚核苷酸及其应用的制作方法
本发明涉及长链非编码rnagman-as在肿瘤侵袭和转移中的应用
背景技术:
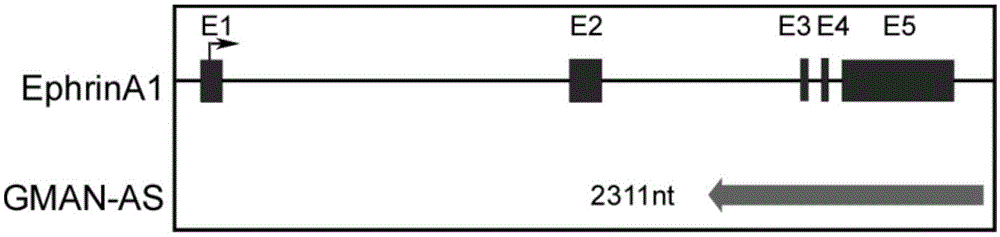
:科技的发展日新月异,同时也给人类的生活带来了深远的影响。由于科技的迅速发展,促使检测全基因组和转录组的微芯片技术和高通量测序技术不断的提高,也为生物科技的研究带来了极大的便利。最新的研究显示,只有不到2%的基因组具有编码蛋白的能力,至少75%的基因组是转录为非编码rna。尽管一些非编码转录本是小的非编码rna,但是大部分的转录本是长度超过200个核苷酸序列的不具有编码功能的rna,因此把他们命名为长链非编码rna(longnoncodingrna,lncrna)。研究发现lncrna是受到各种转录因子精准调控的,通过rna聚合酶ii转录的,一般具有ploya尾的rna。lncrna具有时空表达特异性以及组织表达特异性,在物种间不保守等特征。目前越来越多的证据显示,很多lncrna具有重要的生物学功能,在基因转录、转录后调控、rna剪切、翻译、表观遗传调控、遗传印迹、x染色体失活以及疾病发生发展等过程中都发挥着重要作用。encode数据显示人类基因组中含有超过28000个lncrna转录本,但是目前只有少数lncrna被很好的研究,报道的基因间的lncrna(lincrna)大约只有1000个。越来越多的研究证据说明lncrna在人类的生理和病理过程中发挥着重要的作用,关于肿瘤相关的lncrna的研究也有了一些报道。生物信息分析显示,许多lncrna在肿瘤中异常表达并显示出细胞和组织表达的特异性,进一步的研究表明一些lncrna通过调控致瘤因子或者肿瘤抑制因子在肿瘤的进程中发挥重要的作用。lncrna可作为“支架”,“诱饵”,“信号分子”,“向导者”在调控细胞增殖,细胞活力,生长阻滞,细胞运动,血管生成,免疫反应等肿瘤细胞的多种生理过程中发挥多样化的重要作用。lncrnahotair位于hox家族基因的内含子中,lncrnahotair在乳腺癌中异常高表达并与乳腺癌的不良预后和肿瘤转移显著相关。lncrnahotair作为一个支架分子,其5’端与prc2结合,3’端与lsd1结合,形成转录抑制复合物(corest)沉默hoxd基因的表达。在乳腺癌中,prc2是主要作用在h3k27位的组蛋白甲基转移酶,lncrnahotair作为“支架”促使prc2复合体结合在染色体上引起h3k27位的三甲基化,导致抑制转移相关基因的表达受到抑制,从而促进肿瘤的转移。tp53,kras,lkb1在多种肿瘤中突变失活,尤其是在肺癌中,lkb1的突变频率高达20%-30%。在lkb1突变的肺癌细胞系中,crtc未被磷酸化,进入细胞核内,在支架分子lnc473的协助下形成lnc473/crtc/nono复合体,促使creb的激活转录,促进下游细胞增殖相关基因的表达,促进肺癌的生长。p53在调控细胞命运和肿瘤发生过程中发挥着重要的作用。lincrna-p21在p53依赖的转录应答中发挥转录抑制的作用。细胞在受到压力情况下促使p53激活,促进lincrna-p21的表达,lincrna-p21与hnrnp-k结合,作为向导,协同hnrnp-k作用在转录调控区域,抑制受p53调控的一系列基因的表达。关于lincrna-p21条件敲除的老鼠的研究显示,lincrna-p21还可以作为p53依赖的激活因子调控p21的转录。lincrna-p21条件敲除的老鼠中,p53肿瘤抑制通路以及p21的表达受损,导致g1/s检验点受损,增加细胞增值速率,促进肿瘤的发生发展。细胞内sr家族蛋白的表达受到严格调控,sr蛋白的浓度或者磷酸化的改变会影响许多基因的选择性剪切。核内滞留的lncrnamalat1能够与sr蛋白结合,影响sr蛋白的分布,促进sr蛋白的磷酸化,从而调控一系列基因的选择性剪切。malat1最初也是在肺癌中发现的lncrna,在肺癌转移中具有重要作用。malat1的异常表达与多种肿瘤的发生与发展密切相关。研究显示,在肿瘤中malat1通过影响细胞周期相关的转录因子的pre-mrna的选择性剪切调控细胞周期,促进细胞增殖以及肿瘤的发展。在哺乳动物中,x染色体的失活使不同性别间表达近乎等同的基因量,维持机体的内稳态平衡。xist,tsix,jpx三个lncrna的精确调控在x染色体失活中发挥重要的作用。正常情况下,tsix与pcr2结合,阻止prc2与repa的结合,使xist处于抑制表达的状态。当tsix处于抑制表达的状态时,pcr2与repa结合,导致xic区域的甲基化,进一步抑制xist的负调控因子tsix的表达,促进xist的正调控因子jpx的表达,进而促使xist的激活表达。xist作为信号分子,招募更多的pcr2到染色体上,产生信号的级联放大效应,导致x染色体的失活。已有报道显示x染色体的非整倍性与肿瘤密切相关,但是具体作用原理还知之甚少。jeanniet.lee研究组建立血液腔中xist条件敲除的老鼠模型显示出造血干细胞的异常成熟以及骨髓增殖性肿瘤和增生异常综合征(mpn/mps)。进一步的研究显示,xist的缺失导致x染色体的重新激活和基因组表达的改变,导致肿瘤的发生。因此,xist不仅在维持x染色体失活中具有重要的作用,在肿瘤抑制方面也发挥重要的调控作用。gas5在缺少营养或者生长因子等导致生长受阻的细胞中丰富表达。研究显示,gas5通过5’端的发夹结构形成rna双链的gre类似物,作为诱饵竞争结合糖皮质激素受体(gr)的dbd区域,从而抑制了dna形式的gre与gr的结合,导致受gr调控放入一系列类固醇受体的转录受抑制。在乳腺癌中低表达的gas5,通过发夹结构与gr结合,导致相关基因的转录受阻,促进肿瘤的凋亡。利用gas5的发夹结构合成的gas5激素应答原件类似物(hrem)能够显著的抑制肿瘤细胞的凋亡,提示gas5具有肿瘤治疗的重要潜能。研究显示,在肝癌肿瘤干细胞中,tnf-α/nf-κb通路处于激活状态,nf-κb入核靶向il-6的启动子区域,促进il-6的表达,分泌到胞外的il-6进一步促使il-6/stat3信号通路的激活以及级联放大,促进肿瘤干细胞的自我更新和生长。在肝癌以及肝癌的肿瘤干细胞中低表达lnc-dilc作为诱饵,竞争结合在il-6的启动子区域,抑制nf-κb与il-6的结合以及il-6的转录激活,影响tnf-α/nf-κb和il-6/stat3通路的交流,调控炎症微环境中的肿瘤干细胞的生长。lncrna除了作为“支架”,“向导者”,“信号分子”,“诱饵”在肿瘤的发生与发展中发挥重要的功能,还可以通过多种其他方式调控肿瘤的进程。lncrna可作为或者影响mirna海绵或mirna前体,以保护靶mrna的稳定性或诱导mrna衰减。pten假基因ptenpg1的反义链存在非编码rnaptenpg1asrna,它有两个亚型α和β,其中β亚型与ptenpg1结合影响pten的mrna稳定及microrna海绵的活性。一些lncrna还可通过募集核糖核蛋白复合物来调节mrna的翻译,如trerna通过核糖核蛋白复合物螯合翻译机制并抑制e-cadherinmrna翻译。除了可以按照lncrna发挥功能的方式对lncrna进行分类,也可以按照lncrna与基因的位置关系分为:正义lncrna、反义lncrna、双向lncrna、内含子内lncrna以及基因间lncrna等五大类。一些正义lncrna,反义lncrna或者内含子lncrna由于与基因的部分序列存在相同或者互补的现象,可能对临近的基因具有调控作用。asuch1是与uchl1的5’端序列存在部分重叠的反向转录的lncrna。asuch1通过5'重叠序列和sineb2重复元件的反向转录影响uchl1的翻译效率并促进其蛋白表达。位于bace1的反义链上并反向转录的lncrnabace1-as通过调控bace1的mrna稳定性,促进bace1的mrna和蛋白的表达。总之,lncrna可通过多种方式在调控肿瘤中发挥重要的作用,为我们了解肿瘤的发生与发展提供重要线索,也为肿瘤的干预治疗提供新靶点和新思路。虽然lncrna在肿瘤中发挥重要的功能,但是关于lncrna在胃癌中的研究还是相对比较少的。目前的研究显示,在胃癌中高表达的gclnc1作为wdr5和kat2a的支架,影响组蛋白修饰,进而影响组蛋白调控的一系列基因,包括sod2,促进胃癌细胞的生长和转移。lncrnabc032469作为mir-1207-5p的海绵,调控htert表达,促进胃癌细胞的增殖。lncrnahoxa11-as作为染色体调控因子prc2,lsd1,dnmt1的支架,促进胃癌细胞的增殖和侵袭等。更多关于lncrna在胃癌中的功能及作用机制亟待研究,为了解胃癌的发病机制以及寻找胃癌的诊断与治疗的新方法提供更多便利和潜能。技术实现要素:本发明的目的在于针对现有技术的不足,提供一种用于肿瘤治疗的多聚核苷酸及其应用。本发明采用如下技术方案:一种用于肿瘤治疗的多聚核苷酸,包含seqidno.1所示的mr片段。进一步地,还包含seqidno.2所示的amfr片段。进一步地,所述多聚核苷酸为长链非编码rna。进一步地,所述长链非编码rna为gman-as,序列如seqidno.3所示。进一步地,所述的肿瘤包括鼻腔及鼻窦恶性肿瘤,鼻咽癌,口腔癌,喉癌,涎腺肿瘤,颅内肿瘤,甲状腺癌,舌癌,肺癌,食管癌,贲门癌,乳腺癌,纵膈肿瘤,胃癌,大肠癌,直肠癌,肝癌,胰腺癌与壶腹周围癌,小肠恶性肿瘤,肾癌,前列腺癌,膀胱癌,子宫颈癌,卵巢癌,皮肤恶性黑色素瘤,淋巴瘤。本发明还涉及含有上述多聚核苷酸的重组质粒,以及来自于上述多聚核苷酸的寡核苷酸片段,所述的寡核苷酸片段包括但不限于:反义寡核苷酸aso、锁核酸lna或功能类似的化学修饰的寡核苷酸。本发明的有益效果在于:lncrnagman-as能显著的抑制胃癌细胞的侵袭和转移,在胃癌的发生发展中发挥重要的作用。特别是mr区段和amfr区段能够有效的抑制胃癌的转移,可作为临床上控制肿瘤转移的一个新策略。附图说明图1.1为lncrnagman-as的race实验显示;图2.1为northern印迹检测人胃癌细胞系中gman-as的表达;图2.2为northern印迹检测人胃癌组织中gman-as的表达;图3.1为qrt-pcr实验检测gman-as的敲低效率;图3.2为敲低gman-as对胃癌细胞的细胞侵袭能力的影响;***,p<0.001。图3.3为qrt-pcr实验检测gman-as的过量表达效果;***,p<0.001。图3.4为过量表达gman-as对胃癌细胞的细胞侵袭能力的影响;***,p<0.001。图4.1为稳定过量表达gman-as-mr对胃癌细胞的侵袭能力的影响;***,p<0.001。图4.2为gman-as-m的过量表达对胃癌细胞的肺转移能力的影响;***,p<0.001(n=6)。图5.1为细胞侵袭实验结果图。具体实施方式本发明在发现lncrnagman-as,gman-as能够显著的抑制胃癌细胞的侵袭的基础上,找到了gman-as主要发挥作用的区段mr(themiddleregion),我们在胃癌细胞中过量表达gman-as的mr并建立稳定细胞系,结果显示,外源表达gman-as的mr能显著的抑制胃癌细胞的转移,并具有治疗胃癌转移的重要潜能。由于mr段是一段约500bp的核苷酸序列,无论是化学合成还是靶向的基因编辑技术,都具有操作简单和可行性强的特征,为gman-as的mr段成为治疗胃癌转移的靶点提供了极大的可能。主要内容入如下:1)3’race和5’race确认lncrnagman-as的序列,northern印迹显示在人的胃癌组织及细胞中可检测到gman-as的表达。2)证明了gman-as能显著的抑制胃癌细胞的侵袭。3)发现了gman-as的mr区段是gman-as发挥抑制肿瘤侵袭移的主要作用的区域。4)gman-as的mr区段的过量表达能显著的抑制胃癌细胞的转移,提示gman-as的mr区段可作为治疗胃癌转移的重要靶点。综上所述,lncrnagman-as能显著的抑制胃癌细胞的侵袭和转移,在胃癌的发生发展中发挥重要的作用。特别是gman-as的mr区段能够有效的抑制胃癌的转移,可作为临床上控制肿瘤转移的一个新策略。下面结合实施例对本发明作进一步说明。实施例1:lncrnagman-as是一个长度为2311nt的lncrna为了检测gman-as的5’和3’的末端终序列,我们根据smartertmracecdnaamplificationkit(购自美国clontech)的使用说明进行实验。1、按照race说明书中设计引物的原则,设计race的特异引物如下:5'raceforgman-as:5'-ctaggagtagtattaagtgg-3'3'raceforgman-as:5'-ccctgactcaccgaaacagcgt-3'2、提取人胃癌细胞系的rna并对rna进行加polya处理和纯化细胞总rna的分离提取利用trizol试剂(购自美国invitrogen),并按照试剂说明书的标准操作进行。胃癌细胞hgc-27(约1×106)中加入1mltrizol,用枪头反复吹吸30次并转移到1.5ml的rnasefree的ep管中,室温放置5分钟。加入0.2ml氯仿,剧烈震荡15秒左右,室温静置10分钟。12000g,4℃离心15分钟,样品分成三层:黄色的有机相、中间层和无色的水相,水相包含我们所要的rna,体积约为所用trizol试剂的60%。轻轻吸取上清,把水相转移到新管中,加入0.5ml异丙醇,温和混匀,室温静置10分钟。12000g,4℃离心10分钟,吸除上清,在管侧和管底可见透明胶状沉淀。加入1ml75%乙醇洗涤沉淀,乙醇用depc处理过的水配制。10000g,4℃离心5分钟,弃上清。沉淀在室温晾干,溶于50μldepc水备用。取适量的rna利用dnasei试剂盒(购自美国invitrogen)消化rna中残留的基因组,去除基因组污染。rna加polya处理,利用polya试剂盒(购自美国neb)。取适量rna与polya酶,buffer,rnaseinhibitor混匀,37℃孵育。dna凝胶电泳检测rna的ploya加尾情况。用rneasyplusminikit(购自美国qiagen)纯化rna。取适量加polya尾的rna,加入depc处理过的水至100μl,再加入350μlbufferrlt,混匀。加入250μl无水乙醇,混匀并转移至rneasymini离心柱,12000g离心1分钟。在rneasymini离心柱中加入500μlbufferrpe,12000g离心1分钟。重复加入bufferrpe离心一次,离心柱空离2分钟,12000g。在离心柱中加入20μldepc处理过的水,静置1分钟,12000g离心2分钟,备用。3、race-readyfirst-strandcdna合成3.1配制5’-and3’-race-readycdna合成的buffermix4.0μl5xfirst-strandbuffer0.5μldtt(100mm)1.0μldntps(20mm)5.5μltotalvolume3.2取新的pcr管配制如下溶液5’-race-readycdna的配制1μgrna1μl5’-cdsprimera0-9μlsterileh2o11μltotalvolume3’-race-readycdna的配制1μgrna1.0μl3’-cdsprimera0–10μlsterileh2o12μltotalvolume3.3将步骤3.2中溶液混匀,离心。3.4步骤3.3中的pcr管在72℃孵育3分钟,42℃孵育2分钟,冰上冷却,14000g离心10秒使溶液都位于pcr管的底部。3.5在5’-race-readycdna的配制的pcr管中加入1μlsmarteriiaoligonucleotide。3.6步骤3.1中的buffermix分别加入rnaseinhibitor和转录酶,室温混匀。5.5μlbuffermixfromstep10.5μlrnaseinhibitor(40u/μl)2.0μlsmartscribereversetranscriptase(100u)8.0μltotalvolume3.7步骤3.6中的buffermix分别加入到步骤4(3’-racecdna)和步骤5(5’-racecdna)中,使终体积为20μl。3.8温和混匀,离心使溶液都位于pcr管的底部。3.942℃孵育90分钟,70℃孵育10分钟。3.10用tricine-edtabuffer稀释3’-和5’-race-readycdna,-20℃保存备用。4.cdna末端快速扩增(race)4.1配制3’-和5’-race的pcr反应的mix15.5μlpcr-gradeh2o25.0μl2×seqampbuffer1.0μlseqampdnapolymerase41.5μltotalvolume4.2配制pcr反应,如下4.3pcr反应反应一:5cycles:94℃30sec72℃3min*反应二:5cycles:94℃30sec70℃30sec72℃3min*反应三:20cycles:94℃30sec68℃30sec72℃3min*5、分析race产物5.1race产物凝胶电泳并纯化race的dna产物进行凝胶电泳。dna成像系统观察在dna胶上是否存在目的条带,用小刀小心切下目的条带,并放入1.5ml的ep管中,称量目的条带的重量。按照每100mg的dna琼脂糖凝胶加入200μl的buffernt1的比例,加入buffernt1,50℃孵育5-10分钟,期间上下颠倒ep管促进dna凝胶的溶解。把完全溶解的溶液转移至pcrclean-up的柱子中,11000g离心30秒,弃去flow-through。加入700μl的buffernt3,11000g离心30秒,弃去flow-through。11000g空离1分钟,把柱子放入一个新的1.5ml离心管中,加入30μl的bufferne,室温孵育1分钟,11000g离心1分钟,纯化的dna备用。5.2race产物与克隆载体融合配制融合体系并混匀,如下:50℃孵育15分钟后置于冰上。从10μll的融合体系中取出2.5μl加入到stellarcompetentcells中,温和混匀。加入soc培养基孵育一段时间,把溶液均匀的涂在带有amp+抗性的lb平板上,37℃孵育过夜,挑取lb平板上的克隆进行测序与分析。实验结果我们首先确认在人组织细胞内是否存在gman-as这个分子以及gman-as的具体序列。3’race和5’race的鉴定结果显示,在人的胃癌细胞系hgc-27中存在gman-as,而且gman-as是位于染色体1q22位上的一个2311nt的lncrna,gman-as的序列见表s1。gman-as位于efna1(编码蛋白ephrina1)的基因簇中,是efna1基因的反义链上的一个lncrna(图1.1)。gman-as的序列包含一段mr区域以及amfr区域,目前还未见关于gman-as及其内部mr区域和amfr区域的任何报道。实施例2:gman-as在人的胃组织和胃癌细胞系中表达1、体外转录gman-as的特异性rna探针1.1通过ncbi的blast工具,找到gman-as的一段特异序列,并设计引物,同时设计gapdh的引物(购自上海生工),如下:利用pcr反应获得gman-as/gapdh的一段特异序列,以人胃癌细胞系hgc-27的cdna为模板,用上述引物,进行pcr反应,获得目的片段。1.2cdna合成按照trizol试剂及说明书方法提取人胃癌细胞系的rna并测量浓度。取一个pcr管a加入800ng总的rna,补足depc水至总体积10μl,混匀。取另一个pcr管b加入10×rtbuffer2μl,10×随机引物2μl,dntp0.8μl,rna反转录酶1μl,depc水4.2μl,混匀。将b管的混合物加入管a中,混匀,利用pcr仪进行反转录反应(购自美国abi)。程序如下:25℃10min37℃120min85℃5min将cdna产物放置-20℃,备用。1.3pcr反应获得目的片段取pcr管,按照pcr试剂盒的说明书进行pcr反应(购自日本toyobo)。加入cdna模板2μl,kod高保真酶1μl,10xpcrbuffer5μl,dntp5μl,forwardprimer1μl,reverseprimer1μl,加入ddh2o至50μl,混匀,按以下反应程序进行pcr反应:95℃2min95℃30stm-5℃30s68℃1min-2min(延伸1kb/min)68℃10min循环数:30cycle,pcr扩增产物于4℃保存备用1.4载体pcs107和pcr产物的双酶切按照下表配制酶切反应体系(购自美国neb),37℃,酶切3hdna1μg10×buffer5μlbamhⅰ1μlxholⅰ1μlddh2o至50μl1.5酶切产物回收纯化:酶切产物以1%琼脂糖凝胶电泳进行分离,切下含有目的基因的凝胶块,按照如下步骤进行凝胶回收纯化(购自美国axygen):1)将切下的凝胶块称重;2)加入3倍体积的bufferde-a,75℃水浴,3-5min,至凝胶完全溶解;3)加入bufferde-b(de-a体积的一半),混匀终止反应;4)将上述液体加入dna制备管中,12000g,离心1min,弃滤液;5)加入500μlbufferw1,12000g,离心1min,弃滤液;6)加入700μlbufferw2,12000g,离心1min,弃滤液并重复一次;7)转速12000g,离心1min;8)将dna制备柱放入新的ep管中,加入30-60μl的ddh2o,室温静置1min,12000g,离心1min;测定浓度后备用。1.6连接将退火产物和切胶回收的质粒载体片段按照如下反应体系进行连接反应,16℃,连接反应1h(购自日本toyobo).酶切后的载体片段1退火产物/pcr纯化产物22×ligationhigh5ddh2o21.7转化1)将连接产物与100μl的dh5α感受态混合(购自中国全式金),冰上放置30min;2)42℃水浴90秒;加入800μllb培养基,37℃,220rpm,摇40min;3)取200μl菌液涂到lb平板上,37℃培养箱培养过夜。4)挑取单克隆菌落并培养1.8质粒小量提取与鉴定(购自美国axygen)1)取2ml菌液,12,000g离心1min,去上清;2)加入250μlbuffers1悬浮菌液,再加入250μlbuffers2,颠倒混匀4-6次,裂解细菌约5min;3)加入350μlbuffers3,颠倒混匀,12,000g,4℃离心10min;4)取上清至dna制备管中,12,000g离心1min;弃滤液,加500μlbufferw1,12,000g离心1min;5)弃滤液,加700μlbufferw2,12,000g离心1min,重复一次;6)弃滤液,12,000g离心1min;将dna制备管放入新的ep管中,加入50-60μlddh2o,静置1min,12,000g离心1min,收集dna,测定浓度。所得的质粒进行酶切鉴定并测序。1.9体外合成rna探针由于pcs107载体上含有sp6和t7的启动子,我们把gman-as/gapdh的一段序列构建在两个启动子之间,单酶切后,可以选择通过t7转录酶或sp6转录酶体外转录把gman-as/gapdh的rna探针。把构建的pcs107-gman-as和pcs107-gapdh的质粒用bamh1进行单酶切,把线性化的pcs107载体作为模板。把转录所需的组分加到ep管中,混匀,37℃水浴孵育3h,具体组分如下:模板1μgt7转录酶(购自瑞士roche)2μl10×转录buffer2μlrnamix(dig标签,购自瑞士roche)2μlrnaseinhibitor(购自美国invitrogen)0.5μldepc至20μl转录后,加1μldnasei,37℃,15min,去除模板dna。用rneasyplusminikit(购自美国qiagen)纯化rna,测浓度并取一分部跑胶,确定转录的rna只有单一的目的条带。把纯化的rna分装并-80℃保存。2.northern印迹检测人胃组织和人胃癌细胞系中gman的表达2.1组织或者细胞总rna的分离提取利用trizol试剂(购自美国invitrogen),并按照试剂说明书的标准操作进行,并检测rna的浓度。2.2rna中加入变形剂,混匀,70℃变性15min。2.3rna加入1.2%的变性琼脂糖凝胶孔中,1*mopsbuffer作为电泳缓冲液(购自美国sigma),100v预跑10min,45v电泳4-5h。2.4利用盐桥进行硝酸纤维素膜的转膜,过夜。2.51500v的uv进行膜的crosslink,并用亚甲基蓝染色。2.6剪出目的条带位置的膜,用预杂交液(购自瑞士rohce),50℃孵育1h。2.7加入含有dig标签的rna探针的杂交液,50℃孵育过夜(12h以上)。2.8用2×ssc溶液,60℃洗膜15min,重复两次。2.9用1×ssc溶液,50℃洗膜15min,重复两次。2.10用0.2×ssc溶液,50℃洗膜15min,重复两次。2.11用northernwashbuffer(购自美国sigma)常温洗5min。2.12用blockingbuffer(购自瑞士roche)常温封闭30min。2.13用anti-dig-ap的抗体(购自瑞士roche)常温孵育30min。2.14用northernwashbuffer常温洗15min,重复两次。2.15用detectionbuffer孵育3min。2.16用dig-cdpstar显色液(购自瑞士roche)显色并曝光。实验结果gman-as是一个位于染色体1q22位的2311nt的lncrna。我们的northern印迹结果也进一步验证了gman-as的长度。同时,我们也检测了gman-as在人的胃癌组织中的表达情况,gman-as的特异性探针大约在2311nt位置有一条比较特异的条带,进一步表明在人胃癌细胞系中确实存在这个2311nt的lncrnagman-as(图2.1)。通过对8个新鲜的人胃癌组织中gman-as的表达的检测,显示gman-as在人胃癌组织中表达(图2.2)。实施例3:gman-as能显著的抑制胃癌细胞的侵袭1.细胞转染sirna通过sirna设计软件,设计并合成两条特异靶向gman-as,沉默gman-as表达的sirna(购自中国上海吉玛)。取对数生长期的细胞铺平板,待细胞密度达到50%左右,按照下表转染体系,分别用opti培养基(购自美国gibco)稀释lipornaimax(购自美国invitrogen)和sirna,将稀释的sirna加入lipornaimax管中,混匀后静置5min,然后加至细胞培养液中,摇匀,24后更换培养基。2.细胞转染质粒2.1构建pcdna3.1-gman-as的质粒根据race的结果获得gman-as的全长序列,设计gman-as的引物,通过pcr的方法获得gman-as的dna产物,经过酶切,链接等步骤构建含有gman-as全长的pcdna3.1过表达质粒。2.2细胞转染gman-as过表达质粒取对数生长期的细胞铺平板,待细胞密度达到80%左右,按照下表转染体系,分别用opti培养基稀释lipo3000(购自美国invitrogen)和质粒,将稀释的质粒加入lipo3000管中,混匀后静置5min,然后加至细胞培养液中,摇匀,24后更换培养基。3.实时荧光定量pcr(qrt-pcr)检测gman-as在胃癌细胞中的表达情况根据rochesyergreenkit的说明书(购自瑞士roche)并配制qrt-pcr反应体系。使用roche公司480ii荧光定量pcr仪进行荧光定量pcr反应。所有的反应都重复三次,gapdh作为内参。根据仪器给出的荧光图得到δct值,,从而计算相应表达水平的相对变化。引物如下:primernamessequences(5'-3')gman-asforwardacagcgtgagtacctgaatggman-asreversegaggctctctgtgctacaagapdhforwardgaaggtcggagtcaacgggapdhreversetggaagatggtgatgggat4.细胞侵袭实验在8μm的transwell(24-well,购自美国corning)中预先铺上10倍稀释的基质胶(购自美国bd)和0.5%的明胶(购自中国上海生工)按照体积比1:1的混合胶50μl,37℃细胞培养箱孵育2h。转染后的细胞按照细胞传代的方式进行重悬(1%fbs的1640培养基重悬细胞)并用血球计数板进行细胞计数。在transwell的上层小室中每孔中加入200μl细胞悬液(细胞数目:5×104),在下室中加入700μl的10%fbs的1640培养基,放入培养箱中。待细胞迁移适当时间后,取出transwell并用4%pfa固定10min。0.1%的结晶紫染色15min。pbs清洗掉多余的结晶紫,用棉签小心的擦去transwell小室上层膜的细胞,在显微镜下观察侵袭到transwell下层膜上的细胞并进行拍照和统计分析。实验结果由于胃癌器官转移起病隐匿,发现时多数患者都难以手术切除,因而预后极差,其5年生存率低于10%,是晚期胃癌患者死亡的主要原因之一。已有报道显示lncrna在多种肿瘤中发挥重要的作用,提示lncrna的功能可能为胃癌转移的干预治疗提供新靶点和新思路。那么,我们在胃癌中发现的这个新型的lncrnagman-as与胃癌有何种联系,在胃癌的发生发展中有扮演什么样的角色,gman-as在胃癌的转移中是否发挥作用?我们设计了两个特异靶向gman-as,沉默gman-as表达的sirna。在人胃癌细胞系hgc-27中转染gman-as的sirna敲低gman-as的表达,qrt-pcr检测gman-as的敲低效率,结果显示与对照组的sirna相比较,特异性靶向gman-as的sirna下调gman-as的水平至对照组的60%左右(图3.1)。在胃癌细胞系hgc-27上检测敲低gman-as对胃癌细胞的侵袭能力的影响。结果显示,下调gman-as的表达能够显著的促进胃癌细胞的细胞侵袭能力(图3.2)。同时,我们也构建了gman-as过量表达的质粒,在胃癌细胞系bgc-823上检测gman-as的过量表达对胃癌细胞的影响。qrt-pcr检测gman-as在bgc-823细胞中的过量表达效果,与作为对照的空载质粒相比,gman-as过量表达的效果是其表达的近100倍。(图3.3)。进一步,在人胃癌细胞bgc-823中检测gman-as的过量表达对胃癌细胞的生物学行为的影响。结果说明,gman-as的过量表达能够显著的抑制胃癌细胞的侵袭能力(图3.4)。这些结果说明,gman-as能显著的促进胃癌细胞的侵袭能力,gman-as可能通过影响胃癌细胞的侵袭在胃癌的发生发展中发挥重要的调控作用。实施例4:关键区段mr(middleregion)区段能够显著抑制胃癌细胞侵袭和转移1、筛选mr区段稳定过表达的胃癌细胞系构建mr区段过量表达的载体pcdna3.1-mr,转染人胃癌细胞系sgc7901。利用pcdna3.1上带有的neromycin抗性表达原件作为筛选标记,在转染后的细胞中加入适量的g418药物,促使没有表达pcdna3.1-mr质粒的细胞由于不能产生neromycin抗性而死亡,而表达质粒的细胞得以存活。然后把表达pcdna3.1-mr质粒的细胞重悬并铺在96孔板,进行单克隆筛选。把筛选得到的单克隆细胞株进行qrt-pcr检测细胞中mr的过表达效果以及测序鉴定,最终得到mr稳定过量表达效果良好的胃癌细胞株。2、裸鼠肺转移实验mr区段稳定过表达的胃癌细胞(1×106)通过尾静脉注射到裸鼠的体内,在裸鼠中建立胃癌细胞的肺转移模型。每周观察小鼠的状态及体重变化,8周后,取肺观察肿瘤细胞的肺转移情况。实验结果我们的研究发现gman-as主要通过其mr区段发挥调控作用,mr区段的序列见表s2。构建mr区段稳定过表达的胃癌细胞系,检测mr的过量表达对胃癌细胞的调控作用。细胞侵袭实验显示,mr的稳定过量表达能够显著的抑制胃癌细胞的侵袭(图4.1)。由于gman-as的mr区段的过量表达能够显著的抑制胃癌细胞的侵袭能力,那mr是否可作为治疗肿瘤的一个靶点在体内发挥抑制肿瘤转移的作用呢?我们把稳定过量表达mr的胃癌细胞尾静脉注射到裸鼠体内建立肿瘤细胞的肺转移模型,注射后的每周都观察小鼠的状态和体重。裸鼠接种胃癌细胞8周后,评估裸鼠的肺转移情况。通过裸鼠解剖取肺观察显示,对照组的胃癌细胞发展严重肺转移,肺部有大量肉眼可见的转移灶;而mr过表达组裸鼠的肺部几乎与正常的小鼠的肺部一样,呈现白色并具有相对完整的肺部结构。进一步的肺部he染色也显示,对照组的肺部产生许多大的转移灶,但是mr过表达组的肺部几乎检测不到转移灶(图4.2)。研究显示,mr的过量表达能够显著的抑制胃癌细胞的肺转移能力。mr是一段位于基因的内含子中的565bp的相对特异的核苷酸序列,但是却显示出很强大的促进胃癌细胞转移的功能,具有治疗胃癌转移的重要潜能。而且mr的序列特征使我们设计靶向mr区段的药物既不会影响到其他基因或者rna的表达又极大的降低了出现药物脱靶的可能。这些特征为我们合理的利用基因编辑技术或者合成靶向mr区段的稳定核酸小分子药物提供了极大的便利和可能。因此,基于我们的研究结果以及mr的序列特征,使mr段具有重要的治疗胃癌转移的潜能。实施例5:关键区段amfr(antisensetomfr)区段能够显著抑制胃癌细胞侵袭1、筛选amfr区段稳定过表达的胃癌细胞系构建gman-as的mr区段过量表达的载体pcdna3.1-amfr,转染人胃癌细胞系sgc7901。利用pcdna3.1上带有的neromycin抗性表达原件作为筛选标记,在转染后的细胞中加入适量的g418药物,促使没有表达pcdna3.1-amfr质粒的细胞由于不能产生neromycin抗性而死亡,而表达质粒的细胞得以存活。然后把表达pcdna3.1-amfr质粒的细胞重悬并铺在96孔板,进行单克隆筛选。把筛选得到的单克隆细胞株进行qrt-pcr检测细胞中amfr的过表达效果以及测序鉴定,最终得到amfr稳定过量表达效果良好的胃癌细胞株。实验结果我们的研究发现amfr区段在抑制胃癌细胞侵袭转移方面也同样发挥重要作用。构建amfr区段稳定过表达的胃癌细胞系,检测amfr的过量表达对胃癌细胞的调控作用。细胞侵袭实验显示,amfr的稳定过量表达能够显著的抑制胃癌细胞的侵袭(图5.1)。这也进一步证明了amfr区段是gman-as发挥作用的重要区段,有治疗胃癌转移的重要潜能。而且amfr的序列特征使我们基于amfr设计药物既不会影响到其他基因或者rna的表达又极大的降低了出现药物脱靶的可能。这些特征为我们合理的利用基因编辑技术或者合成靶向amfr区段的稳定核酸小分子药物提供了极大的便利和可能。因此,基于我们的研究结果以及amfr的序列特征,使amfr段具有重要的治疗胃癌转移的潜能。序列表<120>一种用于肿瘤治疗的多聚核苷酸及其应用<160>3<170>siposequencelisting1.0<210>1<211>565<212>dna<213>未知(unknown)<400>1tcacggggtttgcagcagcagaagtggaaggagcagcacagtccaggcaagtgggaagag60gcgtggggcagcactgtgaccgatgctatgtagaacccgcacctctgggtcatctgcaag120gtgagagggcaaaggccaccagtgtgagtggctccactatttgtactggctctcagccca180acaggattccctcagcctcagcctggtaaaggagccacctcctgtacccaacctcttcaa240gcagaccccttcctgtgccccaggcccagtttgctccagctacccacctgctgcaagtct300cttctcctgtggattgtcatgggcctgaggactgtgagctgaaagacaagagtggtagta360gatcaggtactgtatcaaagaggcagagggctgtaagtatgagtgggctgggctgcaaga420cttctataccatcctagatcactagaccgcacccagcatagagatggaggaaggaggccc480acagggctctgacactcactgattttgccactgacagtcaccttcaacctcaagcagcgg540tcttcatgctggtggatgggtttgg565<210>2<211>293<212>dna<213>未知(unknown)<400>2<210>3<211>2311<212>dna<213>未知(unknown)<400>3cggggccgcatgcctcagctggcgttcccagcttccctgactcaccgaaacagcgtgagt60acctgaatggtagtatgccaaagccctgcggtgacggagtgggagtggggtagaggtcgg120ataggaagaacttccagagtggagtgcagctcagaacccgagagacagctgtcaggagca180ctccggtcctggacagccctcagaggaggaaacatcccacccttttggcctcgtgagggg240cacacattctttggagagaaagaaattcaaacccagttgctactgttgtagcacagagag300cctcgcacttagcagggactcaatggtcatatgttttaatatggagtggcagaaaagcat360gtccgaaaaaacacattgctttattttgagacaaagaacattgtataaaaaaactccagt420tgtagaaatcaggacagacacacagcaacttatatacagatactatacacgtgggccctg480ccctttaggctacactctaggcagaatgtacacatgggcactgcccttacagctacactc540taagaacaggttggcacagcccccctgctggcacagctctggggagtgctgccccaggat600gggagagaatgcagtacctggctacaaacttctctgtggcagctccacagatgaggtctt660gctgggagatgctgggtcagcccaagcatgctgcctctcctgtacctggcttccaagcaa720gaaactgtttcttgcttttccttcagtcagttcatctgggcatcctggctctctcctgga780gggggcatctttgacaagctttgcccatccacgtggccccttccagctcagctcccactg840tgccttaagggaccatgcctgcacagcttgtttctttggcttaaaggcaggaatggtggg900aaaggactgtctccacttctttctccatccctccgaggtgaaggtggggatggcactgtc960gggctggttggcctccttccggttgaaaaccttaatactgacccgttttgaggctgctag1020gtgatagcttatgcctgtggtgggagtggttcccagggctgggggctctgaaagtggccc1080caagacaggtttggagtgcctgtccctctcttcagcctgtccctctttaaggccaggtgt1140ggcatacaccttcacggggtttgcagcagcagaagtggaaggagcagcacagtccaggca1200agtgggaagaggcgtggggcagcactgtgaccgatgctatgtagaacccgcacctctggg1260tcatctgcaaggtgagagggcaaaggccaccagtgtgagtggctccactatttgtactgg1320ctctcagcccaacaggattccctcagcctcagcctggtaaaggagccacctcctgtaccc1380aacctcttcaagcagaccccttcctgtgccccaggcccagtttgctccagctacccacct1440gctgcaagtctcttctcctgtggattgtcatgggcctgaggactgtgagctgaaagacaa1500gagtggtagtagatcaggtactgtatcaaagaggcagagggctgtaagtatgagtgggct1560gggctgcaagacttctataccatcctagatcactagaccgcacccagcatagagatggag1620gaaggaggcccacagggctctgacactcactgattttgccactgacagtcaccttcaacc1680tcaagcagcggtcttcatgctggtggatgggtttggctgcaagataagcccacaggggtt1740aaataagaaacctttgctggaagaaaatgtaagtccaaatgcccctcgccctgctttctc1800agctccctactcaatttcattcttctcttccctctaaccttgattcctaccctccttagt1860ttttgctaacttcctgcccaatgttcagcccagcctctcattctttggaaataaccctca1920gcatagacactgcccctccccacatttcatccttcattcctccgagtctgaatatgttcc1980tcttgcctgggccacttaatactactcctaggccaggcgcggtggctcacacatgtaatc2040ccagcactttgagaggccgaggtgggcggatcacgaggtcaggagttcgagaccagcctg2100gccaatatggtgaaaccccgtctctactaaaaatacaaaaattagccgggcatggtggca2160catgcctgtagtcccagctactcgggaggctgaggcagaagaatcaattgaacccgggag2220gtggaggttgcagcaagtcgagatcgtgccactgcactccagtctgggcgacagagcgag2280actctgtctcagaaaaaaaacaaaaaaacaa2311当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1