一种畜禽沙门氏菌活菌快速检测方法与流程
本发明涉及致病菌的快速检测领域,具体涉及一种畜禽沙门氏菌活菌快速检测方法。
背景技术:
食源性致病菌是引起食源性疾病的主要因素之一,在世界食品安全领域中备受关注。who报告表明,全球每年发生40~60亿例食源性疾病,其中约70%是因生物源性污染食品所致。发展中国家每年约有180万人口死于食源性疾病,即使是在发达国家,每年亦有10%以上的人群感染食源性疾病[3,4]。目前世界公认的能引起食源性疾病的重要致病菌,如沙门氏菌、金黄色葡萄球菌、单增李斯特菌、大肠杆菌o157、志贺氏菌等广泛存在于奶制品、蔬菜、水产品、肉制品等多种食物中,是引起食品污染的重要因素[5]。因此,食源性致病菌的有效检测对于监控食品安全是非常重要的,如何区分活菌与死菌,致病菌与非致病菌所造成的污染是有效检测食源性致病菌的关键环节。食源性疾病不但严重危害人们的健康,而且造成巨大的经济损失。
因为只有“活”的病菌才能保留原菌的毒力和致病性,才对食品安全构成潜在的威胁。而经过高温、紫外线等各种途径灭活的“死”病菌已经丧失原菌毒力和致病性,并不会威胁到食品安全。因此食源性病原菌的检测关键是要区分“活”菌与“死”的菌、致病菌与非致病菌,并准确计算“活”菌的含量。目前,用于活菌检测的技术主要包括分离培养鉴定、atp生物发光法、分子生物学检测技术、免疫学技术、流式细胞仪技术、ema-qpcr活菌检测技术等,但都存在着各方面的不足。因此开发一种简单快速的沙门氏菌活菌检测方法就显得非常重要。因此,通过本发明,建立一种畜禽沙门氏菌活菌快速检测方法,为食品安全的快速检测提供更多的选择。
技术实现要素:
本发明的目的在于提供一种畜禽沙门氏菌活菌快速检测方法,为食品安全的快速检测提供更多的选择。本发明通过以下技术方案完成:
(1)待检样品的制备:取1-5g畜禽制品置于增菌液中37℃过夜培养。
(2)取500μl过夜培养的增菌液于eppendorf管中,2000rpm-3000离心5min,弃上清,沉淀用无菌水悬浮。
(3)样本的pma处理:取适量pma工作液加入到上述eppendorf管中,使样品中pma终浓度为12μg/ml,充分混匀。
(4)将eppendorf管置于冰上,放暗处孵育10min,然后置于卤钨灯下曝光7min。
(5)样本dna提取:将步骤(4)处理的eppendorf管置于沸水中煮10min,立即放冰上冷却10min,然后10000rpm离心2-3min,上清液即可作为待用的样本dna模板。
(6)以步骤(5)提取的样本dna为模板,设计引物,进行荧光定量pcr定量检测样本中的沙门氏菌活菌。
所述pma为叠氮溴化丙锭(propidiummonoazide);所述的pma工作液是将pma溶解于20%的二甲基亚砜(dmso)中,配制成5mg/ml的pma原液,将pma原液10倍稀释后即为工作液。所述的引物序列分别为:
内引物1:gtgaaattatcgccacgttcgggcaa,(如seqidno.1所示);
内引物2:tcatcgcaccgtcaaaggaacc;(如seqidno.2所示);
外引物1:cgttaaggcagtttact;(如seqidno.3所示);
外引物2:cgctttaatgagggcggtgcaagc;(如seqidno.4所示)。
所述的引物qpcr反应体系为:
反应条件为:95℃预变性1min;95℃变性30s,60℃退火30s45个循环。
所述的引物混合物由体积比为1:1:4:4的100μm外引物1、外引物2、内引物1和内引物2组成。
与现有技术相比,本发明所具有的有益效果是:
1)不需要特殊试剂与设备;
2)灵敏度高:扩增模板仅需10拷贝或更少,最低检测极限达到10cfu/ml;
3)快速、高效:检测时间90min左右。
附图说明
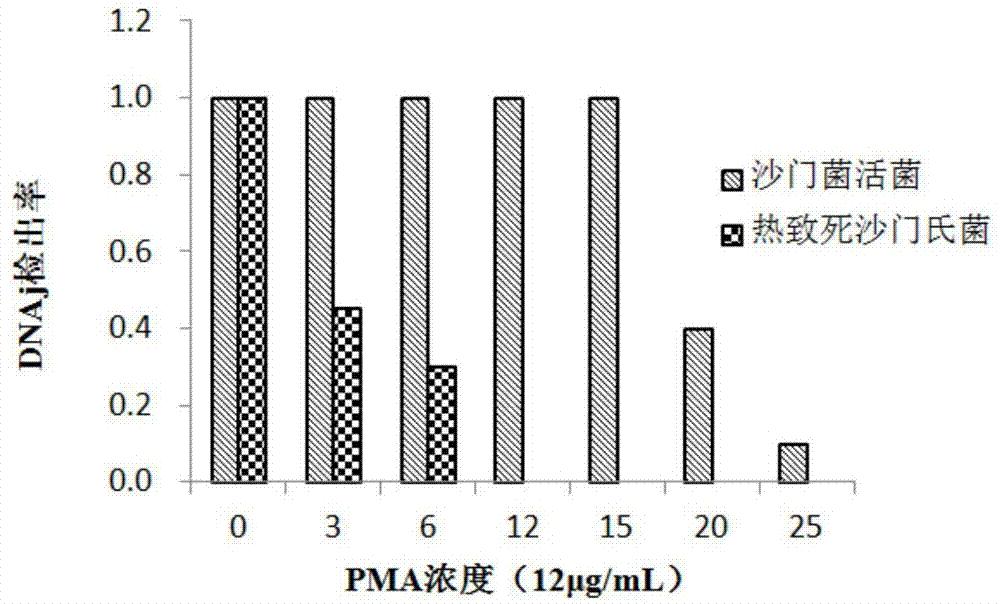
图1为pma浓度与检出率之间的关系;
图2为pma浓度为12μg/ml时,孵育时间与检出率之间的关系;
图3为pma浓度为12μg/ml时,曝光时间与检出率之间的关系。
具体实施方式
以下结合实例对本发明作进一步的详细说明:
实施例1最佳pma浓度的确定
取500μl制备好的活菌悬液和死菌悬液加入一定量的pma工作液,使pma浓度分别为0、3、6、12、15、20和25μg/ml,避光10min后样品置于冰上,650w卤素灯20cm处照射10min后,按照最佳曝光时间进行光反应,提取菌液dna做模板,进行pcr扩增和荧光定量pcr检测。结果显示利用不同浓度pma对热致死菌悬液处理时,随着浓度的增加pma对热致死菌悬液抑制率增大,当浓度为12μg/ml时,pma对热致死菌悬液抑制率达到98%;当pma浓度低于15μg/ml时,活菌检出率基本无变化,当pma浓度为20μg/ml时明显抑制活菌检出率,且浓度越高,抑制作用越明显(图1)。电泳图谱显示未加入pma的样品出现明亮条带,随着pma浓度的增大,pcr后的电泳条带逐渐减弱。在pma浓度为3-9μg/ml时,样品仍有微弱条带,说明pma并没有完全抑制样品中dna的扩增。当pma浓度增加到12μg/ml后,电泳条带消失,样品中死菌的dna完全被抑制,不能进行扩增。因此,确定区分沙门氏菌死活的最佳pma浓度为12μg/ml。
实施例2最佳孵育时间及曝光时间
取活菌悬液及死菌悬液500μl各5份,加入pma工作液,使pma浓度为12μg/ml,充分混匀,避光孵育10min,使pma与样品充分反应。然后将样品平放于冰上,置650w卤素灯下分别照射1、3、5、7和10min,样品距光源20cm。另将不加入pma的样品作为阳性对照。pma处理后提取dna,经pcr扩增,研究pma处理的最佳曝光时间。结果显示,当暗孵育时间为10min时,pma对热致死菌悬液的抑制率可达到99%(图2)。由图3可知,随着曝光时间的延长,pma对热致死菌悬液的抑制率呈上升趋势,当曝光时间为5min时,对热致死菌悬液的抑制率可达到99%。通过以上分析,确定区分沙门氏菌死活的pma最佳暗孵育时间为10min,最佳曝光时间为7min。
实施例3人工染菌样品检测
取2g市售猪肉(已检测不含沙门氏菌),无菌匀浆后,分别加入浓度为101-108cfu/ml的沙门菌菌液,作为人工污染的样品。染菌样品采用优化条件的pma处理后提取dna,进行荧光定量pcr检测,并在构建的标准曲线上判读结果,得到各浓度染菌样品的拷贝数。同时将其与传统的平皿计数法结果做比较。结果显示,当菌液浓度为101和102cfu/ml时均没有明显的扩增信号,记为“阴性”;当菌液浓度为103-108cfu/ml时可测得人工染菌样品的拷贝数。将pma-qpcr与平皿计数法结果的对数值进行配对t检验,结果显示在103-108cfu/ml范围内两者结果差异无统计学意义(p>0.05)(表1)
表1pma-qpcr与平皿计数法结果比较
注:ud=未检测到
序列表
<110>中国计量大学
<120>一种畜禽沙门氏菌活菌快速检测方法
<160>4
<170>siposequencelisting1.0
<210>1
<211>26
<212>dna
<213>人工序列(artificialsequence)
<400>1
gtgaaattatcgccacgttcgggcaa26
<210>2
<211>22
<212>dna
<213>人工序列(artificialsequence)
<400>2
tcatcgcaccgtcaaaggaacc22
<210>3
<211>17
<212>dna
<213>人工序列(artificialsequence)
<400>3
cgttaaggcagtttact17
<210>4
<211>24
<212>dna
<213>人工序列(artificialsequence)
<400>4
cgctttaatgagggcggtgcaagc24
- 还没有人留言评论。精彩留言会获得点赞!