一种重组病毒衣壳结构蛋白及其制备方法和应用与流程
本发明涉及生物工程技术领域,具体涉及一种重组病毒衣壳结构蛋白及其制备方法和应用。
背景技术:
病毒样颗粒(virus-likeparticle,vlp)是由病毒衣壳结构蛋白自组装而形成的空心纳米颗粒,不含病毒本身的核酸遗传物质而没有感染性。但vlp具有与天然病毒相近的结构特征,因此具有很强的免疫原性和生物学活性,适合进行相关疫苗的研发。例如,能够抵御乙型肝炎病毒(hbv)和人乳头瘤病毒(hpv)的vlp疫苗已经成功地应用于临床。
此外,vlp还可作为载体平台,通过化学偶联或基因融合的方式形成嵌合型vlp,或者包裹核酸或小分子。因此,病毒样颗粒作为一种蛋白类的纳米颗粒,在免疫学、基因诊断、药物输送和材料学等领域具有广阔应用前景。例如,乙肝病毒样颗粒呈二十面体,直径30-34nm,由180个或240个乙肝核心蛋白单体分别自组装成t=3、t=4形式的vlp。研究报道,结构蛋白hbc单体中存在一个半光氨酸,可与另外单体以二硫键形成二聚体,继而组装成hbcvlp。每个hbc单体存在一个免疫显性区域(mir),可供外源基因的插入,并且不影响其组装性能。乙肝病毒核心蛋白可在体外进行自组装,但是其稳定性较低,自组装效率不高,易受溶液环境的影响,同时不能够方便的在病毒样颗粒组装和解离之间转换。因而,提高病毒样颗粒的自组装效率和稳定性以及对病毒样颗粒组装和解离快捷转变,对其应用研究具有重大意义。
技术实现要素:
有鉴于此,本发明的目的在于提供一种重组病毒衣壳结构蛋白及其制备方法,使得所述重组病毒衣壳结构蛋白自组装成病毒样颗粒时的效率更高;
本发明的另外一个目的在于提供利用上述重组病毒衣壳结构蛋白自组装的病毒样颗粒,使得所述病毒样颗粒可依靠ph值的调整快捷的实现病毒样颗粒组装和解离;
本发明的另外一个目的在于提供上述重组病毒衣壳结构蛋白和病毒样颗粒在生物载体、疫苗和多酶复合体相关领域的应用。
为了实现上述发明目的,本发明提供了如下技术方案:
一种重组病毒衣壳结构蛋白,在所述病毒衣壳结构蛋白的免疫显性区域(mir)中插入一个或两个以上的酸性氨基酸残基或碱性氨基酸残基(也可理解为插入氨基酸)。
针对现有病毒样颗粒在自组装时存在效率不高以及无法简便实现病毒样颗粒组装和解离的转换的问题,本发明通过构建病毒衣壳结构蛋白的两种重组体,其一通过精氨酸或者赖氨酸等酸性氨基酸残基引入正电荷,另一通过谷氨酸或天冬氨酸等碱性氨基酸残基引入负电荷,通过正负电荷间的静电吸引提高病毒样颗粒的自组装效率和稳定性。
同时,根据vlp的荷电性质,通过溶液ph调整调控vlp自组装:在ph中性时,两种重组病毒衣壳结构蛋白携带的额外电荷分别为正和负电,二者间静电吸引促进自组装;当ph降低时,插入碱性氨基酸残基的重组病毒衣壳结构蛋白逐渐变为电中性,体系中只剩余插入酸性氨基酸残基的重组病毒衣壳结构蛋白携带的正电荷,因而导致静电排斥使vlp解离;当ph升高时,插入酸性氨基酸残基的重组病毒衣壳结构蛋白逐渐变为电中性,体系中只剩余插入碱性氨基酸残基的重组病毒衣壳结构蛋白携带的负电荷,因而导致静电排斥使vlp解离。
作为优选,所述酸性氨基酸残基为精氨酸、赖氨酸和组氨酸中的一种或两种以上;所述碱性氨基酸残基为天冬氨酸和/或谷氨酸;在本发明具体实施方式中,本发明选择精氨酸为酸性氨基酸残基,选择天冬氨酸为碱性氨基酸残基。
在本发明具体实施方式中,本发明以乙肝病毒结构蛋白hbc为例进行试验验证,通过构建乙肝病毒衣壳结构蛋白hbc的两种重组体,m+hbc(插入酸性氨基酸残基)和m-hbc(插入碱性氨基酸残基),按比例直接混合后能够自组装,紫外检测和浊点变温实验证实正负电荷引入使病毒样颗粒自组装效率和热稳定性均得到提高,也可通过调节ph值来实现病毒样颗粒的组装和分离。
为了保证自组装的最佳效果,所述酸性氨基酸残基和碱性氨基酸残基在免疫显性区域中插入个数相同,以确保正负电荷基本相当;在本发明具体实施方式中,以乙肝病毒结构蛋白hbc为例,酸性氨基酸残基或碱性氨基酸残基插入的位置介于hbc的mir中pro79和ala80之间;
根据本发明所述重组病毒衣壳结构蛋白的优点,本发明提供了其在如下任意一个方面的应用:
制备病毒样颗粒、制备疫苗、制备生物载体和制备多酶复合体。
依据上述应用,本发明提供了一种病毒样颗粒,由本发明所述的插入酸性氨基酸残基的重组病毒衣壳结构蛋白以及所述的插入碱性氨基酸残基的重组病毒衣壳结构蛋白自组装而成。
其中,所述插入酸性氨基酸残基的重组病毒衣壳结构蛋白和所述插入碱性氨基酸残基的重组病毒衣壳结构蛋白等比例自组装;所述自组装为透析法自组装或凝胶过滤色谱法自组装。
在本发明具体实施方式中,所述透析法自组装具体如下:
分离纯化所得,两种重组病毒衣壳结构蛋白,等比例混合,室温下置于透析袋(截留分子量3500~7000)中,用自组装缓冲液(10mmtris-hcl,500mmnacl,ph7.4,)透析17h,完成自组装;
同时,本发明还提供了所述病毒样颗粒在如下任意一个方面的应用:
制备疫苗、制备生物载体和制备多酶复合体。
此外,本发明提供了所述重组病毒衣壳结构蛋白的制备方法,包括:
构建包含病毒衣壳结构蛋白编码基因的重组载体,并通过基因工程技术在病毒衣壳结构蛋白的免疫显性区域编码基因上插入一个或两个以上的酸性氨基酸或碱性氨基酸密码子,将所述重组载体导入宿主表达目标蛋白,获得在所述插入了酸性氨基酸残基或碱性氨基酸残基的重组病毒衣壳结构蛋白。
更为具体地,选用商用质粒pet-28a(+),将病毒衣壳结构蛋白编码基因通过酶切方式连接至质粒上,获得重组载体,然后通过酶切方式在病毒衣壳结构蛋白的免疫显性区域编码基因上插入酸性氨基酸或碱性氨基酸密码子,将所述重组质粒导入大肠杆菌中表达目标蛋白,菌体破碎,分离含有目标蛋白的上清液,通过带有筛选标签的亲和柱分离纯化目标蛋白,使用凝胶过滤色谱分离去除咪唑,获得重组病毒衣壳结构蛋白;
由以上技术方案可知,本发明通过引入带正电荷或负电荷的酸性氨基酸残基或碱性氨基酸残基,通过正负电荷间的静电吸引辅助引导这两种重组病毒衣壳结构蛋白之间的自组装,能够提高病毒样颗粒的自组装效率和稳定性,同时通过调整ph值可以快捷的改变酸性氨基酸残基和碱性氨基酸残基的荷电性质,从而实现病毒样颗粒的组装和解离,可促进疫苗的制备、生物类载体开发和多酶复合物等体系的构建。
附图说明
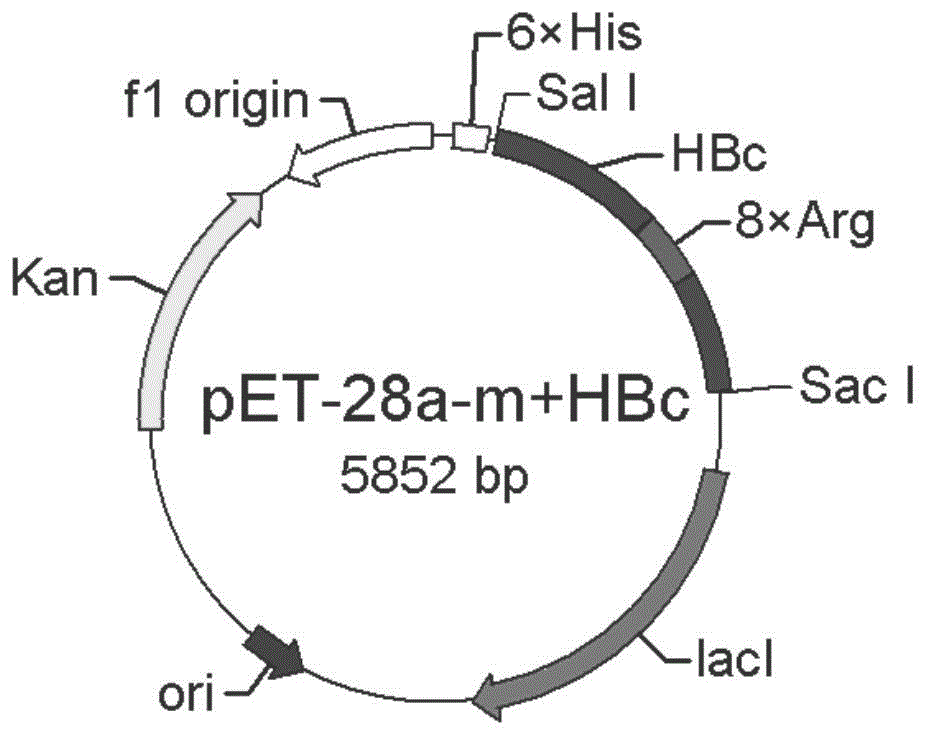
图1所示为插入酸性氨基酸残基精氨酸的重组质粒pet-28a(+)图谱;
图2所示为插入碱性氨基酸残基天冬氨酸的重组质粒pet-28a(+)图谱;
图3所示为本发明乙肝病毒样颗粒的凝胶过滤色谱结果;其中,a为蓝色葡聚糖2000溶液,b为wthbc,c为m-hbc,d为mhbc(即m-hbc与m+hbc等比例混合),e为m+hbc。
具体实施方式
本发明公开了一种重组病毒衣壳结构蛋白及其制备方法和应用,本领域技术人员可以借鉴本文内容,适当改进工艺参数实现。特别需要指出的是,所有类似的替换和改动对本领域技术人员来说是显而易见的,它们都被视为包括在本发明。本发明所述重组病毒衣壳结构蛋白及其制备方法和应用已经通过较佳实施例进行了描述,相关人员明显能在不脱离本发明内容、精神和范围内对本文所述重组病毒衣壳结构蛋白及其制备方法和应用进行改动或适当变更与组合,来实现和应用本发明技术。
以下就本发明所提供的一种重组病毒衣壳结构蛋白及其制备方法和应用做进一步说明。
实施例1:重组乙肝病毒衣壳结构蛋白的制备
1、重组质粒的构建
在带有乙肝病毒样颗粒结构蛋白hbc的基因的质粒pet-28a(+)中插入外源基因序列。根据大肠杆菌e.coilbl21(de3)密码子偏好性在hbc的pro79和ala80之间对应位点插入8个精氨酸密码子(cgtcgtcgtcgtcgtcgtcgtcgt),构建质粒pet-28a-m+hbc,质粒图谱见图1;插入8个天冬氨酸密码子(gatgatgatgatgatgatgatgat),构建质粒pet-28a-m-hbc,质粒图谱见图2。
2、重组乙肝病毒衣壳结构蛋白的表达
将构建的重组质粒转入大肠杆菌,将含有重组质粒的大肠杆菌使用划线法接种于lb固体培养基(10g/l胰蛋白胨,5g/l酵母提取物,10g/l氯化钠,15g/l的琼脂粉)上,过夜培养。然后挑取单菌落接种于25ml含有50~100μg/ml卡那霉素的lb培养基(10g/l胰蛋白胨,5g/l酵母提取物,10g/l氯化钠)中,在37℃,170rpm条件培养10~15h;将种子液分别按1:100~1:1000的比例接种到250ml含50~100μg/ml卡那霉素的lb培养基(10g/l胰蛋白胨,5g/l酵母提取物,10g/l氯化钠)中,在37℃,170rpm条件培养至菌悬液od600为0.5~0.6。加入诱导剂iptg(终浓度0.6~1.0mmol/l),转移至28℃下继续培养10~20h,诱导外源蛋白的表达;
菌液在4℃,4000~5000rpm离心15~30min,收集菌体,加入预冷的l缓冲液(10mmtris-hcl,500mmnacl,20mm咪唑,ph7.4)重悬菌体,250ml菌液离心获得的菌体加60~100ml重悬液;冰水浴超声破碎,破碎条件为:200~400w,60%输出功率,工作2s,间歇3s,70~100个循环。破菌液在4℃,10000~12000rpm离心15~30min以除去细胞碎片,获得含有目标蛋白的上清液。
3、重组乙肝病毒衣壳结构蛋白的分离纯化
获得的含有目标蛋白的上清液通过1mlhistraptmhp亲和柱进行分离:使用l缓冲液以1.0~2.0ml/min的流速平衡亲和柱,以0.5~1.0ml/min流速上样,之后使用洗脱缓冲液e(10mmtris-hcl,500mmnacl,500mm咪唑,ph7.4)以0.5~1.0ml/min的流速洗脱,获得纯化的目标蛋白。向获得的目标蛋白溶液中加入dtt,使其终浓度为10mm,打开二硫键。
凝胶过滤色谱去除咪唑以分离纯化目标蛋白:使用f缓冲液(10mmtris-hcl,500mmnacl,2mmdtt,ph7.4)以0.5~1.0ml/min的流速平衡凝胶过滤柱superdexg-25;将样品以同样流速上样;使用f缓冲液洗脱,保存出峰位置的蛋白,通过电泳验证目标蛋白。
将分离纯化所得的m+hbc(插入精氨酸的重组乙肝病毒衣壳结构蛋白)和m-hbc(插入天冬氨酸的重组乙肝病毒衣壳结构蛋白)均使用圆二色测定其二级结构,扫描光谱范围为190~260nm,以wthbc(野生型乙肝病毒衣壳结构蛋白)作为对照。结果表明,m-hbc和m+hbc与wthbc具有相同二级结构,说明带正电或带负电序列的插入并不影响结构蛋白的二级结构。
实施例2:乙肝病毒样颗粒的自组装
将实施例1分离纯化所得的m+hbc(插入精氨酸的重组乙肝病毒衣壳结构蛋白)和m-hbc(插入天冬氨酸的重组乙肝病毒衣壳结构蛋白)按分子比等比例混合,室温下置于透析袋(截留分子量3500~7000)中,用自组装缓冲液(10mmtris-hcl,500mmnacl,ph7.4,)透析17h。
实施例3:乙肝病毒样颗粒的自组装效率检测
用f缓冲液(10mmtris-hcl,0.5mnacl,2mmdtt,ph7.4)配制0.2mg/ml的蓝色葡聚糖2000溶液,取1ml备用。此外,取0.2mg/ml的三种蛋白(m-hbc、m+hbc与wthbc)样各1ml,另取0.5mlm+hbc和0.5mlm-hbc的混合液1ml。分别将上述样品过sepharose6ff凝胶色谱柱,柱体积为20~30ml,所用流动相为自组装缓冲液(10mmtris-hcl,0.5mnacl,ph7.4),流速为0.5~2ml/min。通过比较不同样品的峰高从而比较不同样品的组装效率,如图3。
由图3可以看出,用蓝色葡聚糖标定色谱出峰情况,从左至右两峰分别为葡聚糖和溶液中dtt。hbc样品呈现三峰,从左至右分别为自组装体,自组装中间体,dtt。所以结果表明野生型和突变型hbc均能形成自组装体,但通过原子力显微镜检测发现野生型hbc形成的多为无规聚集体,而突变体m-hbc形成颗粒尺寸与理论尺寸接近。同时,从自组装中间体的比较显示,突变体m-hbc的中间体多于野生型,表明突变体能够更好的从单体向自组装体过渡,从而能获得更好的自组装效果。同时,图中m-hbc的中间体分布含量最高,这表明后续可能通过m+hbc和m-hbc的比例优化获得更高效的组装效果。由于m+hbc和m-hbc相比野生型hbc更容易且更高效组装,表明其组装推动力更强,进而说明病毒样颗粒的稳定性更强。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!