一种具有嗜冷特性的碱性果胶酶及其应用的制作方法
本发明涉及一种具有嗜冷特性的碱性果胶酶及其应用,属于生物技术领域。
背景技术:
果胶是植物细胞壁和中胶层的重要组成部分,主要是直链α-1,4糖苷键连接的d-半乳糖醛酸残基组成的复合多糖,一般带有阿拉伯糖、鼠李糖、木糖、海藻糖、乳糖等组成的侧链,游离的羧基部分或全部与钙、钾、钠离子,特别是与硼化物结合在一起,含有20种不同的糖苷键。
果胶酶是一类分解果胶质的酶的总称,是含有多种组分的复合酶。果胶酶广泛分布在高等植物和微生物中。目前多种微生物来源果胶酶已经进入到商品化应用阶段,销售额可占到微生物酶制剂产值的25%。但是目前商品化的果胶酶多为酸性果胶酶,在碱性条件下活性较弱。碱性果胶酶研究较少,寻找具有特殊性质的碱性果胶酶,并研究其降解条件及最终产物具有重要意义。
技术实现要素:
本发明针对现有技术的不足,提供了一种具有嗜冷(cold-adapted)特性的碱性果胶酶pelv307及其应用。该酶与已有功能的果胶酶的氨基酸相似度仅为56%。最适反应温度为30℃,最适反应ph为8.6;具有嗜冷的特性,在0℃和10℃下的酶活力分别能达到最大反应温度下活性的33.4%和68.6%。该酶降解方式为内切,降解主产物为不饱和二糖和三糖。
一方面,本发明提供一种新型具有嗜冷特性的碱性果胶酶pelv307,其氨基酸序列如seqidno.1所示。
seqidno.1:
msqkylslslvslavagsmalnsayaaslstnqeltaadigyatenggttggadavsdniylvsnktdfkaalkedkgepriiqisgtidisggeeysdfddqksrsqikipadttiigvtsdagftngslvvskvenviirnisietpvdvephyedgdgwnaewdsmtitystnvwvdhvtfddgsftdadyeevdgeeyvqhdgqldikhgsdyvtvsnsifknhnktmlighsksnsseddghlrvtlannifssiiqrtprvrfgkihvfnnlfegdykddtygymysfglgykgsifsekniftidnlkdskkcklvsvkqsnsslldddsvfngsslslddcdiptdnlswtvpynysllstdeleaslesnagagklyl
另一方面,本发明还提供所述果胶酶pelv307对应的核酸序列,如seqidno.2所示。
seqidno.2:
atgtctcaaaaatacctatctctatctctagtttctctagctgttgctggttctatggctctaaactctgcttacgctgcttctctatctactaaccaagaactaactgctgctgacatcggttacgctactgaaaacggtggtactactggtggtgctgacgctgtttctgacaacatctacctagtttctaacaaaactgacttcaaagctgctctaaaagaagacaaaggtgaaccacgtatcatccaaatctctggtactatcgacatctctggtggtgaagaatactctgacttcgacgaccaaaaatctcgttctcaaatcaaaatcccagctgacactactatcatcggtgttacttctgacgctggtttcactaacggttctctagttgtttctaaagttgaaaacgttatcatccgtaacatctctatcgaaactccagttgacgttgaaccacactacgaagacggtgacggttggaacgctgaatgggactctatgactatcacttactctactaacgtttgggttgaccacgttactttcgacgacggttctttcactgacgctgactacgaagaagttgacggtgaagaatacgttcaacacgacggtcaactagacatcaaacacggttctgactacgttactgtttctaactctatcttcaaaaaccacaacaaaactatgctaatcggtcactctaaatctaactcttctgaagacgacggtcacctacgtgttactctagctaacaacatcttctcttctatcatccaacgtactccacgtgttcgtttcggtaaaatccacgttttcaacaacctattcgaaggtgactacaaagacgacacttacggttacatgtactctttcggtctaggttacaaaggttctatcttctctgaaaaaaacatcttcactatcgacaacctaaaagactctaaaaaatgtaaactagtttctgttaaacaatctaactcttctctactagacgacgactctgttttcaacggttcttctctatctctagacgactgtgacatcccaactgacaacctatcttggactgttccatacaactactctctactatctactgacgaactagaagcttctctagaatctaacgctggtgctggtaaactatacctataa
另一方面,本发明还提供一种所述果胶酶pelv307的制备方法。
另一方面,本发明还提供了所述果胶酶pelv307在裂解果胶中的应用。
另一方面,本发明还提供了所述果胶酶pelv307在制备果胶寡糖中的应用。
另一方面,一种裂解果胶的方法,所选用的果胶酶为所述果胶酶pelv307。
优选:所述裂解条件中反应温度为0~60℃。最适反应温度为30℃。
优选:所述裂解条件中反应ph为3.0~10.6。最适反应ph为8.6。
有益效果:
1.本发明的果胶酶pelv307为结构与功能新颖的酶,归属于多糖裂解酶第1家族(pl-1),其氨基酸序列与已知功能的果胶酶序列相似度最高仅为56%。
2.本发明提供了一种制备该新型果胶酶的方法,即利用基因工程的技术方法,将果胶酶pelv307的基因序列异源重组表达到大肠杆菌,经摇瓶发酵后,发酵液酶活力高达120.9u/ml。并且该酶纯化方法简单,利用镍柱对其进行一步亲和纯化,回收率达到71.3%,蛋白质纯度高达95%。
3.本发明的果胶酶pelv307具有优良的理化性质,该酶最适反应ph为8.6。并且,其具有嗜冷特性,在0℃和10℃下的酶活力分别能达到最大反应温度下活性的33.4%和68.6%。该酶降解方式为内切,降解主产物为不饱和果胶二糖和三糖
综上所述,本发明所述的果胶酶pelv307具有良好的应用前景。
附图说明
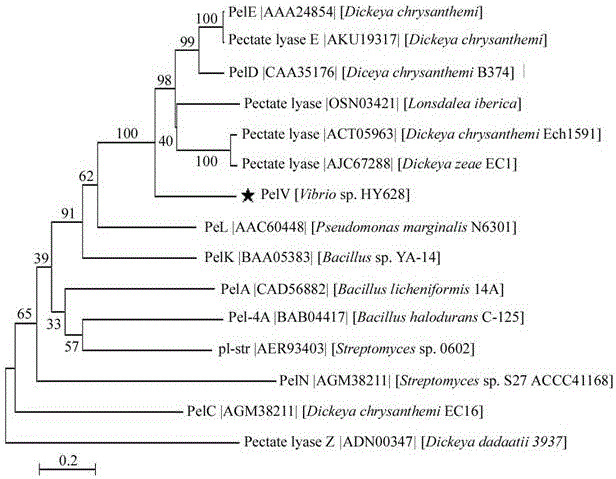
图1为本发明果胶酶pelv307与已知功能果胶酶序列之间的进化关系结果;
图2为本发明果胶酶pelv307蛋白质分离纯化图(m,蛋白质标准品;1,纯化所得果胶酶pelv307);
图3为本发明果胶酶pelv307的温度和ph适应性分析(a,果胶酶pelv307的最适反应温度;b,果胶酶pelv307的温度稳定性;c,果胶酶pelv307的最适反应ph;d,果胶酶pelv307的ph稳定性);
图4为本发明粘度法检测果胶酶pelv307的降解方式(实线为反应体系粘度变化,虚线为反应体系a235变化);
图5为高效液相法(a)和阴离子一级质谱法(b)检测本发明果胶酶pelv307的降解产物(dp2,不饱和果胶二糖;dp3,不饱和果胶三糖)。
具体实施方式
实施例1果胶酶pelv307序列分析
本发明所述果胶酶pelv307的产酶基因pelv307为人工合成序列。前期研究中,我们发现海洋细菌vibriosp.hy628具有较高的果胶酶活性,对其进行全基因测序时,发现其含有一个预测的果胶酶序列。我们将该基因序列根据宿主(大肠杆菌的)的密码子偏好性,进行了序列优化,并由华大基因公司进行全合成。本发明所述果胶酶pelv307包含有1164个碱基序列,编码387个氨基酸序列。利用nationalcenterforbiotechnologyinformation(ncbi)中的保守结构域分析conserveddomain(cdd)和多重序列比对basiclocalalignmentsearchtool(blast)发现,该序列包含有一个多糖裂解酶第1家族(pl-1)的保守区。已经报道的果胶酶中,与pelv307氨基酸序列相似度最高的为来源于dickeyachrysanthemi的多糖裂解酶第1家族(pl-1)的果胶酶peld(genbankaaa24854),两者之间的氨基酸序列相似度(identity)为56%。本发明所述的果胶酶pelv307氨基酸序列进行blast分析,将其与已报道的果胶酶,利用clustalx软件进行多重序列比对,并利用mega7.1软件进行进化树分析。如图1所示,果胶酶pelv307与其他已经报道的果胶酶具有较远的亲缘关系,为一个新颖的果胶酶。
实施例2果胶酶pelv307的重组表达
将实施例1中所述的果胶酶pelv307的产酶基因序列以限制性内切酶ndei和xhoi为酶切位点,设计重组引物如下(下划线为限制性内切酶位点):
正向引物:seqidno.3:pelv307ef:
5’-catatgtctcaaaaatacctatctct-3’(ndei)
反向引物:seqidno.4:pelv307er:
5’-ctcgagtaggtatagtttaccagcacc-3’(xhoi)
pcr扩增条件为:94℃预变性3分钟;94℃变性30秒,55℃退火30秒,72℃延伸1分钟,共30个循环;72℃延伸5分钟;4℃稳定15分钟。pcr反应所用dna聚合酶为primerstarhs购自大连宝生物公司。
pcr产物用限制性内切酶ndei和xhoi进行双酶切,通过琼脂糖凝胶电泳回收酶切后的pcr产物。pet24a(+)质粒dna(美国invitrogen公司),同样用限制性内切酶ndei和xhoi进行双酶切,进行琼脂糖凝胶电泳并回收酶切后的产物片段。酶切所用酶和底物反应体系(温度、时间、dna用量等)均参照大连宝生物提供的产品说明操作。
双酶切处理的pcr产物和pet-24a(+)质粒载体参照dna连接酶(大连宝生物公司)说明书进行连接反应;连接产物转化至大肠杆菌dh5α菌株(美国invitrogen公司),涂布在luria-bertani(lb)培养基固体平板上(含有50μg/ml卡纳霉素的),37℃温箱中培养12-16小时后,挑取单克隆;将单克隆转接至lb液体培养基中(含有50μg/ml卡纳霉素),转速为180rpm的37℃摇床中培养过夜。将单克隆进行序列测定,选择阳性克隆,并将其命名为pet-24a(+)-pelv307。重组质粒转化至大肠杆菌bl21(de3)(购自大连宝生物公司),将重组大肠菌株命名为bl21(de3)/pet-24a(+)-pelv307,保存在-80℃备用。
实施例3果胶酶pelv307的发酵及纯化制备方法
将实施例2中构建的大肠杆菌bl21(de3)/pet-24a(+)-pelv307转接至lb液体培养基中(50μg/ml卡纳霉素),在37℃摇床中180rpm震荡培养至od600=0.6,加入终浓度为0.1mm的诱导剂异丙基-β-d-硫代半乳糖苷(iptg),在20℃诱导20h。果胶酶活性测定方法为:100μl酶液加入900μl0.3%果胶底物(20mmgly-naoh缓冲液,ph=8.6),在30℃下反应10min,用分光光度计测定a235数值。酶活力定义为1ml酶液引起a235数值增加0.1为一个酶活力单位。发酵液酶活力可达120.9u/ml。
发酵停止后,12000rpm离心10min,弃菌体,收集上清液,上样于5ml镍离子亲和层析柱,上样流速为5ml/min,利用10mm咪唑洗脱,去除杂蛋白,再利用150mm的咪唑洗脱,收集洗脱组分。将活性成分透析去除咪唑,分装储存在-20℃备用。通过镍离子一步亲和纯化,蛋白回收率达到71.3%。纯化所得果胶酶进行聚丙烯酰胺凝胶电泳(sds-page),如图2所示,纯化所得pelv307的分子量大约为36.5kda,与序列分析中预测的蛋白大小一致。通过凝胶分析发现,纯化所得果胶酶pelv307的蛋白纯度达到95%以上。
实施例4温度和ph对果胶酶pelv307的影响
将实施例3中纯化所得果胶酶pelv307100μl加入900μl0.3%果胶底物(20mmgly-naoh缓冲液,ph=8.6),在不同温度(0-60℃)下反应10min,用分光光度计测定a235数值,以最高酶活力为100%,计算不同温度下果胶酶pelv307的相对酶活力。如图3a所示,果胶酶pelv307的最适反应温度为30℃。具有嗜冷的特性,在0℃和10℃下的酶活力分别能达到最大反应温度下活性的33.4%和68.6%。
将实施例3中纯化所得果胶酶pelv307(1ml)在不同温度(0-60℃)下孵育1h,取出后,立即在其最适反应温度(30℃)下检测其酶活力,以孵育前的活力作为100%,如图3b所示,果胶酶pelv307温度稳定性较差,在30℃下孵育1h,酶即失去大部分活性,利于在反应过程中定向灭活,终止反应。
将实施例3中纯化所得果胶酶pelv307100μl加入900μl0.3%褐藻胶底物(gly-naoh缓冲液,ph=8.6),在4种不同缓冲液中反应10min,用分光光度计测定a235数值,以最高酶活力为100%,计算不同ph条件下果胶酶pelv307的相对酶活力。使用的4种缓冲液分别为50mm磷酸盐缓冲液,甘氨酸-naoh缓冲液,na2hpo4-柠檬酸缓冲液,tris-hcl缓冲液。如图3c所示,果胶酶pelv307的最适反应ph为8.6。
将实施例3中纯化所得果胶酶pelv307在不同ph条件(3-10.6)下孵育12h,取出后,立即在其最适反应ph(8.6)下检测其酶活力,以孵育前的活力作为100%,如图3d所示,果胶酶pelv307只在比较狭窄的ph范围内保持稳定。
实施例5果胶酶pelv307降解方式的粘度法检测
使用乌氏粘度计进行降解方式的确定,0.1ml果胶酶pelv307酶液(30u)加入9.9ml0.3%果胶底物,30℃反应不同时间(1、5、10、30、60min),煮沸10min终止反应。在室温条件下,利用乌氏粘度计计算不同酶解时间的产物粘度。同时,利用a235法测定不同酶解时间的产物的吸光度变化,测定对应的酶活力。通过测定结果(图4)可知,酶解反应初期(1-5分钟),产物粘度急剧下降,而此时a235法检测的酶解产物形成的不饱和双键没有急剧增加,说明果胶酶pelv307的酶解方式为内切。
实施例6果胶酶pelv307降解产物的高效液相检测
将实施例3中纯化所得果胶酶pelv307(10u)与0.1%的果胶底物共孵育过夜,降解产物12,000g离心10分钟,弃沉淀,将上清20μl上样至预平衡(0.2m的碳酸氢铵)的凝胶过滤柱(superdexpeptide10/300)。流速为0.6ml/min,流动相为0.2m的碳酸氢铵,检测时间为40分钟,在235nm下检测吸光度。如图5a所示,与标准寡糖出峰时间进行比对发现,果胶酶pelv307的降解产物主要为不饱和果胶二糖和三糖。
实施例7果胶酶pelv307酶解产物质谱(esi-ms)分析
将实施例6中孵育所得样品进行脱盐处理,并与乙腈进行等体积混合,进行阴离子一级质谱检测,确定酶解产物的分子量。阴离子模式一级质谱结果表明(图5b),降解主产物为不饱和果胶二糖和三糖,与hplc检测结果一致。
序列表
<110>青岛大学
<120>一种具有嗜冷特性的碱性果胶酶及其应用
<160>4
<170>siposequencelisting1.0
<210>1
<211>387
<212>prt
<213>人工序列(artificialsequence)
<400>1
metserglnlystyrleuserleuserleuvalserleualavalala
151015
glysermetalaleuasnseralatyralaalaserleuserthrasn
202530
glngluleuthralaalaaspileglytyralathrgluasnglygly
354045
thrthrglyglyalaaspalavalseraspasniletyrleuvalser
505560
asnlysthraspphelysalaalaleulysgluasplysglyglupro
65707580
argileileglnileserglythrileaspileserglyglygluglu
859095
tyrserasppheaspaspglnlysserargserglnilelysilepro
100105110
alaaspthrthrileileglyvalthrseraspalaglyphethrasn
115120125
glyserleuvalvalserlysvalgluasnvalileileargasnile
130135140
serilegluthrprovalaspvalgluprohistyrgluaspglyasp
145150155160
glytrpasnalaglutrpaspsermetthrilethrtyrserthrasn
165170175
valtrpvalasphisvalthrpheaspaspglyserphethraspala
180185190
asptyrglugluvalaspglygluglutyrvalglnhisaspglygln
195200205
leuaspilelyshisglyserasptyrvalthrvalserasnserile
210215220
phelysasnhisasnlysthrmetleuileglyhisserlysserasn
225230235240
sersergluaspaspglyhisleuargvalthrleualaasnasnile
245250255
pheserserileileglnargthrproargvalargpheglylysile
260265270
hisvalpheasnasnleuphegluglyasptyrlysaspaspthrtyr
275280285
glytyrmettyrserpheglyleuglytyrlysglyserilepheser
290295300
glulysasnilephethrileaspasnleulysaspserlyslyscys
305310315320
lysleuvalservallysglnserasnserserleuleuaspaspasp
325330335
servalpheasnglyserserleuserleuaspaspcysaspilepro
340345350
thraspasnleusertrpthrvalprotyrasntyrserleuleuser
355360365
thraspgluleuglualaserleugluserasnalaglyalaglylys
370375380
leutyrleu
385
<210>2
<211>1164
<212>dna
<213>人工序列(artificialsequence)
<400>2
atgtctcaaaaatacctatctctatctctagtttctctagctgttgctggttctatggct60
ctaaactctgcttacgctgcttctctatctactaaccaagaactaactgctgctgacatc120
ggttacgctactgaaaacggtggtactactggtggtgctgacgctgtttctgacaacatc180
tacctagtttctaacaaaactgacttcaaagctgctctaaaagaagacaaaggtgaacca240
cgtatcatccaaatctctggtactatcgacatctctggtggtgaagaatactctgacttc300
gacgaccaaaaatctcgttctcaaatcaaaatcccagctgacactactatcatcggtgtt360
acttctgacgctggtttcactaacggttctctagttgtttctaaagttgaaaacgttatc420
atccgtaacatctctatcgaaactccagttgacgttgaaccacactacgaagacggtgac480
ggttggaacgctgaatgggactctatgactatcacttactctactaacgtttgggttgac540
cacgttactttcgacgacggttctttcactgacgctgactacgaagaagttgacggtgaa600
gaatacgttcaacacgacggtcaactagacatcaaacacggttctgactacgttactgtt660
tctaactctatcttcaaaaaccacaacaaaactatgctaatcggtcactctaaatctaac720
tcttctgaagacgacggtcacctacgtgttactctagctaacaacatcttctcttctatc780
atccaacgtactccacgtgttcgtttcggtaaaatccacgttttcaacaacctattcgaa840
ggtgactacaaagacgacacttacggttacatgtactctttcggtctaggttacaaaggt900
tctatcttctctgaaaaaaacatcttcactatcgacaacctaaaagactctaaaaaatgt960
aaactagtttctgttaaacaatctaactcttctctactagacgacgactctgttttcaac1020
ggttcttctctatctctagacgactgtgacatcccaactgacaacctatcttggactgtt1080
ccatacaactactctctactatctactgacgaactagaagcttctctagaatctaacgct1140
ggtgctggtaaactatacctataa1164
<210>3
<211>26
<212>dna
<213>人工序列(artificialsequence)
<400>3
catatgtctcaaaaatacctatctct26
<210>4
<211>27
<212>dna
<213>人工序列(artificialsequence)
<400>4
ctcgagtaggtatagtttaccagcacc27
- 还没有人留言评论。精彩留言会获得点赞!