一种利用羰基还原酶不对称合成度洛西汀中间体的方法与流程
本发明涉及一种利用羰基还原酶不对称合成度洛西汀中间体的方法,属于生物催化
技术领域:
。
背景技术:
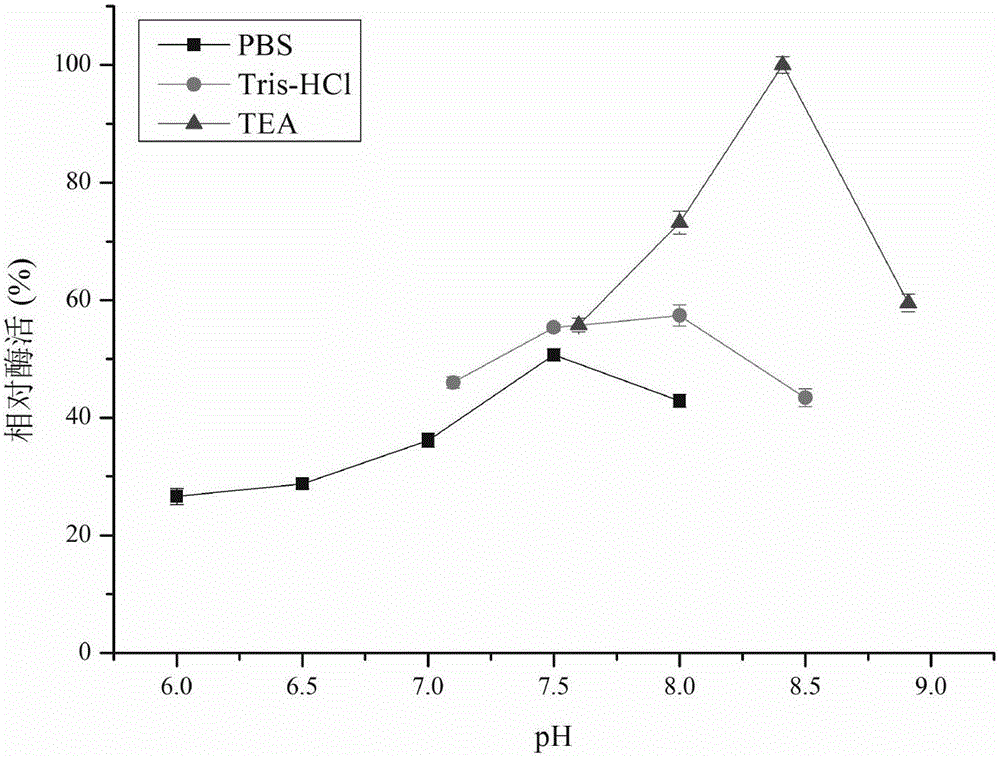
:(S)-DHTP的化学结构为:度洛西汀,英文名(R)-Duloxetine,化学名(S)-N-甲基-3-(1-萘氧基)-3-(2-噻吩基)-1-丙胺,商品名欣百达,是一种5-羟色胺和去甲肾上腺素再摄取的双重抑制剂(SNRIs)。临床上应用其盐酸盐治疗抑郁症、压力性尿失禁、抑郁症伴发慢性疼痛、糖尿病周围神经病性疼痛。度洛西汀的两种化学组成相同的同分对映异构体中,只有(S)-型具有上述药理活性。目前有很多不对称合成手性度洛西汀的方法。通过逆合成分析可以发现,(S)-N,N-二甲基-3-羟基-3-(2-噻吩)-1-丙胺(DHTP)是制备度洛西汀的一种重要手性中间体,N,N-二甲基-3-酮-3-(2-噻吩)-1-丙胺(DKTP)可以被不对称还原生成(S)-DHTP,因而通过(S)-专一性不对称还原DKTP已经成为高效制备度洛西汀的一种重要方法。生物法制备手性醇具有高效、专一、立体选择性好、反应条件温和等优点,已经成为制备手性醇的重要手段。目前,已经筛选得到多株能够不对称还原DKTP制备度洛西汀中间体(S)-DHTP的微生物,例如Exiguobacteriumsp.、Thermoanaerobactersp.、Candidatropicalis、C.parapsilosis、C.viswanathii、SporobolomycessalmonicolorAKU4429等。其中C.tropicalis、C.viswanathii催化1g/LDKTP不对称生成(S)-DHTP时,转化率为80%左右、对映体过量值>99%,但是反应时间长达60h,效率低下,大大限制了其工业应用。目前国内度洛西汀手性中间体的研究较少,且水平较低。因此,有必要寻找高选择性的酶,以实现DKTP不对称生成(S)-DHTP的高效生物反应制备。技术实现要素:为了解决上述问题,本发明的目的是提供一种重组立体选择性羰基还原酶纯酶催化合成度洛西汀重要中间体(S)-N,N-二甲基-3-羟基-3-(2-噻吩)-1-丙胺((S)-DHTP)的方法,通过从CandidamacedoniensisAKU4588获得羰基还原酶基因cr2,利用该基因编码的羰基还原酶CR2催化不对称还原DKTP为(S)-DHTP。本发明目的不仅仅在于构建一种不对称转化制备(S)-DHTP的纯酶催化体系,并将该纯酶体系应用于不对称还原制备(S)-DHTP的反应中,以提高不对称转化制备(S)-DHTP的生产效率,而且利用该纯酶体系,通过控制反应pH、反应温度、金属离子优化,了解CR2催化DKTP的性质和功能,高立体选择性的催化DKTP,通过不对称转化反应制备光学纯的度洛西汀重要中间体(S)-DHTP。本发明提供了一种不对称转化制备(S)-DHTP的方法,所述方法是利用Candidamacedoniensis来源的羰基还原酶作为催化剂催化底物N,N-二甲基-3-酮-3-(2-噻吩)-1-丙胺(DKTP)合成(S)-DHTP。在本发明的一种实施方式中,所述Candidamacedoniensis为CandidamacedoniensisAKU4588。在本发明的一种实施方式中,所述羰基还原酶是NCBI上genebank:AB183149的羰基还原酶(氨基酸序列如SEQIDNO.1所示、核苷酸序列如SEQIDNO.2所示)。在本发明的一种实施方式中,所述方法是以羰基还原酶纯酶作为催化剂。在本发明的一种实施方式中,所述羰基还原酶的添加量为20-100U/L。在本发明的一种实施方式中,所述方法,是在pH7.0-9.5的缓冲液中,于温度30-40℃、Zn2+存在条件下催化底物DKTP反应合成(S)-DHTP。在本发明的一种实施方式中,所述缓冲液为0.1mol/L的磷酸盐缓冲液(PBS)、0.1mol/LTris-HCl缓冲液或者是0.1mol/L三乙醇胺缓冲液(TEA)。在本发明的一种实施方式中,所述缓冲液为0.1mol/LTEA缓冲液(pH8.4)。在本发明的一种实施方式中,所述温度为35℃。在本发明的一种实施方式中,所述Zn2+浓度为1mmol/L在本发明的一种实施方式中,所述底物DKTP的浓度为1-5g/L。在本发明的一种实施方式中,所述方法中还需要添加适量辅酶NAD(P)H。在本发明的一种实施方式中,所述方法中反应合成的时间为4-8h,优选4-6h。在本发明的一种实施方式中,所述方法具体是:在0.1mol/LTEA缓冲液(pH8.4)、35℃、Zn2+浓度为1mmol/L的条件下,加入羰基还原酶催化底物DKTP振荡反应,反应时间为4-6h;底物浓度为1g/L、酶添加量为20U/L、辅酶NAD(P)H添加量为4.55mmol/L。本发明还提供一种所述羰基还原酶的生产方法,是以pET21c为载体、E.coliBL21为宿主表达所述羰基还原酶基因,然后将诱导表达的发酵液中离心获得上清液即为粗酶液,再将粗酶液进行纯化得到羰基还原酶纯酶。在本发明的一种实施方式中,所述诱导表达,是培养至OD600为0.6-0.8时,向培养基中加入0.1mmol/LIPTG,17℃、200r/min诱导表达12h。在本发明的一种实施方式中,所述纯化是采用Ni离子亲和层析法进行分离纯化。在本发明的一种实施方式中,所述纯化具体是:在4℃条件下,先后用20mL20%乙醇、40mL超纯水冲洗柱子,再用20mL的Bindingbuffer(20mmol/LTris-HCl,0.3mol/LNaCl,40mmol/L咪唑,pH7.0)平衡柱子,平衡完成后将粗酶液缓慢加入柱中,先后用10mlBindingBuffer、10ml60mmol/L咪唑(20mmol/LTris-HCl,0.3mol/LNaCl,60mmol/L咪唑,pH7.0)洗去亲和力较弱的杂蛋白,最后加入Elutionbuffer(20mmol/LTris-HCl,0.3mol/LNaCl,300mmol/L咪唑,pH7.0)进行洗脱,得到目标蛋白液。本发明的有益效果:本发明利用纯酶催化反应,通过控制反应pH、反应温度、金属离子优化,了解CR2催化DKTP的性质和功能,高立体选择性的催化DKTP,通过不对称转化反应制备光学纯的度洛西汀重要中间体(S)-DHTP。按照本发明方法,转化后得到产物(S)-DHTP,光学纯度为99%e.e.,产率为92%。附图说明图1为重组羰基还原酶CR2的最适pH值;图2为重组羰基还原酶CR2的最适pH值;图3为重组羰基还原酶CR2的酸碱耐受性;图4为重组羰基还原酶CR2的温度耐受性;图5为重组羰基还原酶CR2催化DKTP的不对称还原的产物(S)-DHTP的产率和光学纯度;图6为重组酶CR2不对称还原DKTP的产物分析。其中A:(R)-DHTP(保留时间,16.4min)和(S)-DHTP(保留时间,18.3min)的标准样;B:没有酶作用的DKTP(保留时间,17.3min);C:反应产物。具体实施方式本发明的技术方案:本发明首先从表达羰基还原酶的重组大肠杆菌出发制备羰基还原酶纯酶,通过控制反应pH、反应温度、金属离子优化,了解CR2催化DKTP的性质和功能,获得较好的催化效果。在此基础上,对该纯酶体系催化不对称还原制备(S)-DHTP转化效果进行考察。利用羰基还原酶的重组菌纯酶体系催化不对称转化制备(S)-DHTP的方法,是以羰基还原酶的重组菌纯酶体系为催化剂,通过控制反应pH、反应温度、金属离子优化,了解CR2催化DKTP的性质和功能,并用于不对称转化反应中,催化DKTP不对称转化反应制备光学纯芳基醇。所用的pH缓冲液为0.1mol/L磷酸盐缓冲液(PBS)(pH6.0-8.0)、0.1mol/LTris-HCl缓冲液(pH7.0-8.5)和0.1mol/L三乙醇胺缓冲液(TEA)(pH7.5-9.0);所用温度梯度为20-80℃,反应底物为N,N-二甲基-3-酮-3-(2-噻吩)-1-丙胺(DKTP),重组菌为表达醛酮还原酶基因的E.coliBL21/pET21c-cr2,羰基还原酶纯酶基因cr2来自于CandidamacedoniensisAKU4588,该基因编码羰基还原酶CR2,催化不对称还原DKTP为(S)-DHTP。其中:(1)重组酶酶活测定体系:100μL体系中含0.1mol/LTris-HCl缓冲液(pH7.5),0.5mmol/LNAD(P)H,5mmol/L底物,30℃恒温3min,最后加入适量纯酶液混合均匀后,开始扫描340nm处的吸光值变化。1个酶活单位(U)是指,每分钟催化氧化1μmol辅酶NAD(P)H的酶量。(2)蛋白含量的测定:用ThermoScientificNanodrop8000型检测器检测280nm处的吸光值E,目标蛋白浓度根据摩尔消光系数换算得到,即蛋白浓度(mg/mL)=E/摩尔消光系数,重组酶的摩尔消光系数通过在线网站http://www.expasy.org/预测获得。比活计算公式:比活(U/mg)=酶活(U)/蛋白量(mg)。(3)产物检测:产物检测均在Agilent1200型液相色谱仪上进行。DKHP的检测条件:ChiralcelOD-H柱(250mm×4.6mm;DaicelChemicalInd.,Ltd.,Japan),紫外检测波长241nm,流动相为正己烷:异丙醇(98:2,体积比),流速0.8mL/min。出峰时间:(R)-DHTP16.4min、(S)-DHTP18.3min。产物对映过量值的计算:对映过量值(e.e.%)=[(CS-CR)/(CS+CR)]×100%产物产率的计算:产率(%)=CS/C0×100%式中CS为反应后(S)-对映体的浓度,CR为反应后(R)-对映体的浓度,C0为反应前底物的浓度。实施例1:重组羰基还原酶的表达及纯化LB培养基(g/L):酵母提取物5.0,蛋白胨10.0,NaCl10.0,pH7.0(固体培养基加入20.0琼脂)。培养基的灭菌条件:1×105Pa,灭菌30min。重组菌构建:将来自于CandidamacedoniensisAKU4588的羰基还原酶纯酶基因cr2(氨基酸序列genebank:AB183149),基于基因序列通过PCR获得全长DNA片段,通过NdeI和XhoI双酶切分别处理羰基还原酶基因cr2的DNA片段和表达载体pET21c,利用连接酶进行目的基因DNA片段与载体片段的粘性末端连接,获得重组质粒pET21c-cr2,进一步转化感受态大肠杆菌E.coliBL21,得到重组菌株E.coliBL21/pET21c-cr2。挑取E.coliBL21/pET21c-cr2单菌落接种到含80μg/mL氨苄青霉素的4mLLB液体培养基中,37℃、200r/min过夜振荡培养,并以2%的接种量转接到含80μg/mL氨苄青霉素的100mLLB液体培养基中,37℃、200r/min振荡培养至OD600为0.6-0.8时,向培养基中加入0.1mmol/LIPTG,17℃、200r/min诱导表达12h。将诱导表达后的发酵液离心,收集菌体并用生理盐水洗涤3次,重悬于20mmol/LTris-HCl缓冲液(pH7.0),高压匀浆破碎。4℃条件下12000r/min离心收集上清液并用0.22μm滤膜过滤,即为粗酶液。采用Ni离子亲和层析法对重组羰基还原酶进行分离纯化:在4℃条件下,先后用20mL20%乙醇、40mL超纯水冲洗柱子,再用20mL的Bindingbuffer(20mmol/LTris-HCl,0.3mol/LNaCl,40mmol/L咪唑,pH7.0)平衡柱子,平衡完成后将粗酶液缓慢加入柱中,先后用10mlBindingBuffer、10ml60mmol/L咪唑(20mmol/LTris-HCl,0.3mol/LNaCl,60mmol/L咪唑,pH7.0)洗去亲和力较弱的杂蛋白,最后加入Elutionbuffer(20mmol/LTris-HCl,0.3mol/LNaCl,300mmol/L咪唑,pH7.0)进行洗脱,得到目标蛋白液。用于不对称转化反应。实施例2:重组羰基还原酶CR2的最适pH值酶活测定体系:100μL体系,0.5mmol/LNAD(P)H,5mmol/L底物,30℃恒温3min,最后加入20U/L纯酶液混合均匀后,开始扫描340nm处的吸光值变化。在不同pH梯度(6.0-9.0)下测定重组羰基还原酶CR2的相对酶活(图1),所用缓冲液为0.1mol/L磷酸盐缓冲液(PBS)(pH6.0-8.0)、0.1mol/LTris-HCl缓冲液(pH7.0-8.5)和0.1mol/L三乙醇胺缓冲液(TEA)(pH7.5-9.0)。研究结果表明,pH值在小于7.0的范围内对CR2的酶活影响较大;在pH7.5-9.0之间,CR2的相对酶活在50%以上;在pH8.4(0.1mol/LTEA)时,CR2催化DKTP的活性最高。实施例3:重组羰基还原酶CR2的最适温度:酶活测定体系:100μL体系,0.1mol/LTris-HCl缓冲液(pH7.5),0.5mmol/LNAD(P)H,5mmol/L底物,不同温度下恒温3min,最后加入20U/L纯酶液混合均匀后,开始扫描340nm处的吸光值变化。在不同温度梯度(20-80℃)下测定重组羰基还原酶CR2的相对酶活(图2)。研究发现,在25-40℃范围内,CR2的相对活性较高,保持在80%以上;在20-35℃范围内,随着温度的升高,CR2的活性不断上升,并在35℃时活性达到最大值;当温度大于40℃时CR2的活性开始下降,当温度高于55℃时完全失活。实施例4:重组羰基还原酶CR2的酸碱耐受性将重组羰基还原酶CR2于4℃分别置于不同pH梯度(6.0-9.0)处理12h,测定其酸碱耐受性(图3)。酶活测定体系:100μL体系中含0.1mol/LTris-HCl缓冲液(pH7.5),0.5mmol/LNAD(P)H,5mmol/L底物,30℃恒温3min,最后加入20U/L纯酶液混合均匀后,开始扫描340nm处的吸光值变化。结果显示,在pH6.0-9.0范围内,处理12h的CR2均保持75%以上的活性,并且在pH7.5-8.5范围内,CR2的活性可以保持在90%以上。实施例5:重组羰基还原酶CR2的温度耐受性将重组羰基还原酶CR2的纯酶分别置于不同温度(15-70℃)处理12h,测定其温度稳定性(图4)。酶活测定体系:100μL体系中含0.1mol/LTris-HCl缓冲液(pH7.5),0.5mmol/LNAD(P)H,5mmol/L底物,30℃恒温3min,最后加入20U/L纯酶液混合均匀后,开始扫描340nm处的吸光值变化。结果显示,在温度低于45℃时,处理12h的CR2还可以保持80%以上的活性;当温度继续升高时,酶的活性下降,甚至完全失活。实施例6:金属离子对重组羰基还原酶CR2活性的影响酶活测定体系:100μL体系中含0.1mol/LTris-HCl缓冲液(pH7.5),0.5mmol/LNAD(P)H,5mmol/L底物,30℃恒温3min,最后加入20U/L纯酶液混合均匀后,开始扫描340nm处的吸光值变化。如表1所示,首先考察金属离子螯合剂EDTA(Na)2对重组CR2活性的影响,在反应体系中添加终浓度为1mmol/L的金属离子螯合剂EDTA(Na)2,其对CR2的活性有抑制作用,即CR2需要某种金属离子激活;然后分别添加终浓度为1mmol/L的不同金属离子(CaCl2、CuSO4、FeSO4、FeCl3、MgSO4、MnCl2、NiSO4和ZnSO4),考察了其对重组CR2活性的影响。其中,Zn2+对CR2酶活具有激活作用,可使CR2活性得到恢复,而其他金属离子对CR2的活性具有一定影响。研究结果说明,CR2是金属离子依赖型的立体选择性羰基还原酶,Zn2+对CR2活性具有促进作用。表1不同金属离子对CR2活性的影响化合物CR2相对酶活Noaddition100EDTA(Na)280CaCl223CuSO465FeSO484FeCl335MgSO436MnCl270NiSO463ZnSO4108实施例7:重组羰基还原酶CR2催化DKTP的不对称还原反应体系为:2mL0.1mol/LTEA缓冲液(pH8.4)中含有1g/LDKTP、4.55mmol/L辅酶NAD(P)H和20U/L酶液、1mmol/LZn2+,于35℃、200r/min反应8h。反应结束后,加入2倍体积乙酸乙酯萃取,有机相用于高效液相色谱HPLC检测反应产物(S)-DHTP的产率和光学纯度,结果如图5所示。在CR2催化DKTP不对称还原的反应过程中,仅能检测到(S)-DHTP单一对映体产物,产物在反应0-4h内快速生成和积累,反应4h产物产率即可达到80%,在反应4-6h内产率增长速率逐渐减缓,并于反应6h时产率达到最大值92.1%,后续时间内产率保持稳定。实施例8:羰基还原酶CR2催化DKTP合成(S)-DHTP反应体系为:2mL0.1mol/LPBS缓冲液(pH7.5)中含有1g/LDKTP、4.55mmol/L辅酶NAD(P)H和20U/L酶液、1mmol/LZn2+,于30℃、200r/min反应8h。反应结束后,加入2倍体积乙酸乙酯萃取,有机相用于高效液相色谱HPLC检测反应产物(S)-DHTP的产率和光学纯度。在CR2催化DKTP不对称还原的反应过程中,仅能检测到(S)-DHTP单一对映体产物,产物光学纯度>99%、产率为62%。实施例9:羰基还原酶CR2催化DKTP合成(S)-DHTP反应体系为:2mL0.1mol/LTEA缓冲液(pH9.0)中含有1g/LDKTP、4.55mmol/L辅酶NAD(P)H和20U/L酶液、1mmol/LZn2+,于40℃、200r/min反应8h。反应结束后,加入2倍体积乙酸乙酯萃取,有机相用于高效液相色谱HPLC检测反应产物(S)-DHTP的产率和光学纯度。在CR2催化DKTP不对称还原的反应过程中,仅能检测到(S)-DHTP单一对映体产物,产物光学纯度>99%、产率为67%。对照例:重组氧化还原酶催化还原DKTP的活性和选择性分析分别测定12种不同的重组氧化还原酶催化还原DKTP的活性及其相应产物DHTP的立体构型,结果如表2所示。其中,CR2、KRD催化不对称还原DKTP的产物构象为(S)-型,CR4、OYE不对称还原DKTP的产物结构为(R)-型。在催化(S)-专一性不对称还原DKTP的氧化还原酶中,CR2的比活和选择性均明显高于KRD,且产物为光学纯的(S)-型单一对映体(图6)。由于度洛西汀的两种对映异构体中只有(S)-型具有药理活性,因此CR2在不对称合成度洛西汀医药中间体的催化转化方面具有较为明显的应用潜力,本发明以CR2作为目标氧化还原酶进行催化性质的研究。表2重组氧化还原酶不对称还原DKTP虽然本发明已以较佳实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可做各种的改动与修饰,因此本发明的保护范围应该以权利要求书所界定的为准。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1