多取代1,4-氧氮杂环庚烷类化合物及合成方法与流程
本发明属于有机合成技术领域,具体涉及一种多取代1,4-氧氮杂环庚烷类化合物及其合成方法。
背景技术:
多取代1,4-氧氮杂环庚烷骨架广泛存在于天然产物和生物活性分子中,同时含有这种结构单元的合成药物广泛应用于临床治疗中,如抗真菌、抗癌、抗炎和抗结核药。因此,对于多取代1,4-氧氮杂环庚烷类化合物的合成方法一直是人们的关注所在。吡啶叶立德1,5-偶极体与不饱和化合物[5+2]环加成反应是一种高效构建1,4-氧氮杂环庚烷的方法。目前吡啶叶立德1,5-偶极体目前主要由吡啶与1-磺酰基-1,2,3-三氮唑在过渡金属催化下生成(韩国yooeunjeong教授团队致力于此,参考:jam.chem.soc.2014,136,11606),然而此方法存在着多步反应、底物类型局限等方面的问题。有鉴于此,确有必要开发一种多取代1,4-氧氮杂环庚烷类化合物及其合成方法。
技术实现要素:
本发明的目的在于克服现有制备技术的缺陷,提供一种操作简单,选择性好,官能团适用范围广,选择性好,收率高的多取代1,4-氧氮杂环庚烷类化合物的合成方法。
本发明为达到上述目的所采用的技术方案是:
一种多取代1,4-氧氮杂环庚烷类化合物,其化学结构通式如下:
其中:(1)r可为卤素、脂肪基(甲基、乙基、异丙基等)、烷氧基、巯(甲)基、硝基、乙酰基、腈基、三氟甲基;
(2)r1可为羧酸酯基(甲酯、乙酯等);
(3)ar,ar1可为单取代苯环,取代基可为苯环的邻、间、对各个位置独立取代的卤素、脂肪基(甲基、乙基、异丙基、正丁基、叔丁基等)、烷氧基、巯(甲)基、硝基、乙酰基、腈基、三氟甲基;
(4)ar,ar1可为多取代苯环,取代基可为(1)所述取代基在苯环的邻、间、对位置双取代或三取代;
(5)ar,ar1可为杂环取代基,取代基可为噻吩、吲哚、呋喃、苯并呋喃、吡啶、喹啉等杂环分子。
本发明的前述多取代1,4-氧氮杂环庚烷类化合物的合成方法,包括以下步骤:将重氮和炔烃溶于溶剂形成混合溶液,将该混合溶液缓慢滴加入含有喹啉、溶剂和催化剂的混合溶液中,不断搅拌,反应温度为从25-100℃,反应时间2-48小时,优选反应温度为室温,反应时间为8小时。除去溶剂后粗产品利用硅胶柱层析分离,得到多取代吲嗪类化合物,该合成方法的过程用化学反应通式表示如下:
优选地,所述的催化剂为特戊酸铑(ii)或双[(α,α,α′,α′-四甲基-1,3-苯二丙酸)铑(ii)]的任一种。优选特戊酸铑(ii)。
优选地,所述的溶剂为苯、甲苯、二甲苯、三甲苯、四氢呋喃、二氯甲烷、1,2-二氯乙烷、三氯甲烷、四氯化碳、乙酸乙酯中的任一种。优选二氯甲烷。
优选地,所述反应为多组分一锅法反应。
优选地,包括各原料物质的摩尔比为:喹啉/重氮的摩尔比为1~5/1、炔烃/重氮的摩尔比为1~5/1、重氮/催化剂的摩尔比为1/0.01~0.1。优选喹啉/炔烃/重氮/催化剂的摩尔比为1/1.2/1.5/0.02。
优选地,该合成方法所得多取代吲嗪类化合物为白色固体。
优选地,该合成方法所得多取代吲嗪类化合物的产率为89%以上。
与现有技术相比,本发明的技术方案具有如下有益效果:
本发明将重氮和炔烃的混合溶液缓慢加入喹啉和催化剂的混合溶液中,室温条件下一锅法得到多取代1,4-氧氮杂环庚烷类化合物。该合成方法原料廉价易得,操作方便,产率高,除了终产物外,一系列转化过程中的中间体均无需分离和纯化,能减少资金和劳动力的投入,为多取代1,4-氧氮杂环庚烷类化合物提供了一种简洁高效地制备方法。本发明有良好的实用价值,对多取代1,4-氧氮杂环庚烷类产品及下游产品的工艺开发具有重要经济价值。
附图说明
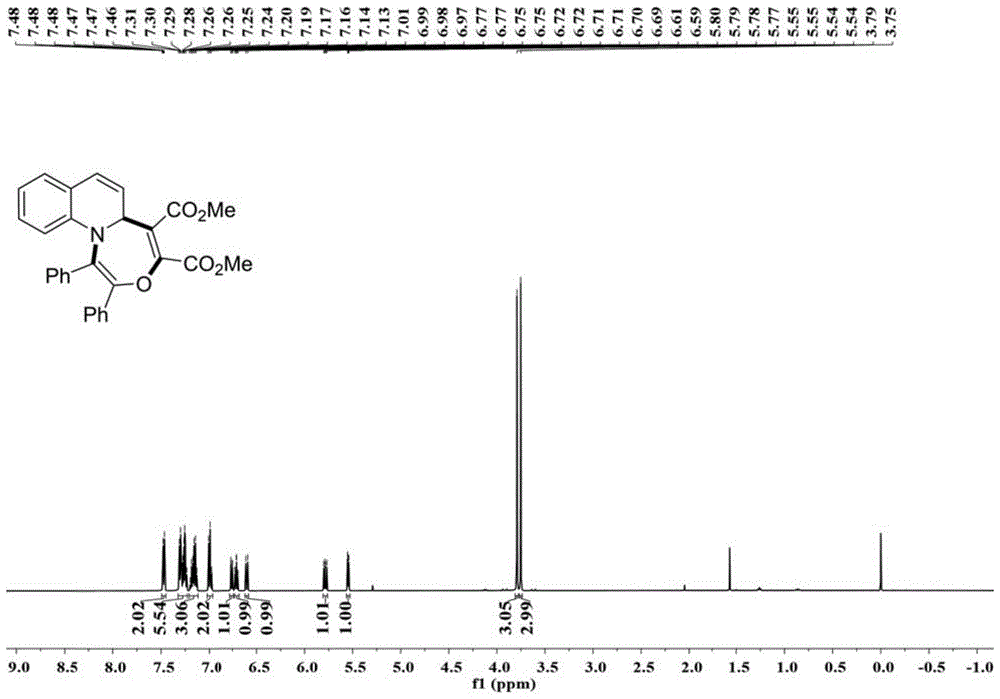
图1本发明实施例1提供的1hnmr谱图;
图2本发明实施例1提供的13cnmr谱图;
图3本发明实施例2提供的1hnmr谱图;
图4本发明实施例2提供的13cnmr谱图;
图5本发明实施例3提供的1hnmr谱图;
图6本发明实施例3提供的13cnmr谱图;
图7本发明实施例4提供的1hnmr谱图;
图8本发明实施例4提供的13cnmr谱图;
图9本发明实施例5提供的1hnmr谱图;
图10本发明实施例5提供的13cnmr谱图;
图11本发明实施例6提供的1hnmr谱图;
图12本发明实施例6提供的13cnmr谱图。
具体实施方式
以下结合附图通过具体实施例对本发明做进一步的详细说明,应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明,凡基于本发明上述内容实现的技术均属于本发明的保护范围。
实施例1
反应式2:
在50ml反应瓶中,重氮(333.4mg,1.5mmol)和炔烃(170.5mg,1.2mmol)溶于二氯甲烷(5.0ml)中,将上述溶液缓慢滴加入喹啉(129.2mg,1.0mmol)和特戊酸铑(12.2mg,0.02mmol)的二氯甲烷(5.0ml)溶液中,反应体系室温搅拌8小时,除去溶剂后粗产品利用硅胶柱层析分离得到黄色固体(414mg,产率:89%)
产品检测数据如下:1hnmr(500mhz,cdcl3):δ7.50-7.44(m,2h),7.33-7.22(m,5h),7.21-7.11(m,3h),7.02-6.96(m,2h),6.78-6.74(m,1h),6.71(td,j=7.4,1.1hz,1h),6.60(d,j=9.8hz,1h),5.78(dd,j=9.8,5.8hz,1h),5.55(dd,j=5.8,0.9hz,1h),3.79(s,3h),3.75(s,3h);13cnmr(125mhz,cdcl3):δ166.4,163.1,153.8,145.0,141.5,134.7,133.9,130.7,129.6,129.5,129.4,129.3,128.4,128.3,128.2,128.1,127.4,127.0,121.5,119.8,119.2,113.4,56.2,52.9,52.4.
实施例2
反应式3:
在50ml反应瓶中,重氮(360.4mg,1.5mmol)和炔烃(170.5mg,1.2mmol)溶于二氯甲烷(5.0ml)中,将上述溶液缓慢滴加入喹啉(129.2mg,1.0mmol)和特戊酸铑(12.2mg,0.02mmol)的二氯甲烷(5.0ml)溶液中,反应体系室温搅拌8小时,除去溶剂后粗产品利用硅胶柱层析分离得到黄色固体(410mg,产率:85%)
产品检测数据如下:1hnmr(500mhz,cdcl3):δ7.48-7.43(m,2h),7.33-7.22(m,5h),7.02-6.97(m,2h),6.87-6.80(m,2h),6.75-6.69(m,2h),6.61(d,j=9.7hz,1h),5.80(dd,j=9.7,5.8hz,1h),5.54(d,j=5.8hz,1h),3.79(s,3h),3.75(s,3h);13cnmr(125mhz,cdcl3):δ166.5,163.7,163.1,161.7,153.4,145.0,141.3,133.9,131.4,131.3,130.82,130.79,129.8,129.7,129.6,129.5,128.4,128.3,127.6,127.3,121.8,120.0,119.5,115.7,115.5,113.7,56.3,53.0,52.6.
实施例3
反应式4:
在50ml反应瓶中,重氮(385.0mg,1.5mmol)和炔烃(170.5mg,1.2mmol)溶于二氯甲烷(5.0ml)中,将上述溶液缓慢滴加入喹啉(129.2mg,1.0mmol)和特戊酸铑(12.2mg,0.02mmol)的二氯甲烷(5.0ml)溶液中,反应体系室温搅拌8小时,除去溶剂后粗产品利用硅胶柱层析分离得到黄色固体(315mg,产率:63%)
产品检测数据如下:1hnmr(500mhz,cdcl3):δ7.49-7.44(m,2h),7.35-7.24(m,4h),7.17-7.13(m,2h),7.08-6.98(m,3h),6.77-6.70(m,2h),6.62(d,j=9.7hz,1h),5.81(dd,j=9.7,5.8hz,1h),5.51(dd,j=5.8,1.0hz,1h),3.79(s,3h),3.75(s,3h);13cnmr(125mhz,cdcl3):δ166.4,163.0,154.6,144.9,141.3,137.1,134.4,133.6,129.8,129.7,129.63,129.60,129.4,129.1,128.6,128.5,128.4,128.0,127.7,127.5,121.9,120.0,119.7,113.5,56.3,53.0,52.6.
实施例4
反应式5:
在50ml反应瓶中,重氮(354.4mg,1.5mmol)和炔烃(170.5mg,1.2mmol)溶于二氯甲烷(5.0ml)中,将上述溶液缓慢滴加入喹啉(129.2mg,1.0mmol)和特戊酸铑(12.2mg,0.02mmol)的二氯甲烷(5.0ml)溶液中,反应体系室温搅拌8小时,除去溶剂后粗产品利用硅胶柱层析分离得到黄色固体(435mg,产率:91%)
产品检测数据如下:1hnmr(500mhz,cdcl3):δ7.39-7.34(m,2h),7.34-7.29(m,2h),7.21-7.12(m,3h),7.06(d,j=8.0hz,2h),7.02-6.97(m,2h),6.77(d,j=8.5hz,1h),6.70(td,j=7.4,1.1hz,1h),6.59(d,j=9.8hz,1h),5.77(dd,j=9.7,5.7hz,1h),5.51(dd,j=5.7,1.1hz,1h),3.79(s,3h),3.76(s,3h),2.33(s,3h);13cnmr(125mhz,cdcl3):δ166.6,163.3,154.6,145.3,141.2,139.6,134.9,131.0,130.2,129.7,129.6,129.4,129.1,128.5,128.4,128.3,127.6,126.8,121.5,120.0,119.2,113.2,56.3,53.0,52.5,21.6.
实施例5
反应式6:
在50ml反应瓶中,重氮(360.4mg,1.5mmol)和炔烃(170.5mg,1.2mmol)溶于二氯甲烷(5.0ml)中,将上述溶液缓慢滴加入喹啉(129.2mg,1.0mmol)和特戊酸铑(12.2mg,0.02mmol)的二氯甲烷(5.0ml)溶液中,反应体系室温搅拌8小时,除去溶剂后粗产品利用硅胶柱层析分离得到黄色固体(395mg,产率:82%)
产品检测数据如下:1hnmr(500mhz,cdcl3):δ7.49-7.43(m,2h),7.31-7.27(m,2h),7.21-7.14(m,3h),7.02-6.91(m,4h),6.74-6.69(m,2h),6.60(d,j=9.7hz,1h),5.79(dd,j=9.7,5.8hz,1h),5.55(d,j=5.8hz,1h),3.80(s,3h),3.75(s,3h);13cnmr(125mhz,cdcl3):δ166.5,164.1,163.1,162.1,152.7,144.9,141.5,134.7,131.74,131.68,130.6,130.21,130.18,129.6,129.5,128.7,128.6,128.3,127.61,127.58,121.7,120.0,119.4,115.5,115.4,113.6,56.4,53.1,52.6.
实施例6
反应式7:
在50ml反应瓶中,重氮(333.4mg,1.5mmol)和炔烃(170.5mg,1.2mmol)溶于二氯甲烷(5.0ml)中,将上述溶液缓慢滴加入喹啉(163.6mg,1.0mmol)和特戊酸铑(12.2mg,0.02mmol)的二氯甲烷(5.0ml)溶液中,反应体系室温搅拌8小时,除去溶剂后粗产品利用硅胶柱层析分离得到黄色固体(415mg,产率:83%)
产品检测数据如下:1hnmr(500mhz,cdcl3):δ7.48-7.44(m,2h),7.32-7.23(m,5h),7.21-7.13(m,3h),6.98(d,j=2.3hz,1h),6.92(dd,j=8.6,2.4hz,1h),6.66(d,j=8.7hz,1h),6.54(d,j=9.8hz,1h),5.86(dd,j=9.7,5.8hz,1h),5.55(d,j=5.8hz,1h),3.81(s,3h),3.75(s,3h);13cnmr(125mhz,cdcl3):δ166.3,163.0,153.7,145.3,140.1,134.4,133.8,130.4,129.7,129.5,129.4,129.1,128.8,128.5,128.4,127.3,127.0,126.7,124.1,123.1,121.6,114.9,56.3,53.1,52.6.
以上所述,仅是本发明的代表性实例,并非对本发明做任何形式上的限制,根据上述说明书的揭示和教导,本发明所属领域的技术人员还可以对上述实施方式进行变更和修改。因此,本发明并不局限于上面揭示和描述的具体实施方式,凡未脱离本发明技术方案的内容,依据本发明的技术实质对以上实施例的任何简单修改、等同变化与修饰,均仍属于本发明技术方案的保护范围内。
- 还没有人留言评论。精彩留言会获得点赞!