含苯并硒二唑和二吲哚并咔唑的有机太阳能电池给体材料及其应用的制作方法
本发明涉及有机太阳能电池材料技术领域,尤其涉及一种含苯并硒二唑和二吲哚并咔唑的有机太阳能电池给体材料及其应用。
背景技术:
1959,kallman等人(journalofchemicalphysics,1959,30,585)首次在有机材料单晶蒽两端加两个电极制备有机太阳能电池器件,这是首次将有机材料作为太阳能吸收转换材料,然而因为其极低的转换效率,在很长一段时间里并没有引起人们的关注。在1986年,tang等人(appliedphysicsletters,1986,48,183)首次报道了双层d-a结构的有机太阳能电池器件,器件转换效率接近1%。1995年,heeger等人(science,1995,270,1789)在有机太阳能电池器件领域取得了突破性进展,并提出了本体异质结(bulkheterojunction,bhj)太阳能电池这个概念:在电子受体和电子给体两个活性层中分别使用富勒烯跟聚合物的混合物、富勒烯跟聚合物的混合物使得电池效率提高到2.9%。这种本体异质结太阳能电池活性层因为给受体之间形成了互穿网络结构,增加了给受体的接触面积,因此能够很好的促进电荷的产生和传输(nature,1995,376,498)。
有机太阳能电池异质结活性层给体材料可分为小分子给体材料和聚合物给体材料。近几年来,基于d-a结构的有机聚合物给体材料发展迅速,人们对其带隙、能级、载流子迁移率和分子平面性等进行了系统的研究(chemicalreviews,2007,38,1324;chemicalsocietyreviews,2015,44,1113)。以聚合物为给体的有机太阳能电池效率取得重大突破,目前最高转换效率已达到15.6%(sciencechinachemistry,2019,62,746)。但是由于聚合物本身聚合度难以控制,不仅不利于对其结构进行分析,同时聚合度不同也会对器件的性能造成影响,从而导致聚合物器件批次存在差异。
相比于聚合物给体材料,小分子给体材料更容易进行纯化,不存在批次的差异,它们通常具有单分散结构,因此更容易进行能级调控。小分子给体材料也不仅仅只是更容易对其结构性质和器件性能之间的关系进行分析,它也通常具有高的开路电压和载流子迁移率,能够实现很高的能量转换效率(chemicalsocietyreviews,2012,41,4245)。因此,溶液可加工的小分子太阳能电池逐渐引起了人们关注,并且在提高有机太阳能电池效率上有着巨大的潜力(advancedmaterials2011,23,1554;advancedmaterials2012,24,1956)。引入聚合物给体材料的结构设计思路,通常将小分子给体材料的主链设计为d-a-d或者a-d-a或者不对称的d-a结构,在d-a单元间以噻吩或炔基等作为π桥连接,形成共轭结构。
2015年,田文晶等人(journalofmaterialsscience,2015,50,937)报道了一类以2,4-二甲基-4-吡楠酮的衍生物(pd)作为中心受体单元,以三苯胺(tpa),咔唑(cz),酚噻嗪(ph)作为电子给体单元合成小分子给体材料phpd,tpapd,czpd。由于三个给体单元强的给电子能力和受体单元强的吸电子能力,因此在给受体间会有强的分子内电荷转移,而且给体材料也会有较宽的吸收谱带。在三个小分子材料中,czpd器件有着最高的能量转换效率为2.0%。李永舫课题组(advancedmaterials,2016,27,7469)报道了以苯并[1,2-b:4,5-b']双噻吩(bdt)为电子给体单元的小分子给体材料bdd-t-s-tr。通过在给体单元侧链上引入烷基化的共轭噻吩基团,不仅增加了小分子给体材料的溶解性,结晶性,空穴迁移率,而且降低了homo能级的能量。在活性层厚度为130nm,器件的最优能量转化效率为9.20%,开路电压为0.97v,填充因子为70.5%,短路电流为13.45ma/cm2。以bdd-t-s-tr作为给体材料的薄膜器件对厚度不敏感,在活性层厚度达到300nm时,器件能量转化效率仍能达到7.58%,这表明这种小分子给体材料在大面积制备上有着巨大的应用潜力。
技术实现要素:
为解决上述技术问题,本发明第一方面提供了一种含苯并硒二唑和二吲哚并咔唑的有机太阳能电池给体材料,所述有机太阳能电池给体材料为tat-th-bse,结构式为:
其中,所述有机太阳能电池给体材料以2,1,3-苯并硒二唑为电子受体单元,以5,10,15-三丁基-二吲哚并[3,2-a:3',2'-c]咔唑为电子给体单元,以3-十二烷基噻吩作为π桥连接,形成d-π-a-π-d结构;
所述2,1,3-苯并硒二唑的结构式为:
所述5,10,15-三丁基-二吲哚并[3,2-a:3',2'-c]咔唑的结构式为:
所述3-十二烷基噻吩的结构式为:
其中,所述有机太阳能电池给体材料的制备方法为:将3-(4,4,5,5-四甲基-1,2,3-二氧硼烷-2-基)-5,10,15-三丁基-二吲哚并[3,2-a:3',2'-c]咔唑与4,7-(5-溴-3-十二烷基噻吩-2-基)-2,1,3-苯并硒二唑、无水乙醇、碳酸钾水溶液、甲苯混合、惰性气体保护下加入四(三苯基膦)钯、升温回流,结束后冷却后经水洗、二氯甲烷萃取、干燥、柱层析提纯、用二氯甲烷与石油醚的混合液作为洗脱剂分离得到红黑色固体,即有机太阳能电池给体材料;
所述3-(4,4,5,5-四甲基-1,2,3-二氧硼烷-2-基)-5,10,15-三丁基-二吲哚并[3,2-a:3',2'-c]咔唑的结构式为:
所述4,7-(5-溴-3-十二烷基噻吩-2-基)-2,1,3-苯并硒二唑的结构式为:
其中,所述3-(4,4,5,5-四甲基-1,2,3-二氧硼烷-2-基)-5,10,15-三丁基-二吲哚并[3,2-a:3',2'-c]咔唑与所述4,7-(5-溴-3-十二烷基噻吩-2-基)-2,1,3-苯并硒二唑的摩尔比为2-5:1。
优选地,所述3-(4,4,5,5-四甲基-1,2,3-二氧硼烷-2-基)-5,10,15-三丁基-二吲哚并[3,2-a:3',2'-c]咔唑与所述4,7-(5-溴-3-十二烷基噻吩-2-基)-2,1,3-苯并硒二唑的摩尔比为3:1,4:1。
其中,所述回流的温度为90-110℃,时间为20-28h。
优选地,
所述回流的温度为95℃,100℃,105℃;
所述回流的时间为21h,22h,23h,24h,25h,26h,27h。
其中,所述洗脱剂中,二氯甲烷与石油醚的体积比为1:1-5。
其中,所述3-(4,4,5,5-四甲基-1,2,3-二氧硼烷-2-基)-5,10,15-三丁基-二吲哚并[3,2-a:3',2'-c]咔唑通过以下步骤制备得到:
(1)10,15-二氢-5h-二吲哚并[3,2-a:3',2'-c]咔唑的合成
将2-吲哚酮溶解于三氯氧磷中并加热反应后,冷却至室温,将反应液缓慢倒入冰水中,再用饱和氢氧化钾水溶液调节ph至中性,此时溶液中析出大量墨绿色固体,抽滤,滤饼用大量水洗涤,再用四氢呋喃将滤饼溶解,接着用无水硫酸镁干燥,用干法上样,通过柱层析进行纯化,用石油醚与二氯甲烷的混合液作为洗脱剂分离得到灰白色粗产品,再用四氢呋喃和石油醚重结晶得到灰白色粉末状固体,即10,15-二氢-5h-二吲哚并[3,2-a:3',2'-c]咔唑,结构式为:
(2)5,10,15-三丁基-二吲哚并[3,2-a:3',2'-c]咔唑的合成
将步骤(1)制备得到的10,15-二氢-5h-二吲哚并[3,2-a:3',2'-c]咔唑与四丁基溴化铵、氢氧化钾混合、并加入四氢呋喃溶解,升温回流,当溶液呈墨绿色,缓慢向瓶中加入溴代正丁烷,此时溶液呈绿色,随后溶液变为黄色,再回流一段时间后,停止反应,冷却至室温;将反应液倒入水中,用二氯甲烷萃取,合并有机相,有机相用盐酸和饱和nacl水溶液洗涤,加入无水硫酸镁干燥过液,用柱层析进行纯化,用石油醚与二氯甲烷的混合液作为洗脱剂分离得到白色粉末状固体,即5,10,15-三丁基-二吲哚并[3,2-a:3',2'-c]咔唑,结构式为:
(3)3-溴-5,10,15-三丁基-二吲哚并[3,2-a:3',2'-c]咔唑的合成
先将步骤(2)制备得到的5,10,15-三丁基-二吲哚并[3,2-a:3',2'-c]咔唑溶解于二氯甲烷中并冷却,再称取n-溴代琥珀酰亚胺溶于四氢呋喃溶液中,再将其缓慢滴加到溶有5,10,15-三丁基-二吲哚并[3,2-a:3',2'-c]咔唑的二氯甲烷溶液中,此时溶液变为宝蓝色,继续反应一段时间后,移至室温下反应过夜,将反应液倒入水中,用二氯甲烷萃取,合并有机相,有机相用水洗涤,用无水硫酸镁干燥有机相过夜,用柱层析进行纯化,用石油醚作为洗脱剂分离得到白色粉末状固体,即3-溴-5,10,15-三丁基-二吲哚并[3,2-a:3',2'-c]咔唑,结构式为:
(4)3-(4,4,5,5-四甲基-1,2,3-二氧硼烷-2-基)-5,10,15-三丁基-二吲哚并[3,2-a:3',2'-c]咔唑的合成
将步骤(3)制备得到的3-溴-5,10,15-三丁基-二吲哚并[3,2-a:3',2'-c]咔唑与双联频哪醇硼酸酯、醋酸钾、1,4-环氧六环混合,惰性气体保护下加入催化剂[1,1-双(二苯基膦)二茂铁]二氯化钯,升温回流后冷却至室温,抽滤,取滤液用二氯甲烷和水萃取,合并有机相,用水洗涤有机相,用无水硫酸镁干燥有机相过夜,过滤溶液旋干,通过柱层析进行纯化,用二氯甲烷与石油醚的混合液作为洗脱剂分离纯化得到白色固体,即3-(4,4,5,5-四甲基-1,2,3-二氧硼烷-2-基)-5,10,15-三丁基-二吲哚并[3,2-a:3',2'-c]咔唑,结构式为:
其中,所述4,7-(5-溴-3-十二烷基噻吩-2-基)-2,1,3-苯并硒二唑通过以下步骤制备得到:
(1)4,7-二溴-2,1,3-苯并噻二唑的合成
将2,1,3-苯并噻二唑溶解于溴化氢溶液中并加热,再缓慢加入液溴,升温回流,蒸发出来的液溴用饱和氢氧化钠水溶液处理,反应一段时间后,停止反应,冷却至室温,倒入饱和nahso3水溶液中,抽滤,滤饼用大量水洗涤,再用少量乙醇洗涤,干燥过夜,用四氢呋喃重结晶,得到灰褐色针状晶体,即4,7-二溴-2,1,3-苯并噻二唑,结构式为:
(2)3,6-二溴-1,2-苯二胺的合成
将步骤(1)制备得到的4,7-二溴-2,1,3-苯并噻二唑溶解于无水乙醇中,惰性气体保护下冷却,再向溶液中分批加入nabh4,待nabh4加入完毕后,移至室温下反应过夜,倒出反应液后加水将析出的固体溶解完全,通过加压蒸馏除去瓶内大量乙醇,再用二氯甲烷和水萃取,合并有机相再用水洗涤,用无水硫酸镁干燥过夜,过滤,取滤液减压蒸馏得到淡黄色固体,即3,6-二溴-1,2-苯二胺,结构式为:
(3)4,7-二溴-2,1,3-苯并硒二唑的合成
将步骤(2)制备得到的3,6-二溴-1,2-苯二胺溶解于无水乙醇中,升温回流,再将二氧化硒溶于蒸馏水中,加入到溶有3,6-二溴-1,2-苯二胺的无水乙醇中,瓶内迅速出现大量黄色固体,继续升温回流后,停止反应,冷却至室温,抽滤,滤饼用大量水洗涤,再用少量无水乙醇洗涤,所得滤饼真空干燥过夜,再用四氢呋喃重结晶得到亮黄色针状晶体,即4,7-二溴-2,1,3-苯并硒二唑,结构式为:
(4)2-(4,4,5,5-四甲基-1,2,3-二氧硼烷-2-基)-3-十二烷基噻吩的合成
将2-溴-3-十二烷基噻吩与无水四氢呋喃混合,惰性气体保护下冷却,此时瓶内析出部分白色固体,再滴加正丁基锂反应一段时间后,白色固体溶解完全,此时溶液呈黄色,再向其中加入异丙醇频哪醇硼酸酯,滴加完毕后反应过夜,将反应液倒入水中,用二氯甲烷萃取,合并有机相,用饱和nacl水溶液洗涤有机相,用无水硫酸镁干燥有机相过夜,过滤,减压蒸馏,用柱层析纯化,用石油醚作为展开剂分离得到无色油状液体,即2-(4,4,5,5-四甲基-1,2,3-二氧硼烷-2-基)-3-十二烷基噻吩,结构式为:
(5)4,7-(3-十二烷基噻吩-2-基)-2,1,3-二苯并硒二唑的合成
将步骤(4)制备得到的2-(4,4,5,5-四甲基-1,2,3-二氧硼烷-2-基)-3-十二烷基噻吩和步骤(3)制备得到的4,7-二溴-2,1,3-苯并硒二唑混合后加入四氢呋喃溶解,再加入碳酸钾水溶液,惰性气体保护下加入四(三苯基磷)钯升温回流后,停止反应并冷却至室温,将溶液倒入水中,用二氯甲烷萃取,合并有机相,用水洗涤有机相,再用无水硫酸镁干燥过夜,过滤溶液旋干,通过柱层析进行纯化,用二氯甲烷与石油醚的混合液作为洗脱剂分离纯化得到亮黄色快状固体,即4,7-(3-十二烷基噻吩-2-基)-2,1,3-二苯并硒二唑,结构式为:
(6)4,7-(5-溴-3-十二烷基噻吩-2-基)-2,1,3-苯并硒二唑的合成
将步骤(5)制备得到的4,7-(3-十二烷基噻吩-2-基)-2,1,3-二苯并硒二唑溶解于三氯甲烷中并冷却,n-溴代琥珀酰亚胺溶解于n,n-二甲基甲酰胺中,再将溶有n-溴代琥珀酰亚胺的n,n-二甲基甲酰胺溶液缓慢滴加到溶有4,7-(3-十二烷基噻吩-2-基)-2,1,3-二苯并硒二唑的三氯甲烷中,滴加完毕后,再将反应装置移至室温下,用锡箔纸包裹,使整个反应体系处于黑暗中,反应过夜,第二天溶液呈橘红色,将反应液倒入水中,用二氯甲烷萃取,合并有机相,用水洗涤有机相,再用无水硫酸镁干燥过夜,过滤溶液旋干,通过柱层析进行纯化,用石油醚作为洗脱剂分离得到橘红色固体,即4,7-(5-溴-3-十二烷基噻吩-2-基)-2,1,3-苯并硒二唑,结构式为:
本发明第二方面提供了一种含苯并硒二唑和二吲哚并咔唑的有机太阳能电池给体材料的应用,由所述有机太阳能电池给体材料tat-th-bse和受体材料pc71bm做为有机太阳能电池器件的活性层,获得本体异质结有机太阳能电池器件;所述有机太阳能电池给体材料tat-th-bse通过权利要求1-8中任意一种方法制备得到。
其中,所述有机太阳能电池器件的结构为ito/zno/活性层/moo3/al;
所述ito为氧化铟锡导电玻璃衬底层;
所述zno为空穴传输层;
所述活性层为给体材料tat-th-bse与受体材料pc71bm的共混层,其共混质量比为tat-th-bse:pc71bm=1:1.5-3;
所述moo3为电子传输层;
所述al为阴极层。
本发明的有益效果:
本发明提供的有机小分子给体材料tat-th-bse与已公开的有机小分子给体材料相比,具有以下优点:
(1)以4,7-(5-溴-3-十二烷基噻吩-2-基)-2,1,3-苯并硒二唑为电子受体单元,以3-(4,4,5,5-四甲基-1,2,3-二氧硼烷-2-基)-5,10,15-三丁基-二吲哚并[3,2-a:3',2'-c]咔唑为电子给体单元,以噻吩作为π桥连接,形成d-π-a-π-d结构;给受体间会有强的分子内电荷转移,而且会有较宽的吸收谱带;
(2)在二吲哚并[3,2-a:3',2'-c]咔唑和噻吩基团上引入烷基链,可以增加小分子给体材料的溶解性和成膜性,有利于有机小分子太阳能电池器件的制备性能提升。
附图说明
为了更清楚地说明本发明的技术方案,下面将对实施方式中需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施方式,对应本领域的普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
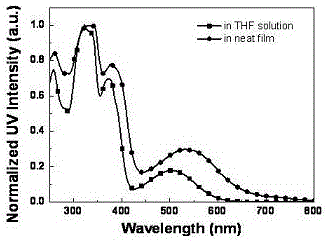
图1为本发明实施例提供的tat-th-bse的紫外-可见吸收光谱图;
图2为本发明实施例提供的tat-th-bse的热分解温度曲线图;
图3为本发明实施例提供的tat-th-bse的热示差扫描量热曲线图;
图4为本发明实施例提供的tat-th-bse有机太阳能电池器件的电流密度与电压曲线图;
图5为本发明实施例提供的tat-th-bse有机太阳能电池器件的外量子效率与波长曲线图。
具体实施方式
以下是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也视为本发明的保护范围。
本发明提供了一种含苯并硒二唑和二吲哚并咔唑的有机太阳能电池给体材料,所述有机太阳能电池给体材料为tat-th-bse,结构式为:
所述有机太阳能电池给体材料以2,1,3-苯并硒二唑为电子受体单元,以5,10,15-三丁基-二吲哚并[3,2-a:3',2'-c]咔唑为电子给体单元,以3-十二烷基噻吩作为π桥连接,形成d-π-a-π-d结构;
所述2,1,3-苯并硒二唑的结构式为:
所述5,10,15-三丁基-二吲哚并[3,2-a:3',2'-c]咔唑的结构式为:
所述3-十二烷基噻吩的结构式为:
本发明提供的含苯并硒二唑和二吲哚并咔唑的有机太阳能电池给体材料通过以下方法制备得到:
第一步:3-(4,4,5,5-四甲基-1,2,3-二氧硼烷-2-基)-5,10,15-三丁基-二吲哚并[3,2-a:3',2'-c]咔唑的合成,包括以下步骤:
(1)10,15-二氢-5h-二吲哚并[3,2-a:3',2'-c]咔唑的合成
将2-吲哚酮(10g,75mmol)加入到100ml圆底烧瓶中,加入三氯氧磷50ml溶解,升温至100℃,反应8h后,停止反应冷却至室温,将反应液缓慢倒入冰水中,再用饱和氢氧化钾水溶液调节ph至中性,此时溶液中析出大量墨绿色固体,抽滤,滤饼用大量水洗涤,再用四氢呋喃将滤饼溶解,再用无水硫酸镁干燥,用干法上样,通过柱层析进行纯化,用石油醚:二氯甲烷=2:1作为洗脱剂分离得到灰白色粗产品,再用四氢呋喃和石油醚重结晶得到灰白色粉末状固体(2.344g,6.78mmol,27.14%),即10,15-二氢-5h-二吲哚并[3,2-a:3',2'-c]咔唑,结构式为:
1hnmr(400mhz,dmso)δ11.85(s,3h),8.67(d,j=7.6hz,3h),7.72(d,j=7.7hz,3h),7.35(dt,j=21.7,6.9hz,6h)。
(2)5,10,15-三丁基-二吲哚并[3,2-a:3',2'-c]咔唑的合成
将10,15-二氢-5h-二吲哚并[3,2-a:3',2'-c]咔唑(1.070g,3.09mmol)加入100ml圆底烧瓶中,加入四丁基溴化铵(0.4g,1.2mmol),加入氢氧化钾(1.0g,17.8mmol),加入四氢呋喃50ml溶解,70℃下回流1h后,溶液呈墨绿色,缓慢向瓶中加入溴代正丁烷,此时溶液呈绿色,随后溶液变为黄色,回流24h后,停止反应,冷却至室温,反应液倒入水中,用二氯甲烷萃取,合并有机相,有机相用wt10%的盐酸和饱和nacl水溶液洗涤,加入无水硫酸镁干燥过液,用柱层析进行纯化,用石油醚:二氯甲烷=10:1作为洗脱剂分离得到白色粉末状固体(828mg,1.603mmol,51.8%),即5,10,15-三丁基-二吲哚并[3,2-a:3',2'-c]咔唑,结构式为:
1hnmr(400mhz,cdcl3)δ8.29(d,j=8.0hz,3h),7.64(d,j=8.1hz,3h),7.44(t,j=7.4hz,3h),7.34(t,j=7.3hz,3h),5.01–4.89(m,6h),2.01–1.89(m,6h),1.28(dq,j=14.8,7.5hz,6h),0.86(t,j=7.4hz,9h)。
(3)3-溴-5,10,15-三丁基-二吲哚并[3,2-a:3',2'-c]咔唑的合成
将5,10,15-三丁基-二吲哚并[3,2-a:3',2'-c]咔唑(828mg,1.603mmol)加入到100ml三口圆底烧瓶中,再加入50ml二氯甲烷溶解,冷却到0℃,再称取n-溴代琥珀酰亚胺(283mg,1.603mmol)溶于5ml四氢呋喃溶液中,再将其缓慢滴加到圆底烧瓶中,此时圆底烧瓶中的溶液变为宝蓝色,继续在0℃下反应1h,移至室温下反应过夜,将反应液倒入水中,用二氯甲烷萃取,合并有机相,有机相用水洗涤,用无水硫酸镁干燥有机相过夜,用柱层析进行纯化,用石油醚作为洗脱剂分离得到白色粉末状固体(788mg,1.33mmol,83%),即3-溴-5,10,15-三丁基-二吲哚并[3,2-a:3',2'-c]咔唑,结构式为:
1hnmr(400mhz,cdcl3)δ8.29(d,j=8.0hz,3h),8.09(s,1h),7.80(d,j=8.1hz,1h),7.64(d,j=8.0hz,2h),7.44(t,j=7.4hz,2h),7.34(td,j=7.4,3.7hz,2h),5.01–4.89(m,6h),2.01–1.89(m,6h),1.28(dq,j=14.8,7.5hz,6h),0.86(t,j=7.4hz,9h)。
(4)3-(4,4,5,5-四甲基-1,2,3-二氧硼烷-2-基)-5,10,15-三丁基-二吲哚并[3,2-a:3',2'-c]咔唑的合成
将3-溴-5,10,15-三丁基-二吲哚并[3,2-a:3',2'-c]咔唑(788mg,1.33mmol)加入到100ml三口圆底烧瓶中,加入双联频哪醇硼酸酯(675mg,2.66mmol)和醋酸钾(2g,20.3mmol)于100ml三口圆底烧瓶中,加入1,4-环氧六环60ml,通氮气,在氮气保护下加入催化剂[1,1-双(二苯基膦)二茂铁]二氯化钯(48.6mg,0.0665mmol),继续通氮气30min后,在氮气保护下升温至110℃回流24h,停止反应冷却至室温,抽滤,取滤液用二氯甲烷和水萃取,合并有机相,用水洗涤有机相,用无水硫酸镁干燥有机相过夜,过滤溶液旋干,通过柱层析进行纯化,用二氯甲烷:石油醚=1:2作为洗脱剂分离纯化得到白色固体(682.4mg,1.06mmol,80.2%),即3-(4,4,5,5-四甲基-1,2,3-二氧硼烷-2-基)-5,10,15-三丁基-二吲哚并[3,2-a:3',2'-c]咔唑,结构式为:
1hnmr(400mhz,cdcl3)δ8.29(d,j=8.0hz,3h),8.09(s,1h),7.80(d,j=8.1hz,1h),7.64(d,j=8.0hz,2h),7.44(t,j=7.4hz,2h),7.34(td,j=7.4,3.7hz,2h),4.93(d,j=8.4hz,6h),2.06–1.85(m,6h),1.38–1.14(m,18h),0.92–0.76(m,9h)。
第二步:4,7-(5-溴-3-十二烷基噻吩-2-基)-2,1,3-苯并硒二唑的合成,包括以下步骤:
(1)4,7-二溴-2,1,3-苯并噻二唑的合成
将2,1,3-苯并噻二唑(13.6g,100mmol)加入100ml三口圆底烧瓶中,再加入60mlhbr(48%wt.h2o)溶解后,升温到100℃,向瓶内缓慢加入液溴(48g,300mmol),升温至130℃回流,蒸发出来的液溴用饱和naoh水溶液处理。反应8h后,停止反应,冷却至室温,倒入饱和nahso3水溶液中,抽滤,滤饼用大量水洗涤,再用少量乙醇洗涤,在60℃下真空干燥过夜,用四氢呋喃重结晶,得到灰褐色针状晶体(12.204g,42.5mmol,42.5%),即4,7-二溴-2,1,3-苯并噻二唑,结构式为:
(2)3,6-二溴-1,2-苯二胺的合成
将4,7-二溴-2,1,3-苯并噻二唑(12.204g,42.5mmol)加入到500ml三口圆底烧瓶中,加入400ml无水乙醇溶解,通氮气,冷却至0℃,向溶液中分批加入nabh4(15.69g,425mmol),nabh4加入完毕后,移至室温下反应过夜,将反应液倒入烧杯中,加入50ml水将瓶内析出的固体溶解完全,通过加压蒸馏除去瓶内大量乙醇,在用二氯甲烷和水萃取,合并有机相再用水洗涤,用无水硫酸镁干燥过夜,过滤,取滤液减压蒸馏得到淡黄色固体(7.583g,28.74mmol,67.6%),即3,6-二溴-1,2-苯二胺,结构式为:
(3)4,7-二溴-2,1,3-苯并硒二唑的合成
将3,6-二溴-1,2-苯二胺(7.583g,28.74mmol)加入到250ml圆底烧瓶中,加入150ml无水乙醇溶解,升温至80℃回流,再将二氧化硒(3.827g,34.5mmol)溶于10ml蒸馏水中,向圆底烧瓶中加入二氧化硒水溶液,瓶内迅速出现大量黄色固体,继续升温回流4h后,停止反应,冷却至室温,抽滤,滤饼用大量水洗涤,再用少量无水乙醇洗涤,所得滤饼在在60℃下真空干燥过夜,再用四氢呋喃重结晶得到亮黄色针状晶体(7.989g,23.53mmol,82%),即4,7-二溴-2,1,3-苯并硒二唑,结构式为:
(4)2-(4,4,5,5-四甲基-1,2,3-二氧硼烷-2-基)-3-十二烷基噻吩的合成
将2-溴-3-十二烷基噻吩(6.61g,20mmol)加入到100ml三口圆底烧瓶中,向圆底三口烧瓶中加入50ml无水四氢呋喃,通氮气,将反应体系放入低温浴装置中冷却到-78℃,此时瓶内析出部分白色固体,在氮气保护下用注射器向其中滴加正丁基锂(10ml,25mmol),-78℃下反应3h后,白色固体溶解完全,此时溶液呈黄色,通过注射器向其中加入异丙醇频哪醇硼酸酯(4.9ml,24mmol),滴加完毕后反应过夜,第二天停止反应,将反应液倒入水中,用二氯甲烷萃取,合并有机相,用饱和nacl水溶液洗涤有机相,用无水硫酸镁干燥有机相过夜,过滤,减压蒸馏,用柱层析纯化,用石油醚作为展开剂分离得到无色油状液体(6.126g,16.2mmol,81%),即2-(4,4,5,5-四甲基-1,2,3-二氧硼烷-2-基)-3-十二烷基噻吩,结构式为:
1hnmr(400mhz,cdcl3)δ7.47(s,1h),7.20(s,1h),2.66–2.57(m,2h),1.60(d,j=7.5hz,2h),1.38–1.20(m,30h),0.88(t,j=6.8hz,3h)。
(5)4,7-(3-十二烷基噻吩-2-基)-2,1,3-二苯并硒二唑的合成
将2-(4,4,5,5-四甲基-1,2,3-二氧硼烷-2-基)-3-十二烷基噻吩(2.633g,6.96mmol)和4,7-二溴-2,1,3-苯并硒二唑(787mg,2.3mmol)加入到250ml三口圆底烧瓶中,加入150ml四氢呋喃溶解,加入20ml2mk2co3水溶液,通氮气,在氮气保护下加入四(三苯基膦)钯(132mg,0.114mmol),继续通氮气30min后,在氮气保护下升温至80℃回流24h后,停止反应,冷却至室温,将溶液倒入水中,用二氯甲烷萃取,合并有机相,用水洗涤有机相,再用无水硫酸镁干燥过夜,过滤溶液旋干,通过柱层析进行纯化,用二氯甲烷:石油醚=1:5作为洗脱剂分离纯化得到亮黄色快状固体(1.277g,1.867mmol,81.1%),即4,7-(3-十二烷基噻吩-2-基)-2,1,3-二苯并硒二唑,结构式为:
1hnmr(400mhz,cdcl3)δ7.87(d,j=1.0hz,2h),7.74(s,2h),7.04(s,2h),2.68(t,j=7.7hz,4h),1.75–1.60(m,4h),1.43–1.21(m,36h),0.88(t,j=6.8hz,6h)。
(6)4,7-(5-溴-3-十二烷基噻吩-2-基)-2,1,3-苯并硒二唑的合成
将4,7-(3-十二烷基噻吩-2-基)-2,1,3-二苯并硒二唑(1.277g,1.867mmol)加入100ml圆底烧瓶中,加入50ml三氯甲烷溶解,冷却到0℃,称取n-溴代琥珀酰亚胺(657mg,3.734mmol),用10mln,n-二甲基甲酰胺溶解,再将n-溴代琥珀酰亚胺溶液缓慢滴加到烧瓶中,滴加完毕后,再将反应装置移至室温下,用锡箔纸包裹,使整个反应体系处于黑暗中,反应过夜,第二天溶液呈橘红色,将反应液倒入水中,用二氯甲烷萃取,合并有机相,用水洗涤有机相,再用无水硫酸镁干燥过夜,过滤溶液旋干,通过柱层析进行纯化,用石油醚作为洗脱剂分离得到橘红色固体(1.194g,1.41mmol,76%),4,7-(5-溴-3-十二烷基噻吩-2-基)-2,1,3-苯并硒二唑,结构式为:
1hnmr(400mhz,cdcl3)δ7.49(d,j=8.3hz,2h),7.04(s,2h),2.66–2.51(m,4h),1.68–1.51(m,4h),1.24(dd,j=24.7,16.4hz,36h),0.87(t,j=6.8hz,6h)。
第三步:有机太阳能电池给体材料tat-th-bse的合成
将3-(4,4,5,5-四甲基-1,2,3-二氧硼烷-2-基)-5,10,15-三丁基-二吲哚并[3,2-a:3',2'-c]咔唑(682.4mg,1.06mmol)和4,7-(5-溴-3-十二烷基噻吩-2-基)-2,1,3-苯并硒二唑(301mg,0.356mmol)加入到100ml三口圆底烧瓶中,加入10ml无水乙醇,加入10ml2mk2co3水溶液,加入50ml甲苯溶解,通氮气,在氮气保护下加入四(三苯基膦)钯(25mg,0.021mmol),继续通氮气30min后,在氮气保护下升温至100℃回流24h后,停止反应,冷却至室温,将溶液倒入水中,用二氯甲烷萃取,合并有机相,用水洗涤有机相,再用无水硫酸镁干燥过夜,过滤溶液取滤液旋干,通过柱层析进行纯化,用二氯甲烷:石油醚=1:3作为洗脱剂分离得到红黑色固体(423mg,0.248mmol,68.5%),即tat-th-bse,结构式为:
1hnmr(400mhz,cdcl3)δ8.30(d,j=7.9hz,4h),7.91(s,2h),7.72–7.59(m,9h),7.40(d,j=40.2hz,10h),5.01(s,12h),2.80–2.70(m,4h),1.98(td,j=15.6,7.8hz,12h),1.83–1.70(m,4h),1.44–1.16(m,48h),0.97–0.78(m,24h).13cnmr(101mhz,cdcl3)δ159.86,145.75,142.97,141.15,141.01,139.65,139.12,138.67,131.83,130.01,125.01,123.50,123.26,122.81,121.74,121.63,119.78,118.22,110.65,110.52,107.82,103.36,46.88,46.79,32.03,31.96,31.90,30.89,29.91,29.73,29.70,29.67,29.55,29.40,22.72,20.08,20.03,14.13,13.89,13.84。
tat-th-bse的紫外可见吸收光谱如图1所示,热分解温度曲线如图2所示,热示差扫描量热曲线如图3所示;从图中可知,tat-th-bse的吸收边带为650nm,分解温度为337℃,玻璃化转变温度为112℃。
利用上述方法制备得到的有机小分子给体材料tat-th-bse与受体材料pc71bm做为有机太阳能电池器件的活性层,获得了本体异质结有机太阳能电池器件,所述器件结构为:ito/zno(40nm)/活性层(90±10nm)/moo3(10nm)/al(100nm)。其中ito即氧化铟锡为导电玻璃衬底层,zno为空穴传输层,活性层是给体材料tat-th-bse与受体材料pc71bm的共混层,其共混质量比为tat-th-bse:pc71bm=1:2,moo3为电子传输层,al为阴极。
将给体材料tat-th-bse与受体材料pc71bm做为有机太阳能电池器件的活性层的有机太阳能电池器件的制备方法为:
在去离子水,丙酮,异丙醇溶液中将ito玻璃超声清洁处理两次,随后装有ito玻璃的异丙醇溶液升温至180℃,将ito玻璃用镊子取出放置于紫外灯下处理30min,随后在ito玻璃上旋涂一层40nm厚的zno作为空穴传输材料,然后在150℃下热处理20min。将配置好的活性层前驱体溶液滴加到zno薄膜上面,在2000rpm旋转30s后形成吸收太阳能的活性层。在活性层上依次真空蒸镀上moo3电子传输层和铝电极。器件的电流-电压(j-v)曲线是在太阳光模拟灯am1.5g(100mwcm-2)下测试获得的。
基于tat-th-bse的有机太阳能电池器件的电流密度与电压曲线如图4所示,外量子效率与波长曲线如图5所示;从图中可知,器件的短路电流为4.12ma/cm2,开路电压为0.86v,光电转换效率为1.45%。
以上实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对本发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都是属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
- 还没有人留言评论。精彩留言会获得点赞!