禽减蛋综合症病毒新型基因工程疫苗、其制备方法与应用与流程
1.本发明涉及一种基因工程疫苗,具体涉及一种禽减蛋综合症病毒新型基因工程疫苗,其制备方法与应用,属于动物免疫药物技术领域。
背景技术:
2.禽减蛋综合症(egg drop syndrome,eds)是一种使产蛋鸡或种母鸡产蛋率下降的病毒性传染病。eds无临床症状,或可见轻微程度腹泻,多发生于产卵高峰期的30~40周龄,会引起被感染鸡群持续3~8周产下蛋壳畸形蛋或产蛋量下降,因此,经济损失巨大。免疫接种是预防本病的主要措施,鸡群在进入产蛋前全部产生抗体,产蛋将不受影响。
3.禽减蛋综合症病毒(egg drop syndrome virus,edsv)属于禽腺病毒ⅲ群,血清型单一,菌株之间几乎不存在抗原性差异,病毒基因组为约33kb的线状双股dna,病毒颗粒由结构蛋白组成,核衣壳直径70~80nm,呈二十面体对称,dna被包于衣壳内。该结构蛋白包括核心蛋白(core protein)、构成衣壳的六邻体(hexon蛋白)、以纤维状突起从衣壳突出的三聚体纤维突出(fiber蛋白)及作为其基部的五邻体(penton蛋白)等。其中,六邻体、纤维及五邻体基座存在中和表位,其中的fiber蛋白与入侵宿主细胞有关。
4.禽减蛋综合症是当前世界范围内严重危害家禽养殖业发展的重要疾病之一。在各种防控措施中,疫苗免疫仍为最重要的措施。目前养禽业中普遍使用的是eds灭活疫苗,但是由于禽减蛋综合症病毒在鸭胚上培养难以获得高滴度的病毒,导致制备的疫苗往往难以提供理想的免疫效果。另外全病毒疫苗生产过程中还存在病毒灭活不完全造成的生物安全方面的风险。
5.亚单位疫苗是近几年发展起来的一种比较切实可行的新型基因工程疫苗,至今未有禽减蛋综合症亚单位疫苗上市。cn108653724a公开了一种用大肠杆菌表达系统表达的禽减蛋综合症病毒fiber蛋白基因工程亚单位疫苗的制备方法,cn106232813a公开了一种以大肠杆菌表达系统表达融合蛋白的亚单位疫苗,但是大肠杆菌表达系统表达出的蛋白折叠性较差、免疫原性差,并且大肠杆菌本身含有内毒素和有毒蛋白,可能混杂在终产物里。因此,临床上急需开发出免疫效果好的亚单位疫苗组合物,以期能够有效防止该病的流行。
技术实现要素:
6.本发明的主要目的在于提供一种禽减蛋综合症病毒新型基因工程疫苗,其制备方法与应用,以克服现有技术中的不足。
7.为实现前述发明目的,本发明采用的技术方案包括:
8.本发明实施例提供了一种抗原蛋白的制备方法,其包括:
9.将重组禽减蛋综合症病毒core蛋白及fiber蛋白的编码基因克隆到穿梭载体上,得到第一重组穿梭载体;
10.将重组禽减蛋综合症病毒penton蛋白及hexon蛋白的编码基因克隆到穿梭载体上,得到第二重组穿梭载体;
11.分别将第一重组穿梭载体、第二重组穿梭载体转化dh10bac菌,获得第一重组杆状病毒载体、第二重组杆状病毒载体;
12.利用所述第一重组杆状病毒载体、第二重组杆状病毒载体分别转染昆虫细胞,获得重组杆状病毒;
13.以所述重组杆状病毒同时接种昆虫细胞,并表达抗原蛋白。
14.其中,重组core蛋白的编码基因包括seq id no:1所示核苷酸序列或者与seq id no:1的核苷酸序列95%以上相同的核酸分子.
15.其中,重组fiber蛋白的编码基因包括seq id no:3所示核苷酸序列或者与seq id no:3的核苷酸序列95%以上相同的核酸分子.
16.其中,重组penton蛋白的编码基因包括seq id no:5所示核苷酸序列或者与seq id no:5的核苷酸序列95%以上相同的核酸分子.
17.其中,重组hexon蛋白的编码基因包括seq id no:7所示核苷酸序列或者与seq id no:7的核苷酸序列95%以上相同的核酸分子。
18.其中,所述重组core蛋白包括seq id no:2所示氨基酸序列或者与seq id no:2的全长氨基酸序列95%以上相同的氨基酸序列.
19.其中,所述重组fiber蛋白包括seq id no:4所示氨基酸序列或者与seq id no:4的全长氨基酸序列95%以上相同的氨基酸序列.
20.其中,所述重组penton蛋白包括seq id no:6所示氨基酸序列或者与seq id no:6的全长氨基酸序列95%以上相同的氨基酸序列.
21.其中,所述重组hexon蛋白包括seq id no:8所示氨基酸序列或者与seq id no:8的全长氨基酸序列95%以上相同的氨基酸序列。
22.其中,至少是所述重组fiber蛋白、penton蛋白与hexon蛋白能够自动组装形成病毒样颗粒。
23.本发明实施例还提供了由前述任一种方法制备的抗原蛋白。
24.本发明实施例还提供了一种蛋白组合物,其包括所述重组禽减蛋综合症病毒core蛋白、fiber蛋白、penton蛋白及hexon蛋白。
25.本发明实施例还提供了一种核酸组合物,其包括所述重组禽减蛋综合症病毒core蛋白、fiber蛋白、penton蛋白及hexon蛋白的编码基因。
26.本发明实施例还提供了一种免疫组合物,其包含:所述的抗原蛋白或者所述的蛋白组合物;以及,药物学上可接受的佐剂。
27.本发明实施例还提供了一种制备前述任一种免疫组合物的方法,其包括:将所述蛋白组合物与药物学上可接受的佐剂混合,从而获得所述的免疫组合物。
28.在本发明的以上实施例中,所述药物学上可接受的佐剂可以包括白油、司本、硬脂酸铝或吐温等,且不限于此。
29.本发明实施例还提供了所述抗原蛋白在制备禽减蛋综合症病毒的检测试剂、用于在受试动物中诱导针对禽减蛋综合症病毒抗原的免疫反应的药剂或者用于预防动物受禽减蛋综合症病毒感染的药剂中的用途。
30.本发明实施例还提供了所述蛋白组合物在制备禽减蛋综合症病毒的检测试剂、用于在受试动物中诱导针对禽减蛋综合症病毒抗原的免疫反应的药剂或者用于预防动物受
禽减蛋综合症病毒感染的药剂中的用途。
31.本发明实施例还提供了所述核酸组合物在制备禽减蛋综合症病毒的检测试剂、用于在受试动物中诱导针对禽减蛋综合症病毒抗原的免疫反应的药剂或者用于预防动物受禽减蛋综合症病毒感染的药剂中的用途。
32.本发明实施例还提供了所述免疫组合物在制备禽减蛋综合症病毒的检测试剂、用于在受试动物中诱导针对禽减蛋综合症病毒抗原的免疫反应的药剂或者用于预防动物受禽减蛋综合症病毒感染的药剂中的用途。
33.本发明实施例还提供了所述抗原蛋白在制备禽减蛋综合症病毒新型基因工程疫苗中的用途。
34.本发明实施例还提供了所述蛋白组合物在制备禽减蛋综合症病毒新型基因工程疫苗中的用途。
35.本发明实施例还提供了所述免疫组合物在制备禽减蛋综合症病毒新型基因工程疫苗中的用途。
36.相应的,本发明实施例提供了一种禽减蛋综合症病毒基因工程亚单位疫苗,其包含前述的任一种免疫组合物。
37.较之现有技术,本发明实施例提供的前述技术方案具有以下突出的优点和效果:通过使用两个杆状病毒载体表达优化后的禽减蛋综合症病毒core蛋白基因(c基因)、fiber蛋白基因(f基因)、hexon蛋白基因(h基因)和penton蛋白基因(p基因),不仅可以实现免疫组合物的大规模生产,质控容易,批次间稳定,生产成本低,而且其中的四种蛋白可以在细胞内自动组装成vlp,使用真核可溶性表达,蛋白折叠正确,活性较高,免疫原性高,更易激发较高的抗体水平,其抗原性、免疫原性和功能与天然蛋白质相似,vlp表达水平较高,能够分泌到上清中,免疫原性强,对禽没有致病性,安全性高,进而使得本发明的疫苗可以使用生物反应器大规模无血清悬浮培养制备,纯化等后处理简单,疫苗生产成本得以大幅降低,利于推广应用。
附图说明
38.为了更清楚地说明本发明实施方式的技术方案,下面将对实施方式中所需要使用的附图作简单地介绍,应当理解,以下附图仅示出了本发明的某些实施例,因此不应被看作是对范围的限定,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他相关的附图。
39.图1为将密码子优化后的edsv-core蛋白基因(c基因)pcr扩增后pcr产物进行凝胶电泳的结果,可以看到0.5kbp附近出现一个条带;其中1为c基因,2为阴性对照,m为分子量标记;
40.图2为c基因转化的菌落样品的pcr扩增后pcr产物进行凝胶电泳的结果,0.5kbp条带附近出现阳性样品。其中1~5均为c基因转化的菌落样品pcr扩增后的产物,6为非阳性样品,m为分子量标记;
41.图3为将密码子优化后的edsv-fiber蛋白基因(f基因)pcr扩增后pcr产物进行凝胶电泳的结果,可以看到2.4kbp附近出现一个条带;其中1为f基因,2为阴性对照,m为分子量标记;
42.图4为含有c基因与f基因的连接产物转化的菌落样品的pcr扩增后pcr产物进行凝胶电泳的结果,2.4kbp条带附近出现阳性样品。其中1~5均为含有c基因与f基因的连接产物转化的菌落样品pcr扩增后的产物,6为非阳性样品,m为分子量标记;
43.图5为构建的含有目的基因的转移载体dual-c-f的示意图;
44.图6为将密码子优化后的edsv-penton蛋白基因(p基因)pcr扩增后pcr产物进行凝胶电泳的结果,可以看到1.4kbp附近出现一个条带;其中1为p基因,2为阴性对照,m为分子量标记;
45.图7为p基因转化的菌落样品的pcr扩增后pcr产物进行凝胶电泳的结果,1.4kbp条带附近出现阳性样品。其中1~5均为p基因转化的菌落样品pcr扩增后的产物,6为非阳性样品,m为分子量标记;
46.图8为将密码子优化后的edsv-hexon蛋白基因(h基因)pcr扩增后pcr产物进行凝胶电泳的结果,可以看到2.7kbp附近出现一个条带;其中1为h基因,2为阴性对照,m为分子量标记;
47.图9为含有p基因与h基因的连接产物转化的菌落样品的pcr扩增后pcr产物进行凝胶电泳的结果,2.7kbp条带附近出现阳性样品。其中1~5均为含有p基因与h基因的连接产物转化的菌落样品pcr扩增后的产物,6为非阳性样品,m为分子量标记;
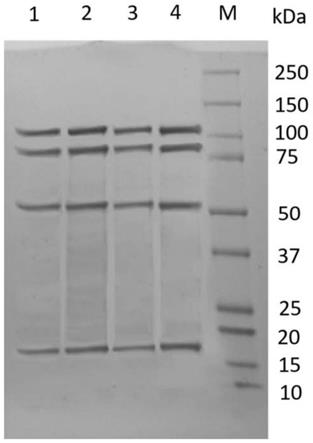
48.图10为构建的含有目的基因的转移载体dual-p-h的示意图;
49.图11为实施例5中收获的细胞培养物上清进行sds-page凝胶电泳的结果,其中在分子量约18kda和85kda附近出现目的条带;其中1为阴性对照,2为实施例4中收获的细胞培养物,m为分子量标记;
50.图12为实施例5中收获的细胞培养物上清进行sds-page凝胶电泳的结果,其中在分子量约51kda和102kda附近出现目的条带;其中1为阴性对照,2为实施例4中收获的细胞培养物,m为分子量标记;
51.图13、14为实施例6中sds-page电泳后的产物western blot检测结果;其中1为阴性对照,2为重组杆状病毒表达样品,m为分子量标记;
52.图15为实施例8中收获的重组杆状病毒edsv-vlp上清进行sds-page凝胶电泳的结果,其中在分子量约18kda、85kda、51kda和102kda附近出现目的条带;其中1为阴性对照,2为实施例7中收获的重组杆状病毒edsv-vlp,m为分子量标记;
53.图16为实施例8中sds-page电泳后的产物western blot检测结果;其中1为阴性对照,2为重组杆状病毒表达样品,m为分子量标记;
54.图17为倒置荧光显微镜观察结果;
55.图18为蛋白纯化后的结果;
56.图19为电镜观察结果;
57.图20为实施例15中未优化的f基因、h基因、c基因和p基因制备重组杆状病毒纯化后结果。
具体实施方式
58.应该指出,以下详细说明都是示例性的,旨在对本发明提供进一步的说明。除非另有指明,本说明书使用的所有技术和科学术语具有与本发明所属技术领域的普通技术人员
通常理解的相同含义。
59.需要注意的是,这里所使用的术语仅是为了描述具体实施方式,而非意图限制根据本发明的示例性实施方式。如在这里所使用的,除非上下文另外明确指出,否则单数形式也意图包括复数形式,此外,还应当理解的是,当在本说明书中使用术语“包含”和/或“包括”时,其指明存在特征、步骤、操作、器件、组件和/或它们的组合。
60.本发明实施例的一个方面提供了一种免疫组合物的制备方法,其包括:
61.将重组禽减蛋综合症病毒core蛋白及fiber蛋白的编码基因克隆到穿梭载体上,得到第一重组穿梭载体;
62.将重组禽减蛋综合症病毒penton蛋白及hexon蛋白的编码基因克隆到穿梭载体上,得到第二重组穿梭载体;
63.分别将第一重组穿梭载体、第二重组穿梭载体转化dh10bac菌,获得第一重组杆状病毒载体、第二重组杆状病毒载体;
64.利用所述第一重组杆状病毒载体、第二重组杆状病毒载体分别转染昆虫细胞,获得重组杆状病毒;
65.以所述重组杆状病毒同时接种昆虫细胞共感染,并表达抗原蛋白。
66.在本发明的前述实施例中,重组core蛋白的编码基因(c基因)包括seq id no:1所示核苷酸序列,重组fiber蛋白的编码基因(f基因)包括seq id no:3所示核苷酸序列,重组penton蛋白的编码基因(p基因)包括seq id no:5所示核苷酸序列,重组hexon蛋白的编码基因(h基因)包括seq id no:7所示核苷酸序列。当然,前述重组core蛋白、重组fiber蛋白、重组penton蛋白、重组hexon蛋白的编码基因序列还可以是seq id no:1、seq id no:3、seq id no:5、seq id no:7所示核苷酸序列的增加或截短的序列,即,其保守性变异序列。例如,这些重组蛋白的编码基因可以是与seq id no:1、seq id no:3、seq id no:5、seq id no:7所示全长核苷酸序列95%以上相同的核酸分子。
67.在一些实施方案中,还可以将获得的抗原蛋白与药物学上可接受的佐剂混合。
68.本发明的前述实施例使用了优化的core蛋白基因(c基因)、fiber蛋白基因(f基因)、hexon蛋白基因(h基因)和penton蛋白基因(p基因)序列,使用悬浮培养sf9细胞进行表达,表达水平较高,蛋白免疫原性好。所获的重组fiber蛋白、hexon蛋白和penton蛋白三种蛋白可以自动组装形成vlp,而重组core蛋白的加入还可以进一步提高vlp组装的效率,同时增加疫苗的免疫效果,四种蛋白共表达使重组疫苗的免疫原性和功能性与天然蛋白更相似。
69.相应的,本发明实施例的另一个方面提供了一种免疫组合物,其包括:重组禽减蛋综合症病毒core蛋白、fiber蛋白、penton蛋白及hexon蛋白。在本发明的前述实施例中,重组core蛋白包括seq id no:2所示氨基酸序列,重组fiber蛋白包括seq id no:4所示氨基酸序列,重组penton蛋白包括seq id no:6所示氨基酸序列,重组hexon蛋白包括seq id no:8所示氨基酸序列。同样的,前述重组core蛋白、重组fiber蛋白、重组penton蛋白、重组hexon蛋白的氨基酸序列还可以是seq id no:2、seq id no:4、seq id no:6、seq id no:8所示氨基酸序列的增加以及截短的序列,即,其保守性变异序列。例如,这些重组蛋白的氨基酸序列可以是与seq id no:2、seq id no:4、seq id no:6、seq id no:8所示全长氨基酸序列95%以上相同的。
70.在一些实施方案中,所述免疫组合物还可包含药物学上可接受的佐剂。
71.本发明前述实施例提供的所述免疫组合物可以应用为禽减蛋综合症病毒基因工程亚单位疫苗。
72.相应的,本发明实施例的另一个方面也涉及一种诱导针对禽减蛋综合症病毒抗原的免疫反应的方法,所述方法包括向受试动物施用所述禽减蛋综合症病毒基因工程亚单位疫苗。
73.相应的,本发明实施例的另一个方面也涉及一种保护受试动物免受禽减蛋综合症病毒感染的方法,所述方法包括向所述受试动物施用所述禽减蛋综合症病毒基因工程亚单位疫苗。
74.本发明实施例的另一个方面提供的适用于诱导针对禽减蛋综合症病毒的免疫反应的疫苗可以为包含上述核酸分子的质粒。核酸分子可被并入病毒颗粒中。疫苗可还包含佐剂分子。佐剂可为il-12、il-15、il-28、ctack、teck、血小板源性生长因子(pdgf)、tnfα、tnfβ、gm-csf、表皮生长因子(egf)、il-1、il-2、il-4、il-5、il-6、il-10、il-18、il-21、il-31、il-33或其组合;并且在一些实施方式中,可为il-12、il-15、il-28或rantes。
75.本发明实施例的另一个方面还提供诱导针对禽减蛋综合症病毒的免疫反应的方法,所述方法包括以下步骤:向个体施用禽减蛋综合症病毒抗原和/或其组合物。
76.本发明实施例的另一个方面还提供保护个体免受禽减蛋综合症病毒感染的方法。所述方法包括以下步骤:向所述个体施用预防有效量的包含此类核酸序列的核酸分子或组合物;其中所述核酸序列在所述个体的细胞中表达,并且针对由所述核酸序列编码的蛋白诱导保护性免疫反应。
77.本发明实施例的另一个方面还提供一种诱导针对禽减蛋综合症病毒抗原的免疫反应的方法,所述方法包括向受试动物施用本发明的核酸分子。
78.本发明实施例的另一个方面还提供一种保护受试动物免受禽减蛋综合症病毒感染的方法,所述方法包括向所述受试动物施用本发明的核酸分子。
79.本发明实施例的另一个方面还提供一种适用于在受试动物中产生针对禽减蛋综合症病毒的免疫反应的疫苗,所述疫苗包含:本发明的核酸分子以及佐剂分子。所述佐剂可为il-12、il-15、il-28、ctack、teck、血小板源性生长因子(pdgf)、tnfα、tnfβ、gm-csf、表皮生长因子(egf)、il-1、il-2、il-4、il-5、il-6、il-10、il-18、il-21、il-31、il-33或其组合;并且在一些实施方式中,可为il-12、il-15、il-28或rantes。这些佐剂可以是通过市场等途径获取的,例如,可以优选采购自苏州世诺生物技术有限公司,以提高疫苗效果。
80.本本发明实施例的另一个方面提供的疫苗还包括一种或多种如上所述的核酸分子和一种或多种由所述核酸分子编码的蛋白
81.本说明书所用的术语仅仅是出于描述具体实施方式的目的而并不旨在限制。如在说明书和所述权利要求中所使用,除上下文另外明确规定之外,单数形式“一个”、“一种”和“所述”包括复数形式。
82.对于本说明书所列举的数值范围,明确涵盖了在有相同精密度之间的每个插入的数字。例如,对于6-9的范围,除了6和9外还涵盖数字7和8,并且对于6.0-7.0的范围,明确涵盖了数字6.0、6.1、6.2、6.3、6.4、6.5、6.6、6.7、6.8、6.9以及7.0。
83.如本说明书所用的“佐剂”意指被添加到本说明书所述的疫苗中来增强由下文所
述编码核酸序列的所编码的抗原的免疫原性的任何分子。
84.如本说明书所用的“抗体”意指类型igg、igm、iga、igd或ige的抗体,或片段、其片段或衍生物,包括fab、f(ab')2、fd以及单链抗体、双链抗体、双特异性抗体、双功能抗体及其衍生物。所述抗体可以是从动物的血清样本中分离出的抗体、多克隆抗体、亲和纯化抗体或其混合物,所述混合物对所需的表位或从其衍生的序列表现足够的结合特异性。
85.如本说明书所用的“编码序列”或“编码核酸”意指包含编码蛋白的核苷酸序列的核酸(rna或dna分子)。所述编码序列可以进一步包括可操作地连接至调控元件的起始信号和终止信号,所述调控元件包括能够在施用核酸的个体或动物的细胞中指导表达的启动子和多聚腺苷酸化信号。
86.如本说明书所用的“互补体”或“互补”意指核酸可以指在核苷酸或核酸分子的核苷酸类似物之间的watson-crick(例如,a-t/u和c-g)或者hoogsteen碱基配对。
87.如本说明书所用的“共有”或“共有序列”意指基于分析特定禽减蛋综合症病毒抗原的一队列的多个亚型的多肽序列。可制备编码共有多肽序列的核酸序列。包含蛋白的疫苗可以被用来诱导针对特定禽减蛋综合症病毒抗原的多种亚型或血清型的广泛免疫,所述疫苗包含编码这些蛋白的共有序列和/或核酸分子。
88.如本说明书所用的术语“遗传构建体”是指包含编码蛋白的核苷酸序列的dna或rna分子。所述编码序列包含可操作地连接至调控元件的起始信号和终止信号,所述调控元件包括能够在施用核酸分子的个体的细胞中指导表达的启动子和多聚腺苷酸化信号。如本说明书所用的术语“表达形式”是指基因构建体,所述基因构建体含有可操作地连接至编码蛋白的编码序列的必须的调控元件,以使得当存在于所述个体的细胞中时,编码序列将表达。
89.如本说明书所用的术语“同源性”是指互补性程度。可存在部分同源性或完全同源性(即,同一性)。至少部分抑制完全互补序列杂交于靶标核酸的部分互补序列是使用功能术语“基本上同源”来提及。当关于如cdna或基因组克隆的双链核酸序列使用时,如本说明书所用的术语“基本上同源”是指探针可在低严格性条件下杂交于双链核酸序列的链。当关于单链核酸序列使用时,如本说明书所用的术语“基本上同源”是指探针可在低严格性条件下杂交于单链核酸模板序列(即,是单链核酸模板序列的互补序列)。
90.在两种或更多种核酸或多肽序列的情况下,如本说明书所用的“相同”或“同一性”意指在指定区域中序列具有相同残基的指定百分比。可以通过以下来计算所述百分比:最佳地比对两个序列、在指定区域比较两个序列、确定在两个序列中相同的残基的位置的数量以产生匹配位置的数量、以匹配位置的数量除以在指定区域内的位置的总数量,并且将结果乘以100以产生序列同一性的百分比。在两个序列具有不同的长度或者比对产生一个或多个交错的末端并且比较的指定区域仅包括单一序列的情况下,单一序列的残基被包括在计算的分母中而不是分子中。当比较dna和rna时,胸腺嘧啶(t)和尿嘧啶(u)可以被认为是等同的。同一性可以手动地或者通过使用计算机序列算法如blast或者blast 2.0来执行。
91.如本说明书所用的“免疫反应”意指响应于抗原如禽减蛋综合症病毒共有抗原的引入,宿主的免疫系统(例如动物的免疫系统)的活化。所述免疫反应可以是细胞反应或体液反应或两者的形式。
92.如本说明书所用的“核酸”或“寡核苷酸”或“多核苷酸”意指共价连接在一起的至少两个核苷酸。单链的描述还定义了互补链的序列。因此,核酸还涵盖了所描述的单链的互补链。核酸的很多变体可以被用于与给定的核酸相同的目的。因此,核酸还涵盖了基本上相同的核酸和其互补体。单链提供可以与靶序列在严格的杂交条件下杂交的探针。因此,核酸还涵盖了在严格杂交条件下杂交的探针。
93.核酸可以是单链的或者双链的或可以含有双链或者单链序列两者的部分。所述核酸可以是dna、基因组和cdna两者、rna或杂合体,其中所述核酸可以含有脱氧核糖核苷酸和核糖核苷酸的组合,以及包括尿嘧啶、腺嘌呤、胸腺嘧啶、胞嘧啶、鸟嘌啉、肌苷、黄嘌呤次黄嘌呤、异胞嘧啶以及异鸟嘌呤的碱基的组合。核酸可以通过化学合成方法或者通过重组方法来获得。
94.基因的表达是在空间上与之连接的启动子的控制下进行的。在其控制下,启动子可以被定位在基因的5'(上游)或者3'(下游)。所述启动子和基因之间的距离可以大约与所述启动子和其在启动子从中衍化的基因中所控制的基因之间的距离相同。如本领域所已知,这个距离的变化可以在没有失去启动子功能的情况下进行调整。“启动子”意指合成的或自然来源的分子,所述分子能够赋予、活化或增强细胞中的核酸的表达。启动子可包含一个或多个特定的转录调控序列以便进一步增强表达和/或改变其空间的表达和/或时间的表达。启动子还可以包含远端增强子或阻遏元件,它们可以位于从转录的起始点开始的差不多几千对碱基对处。启动子可以从包括病毒、细菌、真菌、植物、昆虫以及动物的来源中获得。启动子可以相对于其中发生表达的细胞、组织或器官或相对于发生表达的发育阶段或响应于外部刺激如生理应激、病原体、金属离子或诱导剂而基本地或区别地调控基因组分的表达。启动子的代表性实例包括噬菌体t7启动子、噬菌体t3启动子、sp6启动子、乳糖操纵子-启动子、tac启动子、sv40后期启动子、sv40早期启动子、rsv-ltr启动子、cmv ie启动子、sv40早期启动子或者sv40后期启动子以及cmvie启动子。
[0095]“信号肽”和“前导序列”是指可以被连接在本说明书所述的禽减蛋综合症病毒蛋白的氨基末端的氨基酸序列。信号肽/前导序列通常指示蛋白的位置。本说明书所用的信号肽/前导序列优选地促进蛋白从产生其的细胞中分泌。信号肽/前导序列常常从蛋白的剩余部分裂解,所述蛋白在从细胞分泌后经常被称为成熟蛋白。信号肽/前导序列连接在所述蛋白的n端。
[0096]“严格的杂交条件”意指在所述条件下如在核酸的复杂混合物中第一核酸序列(例如,探针)将与第二核酸序列(例如,靶标)进行杂交。严格的条件是序列依赖性的并且在不同的环境中将是不同的。严格的条件在限定的离子强度ph下可以被选择为比特定序列的热力学熔点(tm)低约5-10℃。所述tm可以是这样的温度(在限定的离子强度、ph以及核酸浓度下),在所述温度下与靶标互补的50%的探针与靶序列在平衡状态下进行杂交(因为靶序列过量存在,在tm下,50%的探针在平衡状态下被占用)。严格条件可以是那些条件,即其中盐浓度小于约1.0m的钠离子,如在ph 7.0至8.3下约0.01-1.0m的钠离子浓度(或其它盐),并且温度对于短的探针(例如,约10-50个核苷酸)为至少约30℃且对于长的探针(例如,大于约50个核苷酸)为至少约60℃。严格的条件还可以通过添加去稳定剂如甲酰胺来实现。对于选择的或特定的杂交,阳性信号可以是背景杂交的至少2至10倍。示例性的严格的杂交条件包括以下:50%甲酰胺、5x ssc以及1%sds、在42℃下孵育,或者5x ssc、1%sds、在65℃下
孵育、在65℃下用0.2x ssc和0.1%sds洗涤。
[0097]
如本说明书所用的“基本上互补”意指第一序列在多个核苷酸或氨基酸的区域内与第二序列的互补体至少60%-99%相同,或者意指两个序列在严格的杂交条件下进行杂交。
[0098]
如本说明书所用的“基本上相同”意指第一序列和第二序列在多个核苷酸或氨基酸区域内是至少60%-99%相同的,或者就核酸而言,如果第一序列与第二序列的互补体基本上互补,则第一序列和第二序列也这样相同。
[0099]“亚型”或“血清型”:如本说明书交换使用的并且关于禽减蛋综合症病毒,意指禽减蛋综合症病毒的基因变体,以使得一个亚型被免疫系统识别而从不同的亚型中分离。
[0100]
本说明书就核酸而言所用的“变体”意指(i)参考核苷酸序列的一部分或片段;(ii)参考核苷酸序列或其部分的互补体;(iii)与参考核酸或其互补体基本上相同的核酸;或者(iv)在严格的条件下与参考核酸、其互补体或与其基本上相同的序列杂交的核酸。
[0101]
就肽或多肽而言的“变体”通过氨基酸的插入、缺失或保守性取代而在氨基酸序列上不同,但是保留至少一种生物活性。变体还意指具有与参考蛋白基本上相同的氨基酸序列的蛋白,所述参考蛋白具有保留至少一种生物活性的氨基酸序列。氨基酸的保守性取代,即以相似特性(例如,亲水性、带电区域的程度和分布)的不同氨基酸来替换氨基酸,在本领域中被认为通常涉及微小变化。如本领域所理解的,这些微小变化可以部分通过考虑氨基酸的亲疏水性指数来识别。凯特(kyte)等,分子生物学杂志(j.mol.biol.)157:105-132(1982)。所述氨基酸的亲疏水性指数是基于其疏水性和电荷的考虑。本领域已知的是相似的亲疏水性指数的氨基酸可以被取代并仍然保留蛋白功能。在一个方面,亲疏水性指数为
±
2的氨基酸被取代。氨基酸的亲水性还可以被用来揭示会产生保留生物功能的蛋白的取代。在肽的情形下考虑氨基酸的亲水性允许计算所述肽最大的局部平均亲水性,这是已经被报道来与抗原性和免疫原性良好关联的有用测量。如本领域所了解的,具有相似亲水性值的氨基酸的取代可以产生保留生物活性(例如免疫原性)的肽。可用具有彼此在
±
2内的亲水性值的氨基酸进行取代。氨基酸的亲疏水性指数和亲水性值两者都受所述氨基酸的特定侧链影响。与所述观察一致的是,与生物功能相容的氨基酸取代被理解为取决于这些氨基酸相对的相似性,并且特别是那些氨基酸的侧链,如通过疏水性、亲水性、电荷、大小以及其它特性所揭示的。
[0102]
如本说明书所用的“载体”意指含有复制起点的核酸序列。载体可以是病毒载体、噬菌体、细菌人工染色体或酵母人工染色体。载体可以是dna或rna载体。载体可以是自我复制的染色体外载体,并优选地是dna载体。
[0103]
本发明的疫苗可被设计来控制受试动物中针对一种或多种禽减蛋综合症病毒血清型的免疫反应的程度或强度。疫苗可包含抑制它整合至染色体中的元件或试剂。疫苗可为编码禽减蛋综合症病毒结构蛋白的rna。可将rna疫苗引入细胞中。本发明的疫苗可包含禽减蛋综合症病毒结构蛋白。禽减蛋综合症病毒结构蛋白是通过诱导1)细胞毒性t淋巴细胞(ctl)反应、2)t辅助细胞反应以及/或3)b细胞反应,或优选所有以上提及的反应,以达成交叉递呈来进行的免疫介导的病毒清除的靶标。
[0104]
所述抗原可以包含使它们特别有效地作为免疫原的蛋白表位,可针对所述免疫原诱导抗禽减蛋综合症病毒免疫反应。禽减蛋综合症病毒抗原可以包括全长翻译产物、其变
体、其片段或其组合。
[0105]
在一些实施方式中,具有与本说明书所公开的蛋白的编码序列同源的本说明书所公开的编码序列的核酸分子包含编码ige前导序列的连接至编码本说明书所公开的同源蛋白序列的编码序列的5’末端的序列。
[0106]
在一些实施方式中,所述核酸序列不含编码前导序列的编码序列。在另一些实施方式中,所述核酸序列不含编码ige前导物的编码序列。
[0107]
在一些实施方式中,片段包含编码前导序列的序列,例如免疫球蛋白前导物,如ige前导物。在另一些实施方式中,片段不含编码前导序列的编码序列,例如像ige前导物的编码序列。
[0108]
在一些实施方式中,蛋白不含前导序列。在一些实施方式中,蛋白不含ige前导物。而在另一些实施方式中,片段包括前导序列,例如像免疫球蛋白前导物,如ige前导物。在一些实施方式中,片段不含前导序列,例如像ige前导物。
[0109]
本说明书中,疫苗可包括编码禽减蛋综合症病毒结构蛋白、禽减蛋综合症病毒抗原以及禽减蛋综合症病毒结构蛋白/抗原的组合的核酸构建体或质粒。本说明书提供可以包含编码本说明书所公开的禽减蛋综合症病毒抗原的核酸序列的遗传构建体,所述核心抗原包括蛋白序列、与蛋白序列同源的序列、蛋白序列的片段以及与蛋白序列的片段同源的序列。另外,本说明书提供可包含编码本说明书公开的禽减蛋综合症病毒表面抗原(包括蛋白序列、与蛋白序列同源的序列、蛋白序列的片段以及与蛋白序列的片段同源的序列)的核酸序列的遗传构建体。所述遗传构建体可以作为功能性染色体外的分子而存在。所述遗传构建体可以是包括着丝粒、端粒或质粒或粘粒的线性微型染色体。
[0110]
所述遗传构建体还可以是重组病毒载体的基因组的一部分,所述重组病毒载体包括重组腺病毒、重组腺病毒伴随病毒以及重组牛痘。遗传构建体可以是在减毒的活微生物或活在细胞中的重组微生物载体中的遗传物质的部分。
[0111]
遗传构建体可以包含用于核酸的编码序列的基因表达的调控元件。调控元件可以是启动子、增强子、起始密码子、终止密码子或多聚腺苷酸化信号。
[0112]
核酸序列可组成可以是载体的遗传构建体。所述载体能够以在动物中有效引发免疫反应的量在动物的细胞中表达抗原。所述载体可以是重组体。所述载体可以包含编码抗原的异源核酸。所述载体可以是质粒。所述载体可以适用于用编码抗原的核酸来转染细胞,所述转化的宿主细胞在其中发生抗原表达的条件下培养并维持。
[0113]
编码序列可以被优化来用于表达的稳定性和高水平。在一些情况下,选择密码子来减少rna二级结构的形成,如由于分子内键而形成的二级结构。
[0114]
所述载体可以包含编码抗原的异源核酸,并且可以进一步包含可以在抗原编码序列的上游的起始密码子和可以在抗原编码序列的下游的终止密码子。起始密码子和终止密码子可以与抗原编码序列在框中。所述载体还包含可操作地连接至抗原编码序列的启动子。可操作地连接至抗原编码序列的启动子可以是来自猿猴病毒40(sv40)的启动子、小鼠乳腺瘤病毒(mmtv)启动子、人免疫缺陷病毒(hiv)启动子如牛免疫缺陷病毒(biv)长末端重复(ltr)启动子、莫洛尼(moloney)病毒启动子、鸟类白血病病毒(alv)启动子、巨细胞病毒(cmv)启动子如cmv立即早期启动子、爱巴二氏(epstein barr)病毒(ebv)启动子或劳氏肉瘤病毒(rsv)启动子。所述启动子还可以是来自人基因的启动子,所述人基因如人肌动蛋
白、人肌凝蛋白、人血红素、人肌肉肌酸或人金属硫蛋白。所述启动子还可以是组织特异性启动子,如天然或合成的肌肉或皮肤特异性启动子。
[0115]
所述载体还可以包含多聚腺苷酸化信号,所述多聚腺苷酸化信号可以在禽减蛋综合症病毒核心蛋白编码序列的下游。所述多聚腺苷酸化信号可以是sv40多聚腺苷酸化信号、ltr多聚腺苷酸化信号、牛生长激素(bgh)多聚腺苷酸化信号、人生长激素(hgh)多聚腺苷酸化信号或人β-球蛋白多聚腺苷酸化信号。所述sv40多聚腺苷酸化信号可以是来自pcep4载体(invitrogen,san diego,ca)的多聚腺苷酸化信号。
[0116]
所述载体也可包含在共有禽减蛋综合症病毒核心蛋白编码序列或共有禽减蛋综合症病毒表面抗原蛋白编码序列的上游的增强子。所述增强子对于dna表达是必须的。所述增强子可以是人肌动蛋白、人肌凝蛋白、人血红素、人肌肉肌酸或病毒增强子,如来自cmv、ha、rsv或者ebv的一种增强子。
[0117]
所述载体还可以包含动物的复制起点,以便将载体维持在染色体外并在细胞中产生载体的多个拷贝。所述载体可以是来自invitrogen(san diego,ca)的pvax1、pcep4或者prep4,其可以包含爱巴二氏病毒的复制起点和核抗原ebna-1编码区域,这可以在没有整合的情况下产生高拷贝附加型复制。所述载体可以是具有变化的pvax1或者pvax1变体,如本说明书所述的变体质粒。所述变体pvax1质粒是主链载体质粒pvax1(invitrogen,carlsbad ca)的2998碱基对变体。所述cmv启动子位于碱基137-724处。t7启动子/引发位点位于碱基664-683处。多克隆位点位于碱基696-811处。牛gh多聚腺苷酸化信号是在碱基829-1053处。卡那霉素(kanamycin)抗性基因是在碱基1226-2020处。puc起点是在碱基2320-2993处。
[0118]
所述载体可以是pse420(invitrogen,san diego,calif.),其可用于在大肠杆菌(e.coli)中产生蛋白。所述载体可以是pyes2(invitrogen,san diego,calif.),其可用于在酵母的酿酒酵母菌株(saccharomyces cerevisiae strain)中产生蛋白。所述载体还可以具有maxbactm完整的杆状病毒表达系统(invitrogen,san diego,calif.),其可用于在昆虫细胞中产生蛋白。所述载体还可以是pcdnai或者pcdna3(invitrogen,sandiego,calif.),其可用于在动物细胞如sf9细胞系中产生蛋白。所述载体可以是通过常规技术和容易可得的起始物质来产生蛋白的表达载体或系统,所述技术和物质包括sambrook等,molecular cloning and laboratory manual,第2版,coldspring harbor(1989)。
[0119]
本发明中,重组杆状病毒载体中的杆状病毒表达系统转移载体包括但不限于pfastbac 1,pvl1393,pfastbac dual等,可以优选采用pfastbac 1。蛋白的启动子可以是p10启动子、ph启动子等且不限于此,还有可能是其他的杆状病毒启动子。蛋白的转录终止信号可以是sv40 polya转染终止信号、hsv tk polya转染终止信号或者opie poly a终止信号中的任一个,且不限于此,而还可能是其他转录终止信号。昆虫细胞系可以是为sf9、high five、s2或sf21细胞,优选的用sf9。本发明所述的动物,主要是指鸡。
[0120]
本发明的原理在于通过构建多个重组杆状病毒穿梭质粒,各质粒上分别包含表达重组禽减蛋综合症病毒core蛋白、fiber蛋白、hexon蛋白和penton蛋白的编码基因。这些编码基因可以使用p10启动子、ph启动子中任一个(应不限于使用这两个启动子,还可能是其他启动子),该fu基因的转录终止信号可以是sv40 polya转染终止信号、hsv tk polya转染终止信号、opie poly a终止信号中的任一个(应不限于使用这三个转录终止信号,还可能是其他转录终止信号)。构建的多个穿梭质粒分别转化dh10bac菌获得多个重组bacmid
(baculovirus plasmid,杆状病毒质粒),获得的多个重组bacmid分别转染sf9细胞,获得重组杆状病毒,将该重组杆状病毒同时接种sf9细胞共感染,能够表达优化的edsv-vlp蛋白。
[0121]
本发明用昆虫细胞表达优化后的禽减蛋综合症病毒core蛋白基因(c基因)、fiber蛋白基因(f基因)、hexon蛋白基因(h基因)和penton蛋白基因(p基因)的蛋白,表达水平较高,蛋白免疫原性好,所获的重组fiber蛋白、hexon蛋白和penton蛋白三种蛋白可以自动组装形成vlp,重组core蛋白的加入可以提高vlp组装的效率,同时增加疫苗的免疫效果,这四种蛋白共表达使重组疫苗的免疫原性和功能性与天然蛋白更相似,且由此获得的疫苗能够在禽体内产生较强的体液免疫,免疫后的禽能够抵御强毒攻毒。
[0122]
以下结合若干更为具体的实施例对本发明的技术方案作详细的阐述。在如下实施例中,若非特别说明,则所使用的试剂、设备、实验操作、检测方式等均是本领域已知的,例如可以参考但不限于《分子生物学实验手册》(马文丽主编,人民军医出版社,2011年出版)等工具书。
[0123]
实施例1转移载体dual-c-f构建与鉴定
[0124]
1.转移载体dual-c构建与鉴定
[0125]
1.1c基因扩增与纯化 在南京金斯瑞公司合成了密码子优化后的c基因(seq id no:1)并克隆到puc17载体上,得到puc-c质粒载体。以puc-c质粒作为模板,c-f、c-r作为上、下游引物进行pcr扩增(c-f、c-r的基因序列如seq id no:9、10所示),扩增体系见表1。
[0126]
表1 c基因扩增体系
[0127][0128]
反应条件为:95℃预变性5分钟;94℃变性45秒,54℃退火45秒,72℃延伸1分钟,35个循环;72℃延伸10分钟。
[0129]
将pcr产物进行凝胶电泳验证目的基因大小,如图1所示,在0.5kbp的位置出现目的条带,目的基因扩增成功,用凝胶回收纯化试剂盒进行回收纯化。
[0130]
1.2酶切与纯化 将质粒和c基因表达框pcr扩增产物使用bamhⅰ、hindⅲ37℃双酶切3小时,具体酶切反应体系见表2、表3。
[0131]
将酶切产物进行凝胶电泳,分别使用凝胶回收纯化试剂盒纯化酶切的pfastbac dual质粒以及c基因片段。
[0132]
表2 c基因酶切反应体系
[0133]
[0134]
表3 pfastbac dual质粒酶切反应体系
[0135][0136]
1.3连接 将双酶切的pfastbac dual质粒和c基因酶切产物使用t4 dna连接酶16℃水浴连接过夜。具体连接反应体系见表4。
[0137]
表4 c基因与pfastbac dual质粒连接体系
[0138][0139][0140]
1.4转化 将10μl连接产物加入100μl的dh5α感受态细胞中混匀,冰浴30分钟,42℃水浴热休克90秒,再冰浴2分钟,加入900μl不含amp的lb液体培养基,37℃培养1小时。取1.0ml菌液浓缩成100μl涂布于含有amp的lb固体培养基上,37℃培养16小时。
[0141]
1.5菌落pcr和测序鉴定 挑取平板上的单菌落分别接种lb液体培养基,37℃培养2小时,以菌液作为模板,c-f和c-r作为引物进行菌落pcr鉴定,将pcr产物进行凝胶电泳验证目的基因的大小,如图2所示,出现0.5kbp条带的样品为阳性样品。将鉴定阳性的菌液送测序公司进行测序,选择测序正确的菌液保存。
[0142]
2.转移载体dual-c-f构建与鉴定
[0143]
2.1f基因扩增与纯化 在南京金斯瑞公司合成了密码子优化后的f基因(seq id no:3)并克隆到puc17载体上得到puc-f质粒载体。以puc-f质粒作为模板,f-f、f-r作为上、下游引物进行pcr扩增(f-f、f-r的基因序列如seq id no:11、12所示),扩增体系见表5。
[0144]
表5 f基因扩增体系
[0145][0146]
反应条件为:95℃预变性5分钟;94℃变性45秒,54℃退火45秒,72℃延伸1分钟,35个循环;72℃延伸10分钟。
[0147]
将pcr产物进行凝胶电泳验证目的基因大小,如图3所示,在2.4kbp附近的位置出现目的条带,目的基因扩增成功,用凝胶回收纯化试剂盒进行回收纯化。
[0148]
2.2酶切与纯化 将dual-c质粒和f基因pcr扩增产物使用xhoⅰ、kpnⅰ37℃双酶切3小时,具体酶切反应体系见表6、表7。
[0149]
将酶切产物进行凝胶电泳,分别使用凝胶回收纯化试剂盒纯化酶切的dual-c质粒以及f基因片段。
[0150]
表6 f基因酶切反应体系
[0151][0152]
表7 dual-c质粒酶切反应体系
[0153][0154]
2.3连接 将双酶切的dual-c质粒和f基因酶切产物使用t4 dna连接酶16℃水浴连接过夜。具体连接反应体系见表8。
[0155]
表8 f基因与dual-c质粒连接体系
[0156][0157]
2.4转化 将10μl连接产物加入100μl的dh5α感受态细胞中混匀,冰浴30分钟,42℃水浴热休克90秒,再冰浴2分钟,加入900μl不含amp的lb液体培养基,37℃培养1小时。取1.0ml菌液浓缩成100μl涂布于含有amp的lb固体培养基上,37℃培养16小时。
[0158]
2.5菌落pcr和测序鉴定 挑取平板上的单菌落分别接种lb液体培养基,37℃培养2小时,以菌液作为模板,f-f和f-r作为引物进行菌落pcr鉴定,将pcr产物进行凝胶电泳验证目的基因的大小,如图4所示,出现2.4kbp条带的样品为阳性样品。将鉴定阳性的菌液送测序公司进行测序,选择测序正确的菌液保存。构建的含有目的基因的转移载体dual-c-f其示意图如图5。
[0159]
实施例2转移载体dual-p-h构建与鉴定
[0160]
1.转移载体dual-p构建与鉴定
[0161]
1.1p基因扩增与纯化 在南京金斯瑞公司合成了密码子优化后的p基因(seq id no:5)并克隆到puc17载体上,得到puc-p质粒载体。以puc-p质粒作为模板,p-f、p-r作为上下游引物进行pcr扩增(p-f、p-r的基因序列如seq id no:13、14所示),扩增体系见表9。
[0162]
表9 p基因扩增体系
[0163][0164]
反应条件为:95℃预变性5分钟;94℃变性45秒,54℃退火45秒,72℃延伸1分钟,35个循环;72℃延伸10分钟。
[0165]
将pcr产物进行凝胶电泳验证目的基因大小,如图6所示,在1.4kbp的位置出现目的条带,目的基因扩增成功,用凝胶回收纯化试剂盒进行回收纯化。
[0166]
1.2酶切与纯化 将pfastbac dual质粒和p基因表达框pcr扩增产物使用bamhⅰ、hindⅲ37℃双酶切3小时,具体酶切反应体系见表10、表11。
[0167]
将酶切产物进行凝胶电泳,分别使用凝胶回收纯化试剂盒纯化酶切的pfastbac dual质粒以及p基因片段。
[0168]
表10 p基因酶切反应体系
[0169][0170]
表11 pfastbac dual质粒酶切反应体系
[0171][0172]
1.3连接 将双酶切的pfastbac dual质粒和p基因酶切产物使用t4 dna连接酶16℃水浴连接过夜。具体连接反应体系见表12。
[0173]
表12 p基因与pfastbac dual质粒连接体系
[0174][0175]
1.4转化 将10μl连接产物加入100μl的dh5α感受态细胞中混匀,冰浴30分钟,42℃水浴热休克90秒,再冰浴2分钟,加入900μl不含amp的lb液体培养基,37℃培养1小时。取1.0ml菌液浓缩成100μl涂布于含有amp的lb固体培养基上,37℃培养16小时。
[0176]
1.5菌落pcr和测序鉴定 挑取平板上的单菌落分别接种lb液体培养基,37℃培养2
小时,以菌液作为模板,p-f和p-r作为引物进行菌落pcr鉴定,将pcr产物进行凝胶电泳验证目的基因的大小,如图7所示,出现1.4kbp条带的样品为阳性样品。将鉴定阳性的菌液送测序公司进行测序,选择测序正确的菌液保存。
[0177]
2.转移载体dual-p-h构建与鉴定
[0178]
2.1h基因扩增与纯化 在南京金斯瑞公司合成了密码子优化后的h基因(seq id no:7)并克隆到puc17载体上得到puc-h质粒载体。以puc-h质粒作为模板,h-f、h-r作为上下游引物进行pcr扩增(h-f、h-r的基因序列如seq id no:15、16所示),扩增体系见表13。
[0179]
表13 h基因扩增体系
[0180][0181]
反应条件为:95℃预变性5分钟;94℃变性45秒,54℃退火45秒,72℃延伸1分钟,35个循环;72℃延伸10分钟。
[0182]
将pcr产物进行凝胶电泳验证目的基因大小,如图8所示,在2.7kbp附近的位置出现目的条带,目的基因扩增成功,用凝胶回收纯化试剂盒进行回收纯化。
[0183]
2.2酶切与纯化 将dual-p质粒和h基因pcr扩增产物使用xhoⅰ、kpnⅰ37℃双酶切3小时,具体酶切反应体系见表14、表15。
[0184]
将酶切产物进行凝胶电泳,分别使用凝胶回收纯化试剂盒纯化酶切的dual-p质粒以及h基因片段。
[0185]
表14 h基因酶切反应体系
[0186][0187]
表15 dual-p质粒酶切反应体系
[0188][0189]
2.3连接 将双酶切的dual-p质粒和h基因酶切产物使用t4 dna连接酶16℃水浴连接过夜。具体连接反应体系见表16。
[0190]
表16 h基因与dual-p质粒连接体系
[0191][0192]
2.4转化 将10μl连接产物加入100μl的dh5α感受态细胞中混匀,冰浴30分钟,42℃水浴热休克90秒,再冰浴2分钟,加入900μl不含amp的lb液体培养基,37℃培养1小时。取1.0ml菌液浓缩成100μl涂布于含有amp的lb固体培养基上,37℃培养16小时。
[0193]
2.5菌落pcr和测序鉴定 挑取平板上的单菌落分别接种lb液体培养基,37℃培养2小时,以菌液作为模板,h-f和h-r作为引物进行菌落pcr鉴定,将pcr产物进行凝胶电泳验证目的基因的大小,如图9所示,出现2.7kbp条带的样品为阳性样品。将鉴定阳性的菌液送测序公司进行测序,选择测序正确的菌液保存。构建的含有目的基因的转移载体dual-p-h其示意图如图10。
[0194]
实施例3重组杆状病毒基因组bacmid-c-f以及bacmid-p-h的构建
[0195]
1.dh10bac菌转化 取实施例1中1μl dual-c-f质粒加入100μl的dh10bac感受态细胞中混匀,冰浴30分钟,42℃水浴热休克90秒,再冰浴2分钟,加入900μl不含amp的lb液体培养基,37℃培养5小时。取100μl菌液稀释81倍后,取100μl稀释的菌液涂布到含有庆大霉素、卡那霉素、四环素、x-gal以及iptg的lb固体培养基上,37℃培养48小时。以同样方法操作实施例2中dual-p-h质粒。
[0196]
2.挑选单克隆 使用接种针分别挑取大的白色菌落,然后在含有庆大霉素、卡那霉素、四环素、x-gal以及iptg的lb固体培养基上划线,37℃培养48小时,然后挑取单菌落接种含有庆大霉素、卡那霉素、四环素的lb液体培养基培养,保存菌种,抽提质粒。分别获得重组质粒bacmid-c-f以及bacmid-p-h。
[0197]
实施例4重组杆状病毒转染与纯化
[0198]
1.重组病毒转染 六孔板中每个孔接种0.8
×
106个sf9细胞,细胞汇合度为50~70%。对于每一个孔制备以下的复合物:用100μl转染培养基t1稀释4μl的cellfectin转染试剂,短暂的漩涡震荡;用100μl转染培养t1基稀释3μg实施例3中的重组bacmid-c-f质粒,将稀释的转染试剂和质粒混合,轻轻吹匀,制备转染混合物。待细胞贴壁后加入上述的转染复合物,27℃孵育5小时,移除上清,添加2ml sf-sfm新鲜培养基,27℃培养4~5日收获上清。获得重组杆状病毒rbac-cf。以同样操作方法转染bacmid-p-h质粒,获得重组杆状病毒rbac-ph。
[0199]
2.重组病毒的纯化(蚀斑纯化) 在直径为6cm的组织培养皿中接种2.0
×
106~2.5
×
106个sf9细胞,室温下放置5分钟。梯度稀释(稀释比例:10-4
~10-7
)上述重组杆状病毒rbac-cf,每个培养皿添加1.0ml稀释的病毒液,室温放置1小时,每15分钟适当震荡,使病毒充分感染。无菌水配置2%的低浓度琼脂糖,微波加热到60℃,充分融化。放置42℃水浴恒温,添加1体积的2
×
grace培养基,混合均匀。弃细胞培养皿中培养液上清,在细胞表面覆盖4.0ml 1%琼脂糖,同时吸走所有气泡,琼脂糖凝固后将培养皿放置于湿润环境中,27℃培养7日,观察蚀斑。挑取培养皿上单个蚀斑,接种sf-sfm培养基,4℃摇晃过夜。收获培养物,接种sf9细胞,27℃培养72小时,收获细胞培养物。定为重组杆状病毒rbac-cf f0代,同理制
备rbac-ph f0代。
[0200]
3.重组病毒滴度测定 纯化得到rbac-cf p0种毒以及rbac-ph p0种毒。使用mtt相对效力法检测病毒滴度,rbac-cf p0种毒病毒滴度为3.4
×
107pfu/ml,扩增重组杆状病毒rbac-cf作为种毒备用;rbac-ph p0种毒病毒滴度为3.1
×
107pfu/ml,扩增重组杆状病毒rbac-ph作为种毒备用。
[0201]
实施例5种毒表达产物sds-page检测
[0202]
将实施例4中收获的细胞培养物分别进行sds-page检测,同时使用感染空杆状病毒的sf9细胞作为阴性对照。具体操作如下:取40μl收获的细胞培养物,加入10μl的5
×
loading buffer,沸水浴5分钟,12000r/min离心1分钟,取上清进行sds-page凝胶(12%浓度凝胶)电泳,电泳后取凝胶经染色、脱色后观察目的条带。如图11、12所示,重组杆状病毒rbac-cf在分子量约18kda和85kda附近出现目的条带,阴性对照在对应位置没有条带;重组杆状病毒rbac-ph在分子量约51kda和102kda附近出现目的条带,阴性对照在对应位置没有出现条带。
[0203]
实施例6种毒表达产物western blot鉴定
[0204]
将实施例5中sds-page电泳后的产物转印到nc(硝酸纤维素)膜上,用5%脱脂牛奶封闭2小时,鸡源抗edsv阳性血清孵育2小时,漂洗,hrp标记的羊抗鸡多克隆抗体二抗孵育2小时,漂洗,然后滴加增强型化学发光荧光底物,使用化学发光成像仪拍照。如图13、14所示,重组杆状病毒表达样品有目的条带,阴性对照没有目的条带,说明目的抗原蛋白在sf9细胞中得到正确表达。
[0205]
实施例7 edsv-vlp表达
[0206]
三角摇瓶中接种sf9细胞,当细胞密度达到2
×
106/ml时,同时接种rbac-cf和rbac-ph两个病毒,使得两个病毒的moi都为3,接毒后96h收获。
[0207]
实施例8 edsv-vlp表达产物鉴定与检测
[0208]
1.sds-page检测
[0209]
将实施例7中收获的edsv-vlp表达产物进行sds-page检测,同时使用感染空杆状病毒的sf9细胞作为阴性对照。具体操作如下:取40μl收获的重组杆状病毒edsv-vlp,加入10μl的5
×
loading buffer,沸水浴5分钟,12000r/min离心1分钟,取上清进行sds-page凝胶(12%浓度凝胶)电泳,电泳后取凝胶经染色、脱色后观察目的条带。如图15所示,edsv vlp表达产物在分子量约18kda、51kda、85kda和102kda附近出现目的条带,阴性对照在对应位置没有条带。
[0210]
2.western blot鉴定
[0211]
将实施例8中sds-page电泳后的产物转印到nc(硝酸纤维素)膜上,用5%脱脂牛奶封闭2小时,鸡源抗edsv阳性血清孵育2小时,漂洗,hrp标记的羊抗鸡多克隆抗体二抗孵育2小时,漂洗,然后滴加增强型化学发光荧光底物,使用化学发光成像仪拍照。如图16所示,重组杆状病毒表达样品有目的条带,阴性对照没有目的条带,说明目的抗原蛋白在sf9细胞中得到正确表达。
[0212]
实施例9 edsv-vlp间接免疫荧光检测
[0213]
向96孔细胞培养板中加入sf9细胞悬液,100μl/孔(细胞浓度为2.5
×
105~4.0
×
105个/ml),接种4孔,27℃静置15分钟,使sf9细胞贴于培养板底壁,然后每孔同时加入10μl
稀释10倍的rbac-cf和rbac-ph毒种。同时设空白细胞对照。接种后细胞置27℃恒温培养箱中培养72~96小时,弃培养液,冷甲醇/丙酮(1:1)固定。首先与edsv-vlp单克隆抗体反应,然后与fitc标记的羊抗鼠igg反应,倒置荧光显微镜观察结果。如图17所示,接种空杆状病毒sf9细胞不能观察到荧光,而接种了重组杆状病毒sf9细胞能够观察到荧光,说明目的抗原蛋白在sf9细胞中得到正确表达并且能够组装成vlp,重组杆状病毒构建正确。
[0214]
实施例10 edsv-vlp纯化以及电镜观察
[0215]
1.蔗糖梯度离心 将重组杆状病毒edsv-vlp细胞培养物冻融三次后,12000r/min离心30分钟,取上清,0.22μm滤膜过滤,去除杂质,使用截留分子量为500kda的超滤管浓缩10倍。每个离心管加入浓度为40%的蔗糖溶液10ml,然后加入2.0ml超滤浓缩样品,29000r/min超速离心2小时,弃上清,沉淀用2.0ml pbs重悬。然后将悬液经过浓度分别为50%、60%、70%、80%的梯度浓度蔗糖离心,29000r/min超速离心2小时,然后收集位于60%~70%浓度交界处的条带。
[0216]
蛋白电泳检测:取60%~70%浓度交界处的条带进行sds-page检测。电泳图如18所示,出现四个条带,分子量分别是18kda、51kda、85kda和102kda,分别是core protein、penton protein、fiber protein和hexon protein。说明这四个蛋白能够形成vlp,通过蔗糖梯度离心的方法纯化得到vlp。
[0217]
2电镜观察 将少量的纯化浓缩后的病毒样颗粒样品滴加到有碳膜的铜网上,自然风干后,滴加2%磷钨酸钠溶液进行负染,负染后进行电镜观察。电镜下观察到与edsv病毒粒子大小相当、形态学相近的病毒样颗粒,vlp直径约20-25nm具体结果见图19。
[0218]
实施例11抗原蛋白血凝检测
[0219]
使用鸡红血球检测edsv-vlp的血凝效价。操作步骤如下:将样品在-80℃反复冻融三次后离心取得上清用于检测。在微量板上,从第1孔至12孔,用移液器每孔加入pbs 0.025ml,用移液器吸取被检样品0.025ml,从第一孔起,依次作2倍系列稀释,至最后1个孔,弃去移液器内0.025ml液体(稀释倍数依次为2,4,8,16,32
……
)。每孔加入1%鸡红细胞悬液0.025ml,并设不加样品的红细胞对照孔,立即在微量板振摇器上摇匀,置室温20~40℃分钟或置2~8℃40~60分钟,当对照孔中的红细胞呈显著纽扣状时判定结果。使红细胞完全凝集的最高稀释度作为判定重点。检测显示edsv-vlp的血凝效价为1:2
15
。
[0220]
实施例12昆虫细胞的生物反应器无血清悬浮培养及edsv-vlp的表达定量以及琼扩效价测定
[0221]
在1000ml摇瓶中无菌培养sf9昆虫细胞3-4天,待浓度长到3~5
×
106cells/ml,活力大于95%时,将细胞接种到5l的生物反应器中,接种浓度为3~8
×
105cells/ml。当细胞浓度达到3~55
×
106cells/ml时,将细胞接种到50l生物反应器中,待细胞长至浓度为3~55
×
106cells/ml,接种到500l生物反应器中,待细胞浓度达到2~85
×
106cells/ml时,接种重组杆状病毒edsv-vlp,反应器培养条件为ph值6.0~6.5、温度25~27℃、溶氧30~80%、搅拌速度100~180rpm。考虑到细胞培养的最适条件,优选的ph6.2、细胞培养阶段温度设定27℃、溶氧50%、搅拌速度100-180rpm。在感染之后继续培养5~9天后,加入千分之一终浓度bei,37℃作用48h后,加千分之二终浓度na2s2o3终止灭活。通过离心或中空纤维过滤的方法收获细胞培养上清,置2~8℃保存疫苗原液。
[0222]
制备的上述疫苗抗原中edsv-vlp含量使用elisa方法检测。操作方式如下:用包被
缓冲液稀释鸡抗edsv多抗血清至合适浓度,每孔100μl,4℃过夜,pbst洗涤三次,1%bsa封闭1h。加入不同浓度的抗原标准品(蔗糖梯度离心纯化得到的edsv-vlp)和梯度稀释待检样品,37℃孵育1小时,pbst洗三次。每孔加入检测抗体:edsv-vlp单克隆抗体(一种识别edsv病毒样颗粒结构的单克隆抗体),37℃孵育1小时,pbst洗三次。每孔加入二抗-即hrp标记的羊抗鸡igg,37℃孵育1小时,pbst洗三次。tmb显色10分钟,2m h2so4终止反应。酶标仪读数,通过标准曲线计算待检样品中edsv-vlp的量。
[0223]
按照实施例12,大规模制备了5批edsv-vlp,elisa检测结果如下表,从表中结果可以看出,疫苗原液中edsv-vlp的平均含量为约160mg/l,5批疫苗原液中edsv-vlp的含量分别为139mg/l、134mg/l、152mg/l、201mg/l和175mg/l。
[0224] 批次1批次2批次3批次4批次5平均edsv-vlp蛋白浓度(mg/l)139175152134201160抗原血凝效价1:2
15
1:2
16
1:2
16
1:2
15
1:2
16 [0225]
实施例13疫苗的制备
[0226]
取实施例12中表达的5个批次疫苗原液,并使用生理盐水分别进行稀释,使得edsv-vlp的浓度达到20ug/ml,然后将混合好的疫苗原液与油佐剂按照2:3的比例配置成油乳剂疫苗。具体的,每1l的混合疫苗原液加入白油1429g,司本70.2g,硬脂酸铝8.43g以及吐温53.3g。然后用乳化破碎机破碎乳化制备成油乳佐剂灭活苗。
[0227]
实施例14免疫原性试验及最小免疫剂量试验
[0228]
1.免疫试验 取21~28日龄spf鸡60只,其中50只各颈部皮下注射实施例13中制备好的5个批次禽减蛋综合征基因工程亚单位疫苗,每批次注射10只,每只0.2ml,;另10只以同样方式注射等体积生理盐水作为对照。接种后21-28日,所有免疫鸡和对照鸡分别采血,分离血清,测定血清禽减蛋综合症hi抗体效价。测定结果显示见下表。
[0229][0230][0231]
2.最小免疫剂量试验 取21~28日龄的spf鸡45只,将其分成5个组,其中1~4组,每组10只,分别以每只0.05、0.1、0.2、0.3ml的剂量颈背部皮下注射实施例13中所制备的第三批次禽减蛋综合征病毒基因工程亚单位疫苗,第5组10只作为对照。免疫后3周所有试验鸡采血分离血清,测定edsv hi抗体效价,结果如下,最小免疫剂量为每羽份0.1ml。
[0232][0233]
实施例15验证试验
[0234]
1.将前述的优化后的f基因、h基因和p基因分别构建载体并转化dh10bac菌后转染昆虫细胞,鉴定基因序列正确后共接毒感染昆虫细胞获得表达产物,通过试验验证后发现,vlp组装效率较低,免疫效果较差。制备5批样品后检测结果表明,疫苗原液中病毒样颗粒的含量分别为16mg/l、13mg/l、18mg/l、13mg/l和20mg/l;琼扩效价为1:2
9-1:2
11
。
[0235]
2.使用未优化后的原始f基因、h基因、c基因和p基因以同样方式制备重组杆状病毒,通过sds-page检测发现,电泳后发现条带弱,不明显(图20)。未优化的序列构建后发现表达量很低,平均表达量为34ug/ml,免疫试验效果与本案edsv-vlp疫苗效果一致。
[0236]
附及,经测序显示,本发明以上实施例获得的禽减蛋综合症病毒重组core蛋白、fiber蛋白、hexon蛋白、penton蛋白的氨基酸序列分别如seq id no:2、seq id no:4、seq id no:6、seq id no:8所示。
[0237]
应当理解,以上所描述的实施例是本发明一部分实施例,而不是全部的实施例。本发明的实施例的详细描述并非旨在限制要求保护的本发明的范围,而是仅仅表示本发明的选定实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
[0238]
[0239]
[0240]
[0241]
[0242]
[0243]
[0244]
[0245]
[0246]
[0247]
[0248]
[0249]
[0250]
[0251]
[0252]
[0253]
[0254]
[0255]
[0256]
[0257]
[0258]
[0259]
[0260]
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- 大豆低温诱导人工合成启动子SP5及应用的制造方法与工艺
- 一种来源于虎眼万年青的尿苷-5’-二磷酸半乳糖差向异构酶,其核苷酸序列及应用的制造方法与工艺
- 一种来源于虎眼万年青的尿苷-5’-二磷酸木糖差向异构酶,其核苷酸序列及应用的制造方法与工艺
- 新的赖氨酸脱羧酶突变体及其应用的制造方法与工艺
- 一种嗜热中性蛋白酶基因、工程菌、酶及其应用的制造方法与工艺
- 一种碱性耐盐普鲁兰酶PulA及其基因和应用的制造方法与工艺
- 一种热稳定性提高的β‑淀粉酶突变体的制造方法与工艺
- 一类耐热型植酸酶突变体及其编码基因和应用的制造方法与工艺
- 含CCL5和SSTR2基因的重组痘病毒及其制备方法与流程
- 一种催化黄酮类化合物葡萄糖苷化的基因工程菌及其应用的制造方法与工艺