同时检测鼠伤寒沙门氏菌,肠炎沙门氏菌,魏氏梭菌A型的三重PCR引物组及试剂盒的制作方法
本发明属于生物检测技术领域,具体涉及一种同时检测鼠伤寒,肠炎,以及魏氏梭菌a型的三重pcr引物组及试剂盒。
背景技术:
沙门氏菌属于肠杆菌科,并且是肠杆菌科中血清型最为复杂的菌属。据调查统计其血清型可高达2000多种。能引起禽类感染的沙门氏菌多达30多种。这些沙门氏菌是造成养禽业中影响最为严重细菌性疾病之一,每年给养殖户带来巨大的经济损失。在养鸡行业中鼠伤寒,肠炎是在沙门氏菌中较为常见的血清型。
鸡感染沙门氏菌精神委顿,缩头颈,闭眼昏睡,绒毛松乱,初期病鸡仅表现食欲减少,继而不食;腹泻,排白色稀浆样粪便,有糊堵肛门现象;严重者因呼吸困难或急性败血症而死亡。被沙门氏菌感染的禽,不但损害鸡的健康,还可通过禽类产品作为传播媒介感染人类。引起人类的肠道疾病,严重还会发生败血症甚至死亡。因此加强对禽沙门氏菌病的防治,无论在养禽业或是公共卫生上都有着重要的意义。
魏氏梭菌a型是可造成鸡肠道坏死,出血较为多见的血清型,一年四季均可发病,每年温度较低的早春和冬季发病率较高,一经发病迅速发生死亡。发病3d后即可出现精神萎顿,羽毛蓬乱,嗜睡,寒颤,食欲减退或废绝,排黄色,黏性带血的粪便。但最常引起死亡的鸡特征是体格健壮,鸡冠眼睑青紫,少数苍白,部分歪颈,步态僵直等神经症状。对中国养鸡业造成诸多威胁。在感染鸡群的魏氏梭菌血清型中a型为优势血清型。
要想做好沙门氏菌病和魏氏梭菌病的防控,减少经济损失,快速的检测出常见的血清型是防治的前提和基础。目前想要检测鸡的肠道细菌,可在各实验室常见的方法有细菌鉴别培养法。但想要准确的鉴别出细菌混合感染以及复杂的血清型可通过免疫印迹技术,酶联免疫吸附法,核酸杂交技术以及聚合酶链式反应(pcr)等。这些检测方法考虑到特异性,灵敏度,损耗时间,操作简便,所需费用以及日后临床推广这些问题。最终选定多重pcr法作为本次实验的检测方法。多重pcr(multiplexpcr)的原理是在同一pcr反应体系中添加二对及二对以上的引物,根据放入引物的对数可以相对应的扩增出多个核酸片段。多重pcr这一方法通过实验操作人员前期摸索最适合的退火温度,引物比例,最佳反应条件。从而确定最适合的反应条件。确定好条件的多重试剂盒,在临床应用中检测人员只需直接加入待检的菌液或者核酸。方便快捷,准确性,特异性高,灵敏度良好,并且大量的节约了经济成本。
技术实现要素:
本发明为了更加准确高效的检测出沙门氏菌的常见血清型和魏氏梭菌a型提供了一个三重pcr检测试剂盒,试验结果表明此方法特异性强,灵敏度高,准确性好。有益于各养禽场应用以及推广。
本发明的方案如下:
同时检测鼠伤寒沙门氏菌,肠炎沙门氏菌,以及魏氏梭菌a型的三重pcr引物组,其特征在于,包含三对引物,分别是鼠伤寒沙门氏菌上下游引物对分别是seqidno:1,seqidno:2;肠炎沙门氏菌上下游引物对分别是seqidno:3,seqidno:4;魏氏梭菌a型引物对分别是seqidno:5,seqidno:6。
引物序列如下:
同时检测鼠伤寒沙门氏菌、肠炎沙门氏菌,以及魏氏梭菌a型的三重pcr检测试剂盒,试剂盒所涉及的试剂如下:2хtaqmix12.5μl,鼠伤寒上下游引物各0.6μl,肠炎沙门氏菌上下游引物各0.7μl,魏氏梭菌上下游引物各0.7μl,水4.5μl,模板各1μl,总体积25μl。
引物对浓度均为10um。各引物对的摩尔比1:1:1:1:1:1:。
本发明还提供一种同时检测鼠伤寒沙门氏菌、肠炎沙门氏菌,以及魏氏梭菌a型的三重pcr检测方法,包括下列步骤:
(一)待测样本的核酸提取
参照青岛英赛特生物科技有限公司的病毒dna/rna提取试剂盒说明书,提取待测样本的dna,-20℃保存。
(二)pcr扩增反应体系
将10×pcr缓冲液、dntps、taqdna聚合酶、检测引物组以及步骤(一)提取的样本dna模板加入灭菌pcr反应管中,添加灭菌双蒸水至总体积25μl,同时设置阳性、阴性对照,使用pcr仪进行扩增反应。
反应体系如下:
2хtaqmix12.5μl
鼠伤寒上下游引物各0.6μl,
肠炎沙门氏菌上下游引物各0.7μl,
魏氏梭菌上下游引物各0.7μl,
模板3μl,
灭菌水补足至总体积25μl。
(三)pcr二步扩增程序:
94℃,2min,98℃,10s,延伸64℃,1min30s循环30。
(四)pcr的结果鉴定:
将2μlpcr产物混匀2μl的1×loadingbuffer,将混匀的样品点进2%的琼脂糖凝胶中,在120v的电泳仪中跑15min。相对分子质量指示是采用dl2000dnamarker。最后通过凝胶成像进行结果分析。
试剂盒判定检测样品中是否含有鼠伤寒沙门氏菌,肠炎沙门氏菌,伤寒沙门氏菌和魏氏梭菌a型,通过观察电泳检测图并与标准分子量相对照,若待测样品在158bp处出现一条明亮的条带,阴性对照没有目的条带。则证明该待测样品中存在鼠伤寒沙门氏菌;若待测样品中在331bp出现一条目的条带,阴性对照没有条带。则证明待测样品中存在肠炎沙门氏菌;若待测样品中245bp出现一条目的条带,阴性对照没有条带,证明待测样品中存在魏氏梭菌a型。
本发明的有益效果:
(1)本发明重点是区分沙门氏菌以及魏氏梭菌常见的血清型,沙门氏菌有2600多种血清型,但在家禽中检测出的血清型有30多种,在专利cn107937584a这篇专利中也提到目前流行的沙门氏菌血清型是肠炎沙门氏菌,鼠伤寒沙门氏菌。这两种血清型不但可以引起人畜共感染并和食品安全相关,流行也较为普遍。目前市场针对危害较为严重的沙门氏菌血清型以及魏氏梭菌血清型鉴定的检测试剂盒较少。关于细菌多重的专利更多的是检测某病原,很少针对具体血清型以及迎合近几年养禽场肠道细菌病发病的流行趋势。cn201710101662.1王雷关于检测猪细菌性肠炎病原的专利是关于三种病原体,在专利数据库中检索到一篇cn107201400a关于沙门氏菌血清型以及大肠杆菌的多重pcr检测试剂盒。本发明也是针对同样的沙门氏菌血清型,考虑到这几种血清型对家禽养殖业的危害以及流行较广。但区别在于本发明是针对检测沙门氏菌血清型和魏氏梭菌a型的检测试剂盒。沙门氏菌和魏氏梭菌都是可以引起宿主肠道细菌性疾病,魏氏梭菌a型近年来对养殖业的危害逐渐加大,造成的经济损失也不容小觑。因此沙门氏菌血清型和魏氏梭菌a型的检测试剂盒是结合临床需求而研发的一款试剂盒。
(2)研究多重检测试剂盒的科研人员大多数都用三步法扩增。本发明为了提高检测的效率,突破了三步法,选用两步法。为了保证扩增的特异性通过多次优化反应条件。最后pcr的扩增程序为预变性94℃,2min;变形98℃,10s;延伸64℃,1min30s,循环30次。
用两步扩增法(变性,延伸)比起常用的多重检测。本发明通过优化条件,最终通过两步法扩增出三条目的条带,保证特异性,准确性以及灵敏度的同时大大缩短了反应的时间。
现有技术中,例如丁圣青cn107201400a这篇专利中也是做的多重pcr,但是本发明在时间上和步骤上都大为缩短,数量较多的临床样品中显然此方法更方便快捷。
附图说明
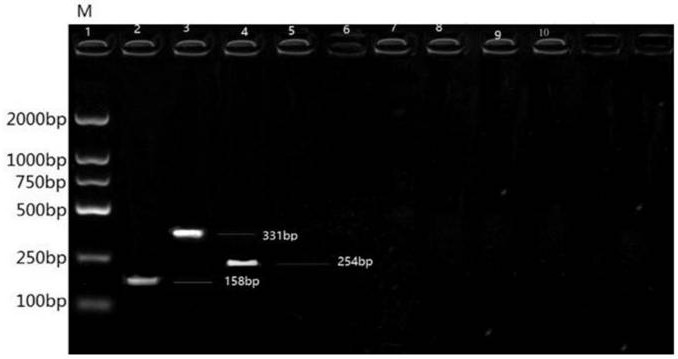
图1是pcr特异性试验结果电泳图。
图2是cr鉴别引物敏感性结果电泳图。
图3是对临床样品进行pcr鉴别检测电泳图。
具体实施方式
以下结合附图和具体实施例对本发明作具体的介绍。
以下实施例中所使用的实验方法如无特殊说明,均为常规方法;所用材料、试剂等,如无特殊说明,均可从商业途径得到。具体所用材料和试剂如下:
试剂:2000bpmarker、病毒dna/rna提取试剂盒为青岛英赛特生物科技有限公司自主研发;2xtaqpcrmix购自北京全式金生物技术有限公司。
一、设计特异性引物:设计了同时检测鼠伤寒沙门氏菌,肠炎沙门氏菌和魏氏梭菌a型的三重pcr引物组,具体序列如下:
二、核酸提取
参照青岛英赛特生物科技有限公司的病毒dna/rna提取试剂盒说明书,提取各种沙门氏菌和魏氏梭菌的dna,-20℃保存。
三、同时检测鼠伤寒沙门氏菌,肠炎沙门氏菌,魏氏梭菌的三重pcr的特异性试验:
本次将鼠伤寒沙门氏菌、肠炎沙门氏菌,魏氏梭菌a型,伤寒沙门氏菌,禽霍乱,鸡白痢,都柏林沙门氏菌,禽霍乱,大肠杆菌的核酸添加到多重pcr体系中进行pcr扩增,电泳图如图1所示,点样顺序从左至右依次为:
泳道1:marker,
泳道2:鼠伤寒沙门氏菌,
泳道3:肠炎沙门氏菌,
泳道4:魏氏梭菌a型,
泳道5:伤寒沙门氏菌,
泳道6:鸡白痢沙门氏菌,
泳道7:都柏林沙门氏菌;
泳道8:禽霍乱;
泳道9:大肠杆菌;
泳道10:阴性对照。
结果图1表明:泳道2出现158bp,泳道3出现331bp,泳道4出现254bp。其余结果均为阴性,证明这个多重pcr的特异性良好。
四、鼠伤寒沙门氏菌和肠炎沙门氏菌,伤寒沙门氏菌,魏氏梭菌a型的敏感性实验
用nanodrop-2000测得鼠伤寒沙门氏菌,肠炎沙门氏菌,以及魏氏梭菌a型的人工质粒浓度,并调整至10ng/ul,10倍稀释梯度后等体积混合作为模板,进行三重pcr扩增,对pcr扩增产物进行电泳,结果如图2所示,点样顺序从左至右依次为:
泳道1:marker;
泳道2:10-1稀释度;
泳道3:10-2稀释度;
泳道4:10-3稀释度;
泳道5:10-4稀释度;
泳道6:10-5稀释度;
泳道7:10-6稀释度;
泳道8:10-7稀释度;
泳道9:10-8稀释度;
泳道10:阴性对照。
从电泳结果可以看出,人工质粒的最低检出限为10-3稀释度。
五、对实际样本进行检测
采用本发明提供的检测方法对采集的9份样本进行检测,先提取核酸,再按照试剂盒中pcr程序进行扩增电泳,若待测样品于158bp处出现了一条明亮的条带,阴性对照没有目的条带,则证明该待测样品中存在鸡鼠伤寒沙门氏菌;若待测样品在331bp出现一条明亮的条带,阴性对照没有目的条带,则证明该待测样品是肠炎沙门氏菌。若待测样品在254bp出现一条明亮的条带,阴性对照没有目的条带,则证明该待测样品是魏氏梭菌。检测结果见图3,点样顺序如下:
泳道1:marker;
泳道2~10:待测样品;
泳道11:阴性对照。
从电泳结果可以看出,2号样品为鼠伤寒沙门氏菌沙门氏菌感染,
3样品为肠炎沙门氏菌感染;4号样品为魏氏梭菌a型。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明技术原理的前提下,还可以做出若干改进和变型,这些改进和变型也应视为本发明的保护范围。
序列表
<110>青岛英赛特生物科技有限公司,山东益生种畜禽股份有限公司,青岛迪诺瓦基因科技有限公司
<120>同时检测鼠伤寒沙门氏菌,肠炎沙门氏菌,魏氏梭菌a型的三重pcr引物组及试剂盒
<141>2020-09-29
<160>6
<170>siposequencelisting1.0
<210>1
<211>26
<212>dna
<213>人工序列(artificialsequence)
<400>1
ttcagtcttaacgataatccgcaacg26
<210>2
<211>26
<212>dna
<213>人工序列(artificialsequence)
<400>2
gataaaccgtgagcaacgacagtaaa26
<210>3
<211>23
<212>dna
<213>人工序列(artificialsequence)
<400>3
agacaccagtgacaacgacgaat23
<210>4
<211>21
<212>dna
<213>人工序列(artificialsequence)
<400>4
ggattacggcggcgaatacca21
<210>5
<211>22
<212>dna
<213>人工序列(artificialsequence)
<400>5
taatgttactgccgttgatagc22
<210>6
<211>22
<212>dna
<213>人工序列(artificialsequence)
<400>6
tagtcatctgttccagcatctt22
- 还没有人留言评论。精彩留言会获得点赞!