一种光/铜共催化合成多取代呋喃的方法与流程
[0001]
本发明涉及一种光/铜共催化合成多取代呋喃的方法。
背景技术:
[0002]
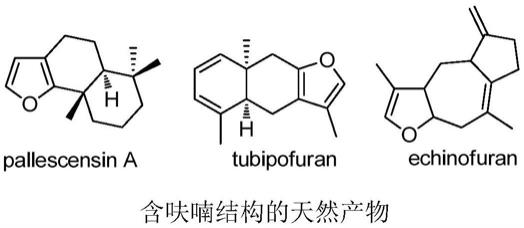
呋喃环作为五元杂环的一个典型代表,广泛地存在于天然产物中。因其固有的生物活性而持续的吸引着有机合成界的注意。近年的研究显示,多取代呋喃化合物在抗病毒、抗菌、抗肿瘤、抗炎杀虫等方面都具有良好的效果。多取代呋喃不仅是天然产物、重要药物的结构单元,而且是有机合成的重要中间体。
[0003][0004]
在众多的合成方法中,过渡金属催化的炔烃环异构化反应是常用的可靠方法之一。2004年,larock等人报道了在金催化催化条件下,2-炔基-2烯酮和各类亲核试剂可以通过“加成—环异构化反应”得到各种多取代呋喃。除了高效的金催化体系外,在加热条件下,廉价的铜盐也能很好地催化此类反应。
[0005][0006]
尽管上述合成方法对各类氧中心亲核试剂具有很好的底物普适性,但对于碳中心亲核试剂,只适用于富电子的吲哚和芳烃类化合物。
技术实现要素:
[0007]
本发明所要解决的技术问题是,克服以上现有技术中只有富电子芳烃和吲哚作为碳中心亲核试剂的缺点,提供一种以碳中心自由基为亲核体,在光/铜共催化条件下合成多取代呋喃的新方法。
[0008]
本发明的技术方案如下:一种光/铜共催化合成多取代呋喃的方法,包括如下步骤:往具有搅拌子的反应管中加入光敏剂、2-炔基-2-烯酮、自由基前体、铜盐、干燥溶剂,氮气保护下置于led灯下照射,室温搅拌反应24h后结束;反应液加饱和na2co3水溶液后用乙酸乙酯萃取,有机相合并用饱和食盐水洗涤,有机相用无水硫酸镁干燥,再过滤得到有机相溶液经旋转蒸发仪除去溶剂;然后再用石油醚和乙酸乙酯的混合液作为淋洗剂进行柱层析分
离,最后经旋转蒸发仪蒸馏得到目标产物多取代呋喃化合物。
[0009]
所述2-炔基-2-烯酮与光敏剂的摩尔比为1︰0.01-0.03。
[0010]
作为优选,所述光敏剂为ir[df(cf3)ppy]2(dtbbpy)pf6。
[0011]
所述2-炔基-2-烯酮与自由基前体的摩尔比为1︰2-4。
[0012]
作为优选,所述自由基前体为烷基双(邻苯二酚)硅酸酯-18-冠醚-6-合钾或4-烷基取代汉斯酯。
[0013]
所述2-炔基-2-烯酮与铜盐的摩尔比为1︰0.1-0.3。
[0014]
作为优选,所述铜盐为三氟甲磺酸铜。
[0015]
所述2-炔基-2-烯酮与干燥溶剂的摩尔比为1︰400-450。
[0016]
作为优选,所述干燥溶剂为二甲基亚砜。
[0017]
作为优选,所述led灯为9w蓝光led灯。
[0018]
作为优选,所述石油醚和乙酸乙酯的混合液中石油醚和乙酸乙酯的体积比为50︰1。
[0019]
作为优选,所述柱层析分离中硅胶柱的长度为10cm。
[0020]
上述反应通式如下:
[0021][0022]
本发明的有益效果是:本发明首次发展了在光/铜共催化的体系下,以自由基为碳中心亲核体,通过和2-炔基-2-烯酮的环合,合成了一系列多取代呋喃;本发明具有底物普适性好、官能团兼容性强、反应条件温和、无外加添加剂等优点。
具体实施方式
[0023]
下面用具体实施例对本发明做进一步详细说明,但本发明不仅局限于以下具体实施例。
[0024]
实施例一
[0025][0026]
往反应管中放入磁子,加入ir[df(cf3)ppy]2(dtbbpy)pf6(4.5mg,0.004mmol,0.02equiv),2-(3,3-二甲基丁炔)-2-环己烯酮(35.2mg,0.2mmol,1.0equiv);将反应管放进手套箱中,在手套箱里称取甲氧基甲基双(邻苯二酚)硅酸酯-18-冠醚-6-合钾(237.1mg,0.4mmol,2.0equiv),三氟甲磺酸铜cu(otf)2(14.4mg,0.04mmol,0.2equiv);称完后将反应管用橡胶塞塞好取出,在氮气下向反应管中加入干燥的二甲基亚砜dmso(6ml,0.033m),用封口膜将橡胶塞封紧。反应管置于9w的蓝色led灯下照射,室温搅拌反应24h后,停止光照反应,反应液加入6ml的饱和na2co3溶液搅拌30min,分层后的水相用乙酸乙酯(4
×
10ml)萃取,有机相合并用5ml的饱和食盐水洗涤,有机相用mgso4干燥15min后过滤,滤液旋蒸除去溶剂,然后用石油醚与乙酸乙酯的混合液(v
石油醚
:v
乙酸乙酯
=50:1)快速柱层析得目标产物38.7mg,收率为87%。分析数据如下:1h nmr(400mhz,cdcl3)δ:5.86(s,1h),3.50-3.47(m,1h),3.38(s,3h),3.35-3.32(m,1h),2.84-2.79(m,1h),2.55-2.53(m,2h),1.95-1.83(m,2h),1.77-1.69(m,1h),1.51-1.45(m,1h),1.25(s,9h);
13
c nmr(100mhz,cdcl3)δ:162.1,149.1,117.9,101.6,76.8,58.8,33.7,32.5,29.2,26.4,23.1,21.1;hrms(esi)[m+na]
+
:calculated for c
14
h
22
nao2:245.1512,found 245.1521.
[0027]
实施例二
[0028][0029]
往反应管中放入磁子,加入ir[df(cf3)ppy]2(dtbbpy)pf6(4.5mg,0.004mmol,0.02equiv),2-苯乙炔-2-环己烯酮(39.2mg,0.2mmol,1.0equiv);将反应管放进手套箱中,在手套箱里称取乙基双(邻苯二酚)硅酸酯-18-冠醚-6-合钾(230.7mg,0.4mmol,2.0equiv),三氟甲磺酸铜cu(otf)2(14.4mg,0.04mmol,0.2equiv);称完后将反应管用橡胶塞塞好取出,在氮气下向反应管中加入干燥的二甲基亚砜dmso(6ml,0.033m),用封口膜将橡胶塞封紧。反应管置于9w的蓝色led灯下照射,室温搅拌反应24h后,停止光照反应,反应液加入6ml的饱和na2co3溶液搅拌30min,分层后的水相用乙酸乙酯(4
×
10ml)萃取,有机相用5ml的饱和食盐水洗一次,合并有机相用mgso4干燥15min,过滤,滤液旋蒸除去溶剂,然后用石油醚与乙酸乙酯的混合液(v
石油醚
:v
乙酸乙酯
=50:1)快速柱层析得目标产物32.6mg,产率为72%。分析数据如下:1h nmr(400mhz,cdcl3)δ:7.62(d,j=5.8hz,2h),7.36-7.32(m,2h),
7.19(t,j=5.9hz,1h),6.55(s,1h),2.68-2.63(m,2h),2.54-2.49(m,1h),2.02-1.95(m,1h),1.94-1.88(m,1h),1.79-1.71(m,2h),1.47-1.35(m,2h),1.00(t,j=5.9hz,3h);
13
c nmr(100mhz,cdcl3)δ:151.5,150.6,131.4,128.5,126.5,123.5,123.2,105.1,34.6,28.5,28.2,23.4,21.4,11.6;hrms(esi)[m+na]
+
:calculated for c
16
h
18
nao:249.1250,found 249.1256.
[0030]
实施例三
[0031][0032]
往反应管中放入磁子,加入ir[df(cf3)ppy]2(dtbbpy)pf6(4.5mg,0.004mmol,0.02equiv),2-苯乙炔-2-环己烯酮(39.2mg,0.2mmol,1.0equiv),4-异丙基汉斯酯(118.1mg,0.4mmol,2.0equiv);将反应管放进手套箱中,在手套箱里称取三氟甲磺酸铜cu(otf)2(14.4mg,0.04mmol,0.2equiv);称完后将反应管用橡胶塞塞好取出,在氮气下向反应管中加入干燥的二甲基亚砜dmso(6ml,0.033m),用封口膜将橡胶塞封紧。反应管置于9w的蓝色led灯下照射,室温搅拌反应24h后,停止光照反应,反应液加入6ml的饱和nacl溶液搅拌5min,分层后的水相用乙酸乙酯(4
×
10ml)萃取,合并有机相用mgso4干燥15min,过滤,滤液旋蒸除去溶剂,然后用石油醚与乙酸乙酯的混合液(v
石油醚
:v
乙酸乙酯
=50:1)快速柱层析得目标产物24.0mg,产率为50%。分析数据如下:1h nmr(400mhz,cdcl3)δ:7.63(d,j=6.6hz,2h),7.36-7.33(m,2h),7.19(t,j=5.9hz,1h),6.54(s,1h),2.69-2.59(m,2h),2.55-2.51(m,1h),2.05-1.98(m,2h),1.79-1.68(m,2h),1.50-1.43(m,1h),1.02(d,j=5.5hz,3h),0.86(d,j=5.5hz,3h);
13
c nmr(100mhz,cdcl3)δ:151.4,151.3,131.5,128.5,126.5,123.2,122.4,105.4,39.4,30.9,24.0,23.4,21.9,20.6,18.3;hrms(esi)[m+na]
+
:calculated for c
17
h
20
nao:263.1406,found 263.1402.
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1