一种四元复合材料及其制备方法和应用与流程
本发明涉及元素分离
技术领域:
,具体涉及一种四元复合材料及其制备方法和应用。
背景技术:
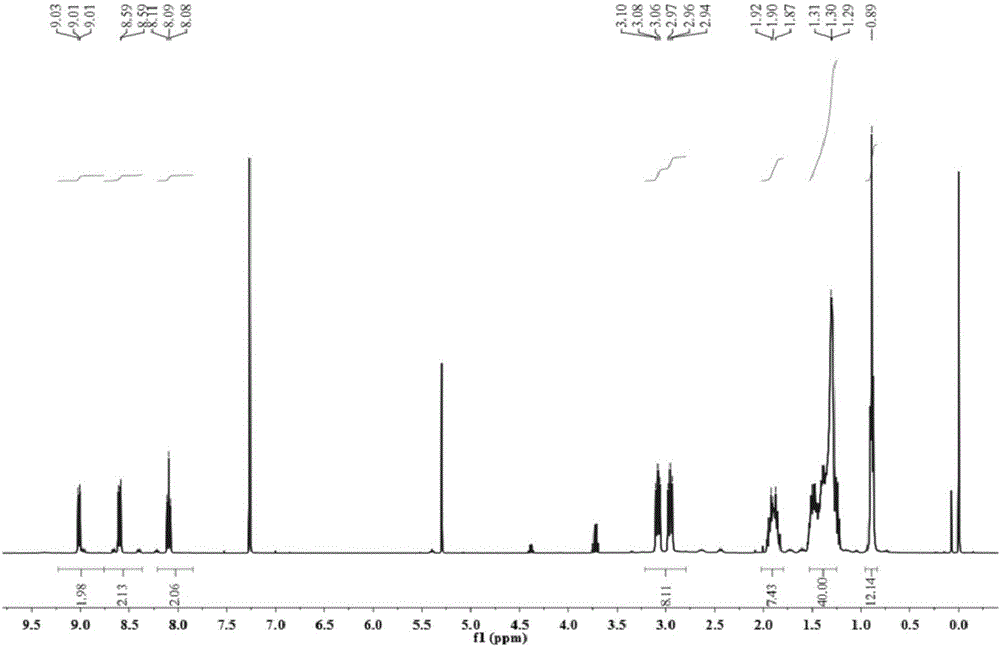
:钴、镍是贵重的有色金属,在国防、航天、原子能、化工、电子等高科技领域都有广泛的用途。钴镍原料除了原生矿物还包括大量的废弃铁镍钴合金,如报废的机器、废旧电池、失效催化剂、废功能合金、冶炼废渣等。废弃铁镍钴合金中含有大量的有价金属镍和钴,对其进行处理回收有利于资源的循环利用,对社会可持续发展具有重要意义。废弃铁镍钴合金的主要来源是废可伐合金电子元件、废高磁合金钢和废镍催化剂等,其常用的处理流程主要包括以下步骤:1)有价金属的酸性浸出,2)浸出溶液的沉淀除铁,3)净化后的钴镍溶液萃取分离,4)反萃、沉淀分别得到钴镍化合物,5)进一步煅烧、氢气还原得到钴粉、镍粉,该处理流程的关键步骤是除铁和钴镍分离。在冶金行业分离工业中,需要将钴镍与铁等其他金属元素进行分离,现有技术中,尚缺乏简单可行的技术手段。技术实现要素:本发明提供了一种四元复合材料及其制备方法和应用,四元复合材料吸附能力强,选择性好,且制备方法简单易行,适用于冶金行业分离工业中将钴和镍同元素铁进行分离后回收利用。一种四元复合材料,以弱极性大孔树脂为载体,载体上同时负载如结构式Ⅰ所示的化合物Ⅰ、如结构式Ⅱ所示的化合物Ⅱ和如结构式Ⅲ所示的化合物Ⅲ;本发明中将三种具有特异性吸附功能的化合物与弱极性大孔树脂相复合,得到的四元复合材料对于钴和镍具有特异性吸附作用,用于从含有碱金属、碱土金属、稀土元素以及典型过渡金属的多元素酸性水溶液中,将钴和镍分离出来。钴和镍的进一步分离可以采用现有技术。作为优选,化合物Ⅰ、化合物Ⅱ和化合物Ⅲ等质量负载在载体上。载体上同时负载相同质量的化合物Ⅰ(双三嗪双吡啶衍生物)、化合物Ⅱ(超分子识别试剂杯[4]单冠醚,正丙基-杯[4]单冠-6,简称BnPCalix[4]MC6)和化合物Ⅲ(2-叔丁基-2环己基-18-冠-6),三种负载物之间相互协同,产生对钴和镍特异性吸附的效果。所述载体为离子交换树脂XAD-7。离子交换树脂XAD-7作为一种已经市场化的弱极性大孔树脂材料,原料易得。作为优选,化合物Ⅰ的与载体的质量比为1:8-10。化合物Ⅱ和化合物Ⅲ的负载量与化合物Ⅰ相同。本发明还提供了一种所述的四元复合材料的制备方法,包括以下步骤:将化合物Ⅰ、化合物Ⅱ和化合物Ⅲ溶于二氯甲烷中,在所得溶液中加入载体混合均匀,经旋蒸干燥后,得到四元复合材料。化合物Ⅰ、化合物Ⅱ和化合物Ⅲ的质量比为1:1:1,每g化合物Ⅰ溶解于450-550mL二氯甲烷中,旋蒸时,使大部分二氯甲烷挥发至近干状态,在毛细作用以及物理吸附作用下,化合物分子进入载体的空隙中,然后将近干状态的物料在50-60℃下真空干燥至少24小时,得到四元复合材料。本发明还提供了一种利用所述的四元复合材料分离钴和镍的方法,将四元复合材料与含有多种金属离子的硝酸水溶液混合,硝酸水溶液中的钴离子和镍离子被四元复合材料吸附分离,所述硝酸水溶液中含有Co(Ⅱ)、Ni(Ⅱ)和其他金属离子,其他金属离子为Li(I)、Na(I)、K(I)、Rb(I)、Ca(Ⅱ)、Mg(Ⅱ)、Ba(Ⅱ)、Nd(Ⅲ)、La(Ⅲ)、Ru(Ⅲ)、Yb(Ⅲ)、Y(Ⅲ)、Fe(Ⅲ)、Zr(Ⅳ)中的至少一种。作为优选,每g四元复合材料与20-30mL硝酸水溶液混合。本发明提供的四元复合材料选择性好,分离效率高,少量使用,即能达到理想的分离效果。为了保证分离效果,优选地,四元复合材料与含有多种金属离子的硝酸水溶液在室温下(25±5℃)混合吸附,吸附时间为120-180min。混合吸附在振荡条件下进行,振荡速率为120-150rpm。在进行元素分离时,硝酸水溶液中硝酸的浓度以及硝酸水溶液中金属离子的浓度均会影响分离效果,优选地,硝酸水溶液中,硝酸的浓度为2-6mol/L。硝酸水溶液中,每种金属离子的浓度为5.0×10-4-1.0×10-3M。本发明提供的四元复合材料吸附能力强,选择性好,且制备方法简单易行,适用于冶金行业分离工业中将钴和镍同元素铁进行分离后回收利用。附图说明图1为实施例1合成的目标产物C8-BTBP的MS-ESI阳离子图谱;图2为实施例1合成的目标产物C8-BTBP的1HNMR图谱;图3为实施例2制备的四元复合材料从硝酸水溶液中分离元素钴和镍的分配系数随硝酸浓度变化的关系图。具体实施方式实施例1C8-BTBP的合成C8-BTBP合成的化学反应方程式如下所示:具体步骤如下:在500mL单口烧瓶中依次加入450.0mL无水四氢呋喃、5.1g化合物9,10-十八-二酮和10.0mL三乙胺,在搅拌条件下加入2.2g化合物[2,2`]-联吡啶-6,6`-二甲酰胺腙,在氮气保护下,69-72℃回流搅拌反应至溶液变澄清(化合物[2,2`]-联吡啶-6,6`-二甲酰胺腙和化合物9,10-十八-二酮以摩尔比1:2.2进行反应,二酮过量)。停止反应后,过滤除去固体残渣,滤液经蒸馏除去无水四氢呋喃,得粗产品,然后用无水乙醚研磨,抽滤除去溶剂得到固体,用石油醚/乙酸乙酯作为流动相(体积比4:1)进行柱色谱技术分离和纯化,得到目标化合物,在60℃下真空干燥5h,最终得到2.5g金黄色固体,产率40.3%。C8-BTBP化合物表征a.C8-BTBP的元素分析,结果见表1。表1C,%H,%N,%理论值75.739.8614.42实验值75.489.8214.64C8-BTBP的分子式为C48H74N8,测得C、H、N实验值与理论值相吻合,说明合成的6,6'-双(5,6-二–辛基-1,2,4-三嗪-3-基)-2,2'-联吡啶(C8-BTBP)是要合成的目标化合物。b.MS-ESI分析,结果见图1。测试了C8-BTBP的MS-ESI阳离子图谱,分析结果表明:[M+H+]=763.6,[M-2H++Na+]=783.0,[M+Na+]=785.5,计算值m/z为762.6。C8-BTBP的理论分子量为762.6,此结果与C8-BTBP分子量的理论值相符。MS-ESI分析说明合成了目标化合物。c.1HNMR分析,结果见图2。测试了合成的C8-BTBP化合物的1HNMR图谱,分析结果表明:(1HNMR(CDCl3,400MHz):δ=0.8-0.9ppm,m,4×CH3,12H;δ=1.2-1.6ppm,m,20×CH2,40H;δ=1.8-1.9ppm,m,4×CH2,8H;δ=2.9-3.0ppm,t,4×CH2,8H;δ=8.1ppm,t,Ar-H,2H;δ=8.7ppm,d,Ar-H,2H;δ=9.0ppm,d,Ar-H,2H。图2中δ=7.2ppm为氘代氯仿的峰,δ=5.3ppm处的单峰是溶剂二氯甲烷中质子形成的峰,化学位移和氢原子个数等指认结果均与C8-BTBP的结构信息相符。实施例2分别将0.2g实施例1制备的C8-BTBP(结构式Ⅰ所示的化合物)、0.2g冠醚(2-叔丁基-2-环己基-18-冠-6,即结构式Ⅱ所示的化合物)以及0.2g杯芳单冠(正丙基-杯[4]-单冠-6,即结构式Ⅲ所示的化合物)固体溶解于100.0mL二氯甲烷中,充分溶解得到淡黄色澄清溶液;向此淡黄色澄清溶液中加入1.8g离子交换树脂XAD-7搅拌均匀,并使用旋转蒸发仪,在减压条件下旋转蒸发使二氯甲烷挥发至物料到近干状态,然后再将近干状态的物料在55℃下真空干燥24h,将三种有机功能配体负载在离子交换树脂XAD-7上,得到四元复合材料。实施例3分别将0.2g实施例1制备的C8-BTBP(结构式Ⅰ所示的化合物)、0.2g冠醚(2-叔丁基-2-环己基-18-冠-6,即结构式Ⅱ所示的化合物)以及0.2g杯芳单冠(正丙基-杯[4]-单冠-6,即结构式Ⅲ所示的化合物)固体溶解于90.0mL二氯甲烷中,充分溶解得到淡黄色澄清溶液;向此淡黄色澄清溶液中加入1.6g离子交换树脂XAD-7搅拌均匀,并使用旋转蒸发仪,在减压条件下旋转蒸发使二氯甲烷挥发至物料到近干状态,然后再将近干状态的物料在50℃下真空干燥24h,将三种有机功能配体负载在离子交换树脂XAD-7上,得到四元复合材料。实施例4分别将0.2g实施例1制备的C8-BTBP(结构式Ⅰ所示的化合物)、0.2g冠醚(2-叔丁基-2-环己基-18-冠-6,即结构式Ⅱ所示的化合物)以及0.2g杯芳单冠(正丙基-杯[4]-单冠-6,即结构式Ⅲ所示的化合物)固体溶解于110.0mL二氯甲烷中,充分溶解得到淡黄色澄清溶液;向此淡黄色澄清溶液中加入2.0g离子交换树脂XAD-7搅拌均匀,并使用旋转蒸发仪,在减压条件下旋转蒸发使二氯甲烷挥发至物料到近干状态,然后再将近干状态的物料在60℃下真空干燥24h,将三种有机功能配体负载在离子交换树脂XAD-7上,得到四元复合材料。实施例5-11(1)将碱金属硝酸盐LiNO3、NaNO3、KNO3、RbNO3;碱土金属硝酸盐Mg(NO3)2、Ca(NO3)2、Ba(NO3)2;Ru的硝酸盐溶液;过渡金属盐Fe(NO3)3、ZrO(NO3)2、Co(NO3)2、Ni(NO3)2以及稀土金属氧化物Y2O3、稀土金属硝酸盐La(NO3)3、Yb(NO3)3、Nd(NO3)3溶解于去离子水中配制成硝酸浓度为4.0M且同时含有16种金属元素的硝酸水溶液,该硝酸水溶液中所含的16种金属离子的浓度分别约为2.0×10-3-5.0×10-3M。(2)在硝酸水溶液中加入浓硝酸和去离子水进行稀释,调节硝酸水溶液中的硝酸浓度分别为0.4、1.0、2.0、3.0、4.0、5.0、6.0M,每种金属离子的浓度为5.0×10-4M。(3)将实施例2制备得到的四元复合材料与步骤(2)得到的不同硝酸浓度的硝酸水溶液分别进行混合,混合时的用量比为:每3.0mL硝酸水溶液对应0.15g四元复合材料。(4)将步骤(3)所得混合液在TAITECMM-10型振荡器上进行震荡使固液相充分接触,振荡器振荡速率为120rpm,温度为298K,为使吸附达到平衡,振荡时间设置为120min,然后用等离子体电感耦合原子发生光谱(ICP-OES)和原子吸收光谱(AA240)对吸附前后水相中各元素的含量进行检测。实施例5-11的吸附结果如图3所示,当硝酸浓度为2.0mol/L时,该四元复合材料同时吸附分离元素钴和镍的能力最强,分配系数大于10000cm3/g,即水相中所含的钴和镍吸附率为100%。与此同时,该四元复合材料对其他14种共存离子的吸附分配系数均小于20cm3/g,此结果表明该四元复合材料在硝酸浓度大于2.0M条件下,能够高效地高选择性地将钴和镍与其他金属,例如铁、碱金属、碱土金属、过渡金属以及稀土元素相分离,应用前景广阔。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1