基于微电火花空化的细胞分选装置和方法与流程
本发明涉及分析技术领域,具体地,涉及细胞分选系统以及进行细胞分选的方法,更具体地,涉及用于流式细胞仪的微电火花空化分选方法。
背景技术:
流式细胞仪能够对细胞群体中每一个细胞(或生物微粒)的生物物理和生物化学信息进行快速检测。有鉴于此,其被广泛应用于科学研究、临床检测和生产活动中。流式细胞仪可以分为分析型和分选型两种。其中,分选型流式细胞仪不仅能够检测和分析细胞,还能够根据分析结果将特定细胞分选出来,因而其功能更为丰富、应用也更为广泛。
然而,目前的细胞分选系统以及进行细胞分选的方法仍有待改进。
技术实现要素:
本发明是基于发明人对于以下事实和问题的发现和认识作出的:
发明人发现,目前的流式细胞仪分选普遍采用的是静电场分选法。这种分选方式存在体积大、静电电压高、易产生气溶胶污染、细胞收集时对细胞的机械冲击力大等问题。发明人经过深入研究以及大量实验发现,这主要是由于采用静电场分选法的流式细胞仪需要设置一对体积大的(十几公分长)的平板电极,以便形成用于分选的静电场。上述静电场需要在平板电极上施加正负数千伏电压,因此不利于仪器的小型化,更具有较高的安全隐患。
本发明旨在至少一定程度上缓解或解决上述提及问题中至少一个。
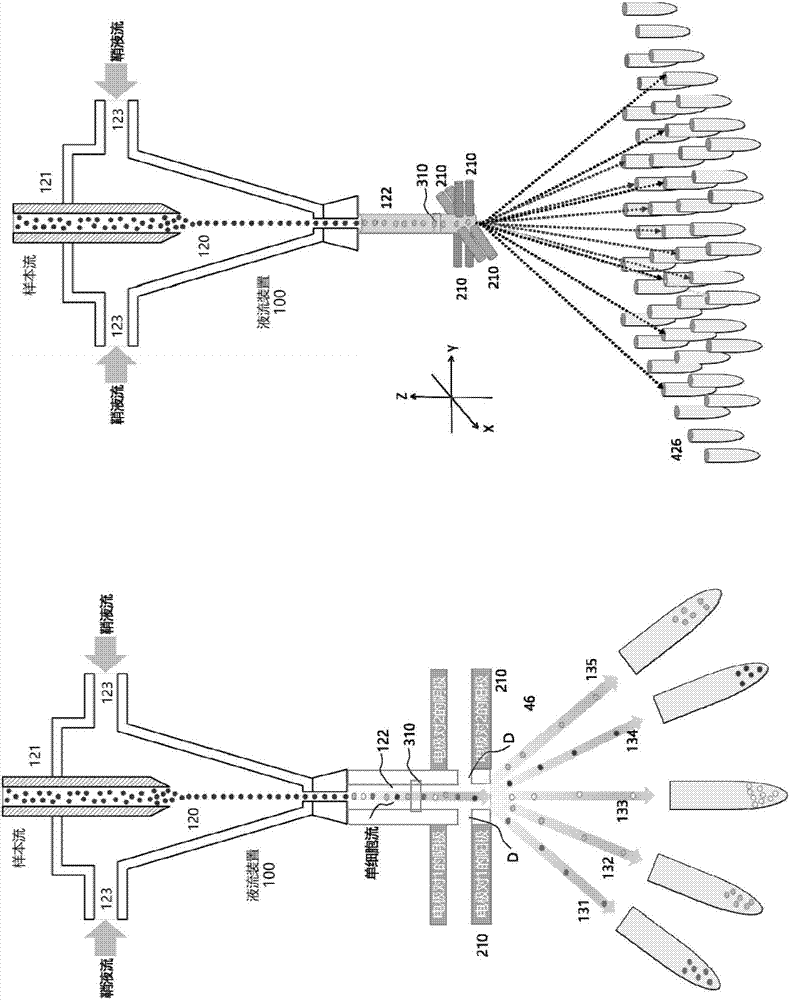
有鉴于此,在本发明的一个方面,本发明提出了一种细胞分选系统。该细胞分选系统包括:液流装置,所述液流装置具有液流入口以及多个分选出口;以及细胞分选装置,所述细胞分选装置包括分选电极对,所述分选电极对设置在所述液流入口以及多个所述分选出口之间,所述电极对被设置为能够利用脉冲电压产生分选力。由此,该细胞分选系统的体积减小,安全性提高,可实现高速、高通量、高精度的单细胞分选。
根据本发明的实施例,所述液流装置进一步包括流动室,所述流动室包括:主流道,所述主流道的一端与所述液流入口相连,另一端与多个所述分选出口相连。由此,可以进一步提高利用该细胞分选系统进行分选的性能。
根据本发明的实施例,所述分选电极对包括阳极以及阴极,所述阴极以及所述阳极位于所述主流道的同侧。由此,可以进一步提高利用该细胞分选系统进行分选的性能。
根据本发明的实施例,所述待分选细胞液受到所述分选力作用的流程为10-500微米。由此,可以限定分选冲力作用的空间,进而提高空间分辨率,实现高速、高通量分选。
根据本发明的实施例,所述液流装置包括微流体芯片,所述微流体芯片包括:芯片基板,所述芯片基板上设置有所述流动室;样本流微流道,所述样本流微流道设置在所述芯片基板上且与所述流动室相连;鞘液流微流道,所述鞘流液微流道设置在所述芯片基板上且与所述流动室相连;多个分选流道,所述多个分选流道分别与所述流动室相连,其中,所述分选电极对为面电极,所述分选电极对设置在所述芯片基板上。该微流体芯片具有下一优点的至少之一:体积小、便于集成、安全性提高、具有高时间分辨率与高空间分辨率,从而可以实现高速、高通量、高精度的单细胞分选。
根据本发明的实施例,该细胞分选系统进一步包括:检测装置,所述检测装置与所述细胞分选装置相连,所述检测装置被设置为能够逐一判定通过所述细胞分选装置的细胞是否为目标细胞。由此,可以进一步提高该细胞分选系统的性能。
在本发明的另一个方面,本发明提出了一种由前面所述的细胞分选系统进行细胞分选的方法,该方法包括:将待分选细胞液供给至液流装置中;利用细胞分选装置产生分选力,并作用于所述待分选细胞液,以便实现细胞分选。由此,该细胞分选的方法具有前面描述的细胞分选系统所具有的全部特征以及优点,在此不再赘述。
根据本发明的实施例,所述细胞分选是通过以下步骤实现的:在分选电极对上施加脉冲电压进行微电火花放电,微电火花放电击穿所述分选电极对之间的介质,以便产生所述分选力,使所述分选力作用于所述目标细胞,以便改变所述目标细胞的流动方向。由此,可以提高分选响应速度,既可以改变目标细胞的运动方向,实现对目标细胞的分选,也可以改变除目标细胞以外的细胞(非目标细胞)的运动方向,从而实现非目标细胞的分选。
根据本发明的实施例,所述脉冲电压的幅值为100-1000v、脉冲时长为100ns-100μs。由此,可以通过调节脉冲电压和脉冲时长,能够改变分选冲力或吸力作用的大小,从而实现多路分选。
附图说明
图1显示了根据本发明一个实施例的细胞分选系统的结构示意图;
图2显示了根据本发明一个实施例的细胞分选系统的部分结构示意图;
图3显示了根据本发明另一个实施例的细胞分选系统的部分结构示意图;
图4显示了根据本发明一个实施例的细胞分选系统的结构示意图;
图5显示了根据本发明一个实施例的基于微电火花空化分选的原理示意图;
图6显示了根据本发明一个实施例的利用冲力实现细胞分选的原理示意图;
图7显示了根据本发明一个实施例的利用吸力实现细胞分选的原理示意图;
图8显示了根据本发明一个实施例的利用冲力和吸力实现一个维度上细胞多路分选的原理示意图;
图9显示了根据本发明一个实施例的利用冲力实现一个维度上细胞多路分选的示意图;
图10显示了根据本发明一个实施例的利用冲力和吸力实现一个或两个维度上细胞多路分选的示意图;
图11显示了根据本发明一个实施例的利用冲力实现一个或两个维度上细胞多路分选的示意图;
图12显示了根据本发明一个实施例的微流体芯片的结构示意图;
图13显示了根据本发明一个实施例的利用微流体芯片实现细胞分选的原理示意图;
图14显示了根据本发明一个实施例的细胞分选方法的流程的示意图;
图15显示了根据本发明一个实施例的微流体芯片实物图;
图16显示了根据本发明实施例2中利用冲力实现分选过程的光学显微照片;以及
图17显示了根据本发明实施例2中利用冲力或吸力实现分选过程的光学显微照片。
附图标记说明:
100:液流装置;110:液流入口;120:流动室;121:样本流入口;122:主流道;123:鞘液流入口;130:分选出口;200:细胞分选装置;210:分选电极对;211:阳极;212:阴极;220:分选作用区域;300:检测装置;310:检测区域;400:微流体芯片;410:芯片基板;420:样本流微流道;430:鞘液微流道;440:分选流道。
具体实施方式
下面详细描述本发明的实施例,所述实施例的示例在附图中示出。下面通过参考附图描述的实施例是示例性的,旨在用于解释本发明,而不能理解为对本发明的限制。
在本发明的一个方面,本发明提出了一种细胞分选系统。根据本发明的实施例,参考图1,该细胞分选系统包括:液流装置100以及细胞分选装置200。根据本发明的实施例,该液流装置100具有液流入口110以及多个分选出口130,该液流装置100用于为待分选的细胞液提供流动通路并将细胞前后排列,尽量使同一时刻仅有一个细胞通过分选装置的作用区域,形成单细胞的样本流,以便在细胞液流动过程中,准确地实现对目标细胞的分选。根据本发明的实施例,细胞分选装置200包括分选电极对210,分选电极对210被设置为能够利用脉冲电压进行微电火花放电进而产生空化气泡,利用空化气泡扩张与溃灭时产生的分选力(空化气泡扩张时的分选冲力或空化气泡溃灭时的分选吸力)对待分选细胞液进行分选。该细胞分选系统的体积减小,安全性提高,可实现高速、高通量、高精度的单细胞分选。
下面根据本发明的具体实施例,对该细胞分选系统的各个装置进行详细说明:
根据本发明的实施例,参考图2,液流装置100进一步包括流动室120,流动室120包括:主流道122。根据本发明的实施例,液流入口110以及多个分选出口130分别独立地与流动室120相连,主流道122的一端与液流入口110相连,另一端与多个分选出口130相连。需要说明的是,在本发明中,液流装置100的具体结构不受特别限制,只要能够实现为细胞液的流动以及分选提供流动通路即可,本领域技术人员可以根据实际情况,对液流装置100的具体结构进行设计。或者,可以选择目前的流式细胞仪所具有的常规的液流装置,形成根据本发明实施例的液流装置100。
根据本发明的实施例,流动室120可以进一步包括:样本流入口121以及鞘液流入口123。根据本发明的实施例,当只有样本流(含有待分选细胞的细胞液)流入时,仅需要一个入口作为样本流入口121。当样本流需要流体动力聚焦时,需要另外加入一个或多个入口用于鞘液流流入。也即是说,流动室120还可以包括多个鞘液流入口123。根据本发明的实施例,包含细胞的样本流由样本流入口121流入流动室120中,鞘液从鞘液流入口123流入流动室120中,鞘液流将包含细胞的样本流包裹,鞘液流和样本流一同流入主流道122中,同时在流体动力聚焦的作用下样本流被鞘液流聚焦在主流道122的中心位置,形成单细胞轴流。也即是说,细胞在主流道122中一个一个前后排列。主流道122的一端与流动室120相连,另一端与多个分选出口130相连。由此,可以进一步提高利用该细胞分选系统进行分选的性能。
根据本发明的实施例,参考图3,细胞分选装置200包括:分选电极对210。分选电极对210设置在流动室120末端的主流道122以及多个分选出口130之间。根据本发明的实施例,分选电极对210进一步包括:阳极211以及阴极212。根据本发明的实施例,分选电极对210的具体数量不受特别限制,本领域技术人员可以根据实际情况进行选择,例如,可以为一对(参考图1),也可以为两对(参考图3)。分选电极对210被设置为能够利用脉冲电压,对经过细胞分选装置200的待分选细胞液产生分选力(可以为冲力,也可以为吸力)。由此,该细胞分选装置可实现高速、高通量、高精度的单细胞分选。
本领域技术人员能够理解的是,为了实现目标细胞的识别,参考图4,该系统该可以进一步包括检测装置300。检测装置300用于逐一判定样本流中的细胞是否为目标细胞。具体地,在将待分选细胞液供给至液流装置100之前,预先采用诸如荧光标记物等,对细胞进行标记,当经过标记的样本流流经检测区域时,激光器1和激光器2发出激光,照射样本流中的待分选细胞等微粒并产生光信号。光信号经滤镜和二向色镜(接收侧向散射光),传输至检测装置300(可报考荧光检测以及pc段等部件)中进行检测分析,从而识别出目标细胞。根据本发明的实施例,检测装置300也可利用诸如电阻抗测量等方式,识别目标细胞和非目标细胞。当检测到流经分选电极对210作用区域中的细胞为目标细胞时,利用分选电极对210产生分选力(冲力或吸力),目标细胞受分选力作用改变了运动方向,从而落入到收集管中,非目标细胞没有受到分选力的作用从而落入到废品管中。由此,可以实现目标细胞与非目标细胞的分选。
为了方便理解,下面首先对利用分选电极对210产生分选力的原理进行简要说明:
参考图5,当分选电极对210(包括阳极211以及阴极212)间的电场强度大于介质的击穿场强时,从阴极溢出的电子16被加速,并且向阳极冲击17,也就是说,分选电极击穿了分选电极对210之间的介质。在电子向阳极211运动的过程中,由于电子和介质的中性分子的撞击会形成更多的电子16和正离子15,从而使电极间的带电粒子雪崩式地增加,并在电极间形成导电通道18。在介质被击穿的过程中,粒子间、粒子与电极间的撞击产生的热量使得导电通道和对应的电极部位及它们周边的有限空间内形成了局部高温,电极周围的介质及电极材料被瞬间气化、体积膨胀从而产生空化气泡19,空化气泡向外膨胀发出冲击波,既分选冲力20。该分选冲力可以改变电极间生物微粒(如细胞、蛋白、病毒等其它生物微粒)的运动方向。停止通电后,由于空化气泡缺乏能量输入同时伴随着空化气泡自身能量向周围环境的迅速消散,空化气泡19的内部压力小于环境压力,从而迅速发生溃灭并引发周围液体介质填充空化气泡溃灭后空余的空间,并对外产生一个瞬间的分选吸力21,利用这个吸力同样可以改变电极间生物微粒的运动方向。在空化气泡溃灭的过程中伴随着电极间的介质消电离并重新绝缘,进而为下一次分选做好准备。与传统的静电场分选相比,利用脉冲电压产生的冲力所需要的电压值更小,且无需持续对分选电极板施加电压,仅需在需要进行分选时对电极施加脉冲电压,产生足以改变细胞或粒子运动方向的冲力或吸力即可。由此,可以大幅降低分选电极对的电极长度(用以形成长距离的静电场,一般长达十几厘米)以及分选所需的电压值(传统静电场分选需要提供数千伏的电压),从而可以提高利用该分选系统的安全性能,并可以大幅降低该系统的体积。
根据本发明的具体实施例,分选电极对210设置在主流道122的同侧。参考图6,当分选电极对210上未施加脉冲电压时,单细胞流在主流道122中保持原有流动方向。当需要产生冲力20时,在分选电极对210上施加脉冲电压,产生的空化气泡19向外发出冲击波,既冲力20。冲力20作用于此时流经主流道122的单个目标细胞31,使目标细胞向远离电极的方向运动。由此,可以实现细胞分选的功能。参考图7,当需要产生吸力21时,在分选电极对210上施加脉冲电压,空化气泡19先膨胀生长,待空化气泡扩张结束后会瞬间溃灭,此时周围的液体介质迅速填充空泡,并产生指向空泡的反向冲击波,既吸力21。吸力21作用于此时流经主流道122的单个目标细胞31,使目标细胞向靠近电极的方向运动。由此,可以实现反向的细胞分选的功能。两种分选分别利用了空化气泡在膨胀过程中产生的冲力和之后溃灭过程中产生的吸力,实现了对分选方向的控制。本领域技术人员能够理解的是,此时是利用分选电极对210之间产生的冲力或吸力实现细胞分选,因此,需要使得电极间产生的冲力或吸力,可以作用于主流道122。例如,可以在分选电极对的位置,在主流道122中设置一个对应的开口。当目标细胞流经分选装置的开口时,向电极对210施加脉冲电压,击穿电极对之间的介质,产生分选力(冲力或吸力),该分选力传递到主流道122中,并作用于目标细胞,使目标细胞的运动方向改变,从而实现分选。本领域技术人员能够理解的是,击穿过程中形成的导电通道仅存在于正负电极之间的局部位置,例如,击穿流经分选电极对之间的液体介质,击穿过程中产生的电流不会通过主流道中的液体,包括其中的细胞流(因为液体是不良导体,如蒸馏水或常用的pbs溶液),仅仅是利用空化气泡膨胀或溃灭时的机械力进行分选,因而不会对细胞产生损害。由此,可以在保证细胞活性的前提下,实现细胞分选。并且,通过调节在分选电极对210上施加的脉冲电压的幅值等参数改变单次分选中空化气泡的大小和释放的能量,可以调控产生的分选力的大小,通过控制分选的时机以利用空化气泡膨胀是的冲力或溃灭时的吸力,可以实现对分选力方向的调控。参考图8,通过调控施加在分选电极对210上的脉冲电压的参数以及控制分选的时机,可以将目标细胞分选至不同的位置上,进而实现同时对多种细胞进行分选,例如图8中所示,可以通过设置一对分选电极对(阳极211以及阴极212)实现131-135共5路分选)。类似地,参考图9,可以通过设置两对分选电极对(电极对1的阴极和阳极,电极对2的阴极和阳极),仅利用分选冲力实现一个维度上细胞分选方向的控制,并控制冲力的能量大小,同样可以实现同时对多种细胞进行分选(如图9中所示实现131~135共5路分选)。
根据本发明的实施例,为了实现目标细胞的分选,需要控制施加的电压脉冲的幅值与时长。电压脉冲的幅值与时长和分选的效果有关,电压脉冲的幅值过高,会造成耗电量增大以及冲击力过强;幅值过低,会造成介质无法被击穿,进而无法实现分选。施加电压脉冲时间过长,会伴随液体电解,造成大量电解气泡的产生,影响分选效果(气泡积累过多后会发生微爆炸);时间过短会造成冲击力度不够。根据本发明的实施例,电压脉冲的幅值、时长与电极间液体的种类有关。根据本发明的具体实施例,当电极间隙是200μm,电极间介质为pbs溶液,细胞液中细胞流速是5m/s时,施加电压脉冲的幅值可以是100-1000v,时长可以是100ns-100μs,单次分选(分选开始至液流重新恢复稳定的时间长度)用时0.25ms,由此,分选速率最高可达到4000个每秒。
根据本发明的实施例,参考图3,待分选细胞液受到分选力作用的流程可以为10-500μm。需要说明的是,在本发明中,“分选力作用的流程”为细胞液在流动过程中,能够受到分选力的流动距离。具体的,分选力作用的流程可以是如图3中的长度d(电极腔室与主流道联通处的长度)。根据本发明的实施例,长度d可以是200μm。由此,可以限定分选力作用的空间,进而提高空间分辨率,实现高速、高通量、高精度的单细胞分选。与现有的利用静电场实现分选的细胞分选系统相比,传统静电分选的电压高,在静电场中分离,需要两个电极之间具有足够的距离且电极需要达到足够的长度,一般长达十几厘米。本申请采用的是瞬间的冲力或吸力作用于单细胞流实现细胞分选,因此,仅需保证单细胞流在一定距离内,受到分选力,即可实现目标细胞的分离。因此,距离可以较短。也即是说,电极以及分选作用力的流程可以仅为百微米乃至十微米的尺度,同时,电压低,安全性能高,利于集成。
根据本发明的实施例,为了进一步提高利用该系统进行分选的效率以及效果,还可以设置多个分选电极对210。将多个分选电极对设置在不同的方向,能够使得单细胞流受到不同方向的作用力,从而能够实现多路分选。参考图10,当具有一对分选电极对210时,同时利用冲力和吸力进行分选,可以实现一个维度的m路分选(如图10所示,m=5),然后将细胞分选到不同的采集管当中;当具有两对分选电极对210时,同时利用冲力和吸力进行分选,其中第一对分选电极对210在x轴方向上可以实现m路分选,第二对分选电极对210在y轴方向上可以实现n路分选,两对分选电极一起作用时,可以实现m×n路分选(如图10所示,m=7,n=7),然后将细胞分选到不同的采集管当中。参考图11,当具有两对分选电极对210时,只利用冲力进行分选,也可以实现一个维度的m路分选(如图11所示,m=5),然后将细胞分选到不同的采集管当中;当具有4对分选电极对210时,只利用冲力进行分选,其中第两对分选电极对210在x轴方向上可以实现m路分选,另外两对分选电极对210在y轴方向上可以实现n路分选,四对分选电极一起作用时,可以实现m×n路分选(如图11所示,m=7,n=7),然后将细胞分选到不同的采集管当中。
根据本发明的实施例,上述细胞分选系统利于集成。因此,该细胞分选系统可以用于采用微流体芯片400的液流装置100。根据本发明的实施例,参考图12,微流体芯片400上设置有流动室120,微流体芯片400包括:芯片基板410、样本流微流道420、鞘液流微流道430、多个分选流道440。也即是说,可以采用微流体芯片,替代传统的流动室,从而有利于进一步提高该细胞分选系统的集成程度。根据本发明的具体实施例,微流体芯片400可以包括样本流微流道420以及多个鞘液流微流道430,以便向该微流体芯片400供给待分选细胞液以及鞘液。样本流微流道420设置在芯片基板410上且与流动室120相连,样本流微流道420用于为待分选的样本流提供流动通道,鞘液微流道430设置在芯片基板410上且与流动室120相连,鞘液流微流道430为鞘液流提供流动通道。根据本发明的实施例,包含细胞的样本流从样本流微流道420进入流动室120中,鞘液从鞘液微流道430进入流动室120中,鞘液流将样本流包裹,鞘液流和样本流一同流入主流道122中,同时在流体动力聚焦的作用下样本流被鞘液流聚焦在主流道122的中心位置,形成单细胞轴流,细胞会全部都按照流动方向呈一条直线并且单一的流经主流道122,由此有利于提高分选效果。当然,根据实际情况,样本流也可以仅完成一个维度的聚焦,既样本流仅被聚焦在主流道122的水平中心或垂直中心。本领域技术人员可以理解的是,上述鞘液的具体种类不受特别限制,只需实现细胞分选的功能即可。例如,鞘液可以为蒸馏水、去离子水、pbs缓冲液。需要说明的是,在本发明中,液流装置100的具体结构不受特别限制,只要能够实现对样本流中的细胞聚焦并形成单细胞流便可,本领域技术人员可以根据实际情况,对液流装置100的具体结构进行设计。根据本发明的实施例,在检测区域310中实现对目标细胞的识别,检测利用芯片外部的光学系统通过检测荧光标记物的手段实现,检测区域310有照射细胞的激光光斑。分选电极对210也可以设置在芯片基板410上,用于对细胞的运动方向进行改变,从而实现分选。根据本发明的实施例,分选电极的具体类型不受特别限制,只要满足实现细胞分选的功能即可。例如,可以为面电极,由此可以利于集成在微流体芯片上,实现该微流体芯片的扁平化。根据本发明的实施例,多个分选流道440分别与流动室120相连,用于对已经改变运动方向的细胞进行收集,实现分选。根据本发明的实施例,参考图13,可以利用微流体芯片进行多路细胞分选,关于利用冲力或吸力进行分选的原理,前面已经进行了详细的描述,在此不再赘述。微流体芯片能够在完全封闭的流道内实现分选,避免了气溶胶污染,有利于保护操作人员的健康安全。低成本的微流体分选芯片能够实现一片一用,既每次检测中都用一个全新的芯片,能够从根本上避免交叉污染,提高检测和分选的准确度。总的来说,该微流体芯片具有下一优点的至少之一:体积小、便于集成、安全性提高、具有高时间分辨率与高空间分辨率,从而可以实现高速、高通量、高精度的单细胞分选。
需要说明的是,上述系统不仅可以用于分选细胞,还可以用于实现诸如蛋白、病毒以及其他生物微粒的分选。也即是说,样本流中可以包括细胞、蛋白、病毒等其它生物微粒的至少之一。
在本发明的另一个方面,本发明提出了一种由前面所述的细胞分选系统进行细胞分选的方法。根据本发明的实施例,该方法包括:将待分选细胞液供给至液流装置中,利用细胞分选装置产生分选力,使分选力作用于待分选细胞液,改变目标细胞的流动方向,从而实现细胞的分选。具体地,参考图14,该方法可以包括:
s100:将包含细胞的样本流输入到液流系统中
在该步骤中,将待分选的包含细胞的样本流输入到液流装置100中。如前所述,在将样本流输入到液流装置100之前,在预先采用诸如荧光物质等标记物,对细胞进行标记,以便于通过荧光检测的手段识别目标细胞,当然也可以通过其他手段识别目标细胞,如电阻抗测试。根据本发明的实施例,样本流的具体类型不受特别限制,例如可以为细胞、蛋白、病毒等其它生物微粒。
s200:检测装置对细胞逐一进行识别
在该步骤中,利用检测装置300对细胞逐一进行识别,判别细胞的种类,以确定被检测的细胞是否被分选(是否为目标细胞),如果是多路分选,还需要根据细胞的具体类型判定该目标细胞需要被分选到哪一个具体流道中。根据本发明的具体实施,在待分选的包含细胞的样本流供给至液流装置之后,在鞘液流的作用下形成单细胞流。单细胞流流经分选装置之前,预先对细胞液进行识别,以便分辨出目标细胞以及非目标细胞。根据本发明的实施例,进行细胞识别的具体方法不受特别限制,例如,可以通过激光照射检测细胞的荧光和散射光信号,或是检测细胞的阻抗实现目标细胞以及非目标细胞的识别。
s300:利用微电火花空化产生的冲力或吸力实现细胞分选
在该步骤中,基于前面的检测结果,使细胞分选装置200产生分选冲力或吸力,并作用于待分选细胞液,以便实现细胞分选。关于利用分选冲力或吸力进行分选的原理,前面已经进行了详细的描述,在此不再赘述。总的来说,在该步骤中,对分选电极对210施加脉冲电压,使分选电极对210击穿电极对之间的介质并产生空化气泡,利用瞬间空化气泡膨胀的冲力或溃灭时的吸力改变粒子的流动方向,从而将目标细胞从细胞流中分选出来。
具体的,将分选电极对设置在主流道122的同侧,单细胞流在主流道122中流动,通过检测装置300识别出单细胞流中的目标细胞。当目标细胞流经分选装置200,在分选电极210对上施加脉冲电压,击穿电极对之间的介质,介质在被击穿过程中,电极间产生空化泡,空化泡膨胀在四周产生冲击力,该冲击力传递到主流道122中,并作用于目标细胞,使目标细胞向远离电极的方向运动,从而实现分选;或者在目标细胞通过分选装置之前就击穿液体产生空化气泡,当目标细胞通过分选装置时的同时空化气泡溃灭并在四周产生吸力,该吸力传递到主流道122中,并作用于目标细胞,使目标细胞向靠近电极的方向运动,从而实现反向分选。
本领域技术人员能够理解的是,击穿过程中形成的导电通道仅存在于正负电极之间的局部位置,击穿过程中产生的电流不会通过主流道中的液体,包括其中的细胞流(因为液体是不良导体,如蒸馏水或常用的pbs溶液),仅仅是利用空化气泡膨胀或溃灭时的机械力进行分选,因而不会对目标细胞产生损害。由此,可以在保证目标细胞活性的前提下,实现细胞分选。并且,通过调节在分选电极对210上施加的脉冲电压的幅值等参数改变单次分选中空化气泡的大小和释放的能量,可以调控产生的分选力的大小,通过控制分选的时机以利用空化气泡膨胀是的冲力或溃灭时的吸力,可以实现对分选力方向的调控。通过调控施加在分选电极对210上的脉冲电压的参数以及控制分选的时机,可以将目标细胞分选至不同的位置上,进而实现同时对多种细胞进行分选。类似地,可以通过设置多个分选电极对210,仅利用分选冲力实现对细胞分选方向的控制,同样可以实现同时对多种细胞进行分选。
根据本发明的具体实施例,上述细胞分选可以是通过以下步骤实现的:
将分选电极对设置在主流道的同侧。在目标细胞流经设置有该分选电极对的主流道相对应的区域时,对电极对间的液体介质进行击穿并产生空化气泡,利用瞬间空化气泡膨胀的冲力或溃灭时的吸力实现对目标细胞运动方向的定向和定量改变,从而完成分选。该分选冲力或吸力作用于目标细胞,改变该目标细胞的运动方向。如前所述,每次施加脉冲电压,只改变待分选单细胞流中的一个细胞的流动方向,由此实现单细胞分选功能。也即是说,当含单细胞流中的目标细胞流经与分选电极对相对应的区域时,施加脉冲电压,击穿电极对之间的介质并产生空化气泡,空化气泡瞬间膨胀产生冲击波,并形成一个朝向主流道方向的冲击力,该冲击力作用于目标细胞,改变目标细胞流动方向,从而实现分选;或者在目标细胞通过分选装置之前就击穿液体产生空化气泡,当目标细胞通过分选装置时的同时空化气泡溃灭并在四周产生吸力,该吸力传递到主流道中,并作用于目标细胞,使目标细胞向靠近电极的方向运动,从而实现反向分选。
根据本发明的实施例,脉冲电压的幅值为100-1000v、脉冲时长为100nm-100μs。根据本发明的实施例,为了实现目标细胞的分选,需要控制施加的电压脉冲的幅值与时长,电压脉冲的幅值与时长和分选的效果有关,电压脉冲的幅值过高,会造成耗电量增大以及冲击力过强;幅值过低,会造成介质无法被击穿,进而无法实现分选。施加电压脉冲时间过长,会伴随液体电解,造成大量电解气泡的产生,影响分选效果(气泡积累过多后会发生微爆炸);时间过短会造成冲击力度不够。根据本发明的实施例,电压脉冲的幅值、时长与电极间液体的种类有关。根据本发明的具体实施例,当电极间隙是200μm,电极间介质为pbs溶液,细胞液中细胞流速是5m/s时,施加电压脉冲的幅值可以是100-1000v,时长可以是100ns-100μs,单次分选(分选开始至液流重新恢复稳定的时间长度)用时0.25ms,由此,分选速率最高可达到4000个每秒。
综上所述,由前面所述的细胞分选系统进行细胞分选的方法具有以下优点的至少之一:安全性提高,时间、空间分辨率高,可实现高速、高通量、高精度的单细胞分选。
下面将结合实施例对本发明的方案进行解释。本领域技术人员将会理解,下面的实施例仅用于说明本发明,而不应视为限定本发明的范围。实施例中未注明具体技术或条件的,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。所用试剂或仪器未注明生产厂商者,均为可以通过市购获得的常规产品。
实施例1
采用图2所示的传统流式细胞仪采用的液流装置,同一对分选电极对设在主流道的同侧,通过击穿电极对间的介质并产生空化气泡,利用瞬间空化气泡膨胀的冲力或溃灭时的吸力实现对目标细胞运动方向的定向和定量改变,从而完成分选。参考图10,电极对210和主流道122相通的长度d(如图3中所示长度d)为200μm,主流道122的水力内径为200μm,位于主流道122中心的单细胞流的速度为5m/s,施加电压脉冲的幅值100-1000v、时长100ns-100μs,理论可达到的极限分选速度可以为25000个每秒(=流速/通口高度=5m/s÷200μm)。通过流式细胞检测装置300确定细胞的分类后,通过控制脉冲电压以及目标细胞通过分选作用区域的时机来调控力脉冲的大小和方向。当具有一对分选电极对210时,同时利用冲力和吸力进行分选,可以实现一个维度的5路分选,可将各个细胞分选至不同的空间位置131-135,细胞进入到空气46中,最终落入到不同的采样管中,从而实现对细胞群的多路分选;当具有2对分选电极对210时,同时利用冲力和吸力进行分选,其中第一对分选电极对210在x轴方向上可以实现7路分选,第二对分选电极对210在y轴方向上可以实现7路分选,两对分选电极一起作用时,可以实现7×7路分选,然后将细胞分选到不同的采集管当中。参考图11,当具有2对分选电极对210时,只利用冲力进行分选,也可以实现一个维度的5路分选,然后将细胞分选到不同的采集管当中;当具有4对分选电极对210时,只利用冲力进行分选,其中第两对分选电极对210在x轴方向上可以实现7路分选,另外两对分选电极对210在y轴方向上可以实现7路分选,四对分选电极一起作用时,可以实现7×7路分选,然后将细胞分选到不同的采集管当中。
实施例2
微流体芯片400的液流装置100,参考图15微流体芯片400包括:芯片基板410、样本流微流道420、鞘液流微流道430、多个分选流道440、流动室120、主流道122、检测区域310、分选装置200(分选电极对)以及分选作用区域220。芯片基板410上设置有流动室120,该流动室120用于为样本流提供流动通道,并将细胞前后排列以形成单细胞流,尽量使同一时刻仅有一个细胞通过检测区域和分选装置的分选作用区域220,以便在细胞流动过程中实现对目标细胞的分选。包含细胞的样本流从样本流微流道420进入流动室120中,鞘液从鞘液微流道430进入流动室120中,鞘液流将样本流包裹,鞘液流和样本流一同流入主流道122中,同时在流体动力聚焦的作用下样本流被鞘液流聚焦在主流道122的中心位置,形成单细胞轴流,细胞会全部都按照流动方向呈一条直线并且单一的经过分选装置200,由此有利于提高分选效果。当然,根据实际情况,样本流也可以仅完成一个维度的聚焦,既样本流仅被聚焦在主流道122的水平中心或垂直中心。分选电极210对的阴极以及阳极设置在主流道122同侧,通过击穿介质,电极间产生冲力或吸力,对目标细胞的流动方向进行改变。利用冲力单次分选过程的光学显微照片如图16所示。在未分选时,样本流被聚焦到主流道122的中心位置,随后进入下游的右侧的分选流道440;当阳极211和阴极212之间被施加一个电压幅值600v、时长5μs的电脉冲时,正负电极间的液体被击穿并产生空化气泡19,空化气泡膨胀产生一个机械冲击波,导致局部的样本流改变运动方向,并进入左侧的分选流道440中;电脉冲结束后,液路恢复稳定,样本流重新回到主流道122的中心位置,并重新进入到下游右侧的分选流道440。单次分选过程中,单次分选的液路稳定时间为0.25ms,分选作用空间为200μm,样本流流速5m/s,其最高分选速度可以为4000个每秒。图17展示了电极对处空化气泡的膨胀和溃灭过程的光学显微照片,对应样本流先被冲击远离电极,之后在吸力作用下被吸向电极位置,最后样本流恢复稳定。这说明不仅可以利用空化气泡膨胀过程中的冲力实现分选,还可利用空化气溃灭胀过程中的吸力实现分选。
在本发明的描述中,术语“上”、“下”等指示的方位或位置关系为基于附图所示的方位或位置关系,仅是为了便于描述本发明而不是要求本发明必须以特定的方位构造和操作,因此不能理解为对本发明的限制。
在本说明书的描述中,参考术语“一个实施例”、“另一个实施例”等的描述意指结合该实施例描述的具体特征、结构、材料或者特点包含于本发明的至少一个实施例中。在本说明书中,对上述术语的示意性表述不必须针对的是相同的实施例或示例。而且,描述的具体特征、结构、材料或者特点可以在任一个或多个实施例或示例中以合适的方式结合。此外,在不相互矛盾的情况下,本领域的技术人员可以将本说明书中描述的不同实施例或示例以及不同实施例或示例的特征进行结合和组合。
尽管上面已经示出和描述了本发明的实施例,可以理解的是,上述实施例是示例性的,不能理解为对本发明的限制,本领域的普通技术人员在本发明的范围内可以对上述实施例进行变化、修改、替换和变型。
- 还没有人留言评论。精彩留言会获得点赞!