一种复方制剂中硫酸氢氯吡格雷特定杂质的检测方法与流程
本发明属于医药
技术领域:
,涉及一种药物制剂的有关物质的检测方法,具体涉及一种急性冠脉综合征治疗药硫酸氢氯吡格雷阿司匹林复方制剂氯吡格雷有关物质特定杂质的检测方法。
背景技术:
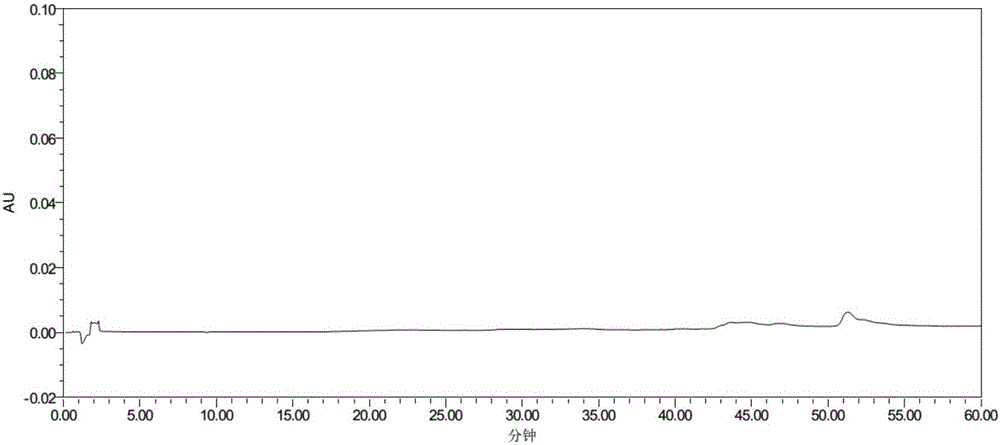
:急性冠脉综合症(ACS)是以冠状动脉粥样硬化斑块破裂或侵蚀,继发形成完全或不完全闭塞性血栓为病例基础的一组临床综合征。包括ST段抬高性心肌梗死、急性非ST段抬高性心肌梗死和不稳定性心绞痛。药理学研究显示:血小板激活在ACS的发病进程中,以及经药物或介入治疗后缺血事件的复发中扮演着重要角色,已经成为治疗ACS的基础。在过去20年里,抗血小板治疗已经成为ACS后二级预防的常规手段,当前临床实践中75%以上患者在出院时接受双重抗血小板治疗。阿司匹林和氯吡格雷都具有抗血小板聚集作用,两者机制不同,作用互补,两者的双联疗法是目前最常用的抗血小板治疗策略。用于非ST段抬高性冠脉综合征(包括不稳定性心绞痛或非Q波心肌梗死),和ST段抬高性急性冠脉综合征的治疗,以预防动脉粥样硬化血栓事件再次发生。硫酸氢氯吡格雷阿司匹林复方制剂属于固定剂量组成的复方制剂,目前国内尚无上市品。针对需要长期服药的患者,复方制剂具有更好的顺从性和更佳的治疗效果,因此开发该复合物对提供一种疗效确切,安全方便,副作用小的ACS治疗药物十分重要。现有的国家药品标准、进口注册标准及文献报道,主要涉及硫酸氢氯吡格雷或阿司匹林单一成分的质量控制方法。但硫酸氢氯吡格雷阿司匹林复方制剂在湿、热、酸、碱、氧化等条件下均不稳定,其杂质不仅来自于原料本身,亦有两者相互作用产生的特定杂质。该特定杂质增长极为迅速,且未经病理毒理学验证,是复方制剂安全用药的一个重要隐患。但是,目前关于复方制剂有关物质特定杂质的研究尚未见报道。因此,研究复方制剂有关物质特定杂质的检测方法,制定严格的质量控制标准,对于保证药物质量的安全性、有效性和质量可控性是非常重要的。技术实现要素:鉴于现有技术没有公开硫酸氢氯吡格雷阿司匹林有关物质特定杂质的检测方法,本发明的目的在于提供一种硫酸氢氯吡格雷与阿司匹林复方制剂有关物质特定杂质的检测方法,复方制剂包括:片剂、胶囊剂、分散片、颗粒剂、微丸剂、滴丸剂、膜剂、口服液体制剂和缓控释剂等。该分析方法可用于硫酸氢氯吡格雷阿司匹林复方制剂的制备过程和最终产品的质量控制,尤其用于复方制剂中特定杂质的检测。为实现上述目的,本发明采取了以下技术方案:一种硫酸氢氯吡格雷与阿司匹林复方制剂中有关物质特定杂质的检测方法,采用高效液相色谱法,测定其中的有关物质,特别是该复方制剂产生的特定杂质。采用十八烷基键合硅胶为色谱柱担体,以缓冲盐-有机溶剂的混合相和有机相为流动相,按照梯度条件进行洗脱。检测波长为220nm,进样体积10μL,流速为1.0ml/min,柱温为30~40℃。以不加校正因子的主成分自身对照法计算有关物质。本发明方法所述有机相选自乙腈、甲醇或甲醇和乙腈的混合物,优选乙腈和甲醇的混合物,混合比例为乙腈-甲醇=96:4~99:1。缓冲盐-有机溶剂的混合相中缓冲盐为磷酸盐缓冲液、乙酸盐缓冲液或离子对试剂,优选离子对试剂。离子对缓冲液浓度为0.02mol/L~0.14mol/L,pH范围为2.0~5.0,优选pH为2.5。缓冲盐-有机溶剂混合相中有机溶剂选自甲醇或乙腈,优选甲醇,离子对缓冲盐与甲醇的比例为96:4~99:1。梯度洗脱程序如表1所示,其中A相为离子对缓冲液-甲醇=96:4~99:1,B相为乙腈-甲醇=96:4~99:1。表1梯度洗脱程序R*=11~22min;X*=90%~85%。本发明方法所述配置样品混合溶剂为:流动相A相-乙腈=40:60。本方法所述测定样品的配制方法为:将硫酸氢氯吡格雷阿司匹林复方制剂用混合溶剂超声溶解。优选的超声温度控制为15℃~25℃。与现有技术和分析方法相比,本发明涉及的硫酸氢氯吡格雷阿司匹林复方制剂氯吡格雷有关物质特定杂质的检测方法具有如下优点和显著进步:(1)可以将已知杂质(2S)-(2氯苯基)-(6,7-二氢噻吩并[3,2-c]吡啶-5-4H基)-乙酸(欧洲药典氯吡格雷杂质A)与阿司匹林主峰及2-羟基苯甲酸(中国药典水杨酸)有效分离;(2)甲基(2S)-(2氯苯基)[4,7-二氢噻吩并[2,3-c]吡啶-6-5H基]-乙酸(欧洲药典氯吡格雷杂质B)与硫酸氢氯吡格雷分离度增加,分离更加完全;(3)硫酸氢氯吡格雷与阿司匹林复方制剂中的两个特定杂质(保留时间分别为25.4min和26.7min)有效分离,且均与阿司匹林及2-羟基苯甲酸(中国药典水杨酸)分离良好。本发明方法检测灵敏度高,精密度好,对于硫酸氢氯吡格雷阿司匹林复方制剂中的特定杂质专属性很强,是严格控制该类复方制剂质量的有效方法。同时,结合实施例6中对特定杂质的结构分析,可以考虑定向合成复方制剂中的特定杂质,为制剂安全性研究提供进一步依据。附图说明图1为实施例1硫酸氢氯吡格雷阿司匹林复方制剂有关物质检测色谱图;图2为实施例1硫酸氢氯吡格雷阿司匹林复方制剂有关物质空白辅料图;图3为实施例2硫酸氢氯吡格雷阿司匹林复方制剂碱破坏试验色谱图;图4为实施例3硫酸氢氯吡格雷阿司匹林复方片剂60℃放置10天有关物质检测色谱图;图5为实施例4硫酸氢氯吡格雷阿司匹林复方片剂加速3个月有关物质检测色谱图;图6为实施例6硫酸氢氯吡格雷阿司匹林复方制剂在RH90%±5%条件下放置15天的LC/MS/MS图。具体实施方式下面的实施例将对本发明作更具体的解释,但本发明并不仅仅局限于这些实施例,同样这些实施例也不以任何方式限制本发明。实施例1仪器与条件:采用C18柱,流动相A相为甲醇-0.05mol/L戊烷磺酸钠(调节pH值为2.5)=3:97,流动相B为甲醇-乙腈=3:97,梯度洗脱程序如表2所示:表2梯度洗脱程序检测波长为220nm,流速为1.0ml/min,柱温为35℃。精密称取硫酸氢氯吡格雷阿司匹林复方制剂细粉适量,置于离心管中,加入混合溶剂(流动相A相-乙腈=40:60)配置成每1ml中约含硫酸氢氯吡格雷6.5mg的溶液,15℃~25℃控温超声,离心,取上清液测定,作为供试品溶液。精密量取供试品溶液1ml,加入混合溶剂(流动相A相-乙腈=40:60)配置成每1ml中约含硫酸氢氯吡格雷6.5μg的溶液,作为对照溶液。另取硫酸氢氯吡格雷原料、阿司匹林原料、辅料按上述方法配置溶液并同条件测定。硫酸氢氯吡格雷阿司匹林组合物原料、已知杂质及特定杂质的保留时间见表3。表3硫酸氢氯吡格雷阿司匹林组合物原料、已知杂质及特定杂质的保留时间峰名称保留时间相对保留时间阿司匹林19.9min0.4642-羟基苯甲酸23.5min0.548(2S)-(2氯苯基)-(6,7-二氢噻吩并[3,2-c]吡啶-5-4H基)-乙酸22.3min0.520甲基(2S)-(2氯苯基)[4,7-二氢噻吩并[2,3-c]吡啶-6-5H基]-乙酸45.2min1.054硫酸氢氯吡格雷42.9min1.000特定杂质125.5min0.594特定杂质226.8min0.627测定结果显示,除硫酸氢氯吡格雷原料、阿司匹林原料中检出的杂质外,硫酸氢氯吡格雷与阿司匹林复方制剂的色谱图中25.5min,26.8min处有未知杂质峰,为该复方制剂的特定杂质,方法专属性良好,空白辅料不干扰测定。实施例2为验证色谱条件的可行性,进一步对复方制剂进行了酸破坏、碱破坏、氧化破坏、高温破坏及光照破坏试验。1.酸破坏:取硫酸氢氯吡格雷阿司匹林复方制剂细粉适量,置于离心管中,加入1mol/L盐酸适量,加入混合溶剂(流动相A相-乙腈=40:60)适量,15~25℃控温超声溶解,离心后取上清液,60℃烘箱中放置2h,作为酸破坏溶液。2.碱破坏:取硫酸氢氯吡格雷阿司匹林复方制剂细粉适量,置于离心管中,加入1mol/L氢氧化钠适量,加入混合溶剂(流动相A相-乙腈=40:60)稀释至样品浓度,15~25℃控温超声溶解,离心后取上清液,60℃烘箱中放置2h,作为碱破坏溶液。3.氧化破坏:取硫酸氢氯吡格雷阿司匹林复方制剂细粉适量,置于离心管中,加入30%过氧化氢溶液适量,加入混合溶剂(流动相A相-乙腈=40:60)稀释至样品浓度,15~25℃控温超声溶解,离心后取上清液,室温放置1h,作为氧化破坏溶液。4.高温破坏:取硫酸氢氯吡格雷阿司匹林复方制剂细粉适量,置于离心管中,加入混合溶剂(流动相A相-乙腈=40:60),15~25℃控温超声,离心后取上清液,60℃烘箱中放置4h,作为高温破坏溶液。5光照破坏:取硫酸氢氯吡格雷阿司匹林复方制剂细粉适量,置于离心管中,加入混合溶剂(流动相A相-乙腈=40:60),15~25℃控温超声,离心后取上清液,4000LX±500LX强光下照射24h,作为光破坏溶液。按照实施例1的测定方法精密量取上述各溶液进行测定。测定结果显示:硫酸氢氯吡格雷与阿司匹林复方制剂经酸破坏、碱破坏、氧化破坏、热破坏以及光照破坏试验后,杂质均有所增加。尤其是碱破坏试验下,25.4min、26.7min处特定杂质峰明显增加。各破坏产物杂质峰与主峰完全分离,该色谱条件具有良好的选择性。实施例3为了进一步验证色谱条件的适用性,并确证硫酸氢氯吡格雷阿司匹林复方制剂中的特定杂质的共有性,分别取硫酸氢氯吡格雷阿司匹林复方片剂和硫酸氢氯吡格雷阿司匹林复方胶囊,于RH90%±5%高湿条件、60℃高温条件和4000±500LX强光条件下放置10天,按照实施例1的测定方法进行测定。测定结果如表4所示。表4不同剂型硫酸氢氯吡格雷阿司匹林复方制剂杂质测定结果结果显示,不同剂型硫酸氢氯吡格雷阿司匹林复方制剂中均能检测出25.4min、26.7min特定杂质;在RH90%±5%高湿条件、60℃高温条件和4000±500LX强光条件放置10天,特定杂质明显增加。进一步验证了色谱条件的适用性,并且可有效控制该复方制剂的质量。实施例4为了考察硫酸氢氯吡格雷阿司匹林复方制剂中的特定杂质在储存过程中的增长情况,取硫酸氢氯吡格雷阿司匹林复方片剂于长期条件(60%±5%、温度25℃±2℃)、加速条件(相对湿度为75%±5%,温度40℃±2℃)下放置3个月,按照实施例1的测定方法进行测定。测定结果如表5所示。表5不同放置条件硫酸氢氯吡格雷阿司匹林复方制剂特定杂质测定结果结果显示:硫酸氢氯吡格雷阿司匹林复方制剂稳定性较差,在湿热条件下易于产生特定杂质,新生成的特定杂质未经毒理学验证,在安全用药方面具有一定隐患。因此建议复方制剂应密封,置于25℃以下干燥处保存。实施例5为了考察不同离子对浓度、流动相A相中缓冲盐与甲醇的混合比例,以及梯度条件的改变,对硫酸氢氯吡格雷阿司匹林复方制剂中特定杂质检测的影响,对实施例1中测定方法进行调整。5.1梯度条件的选择:将实施例1中梯度条件按下述梯度条件表进行调整,其它色谱条件保持不变。取硫酸氢氯吡格雷阿司匹林复方片剂60℃放置10天的样品,测定复方制剂的有关物质。表6梯度洗脱程序表R*分别为5min,10min和23min。分离效果见下表:表7分离效果5.2流动相A相缓冲盐与甲醇的混合比例:将实施例1中甲醇与离子对缓冲液的比例分别变更为纯水相和5:95,其它色谱条件同实施例1中所述。取硫酸氢氯吡格雷阿司匹林复方片剂60℃放置10天的样品,测定复方制剂的有关物质,分离效果如下表:表8分离效果流动相A分离效果纯水相梯度洗脱基线不稳甲醇-离子对缓冲液=5:95两个特定杂质无法完全分离5.3离子对浓度:将实施例1中离子对缓冲液浓度变更为0.01mol/L和0.15mol/L,其它色谱条件同实施例1中所述。取硫酸氢氯吡格雷阿司匹林复方片剂60℃放置10天的样品,测定复方制剂的有关物质,分离结果见下表:表9分离效果结果表明:梯度洗脱第一步R*应控制在10~22min的范围内,流动相A中甲醇与离子对缓冲盐的比例应控制在96:4~99:1的范围内,离子对试剂的浓度应控制在0.02mol/L~0.14mol/L的范围内。实施例6为了进一步确定25.4min和26.7min未知杂质的结构,采用液相质谱联用的方法,测定特定杂质的分子量,从而推测特定杂质可能的结构。液相部分采用C18柱,流动相A相为甲醇-0.0025mol/L乙酸铵(乙酸调节pH值为4.0)=6:94,流动相B为甲醇-乙腈=6:94。梯度洗脱条件如下:表10梯度洗脱条件流速为1.0ml/min,检测波长为230nm,柱温为35℃。质谱参数如下:雾化气压力为30psi;干燥气流速为8.0ml/min;干燥气温度为350℃;扫描范围为50-1000m/z,扫描频次为5s;检测方式为正离子模式一级、二级扫描。将硫酸氢氯吡格雷阿司匹林复方制剂在RH90%±5%条件下放置15天,取该复方制剂细粉适量,置于离心管中,加入混合溶剂(流动相A相-乙腈=40:60),15~25℃控温超声溶解,离心后取上清液测定。结果显示:在该LC/MS条件下,原25.4min杂质峰变为27min,原26.7min杂质峰变为34.0min。(1)根据质谱一级谱推测25.4min特殊杂质结构可能为:结果显示,其二级谱碎片为590.9,可能裂解途径为:(2)根据质谱一级谱推测26.8min特殊杂质结构可能为:其二级谱碎片为335.7、182.7、154.7,可能裂解途径为:。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1