组织辨识方法以及用于组织辨识的生物传感器与流程
本发明涉及一种组织辨识方法以及用于组织辨识的生物传感器,尤其涉及一种生物组织辨识方法以及用于生物组织辨识的生物传感器。
背景技术:
在医疗专业发展中,外科医疗手术为重要的治疗方式之一,尤其是在肿瘤或癌症病患的治疗方面,藉由手术切除肿瘤为最基本且效果良好的治疗方式。
更详细而言,在外科医疗手术领域中,组织部位辨识对于手术的成功率及安全性而言相当重要。过去外科医师在手术当下,通常难以精确区别肿瘤组织与健康组织。然而,若欲于手术过程中进行切片送交病理检验,至少需耗时30分钟左右,才能得知组织辨识结果。此外,在先前技术中,虽有内视镜等设备辅助,但外科医师可能仍须通过临床经验加以判断。如此一来,可能难以有效且安全地进行手术,导致肿瘤组织的切除准确度降低,使疾病复发的可能性增加,对病患的存活率造成不良影响,亦可能因未能完全切除肿瘤组织而需于原手术部位再次进行手术,使手术次数增加而造成病患的负担。
另一方面,外科医师在进行一般切除手术时,在未能精确辨识血管及其周边组织的情况下,可能不慎接触或误切血管,引发不必要的出血。若出血情形严重,甚至可能危及病患的生命安全,增加外科医疗手术风险。
综上所述,亟需一种能够更有效且快速地辨识及区分组织的方法,以使外科医疗手术更有效且安全地进行。
技术实现要素:
本发明提供一种组织辨识方法,能够更有效、简单且快速地辨识及区分组织,以使外科医疗手术更有效且安全地进行。
本发明提供一种用于组织辨识的生物传感器,其可用于上述组织辨识方 法中。
本发明的组织辨识方法,包括准备步骤以及检测步骤。准备步骤包括准备生物传感器,生物传感器包括晶体管及反应电极,反应电极相对于晶体管的栅极端而与晶体管彼此间隔设置。检测步骤包括将待辨识的生物组织样本放置于反应电极上,并施加具有可调变脉波宽度与高度的脉波电压于反应电极,以使反应电极与晶体管的栅极端之间产生压差,并于脉波宽度内量测运算自晶体管产生的检测电流,以得到第一感测指标。
在本发明的一实施例中,还包括于检测步骤之后进行的转换步骤,其中将检测电流相对于脉波宽度进行积分转换,以得到第二感测指标。
在本发明的一实施例中,还包括于检测步骤之后进行的转换步骤,将对应于脉波宽度的检测电流值除以检测电流的最大值,并对脉波宽度进行积分转换,以得到第三感测指标。
在本发明的一实施例中,晶体管包括高速电子迁移率场效晶体管、硅基场效晶体管、纳米线场效晶体管、纳米碳管场效晶体管、石墨烯场效晶体管或二硫化钼场效晶体管。
在本发明的一实施例中,反应电极间隔地设置于晶体管的栅极端上方。
在本发明的一实施例中,反应电极设置于晶体管的基板上,而与晶体管的栅极端位于同一平面。
在本发明的一实施例中,生物组织样本的来源包括肌肉、血管、血管周边组织、脂肪、内脏或肿瘤组织。
本发明的用于组织辨识的生物传感器,包括具有栅极端的晶体管以及反应电极。反应电极相对于晶体管的栅极端而与晶体管彼此间隔设置,待辨识的生物组织样本放置于反应电极上。其中施加电压于反应电极时,反应电极与晶体管的栅极端之间产生压差。
在本发明的一实施例中,晶体管包括高速电子迁移率场效晶体管、硅基场效晶体管、纳米线场效晶体管、纳米碳管场效晶体管、石墨烯场效晶体管或二硫化钼场效晶体管。
在本发明的一实施例中,反应电极间隔地设置于晶体管的栅极端上方。
在本发明的一实施例中,反应电极设置于晶体管的基板上,而与晶体管的栅极端位于同一平面。
在本发明的一实施例中,生物组织样本的来源包括肌肉、血管、血管周边组织、脂肪、内脏或肿瘤组织。
基于上述,本发明的组织辨识方法可藉由高速电子迁移率场效晶体管(highelectronmobilitytransistor,hemt)进行,高速电子迁移率场效晶体管具有良好的电性特质、化学稳定性、生物兼容性、热稳定性与低功率消耗等优点。因此,本发明以场效晶体管辨识组织的方法能够更有效、简单且快速地辨识及区分组织,以避免医师在进行外科手术时误切血管,并可于肿瘤组织切除手术中避免伤及正常组织且更有效地切除肿瘤组织,进而提升外科医疗手术的效率及安全性。
为让本发明的上述特征和优点能更明显易懂,下文特举实施例,并配合附图作详细说明如下。
附图说明
图1为依照本发明第一实施例用于组织辨识的生物传感器的侧视示意图;
图2为依照本发明第二实施例用于组织辨识的生物传感器的俯视示意图;
图3为实例1中以本发明的组织辨识方法针对骨骼肌样本与脂肪样本进行检测所得的电流对时间关系图;
图4为实例1的电荷对时间关系图,用以说明图3的电流对时间作积分的曲线图;
图5为实例1的特定时间与电荷关系图,用以辅助说明图4在50μs时的电荷值;
图6为实例2中以本发明的组织辨识方法针对肾血管样本与肾血管周边肌肉样本进行检测所得的电流对时间关系图;
图7为实例2的电荷对时间关系图,用以说明图6的电流对时间作积分的曲线图;
图8为实例2的特定时间与电荷关系图,用以辅助说明图7在50μs时的电荷值;
图9为实例2中以本发明的组织辨识方法针对pbs、肾血管样本与肾血 管周边肌肉样本进行检测所得的电流对时间关系图。
具体实施方式
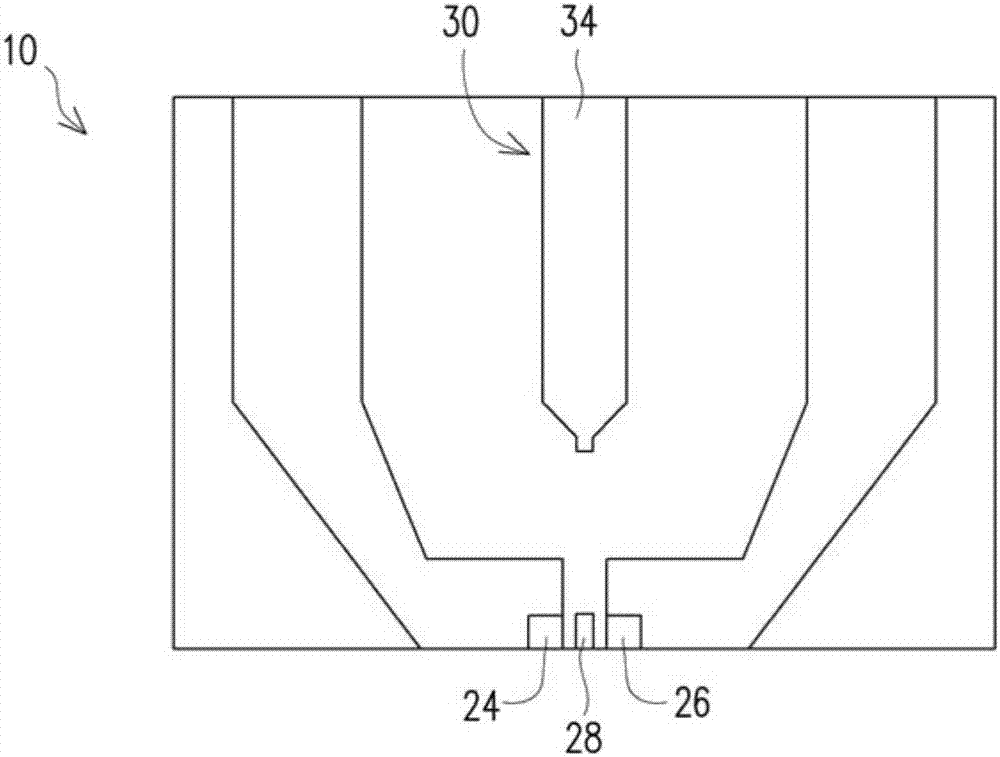
图1为依照本发明第一实施例用于组织辨识的生物传感器的侧视示意图。
请参照图1,用于组织辨识的生物传感器10包含晶体管20以及反应电极30。
如图1所示,晶体管20可包括基体22、源极端24、漏极端26以及设置于源极端24与漏极端26之间的栅极端28。
更详细而言,适用于本发明生物传感器10的晶体管20可包括高速电子迁移率场效晶体管、纳米碳管场效晶体管、石墨烯场效晶体管或二硫化钼场效晶体管,但不限于此。本实施例是使用高速电子迁移率场效晶体管为例作说明,其结构例如是于蓝宝石(sapphire)基板上依序形成氮化镓(gan)层及氮化铝铟(alinn)层,以得到基体22,并通过曝光显影制程于基体22上形成源极端24、漏极端26与门极端28以构成晶体管20。由于曝光显影制程为本领域常用技术且非本发明的重点,故于此不加以赘述。
本实施例使用高速电子迁移率场效晶体管,其主要是藉由alinn/gan之间具有低维异质结构界面,以使晶体管20应用于生物传感器时,能够具有卓越的载子传输特性。必须说明的是,形成于该氮化镓层上的层的材料并不限于氮化铝铟,亦可使用氮化铝镓(algan)等具有压电特性的其他材料。
请再参照图1,反应电极30包括位于顶面的反应层34,且反应层34例如是由金所构成。更详细而言,反应层34相对于晶体管20的栅极端28而与晶体管20彼此间隔设置于晶体管20的栅极端28上方,且反应电极30与栅极端28无电连接。
如图1所示,本实施例的反应电极30实质上可由两个结构相同的第一子电极31与第二子电极32彼此相对地连接所构成。更详细而言,在第一子电极31与第二子电极32中,均可于硅基板38上形成氮化硅层36,再于氮化硅层36上形成反应层34。如此一来,氮化硅层36可阻隔反应层34于后续进行生物检测产生的电子传递至硅基板38上,因而可降低量测的误差值。
在本实施例中,第一子电极31例如是以反应层34远离硅基板38的方向 设置于玻璃基板33上,且第一子电极31与玻璃基板33的高度和大于晶体管20的高度。之后,再将第二子电极32的反应层34与第一子电极31的反应层34彼此相连接,并使第二子电极32的反应层34凸伸出第一子电极31,而使第二子电极32的反应层34位于晶体管20的栅极端28上方,并使第二子电极32的反应层34与栅极端28之间形成间隙间隔。
必须说明的是,反应电极30的形成方式并不限于上述结构,亦可视情况以一体成型方式构成反应电极30。
图2为依照本发明第二实施例用于组织辨识的生物传感器的俯视示意图。图2所示的第二实施例相似于图1所示的第一实施例,故相同组件以相同标号表示且在此不予赘述。
请参照图2,第二实施例的层体结构与组成材料大致是与上述第一实施例相同。本实施例与上述第一实施例不同之处在于,反应电极30与晶体管20的栅极端28位于同一平面,且形成于晶体管20的氮化镓(gan)层上的是氮化铝镓(algan)层。更详细而言,本实施例是藉由延伸晶体管20的基板,并将反应电极30设置于基板上,以使反应电极30可与晶体管20的栅极端28位于同一平面并间隔相对设置。
本发明亦提出一种使用上述第一实施例或第二实施例的生物传感器10所进行的组织辨识方法,其中包括准备步骤及检测步骤,准备步骤包括准备如图1或图2所示的生物传感器10。接下来,将以图1所示的生物传感器10说明本发明的组织辨识方法。
请参照图1,准备生物传感器10之后,进行检测步骤,将待辨识的生物组织样本(未显示)放置于反应电极30上,并按压生物组织样本以使其与反应电极30充分接触。接着,施加具有可调变脉波宽度与高度的脉波电压v于反应电极30的反应层34上,以使反应电极30与晶体管20的栅极端28之间产生压差,并于脉波宽度内量测运算自晶体管20产生的检测电流i,以得到由生物组织样本产生的第一感测指标。得到第一感测指针之后,移除生物组织样本,并依序以pbst(pbs+tween20,其中pbs为磷酸盐缓冲液(phosphatebufferedsaline))及去离子水清洗生物传感器。
更详细而言,例如是将待辨识的生物组织样本切成厚度为约2.5mm的薄片以进行检测。然而,本发明并不以此为限,亦可依实际操作情形调整生物 组织样本的尺寸,只要能够通过本发明的生物传感器产生第一感测指标即可。另外,所施加的脉波电压v的脉波宽度与高度的大小可依据使用者所欲分析的检测时间及检测所需的电压大小进行调整,例如是:
单一脉波:漏极电压=2v;栅极电压=0.5v;栅极脉波宽度=0.5μs
双相脉波:漏极电压=2v;栅极电压=0.5v;栅极循环脉波宽度=1ms
必须说明的是,可于检测步骤之后进行转换步骤,其中将第一感测指标的检测电流i进行转换以得到其他感测指标。第一种转换方式是将检测电流i相对该脉波宽度(t)进行积分转换,此时即为对电流与时间进行积分,而可得到电荷量,从而得知特定时间于晶体管20的源极端24所累积的总电荷量,以作为第二感测指标。第二种转换方式则是将对应脉波宽度(t)的检测电流i除以检测电流的最大值ipeak,以得到动态电流值p(t),并对动态电流值p(t)相对脉波宽度(t)进行积分转换,得到时间常数(timeconstant),以作为第三感测指标。
在本发明中,待辨识的生物组织样本的来源可包括肌肉、血管、血管周边组织、脂肪、内脏或肿瘤组织。肌肉例如是骨骼肌,血管例如是肾血管。然而,本发明并不以此为限,亦可依据实际需求使用其他种类的生物组织进行辨识。由于来自身体不同部位的生物组织样本具有不同的结构组成,因此,能够引发不同的电性反应。如此一来,通过上述本发明的组织辨识方法对不同的生物组织样本进行检测,能够得到不同的第一感测指标,藉此辨识并区分不同的组织。举例而言,可藉由本发明的组织辨识方法分辨肾血管与其周边组织、脂肪与骨骼肌或健康组织与肿瘤组织。
由于本发明所提出的组织辨识方法能够有效、简单且快速地辨识及区分组织,因此,可应用于外科医疗手术相关领域。即,可将本发明的生物传感器用作外科医疗手术辅助工具。举例而言,在进行肾脏血管止血前的周边组织切除手术时,可将生物传感器安装于探针头,将探针慢慢刺入肾脏旁肌肉,当探针碰触到血管时,发出不同的讯号,此时停止推进探针,手术刀顺着探针向下切割。如此一来,能够避免医师在进行手术时误切血管,并可于肿瘤组织切除手术中避免伤及正常组织且更有效地切除肿瘤组织,进而提升外科医疗手术的效率及安全性。
以下,藉由实验例来详细说明本发明所提出的组织辨识方法及其特性, 然而,下述实验例并非用以限制本发明。必须说明的是,在下述实验例中使用的是猪的生物组织样本,但本发明并不以此为限,本发明所提出的组织辨识方法亦可应用于任何其他具有组织辨识需求的生物体。举例而言,本发明的组织辨识方法亦可应用于人体的生物组织样本的组织辨识。
实验例
为了证明本发明所提出的组织辨识方法能够有效、简单且快速地辨识及区分组织,以下特别作此实验例。
必须说明的是,由于组织辨识方法的流程已于上文中详细地描述,因此,下文中为求方便说明故省略部分细节的叙述。
以组织辨识方法针对生物组织样本进行检测
实例1
准备上述第一实施例的生物传感器,将猪的骨骼肌切成厚度为约2.5mm的薄片作为生物组织样本放置于反应电极上,并按压骨骼肌样本以使其与反应电极充分接触。接着,施加脉波宽度与脉波高度分别为50μs及0.5v的脉波电压v于反应电极上,并于脉波宽度内量测运算自晶体管产生的检测电流i,以得到由骨骼肌样本产生的第一感测指标。
得到第一感测指标之后,移除骨骼肌样本,并依序以pbst及去离子水清洗生物传感器。再将猪的脂肪切成厚度为约2.5mm的薄片作为生物组织样本放置于反应电极上,并按压脂肪样本以使其与反应电极充分接触。接着,施加脉波宽度与脉波高度分别为50μs及0.5v的脉波电压v于反应电极上,并于脉波宽度内量测运算自晶体管产生的检测电流i,以得到由脂肪样本产生的第一感测指标。
数据分析
图3为实例1中以本发明的组织辨识方法针对骨骼肌样本与脂肪样本进行检测所得的电流对时间关系图。图4为实例1的电荷对时间关系图,用以说明图3的电流对时间作积分的曲线图。图5为实例1的特定时间与电荷关系图,用以辅助说明图4在50μs时的电荷值。
请参照图3,在50μs的时间区段内,骨骼肌样本与脂肪样本的检测电流 (第一感测指标)明显有所差异,因此,本发明所提出的组织辨识方法能够有效、简单且快速地辨识及区分骨骼肌与脂肪。
本发明除了使用检测电流i作为第一感测指标外,还可进一步地通过如上文中所述的转换步骤,而得到以电荷作为指标的第二感测指标。
请参照图4,图4显示图3的各曲线电流值相对时间进行积分转换而得到相对时间的电荷曲线。由图4可知,在50μs的时间区段内,骨骼肌样本与脂肪样本的总电荷量(第二感测指标)明显有所差异。由电荷量等于电流乘以时间(q=i×t)可知,电荷量与电流成正比,因此,图4所显示的电荷曲线确实符合图3的结果。接着,请参照图5,其中显示针对图4在50μs取其相对应的电荷值,骨骼肌样本与脂肪样本的电荷值亦明显有所差异。
实例2
准备上述第一实施例的生物传感器,将猪的肾血管切成厚度为约2.5mm的薄片作为生物组织样本放置于反应电极上,并按压肾血管样本以使其与反应电极充分接触。接着,施加脉波宽度与脉波高度分别为50μs及0.5v的脉波电压v于反应电极上,并于脉波宽度内量测运算自晶体管产生的检测电流i,以得到由肾血管样本产生的第一感测指标。
得到第一感测指标之后,移除肾血管样本,并依序以pbst及去离子水清洗生物传感器。再将猪的肾血管周边肌肉切成厚度为约2.5mm的薄片作为生物组织样本放置于反应电极上,并按压肾血管周边肌肉样本以使其与反应电极充分接触。接着,施加脉波宽度与脉波高度分别为50μs及0.5v的脉波电压v于反应电极上,并于脉波宽度内量测运算自晶体管产生的检测电流i,以得到由肾血管周边肌肉样本产生的第一感测指标。
数据分析
图6为实例2中以本发明的组织辨识方法针对肾血管样本与肾血管周边肌肉样本进行检测所得的电流对时间关系图。图7为实例2的电荷对时间关系图,用以说明图6的电流对时间作积分的曲线图。图8为实例2的特定时间与电荷关系图,用以辅助说明图7在50μs时的电荷值。
请参照图6,在50μs的时间区段内,肾血管样本与肾血管周边肌肉样本的检测电流(第一感测指标)明显有所差异,因此,本发明所提出的组织辨 识方法能够有效、简单且快速地辨识及区分肾血管与肾血管周边肌肉,以避免医师在进行外科手术时误切血管。
本发明除了使用检测电流i作为第一感测指标外,还可进一步地通过如上文中所述的转换步骤,而得到以电荷作为指标的第二感测指标。
请参照图7,图7显示图6的各曲线电流值相对时间进行积分转换而得到相对时间的电荷曲线。由图7可知,在50μs的时间区段内,肾血管样本与肾血管周边肌肉样本的总电荷量(第二感测指标)明显有所差异。由电荷量等于电流乘以时间(q=i×t)可知,电荷量与电流成正比,因此,图7所显示的电荷曲线确实符合图6的结果。接着,请参照图8,其中显示针对图7在50μs取其相对应的电荷值,肾血管样本与肾血管周边肌肉样本的电荷值亦明显有所差异。
图9为实例2中以本发明的组织辨识方法针对pbs、肾血管样本与肾血管周边肌肉样本进行检测所得的电流对时间关系图。
请参照图9,在1000μs的时间区段内,1×pbs、肾血管样本与肾血管周边肌肉样本的检测电流(第一感测指标)明显有所差异,因此,再次证明本发明所提出的组织辨识方法能够有效、简单且快速地辨识及区分肾血管与肾血管周边肌肉,以避免医师在进行外科手术时误切血管。
综上所述,本发明的组织辨识方法是藉由高速电子迁移率场效晶体管进行,高速电子迁移率场效晶体管具有良好的电性特质、化学稳定性、生物兼容性、热稳定性与低功率消耗等优点。因此,能够更有效、简单且快速地辨识及区分组织。本发明的组织辨识方法可应用于外科医疗手术相关领域,且本发明的生物传感器可用作外科医疗手术辅助工具(例如:与手术刀等外科手术装置结合运用)。如此一来,能够避免医师在进行外科手术时误切血管,并可于肿瘤组织切除手术中避免伤及正常组织且更有效地切除肿瘤组织,进而提升外科医疗手术的效率及安全性。
虽然本发明已以实施例揭示如上,然其并非用以限定本发明,任何所属技术领域中普通技术人员,在不脱离本发明的精神和范围内,当可作些许的改动与润饰,故本发明的保护范围当视所附权利要求界定范围为准。
- 还没有人留言评论。精彩留言会获得点赞!