一种基于贵金属纳米粒子的可视化检测方法及应用与流程
本发明涉及免疫检测分析领域,尤其涉及一种基于贵金属纳米粒子的可视化检测方法及应用。
背景技术:
比色法因具有肉眼直接读出信号,不需要借助于其他精密昂贵的仪器设备等自身优势,在很多方面都有应用。以往报道的很多与比色相关的方法大都是通过控制金或者是银纳米粒子的聚集和分散状态以达到颜色改变的目的。但是这些方法往往需要对金属纳米粒子的表面进行修饰,或者是向他们的溶液中添加一些电解质以改变其表面的电荷,从而达到溶液变色的目的。然而,复杂的修饰过程很可能会导致金属纳米粒子的非特异性聚集从而产生假阳性或者假阴性信号。此外,虽然目前报道的许多方法都取得了良好的灵敏度,但是大部分方法都不能适用于临床的直接检测。本发明所公开的方法能够方便、快捷、高灵敏的可视化检测包括肿瘤标志物、细菌、病毒等在内的多种物质,具有很好的普适性。
技术实现要素:
本发明的目的是克服现有技术存在的上述不足,提供了一种高灵敏的实用型的可视化检测方法。所述方法将酶的高效催化活性与贵金属纳米粒子高的消光系数相结合直接原位生长金或银纳米粒子用于包括肿瘤标志物、细菌、病毒等在内的多种物质的检测。本发明中酶催化其底物产生的还原剂能够迅速的将金或银离子还原为颜色明显的纳米粒子溶液。主要特点是整个过程无需复杂的探针修饰,直接原位生长金或银纳米粒子得到不同颜色深浅的纳米粒子溶液。
为达到此发明目的,本发明采用以下技术方案:
一种基于贵金属纳米粒子的可视化检测方法,包括
1)含酶催化溶液制备的步骤;
2)贵金属纳米粒子溶液制备的步骤;
3)肉眼观察孔板中的颜色变化,并用相机拍照,得到可视化检测结果;
4)用微孔板读数器读取孔板中金或银纳米粒子的溶液的吸光度值,将碱性磷酸酶(ALP)的浓度与所得吸光度值做线性拟合;
其中:含酶催化溶液是将L-抗坏血酸-2-磷酸酯三钠盐(AA-P)溶解在二乙醇胺-硝酸的缓冲溶液(DEA buffer)中,在孔板中与不同浓度的碱性磷酸酶(ALP)孵化得到;
其中贵金属为金或银,其纳米粒子溶液是将氯金酸(HAuCl4)或硝酸银(AgNO3)加入到1)的溶液中启动氧化还原反应原位生长金或银纳米粒子得到。
进一步的,步骤1)中,L-抗坏血酸-2-磷酸酯三钠盐(AA-P)溶解在二乙醇胺-硝酸的缓冲溶液(DEA buffer)中,取50-500μL上述溶液与不同浓度的碱性磷酸酶(ALP)于4-37℃下孵化0.5-24h;
步骤4)中,金或银纳米粒子的溶液的吸光度值是金或银纳米粒子的溶液在530nm或400nm处的吸光度值(A530nm or A400nm),并将ALP的浓度与A530nm或A400nm做线性拟合。
进一步的,步骤1)所述AA-P的浓度为5-50mM,优选为10mM;所述DEA buffer的浓度为50-400mM,优选为160mM;所述DEA buffer的pH为9.8;所述ALP的浓度为0-100U/L。
进一步的,步骤2)所述氯金酸或硝酸银的浓度为1M;所述氯金酸或硝酸银的体积为0.5-3μL,优选为3μL。
本发明提供了一种基于贵金属纳米粒子的可视化检测方法的应用,包括如下步骤:
1)将不同浓度的抗原通过抗原抗体的特异性结合吸附到捕获抗体包被的ELISA孔板上;
2)将生物素化的检测抗体(biotin-Ab2)通过抗原抗体的特异性结合吸附到ELISA孔板上;
3)将链霉亲和素标记的碱性磷酸酶(streptavidin-ALP)通过生物素与亲和素的特异性结合吸附到ELISA孔板上;
4)L-抗坏血酸-2-磷酸酯三钠盐(AA-P)溶解在二乙醇胺-硝酸的缓冲溶液(DEA buffer)中得到AA-P的溶液,将所得溶液加入到3)所述孔板中,恒温条件下孵化1h;
5)将HAuCl4或AgNO3加入到4)中启动氧化还原反应原位生长金或银纳米粒子,得到金或银纳米粒子的溶液;
6)肉眼观察孔板中的颜色变化,并用相机拍照,得到可视化检测结果;
7)用微孔板读数器读取孔板中金或银纳米粒子的溶液在530nm或400nm处的吸光度值(A530nm or A400nm),将ALP浓度与A530nm或A400nm做线性拟合。
进一步的,步骤1)所述抗原为甲胎蛋白(AFP)、癌胚抗原(CEA)、前列腺特异抗原(PSA)、肿瘤抗原153(CA153);或免疫球蛋白(IgG);或大肠杆菌、金黄色葡萄球菌、绿脓杆菌;或人类免疫缺陷病毒(HIV)、甲型肝炎病毒(HAV)、乙型肝炎病毒(HBV)。
进一步的,步骤2)所述biotin-Ab2的浓度为0.1-3μg/mL,优选为2μg/mL;所述streptavidin-ALP的浓度为0.1-3μg/mL,优选为1μg/mL。
与现有技术相比,本发明具有以下有益效果:
本发明通过贵金属纳米颗粒原位生长的方法来检测多种物质,所得纳米粒子溶液的颜色深浅与酶浓度和检测物质的浓度密切相关,并且在一定浓度范围内可通过所得纳米粒子溶液的颜色半定量酶的浓度。该过程无需任何复杂的探针修饰,也不涉及任何后续添加物,更无需昂贵精密的仪器设备以及专业的科学分析,只需肉眼即可实现包括肿瘤标志物、细菌、病毒等在内的多种物质的可视化检测。与传统的ELISA相比,该检测方法更加方便、快速、低耗且适用范围更加广泛。
附图说明
图1一种基于贵金属纳米粒子的可视化检测方法在免疫检测分析中的应用示意图。
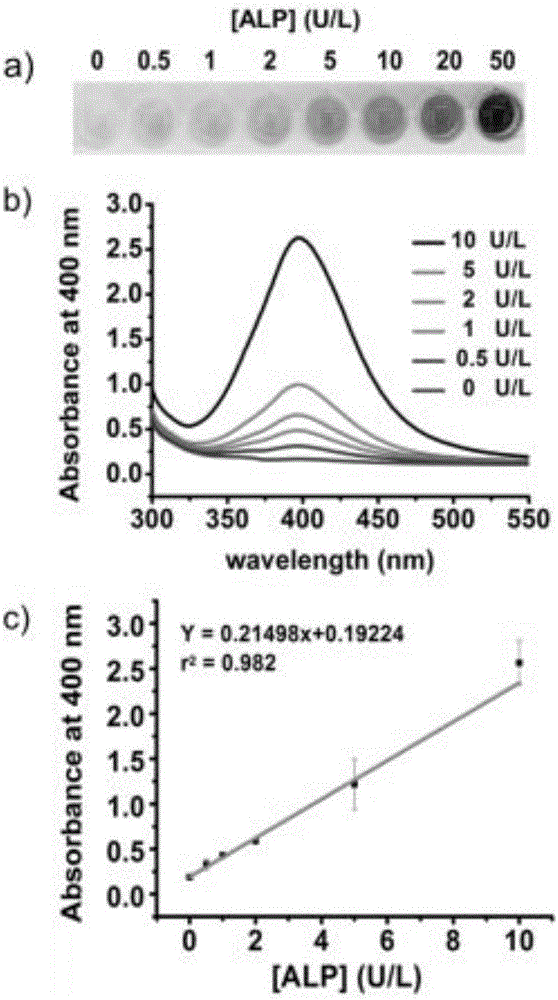
图2一种基于贵金属纳米粒子的可视化检测方法(以原位长银为例)。a)是不同酶浓度条件下银纳米粒子原位生长的可视化检测结果图;b)不同酶浓度条件下所得的银纳米粒子溶液的紫外-可见吸收光谱;c)不同浓度的酶与所得银纳米粒子溶液在400nm处吸光度值的拟合直线图;误差线代表了三次独立实验的标准偏差。
图3是贵金属纳米粒子原位生长的可视化检测方法(以原位长银为例)与传统的HRP方法用于检测游离AFP的结果图;误差线代表了三次独立实验的标准偏差。
图4是贵金属纳米粒子原位生长的可视化检测方法(以原位长银为例)以及传统的HRP方法用于检测不同癌症病人血清中AFP的结果图。
图5是贵金属纳米粒子原位生长的可视化检测方法(以原位长银为例)以及传统的HRP方法用于检测对接受治疗后的癌症病人血清中AFP的结果图。
具体实施方式
下面结合实施例对本发明进行进一步的说明。除非本申请上下文中另有其他说明,否则本申请中所用技术术语及缩写均具有本领域技术人员所知的常规含义;除非另有说明,否则下述实施例中所用原料化合物均为商购获得。
本发明中涉及到贵金属金、银所表述的长金法,为现有技术中常规的金属纳米粒子生长方法。
按照本发明所提供的一种酶调节的贵金属纳米粒子原位生长的可视化检测方法及其在免疫检测分析中的应用,其具体实施方式如下:
图1是贵金属纳米粒子原位生长的方法在免疫检测分析中的应用示意图。由图1可知本发明将传统的ELISA技术与酶的高效催化活性以及贵金属纳米粒子高的消光系数相结合,可快速、便捷的可视化检测包括肿瘤标志物、细菌、病毒等在内的多种物质。
实施例1:
一种基于银纳米粒子原位生长的可视化检测方法1
将AA-P溶解在160mM的DEA buffer中,使其终浓度为10mM。再将上述100μL溶液加入96孔板中并与不同浓度的ALP在37℃下孵化1h。然后再加入3μL1 M的硝酸银溶液来启动氧化还原反应原位生长银纳米粒子。肉眼观察孔板中的颜色变化,并用相机拍照,得到可视化检测结果,同时用微孔板读数器读取AgNPs在400nm处的吸光度值(A400nm),将ALP的浓度与A400nm做线性拟合。如图2,a)是不同酶浓度条件下银纳米粒子原位生长的可视化检测结果图;b)不同酶浓度条件下所得的银纳米粒子溶液的紫外-可见吸收光谱;c)不同浓度的酶与所得银纳米粒子溶液在400nm处吸光度值的拟合直线图。
实施例2:
一种基于银纳米粒子原位生长的可视化检测方法2
将AA-P溶解在120mM的DEA buffer中,使其终浓度为8mM。再将上述100μL溶液加入96孔板中并与不同浓度的ALP 37℃下孵化1h。然后再加入2.5μL 1M的硝酸银溶液来启动氧化还原反应原位生长银纳米粒子。肉眼观察孔板中的颜色变化,并用相机拍照,得到可视化检测结果,同时用微孔板读数器读取AgNPs在400nm处的吸光度值(A400nm),将ALP的浓度与A400nm做线性拟合。
实施例3:
一种基于金纳米粒子原位生长的可视化检测方法1
将AA-P溶解在160mM的DEA buffer中,使其终浓度为10mM。再将上述100μL溶液加入96孔板中并与不同浓度的ALP 37℃下孵化1h。然后再加入3μL1 M的氯金酸溶液来启动氧化还原反应原位生长金纳米粒子。肉眼观察孔板中的颜色变化,并用相机拍照,得到可视化检测结果,同时用微孔板读数器读取AuNPs在530nm处的吸光度值(A530nm),将ALP的浓度与A530nm做线性拟合。
实施例4:
一种基于金纳米粒子原位生长的可视化检测方法2
将AA-P溶解在120mM的DEA buffer中,使其终浓度为8mM。再将上述溶液加入96孔板中并与不同浓度的ALP 37℃下孵育1h。然后再加入2.5μL 1M的氯金酸溶液来启动氧化还原反应原位生长金纳米粒子。肉眼观察孔板中的颜色变化,并用相机拍照,得到可视化检测结果,同时用微孔板读数器读取AuNPs在530nm处的吸光度值(A530nm),将ALP的浓度与A530nm做线性拟合。
实施例5:
一种基于银纳米粒子原位生长的可视化检测方法用于AFP的检测1
第一步,将不同浓度的AFP(0、2、5、10、20、50、100、200ng/mL)通过抗原抗体的特异性结合吸附到捕获抗体包被的96孔板上,DEA buffer(含0.05%tween 20)洗涤3次后,再将2ug/mL biotin-Ab2通过抗原抗体的特异性结合吸附到96孔板上,3次洗涤后将1ug/mL的streptavidin-ALP通过生物素与亲和素的特异性结合固定到96孔板上,洗涤3次。
第二步,将AA-P溶解在160mM的DEA buffer中,使其终浓度为10mM。再将上述溶液加入到第一步的孔板中37℃下孵化1h。然后再加入3μL 1M的硝酸银溶液来启动氧化还原反应原位生长银纳米粒子。肉眼观察孔板中的颜色变化,并用相机拍照,得到可视化检测结果;同时用微孔板读数器读取AgNPs在400nm处的吸光度值(A400nm),将AFP的浓度与A400nm做线性拟合,两者在一定的范围内呈线性关系,在3σ(σ=S0/S;S0,空白样品的标准偏差;S,标准曲线的斜率)处的最低检测限为0.23ng/mL。如图3是银纳米粒子原位生长的可视化检测方法与传统的HRP方法用于检测AFP的结果图;误差线代表了三次独立实验的标准偏差。
实施例6:
一种基于银纳米粒子原位生长的可视化检测方法用于CEA的检测1
第一步,将不同浓度的CEA(0、0.5、1、2、4、8、16、32ng/mL)通过抗原抗体的特异性结合吸附到捕获抗体包被的96孔板上,DEA buffer(含0.05%tween 20)洗涤3次后,再将2ug/mL biotin-Ab2通过抗原抗体的特异性结合吸附到96孔板上,3次洗涤后将1ug/mL的streptavidin-ALP通过生物素与亲和素的特异性结合固定到96孔板上,洗涤3次。
第二步,将AA-P溶解在160mM的DEA buffer中,使其终浓度为10mM。再将上述溶液加入到第一步的孔板中37℃下孵化1h。然后再加入3μL 1M的硝酸银溶液来启动氧化还原反应原位生长银纳米粒子。肉眼观察孔板中的颜色变化,并用相机拍照,得到可视化检测结果;同时用微孔板读数器读取AgNPs在400nm处的吸光度值(A400nm),将CEA的浓度与A400nm做线性拟合。
实施例7:
一种基于银纳米粒子原位生长的可视化检测方法用于IgG的检测1
第一步,将不同浓度的IgG(0、0.1、0.3、0.9、2.7、8.1、24.3、72.9ng/mL)通过抗原抗体的特异性结合吸附到捕获抗体包被的96孔板上,DEA buffer(含0.05%tween 20)洗涤3次后,再将2ug/mL biotin-Ab2通过抗原抗体的特异性结合吸附到96孔板上,3次洗涤后将1ug/mL的streptavidin-ALP通过生物素与亲和素的特异性结合固定到96孔板上,洗涤3次。
第二步,将AA-P溶解在160mM的DEA buffer中,使其终浓度为10mM。再将上述溶液加入到第一步的孔板中37℃下孵化1h。然后再加入3μL 1M的硝酸银溶液来启动氧化还原反应原位生长银纳米粒子。肉眼观察孔板中的颜色变化,并用相机拍照,得到可视化检测结果;同时用微孔板读数器读取AgNPs在400nm处的吸光度值(A400nm),将IgG的浓度与A400nm做线性拟合。
实施例8:
一种基于银纳米粒子原位生长的可视化检测方法用于大肠杆菌的检测1
第一步,将不同浓度的灭活的大肠杆菌通过抗原抗体的特异性结合吸附到捕获抗体包被的96孔板上,DEA buffer(含0.05%tween 20)洗涤3次后,再将2ug/mL biotin-Ab2通过抗原抗体的特异性结合吸附到96孔板上,3次洗涤后将1ug/mL的streptavidin-ALP通过生物素与亲和素的特异性结合固定到ELISA孔板上,洗涤3次。
第二步,将AA-P溶解在160mM的DEA buffer中,使其终浓度为10mM。再将上述溶液加入到第一步的孔板中37℃下孵化1h。然后再加入3μL 1M的硝酸银溶液来启动氧化还原反应原位生长银纳米粒子。肉眼观察孔板中的颜色变化,并用相机拍照,得到可视化检测结果;同时用微孔板读数器读取AgNPs在400nm处的吸光度值(A400nm),将大肠杆菌的浓度与A400nm做线性拟合。
实施例9:
一种基于银纳米粒子原位生长的可视化检测方法用于金黄色葡萄球菌的检测1
第一步,将不同浓度的灭活的金黄色葡萄球菌通过抗原抗体的特异性结合吸附到捕获抗体包被的96孔板上,DEA buffer(含0.05%tween 20)洗涤3次后,再将2ug/mL biotin-Ab2通过抗原抗体的特异性结合吸附到96孔板上,3次洗涤后将1ug/mL的streptavidin-ALP通过生物素与亲和素的特异性结合固定到96孔板上,洗涤3次。
第二步,将AA-P溶解在160mM的DEA buffer中,使其终浓度为10mM。再将上述溶液加入到第一步的孔板中37℃下孵化1h。然后再加入3μL 1M的硝酸银溶液来启动氧化还原反应原位生长银纳米粒子。肉眼观察孔板中的颜色变化,并用相机拍照,得到可视化检测结果;同时用微孔板读数器读取AgNPs在400nm处的吸光度值(A400nm),将金黄色葡萄球菌的浓度与A400nm做线性拟合。
实施例10:
一种基于银纳米粒子原位生长的可视化检测方法用于血清中AFP的检测
第一步,将来源于54个不同的人的血清样品分别加入到捕获抗体包被的96孔板中,洗涤3次后,再将1.5ug/mL biotin-Ab2通过抗原抗体的特异性结合吸附到96孔板上,3次洗涤后将1ug/mL streptavidin-ALP通过生物素与亲和素的特异性结合吸附到孔板上,洗涤3次。
第二步,将AA-P溶解在160mM的DEA buffer中,使其终浓度为10mM。再将上述溶液加入到第一步的96孔板中37℃下孵化1h。然后再加入3μL 1M的硝酸银溶液来启动氧化还原反应原位生长银纳米粒子。用肉眼观察孔板中的颜色变化,并用相机拍照,得到可视化检测结果,同时用微孔板读数器读取AgNPs在400nm处的吸光度值(A400nm)。如图4是酶调节的银纳米粒子原位生长的方法和传统的ELISA方法用于血清中AFP检测的结果图。由图4可知酶调节的银纳米粒子生长的方法对于血清中AFP的检测灵敏度远远高于传统的ELISA方法。
实施例11:
一种基于银纳米粒子原位生长的可视化检测方法用于检测接受治疗后的癌症病人的血清AFP
第一步,将来源于7个接受治疗的不同的癌症病人的血清样品分别加入到捕获抗体包被的96孔板中,洗涤3次后,再将1.5ug/mL biotin-Ab2通过抗原抗体的特异性结合吸附到96孔板上,3洗涤次后将1ug/ml streptavidin-ALP通过生物素与亲和素的特异性结合吸附到96孔板上,洗涤3次。
第二步,将AA-P溶解在160mM的DEA buffer中,使其终浓度为10mM。再将上述100μL溶液加入到第一步的96孔板中37℃下孵化1h。然后再加入3μL1M的硝酸银溶液来启动氧化还原反应原位生长银纳米粒子。肉眼观察孔板中的颜色变化,并用相机拍照,得到可视化检测结果,同时用微孔板读数器读取AgNPs在400nm处的吸光度值(A400nm)。图5所示是酶调节的银纳米粒子原位生长的方法以及传统的ELISA方法对接受治疗后的癌症病人血清中AFP检测结果图。由图5可知酶调节的银纳米粒子生长的方法对于检测接受治疗后的癌症病人血清中AFP与传统的ELISA相比具有较高的检测灵敏度。
需要说明的是,本发明是一种基于贵金属纳米粒子原位生长的可视化检测方法及该检测方法的应用,同时给出了该方法在包括肿瘤标志物、细菌、病毒等多种物质在内的可视化检测方法,其目的是为了给出一种区别于传统方法的可视化检测方法,并非属于对疾病的诊断及治疗。说明书中所描述的肿瘤标志物等内容,只是为了起到对本发明的内容的了解及说明作用。另外,本发明方法是基于贵金属纳米粒子直接原位生长导致溶液颜色从无色到有色的明显变化,不需要任何复杂的探针修饰过程和精密的仪器设备,使得该方法具有广泛的普适性。仍需进一步说明的是,本发明不限于这里的实施例,本领域技术人员根据本发明的揭示,按本发明构思所做出的显而易见的改进和修饰都应该在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!