一种碳纳米管修饰电极的制备方法与流程
本发明涉及电化学领域,具体地说,涉及一种碳纳米管修饰电极的制备方法。
背景技术:
瘦肉精残留分析在食品安全领域的应用中至关重要,目前,用于瘦肉精分析有许多方法,常规的有高效液相色谱法、气相色谱-质谱法等。最近,电化学方法也备受关注,电化学方法由于其操作简单,成本低,并且灵敏度高而备受青睐。随着纳米材料及纳米孔隙技术的发展,研究发现可能通过构建电子加速通道,来释放有机物质微小的电学信号。
其中,碳纳米管(CNT)是常用的电极制备材料,碳纳米管(CNT)又名巴基管(buckytubes),是1991年由日本科学家饭岛(Iijirna)在高分辨透射电镜(HRTEM)下发现的一种针状管形碳,碳纳米管作为电极材料用于电化学研究则始于1996年,Britto研究多巴胺、细胞色素c和氧等的电催化伏安行为,证实了碳纳米管可加速在其界面上的电子转移。碳纳米管在化学性质上表现出类似石墨的反应惰性,但这种惰性是相对的,在一定条件下碳纳米管也能发生生化反应。
碳纳米管往往以物理吸附或粘附状态进行电极修饰,这种修饰方法使得碳纳米管在电极表面无序排列,这种无方向性排列形成的电子加速通道或催化通道与有机物接触的机会较小,降低了材料的利用效率。相比于无序排列的碳纳米管,有序排列的碳纳米管阵可以改善许多电化学性能及空间性能,基于其小直径,高比表面积和良好的导电性。因此形成竖直取向的单层壁碳纳米管丛(v-SWCNT)用作修饰电极是目前研究的热点。但是它如何装配在修饰表面位置上,且具有可控的密度和取向是研究的难点。两种方法常用于制备v-SWCNTs。一种是直接在基板上生成垂直排列的单壁碳纳米管,采用CVD法形成。这种方法制备条件苛刻,温度高,难以控制。另一个是通过将碳纳米管进行氧化截断,形成含有大量羧基官能团,然后利用化学合成方法将碳纳米管链接上基质。链接方法主要是通过Au-S,酰胺键,Si-O等完成。化学合成法是目前常用的v-SWCNTs制备方法,然而,化学合成方法过于复杂,通常要超长的时间(12小时,24小时)进行自组装,或需要绝对无水无氧的操作。
因此,亟需开发一种条件简单易控制、可操作性强的单层壁碳纳米管丛(v-SWCNT)修饰电极的制备方法。
技术实现要素:
为了解决现有技术中存在的问题,本发明的目的是提供一种碳纳米管修饰电极的制备方法及所述电极在检测瘦肉精方面的应用。
为了实现本发明目的,本发明的技术方案如下:
第一方面,本发明提供了一种碳纳米管修饰电极的制备方法,包括如下步骤:
1)将玻碳电极在重铬酸钾溶液中用循环伏安法扫描1~20圈,扫描范围为0V~1.6V,扫描速度为0.1~0.5V/s;
2)将步骤1)所得电极在乙二胺溶液中用循环伏安法扫描5~25圈,扫描范围为0V~2.0V,扫描速度为0.1~0.5V/s;
3)将步骤2)所得电极在碳纳米管溶液中用循环伏安法扫描5~25圈,扫描范围为0V~2.0V,扫描速度为0.1~0.5V/s。
其中,碳纳米管可加快电子在电极界面上的转移速度。乙二胺的氨基分别和电极表面的羧基、羧化碳纳米管的羧基发生反应,将碳纳米管有序地结合在电极表面。
作为优选,为了使所述电极在峰电流响应和出峰情况上具有更佳表现,本发明优化了上述步骤中的扫描圈数如下:在重铬酸钾溶液中用循环伏安法扫描4~5圈,在乙二胺溶液中用循环伏安法扫描20圈,在碳纳米管溶液中用循环伏安法扫描20圈。
需要说明的是,在以上优化中择其一或择其二进行,也属于本发明的保护范围。
进一步地,所述玻碳电极在使用前进行打磨处理,并用循环伏安法扫描(-1.0V~1.0V)至曲线稳定,取出电极并洗净,放入铁氰化钾溶液中进行表征(-0.2V~0.6V),表征的要求为ΔE<64V。
所述铁氰化钾溶液的制备方法为:将0.1M KCl和0.05mM k3Fe(CN)6混合,配制成铁氰化钾溶液,溶液呈透明的亮绿色。
更进一步地,所述打磨处理可采用常规方法,也可优选下述打磨方法:
用0.3mm Al2O3在光滑的鹿皮表面打磨玻碳电极3-5min后用1:1乙醇超声2-3min,取出电极用蒸馏水冲洗干净,再用0.05mm Al2O3打磨3-5min,用1:1HNO3溶液、蒸馏水分别超声2-3min。
进一步地,所述重铬酸钾溶液的浓度为2.5~10%,优选2.5%;所述乙二胺溶液的浓度为5~15mM,优选5mM;所述碳纳米管溶液的浓度为2.5~10g/L,优选4g/L。
第二方面,本发明提供了前述方法制备得到的碳纳米管修饰电极,以及所述碳纳米管修饰电极在检测瘦肉精方面的应用。
所述应用具体可体现在一种检测瘦肉精的方法,具体为,将待测样品溶于pH1~8的缓冲溶液中,用循环伏安法或方波伏安法,在-1.0V~1.2V条件下扫描检测。
本发明经过对比检测方法和缓冲溶液pH值对检测结果的影响后,优选一种最佳的检测方案为:将待测样品溶于pH1的硫酸缓冲溶液中,用方波伏安法,在-0.4V~1.2V条件下扫描检测。
所述缓冲溶液可为本领域常规使用的缓冲溶液。
本发明的有益效果在于:
本发明首创不使用任何酰胺化化学试剂,仅仅使用简单的电循环伏安法,将固态的碳纳米管以化学键合的方式键合在电极表面,合成v-SWCNT到玻碳电极(GCE)。碳纳米管成功通过乙二胺作为桥梁,在GCE上有序可控生长,形成单层碳纳米管阵列。
本发明所制备的电极对瘦肉精的检测灵敏度高,检测速度快。该修饰电极制备方法新颖,修饰材料简单,操作安全。下一步将尝试电极在实际农残检测中的应用。
附图说明
图1为重铬酸钾溶液氧化电极5、10、15、20圈检测瘦肉精(SWV法扣背景)。
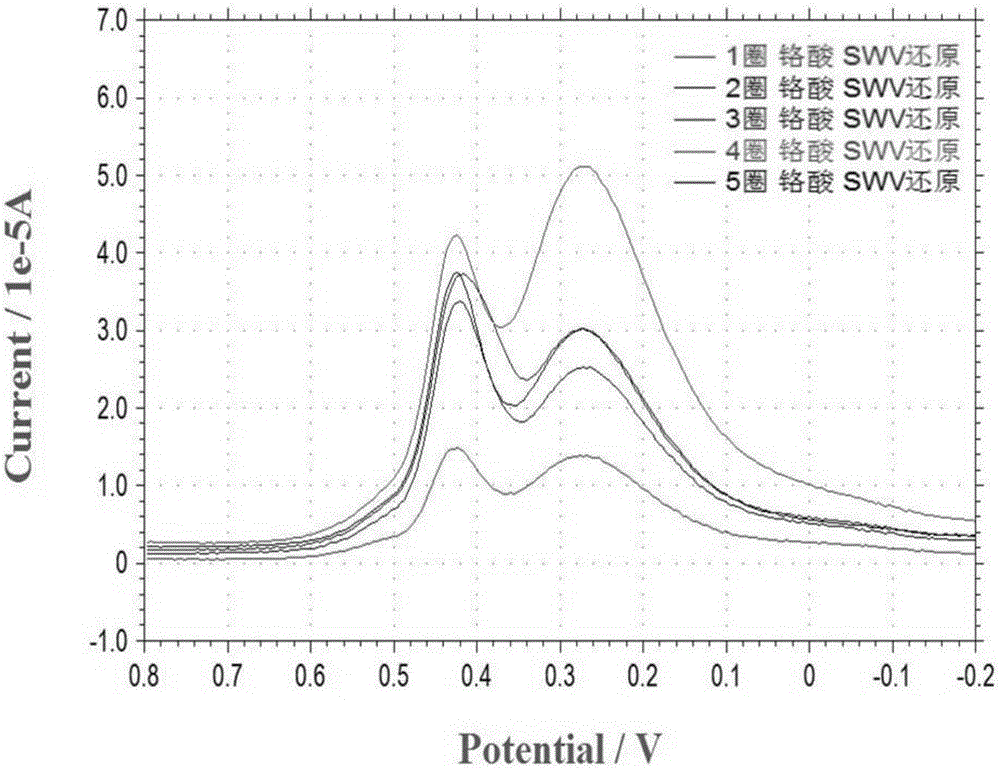
图2为重铬酸钾溶液氧化电极1、2、3、4、5圈检测瘦肉精(SWV法扣背景)。
图3为乙二胺溶液修饰电极5、10、15、20圈检测瘦肉精(SWV法扣背景)。
图4为乙二胺溶液修饰电极20、25圈检测瘦肉精(SWV法扣背景)。
图5为碳纳米管修饰电极5、10、15、20圈检测瘦肉精(SWV法扣背景)。
图6为碳纳米管修饰电极20、25圈检测瘦肉精(SWV法扣背景)。
图7为碳纳米管修饰电极在pH1-8环境中检测瘦肉精(SWV还原法扣背景)。
图8为碳纳米管修饰电极在pH1-8环境中检测瘦肉精(SWV法扣背景)。
图9为碳纳米管修饰电极在pH1环境中检测16ppm瘦肉精(CV法)。
图10为碳纳米管修饰电极在pH1环境中检测16ppm瘦肉精(SWV还原法)。
图11为碳纳米管修饰电极在pH1环境中检测16ppm瘦肉精(SWV氧化法)。
图12为检测10、30、60、90、120ppb瘦肉精其碳纳米管峰电流响应情况(A为SWV还原图,B为扣背景SWV还原图)。
图13为检测10、30、60、90、120ppb瘦肉精其碳纳米管峰电流响应情况(A为SWV氧化图,B为扣背景SWV氧化图)。
图14为检测10、30、60、90、120ppb瘦肉精其碳纳米管峰电流值的线性关系(SWV还原法扣背景)。
图15为检测10、30、60、90、120ppb瘦肉精其碳纳米管峰电流值的线性关系(SWV氧化法扣背景)。
图16为GCE、乙二胺/GCE、碳纳米管/乙二胺/GCE三种修饰电极的方法检测16ppm瘦肉精(SWV还原法)。
图17为GCE、乙二胺/GCE、碳纳米管/乙二胺/GCE三种修饰电极的方法检测16ppm瘦肉精(SWV氧化法)。
图18为修饰电极镜面照片。
图19为SEM表征碳纳米管/乙二胺/玻碳电极。
图20为本发明所述碳纳米管修饰电极的制备方法流程示意图。
具体实施方式
下面将结合实施例对本发明的优选实施方式进行详细说明。需要理解的是以下实施例的给出仅是为了起到说明的目的,并不是用于对本发明的范围进行限制。本领域的技术人员在不背离本发明的宗旨和精神的情况下,可以对本发明进行各种修改和替换。
下述实施例中所使用的实验方法如无特殊说明,均为常规方法。
下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
实施例1
一、试剂与仪器
主要仪器:
电化学测量采用CHl420A型电化学工作站(上海辰华仪器公司);三电极系统:玻碳电极为工作电极,Hg/HgCI(饱和KCl溶液)电极为参比电极,铂丝电极为对电极。
试剂:
1、250μg/mL盐酸克伦特罗;
2、单壁碳纳米管(上海鼎雳化工);
3、0.25mol/L的硫酸溶液;
4、重铬酸钾混合溶液:2.5%K2CrO7+10%HNO3溶液,溶液呈透明的橘黄色;
5、乙二胺混合溶液:5mM乙二胺+0.1M KNO3水溶液,整体无色透明;
6、碳纳米管混合溶液:100mg SWCNTs经过2.6%HNO3溶液加热回流24小时,过滤去除硝酸溶液,将碳纳米管混于10mL 65%HNO3与浓硫酸1:3(V/V)的混合溶液中,超声处理,冰浴控温,反应4小时。反应后倒入100mL冰水,离心分离,三次水清洗碳纳米管至中性,在105℃烘干得功能化碳纳米管;称量2mg功能化SWCNTs溶于5mL水中,再加入0.1M KNO3,用封口膜封好,放入超声仪中超声3-6分钟,配置成碳纳米管混合溶液;
7、电解质溶液(pH1-8缓冲溶液):连接pH酸度计电源,洗净玻璃电极,用pH=4.0和pH=6.86缓冲剂进行两点校准,待仪器校准完毕,再洗干净玻璃电极测pH溶液。pH1、2溶液的配制:0.1M KCl去离子水溶液加浓硫酸配制;pH3、4、5、6、7、8溶液配制:0.1M NaHPO43-,加入浓硫酸或氢氧化钠调整相应pH;
8、铁氰化钾混合溶液:将0.1M KCl和0.05mM k3Fe(CN)6混合,配制成铁氰化钾溶液,溶液呈透明的亮绿色。
除非特别说明,下面所用溶液皆为配置好的混合溶液,实验用水为去离子三次水。
二、实验过程
1、打磨电极并表征
用0.3mm Al2O3在光滑的鹿皮表面打磨玻碳电极3-5min后用1:1乙醇超声2-3min,取出电极用蒸馏水冲洗干净,再用0.05mm Al2O3打磨3-5min,用1:1HNO3溶液、蒸馏水分别超声2-3min;取0.25mol/L硫酸溶液5mL放入底液槽中,打开仪器,连接电极,用循环伏安法(-1.0V~1.0V)扫描至曲线稳定,然后取出电极,用蒸馏水清洗干净,放入配制好的铁氰化钾溶液中进行表征(-0.2V~0.6V),表征的要求为ΔE<64V。
2、优化修饰溶液的圈数及电解质溶液的pH
优化电极之前,先设定除优化溶液之外的其他修饰溶液圈数为5圈,电解质溶液为pH1缓冲溶液。
2.1优化氧化重铬酸钾溶液的圈数
取重铬酸钾溶液5mL,放入底液槽中,连接电极,将打磨好的电极分别用循环伏安法(CV法)(0V~1.6V)扫描1、2、3、4、5、10、15、20圈,乙二胺溶液、碳纳米管溶液、电解质溶液等优化条件不变,检测瘦肉精。
2.2优化乙二胺溶液的圈数
取乙二胺溶液5mL,放入底液槽中,连接电极,将打磨好的电极分别用CV法(0V~2.0V)扫描重铬酸钾溶液4圈,扫描乙二胺溶液5、10、15、20、25圈,碳纳米管、电解质溶液等优化条件不变,检测瘦肉精。
2.3优化碳纳米管溶液的圈数
将打磨好的电极分别用CV法(0V~2.0V)扫描重铬酸钾溶液4圈、乙二胺溶液20圈后,将碳纳米管混合溶液在超声仪中超声3-6min,待其分散均匀,取出5mL放入底液槽中,连接电极,为底液槽通入高纯氮,扫描碳纳米管5、10、15、20、25圈,电解质溶液优化条件不变,检测瘦肉精。
2.4优化电解质溶液的pH
将修饰好的电极分别放入5mL pH1-8的缓冲液中,检测瘦肉精。
三、结果与讨论
1、探索最佳优化修饰溶液的圈数及电解质溶液的pH
1.1氧化重铬酸钾溶液圈数
先扫描重铬酸钾溶液5、10、15、20圈,检测16ppm瘦肉精,将其扣背景的曲线进行对比,如图1,观察到电极在扫描5圈后瘦肉精的峰电流响应最佳。继续优化,扫描重铬酸钾溶液1、2、3、4、5圈,检测16ppm瘦肉精,将其扣背景的曲线进行对比,发现在扫描4圈的的时候,瘦肉精的峰电流响应最佳,如图2,因此将重铬酸钾溶液的最佳氧化圈数定为4圈。
1.2优化乙二胺溶液圈数
用扫描乙二胺溶液5、10、15、20圈的电极检测16ppm瘦肉精,对比其扣背景后瘦肉精的峰,发现在20圈的时候,瘦肉精的峰电流响应最佳,如图3。继续优化,扫描乙二胺溶液20、25圈,检测6ppm瘦肉精,对比其出峰情况,发现25圈以上的时候碳纳米管与瘦肉精底峰基本重合,不利于检测,因此,将乙二胺溶液的最佳优化圈数定为20圈,如图4
1.3优化碳纳米管溶液圈数
扫描碳纳米管溶液5、10、15、20圈,检测6ppm瘦肉精,对比其扣背景后的出峰情况,观察到在扫描20圈的时候,瘦肉精的峰电流响应最佳,如图5。继续优化,扫描碳纳米管溶液20、25圈,检测16ppm的瘦肉精,观察其出峰状况,发现在扫描20圈的时候,瘦肉精的峰电流响应最佳,其原因主要是扫描碳纳米管的圈数越多,酰胺化反应几率越大,达到了反应饱和,反应圈数不能再促进反应,因此不选择25圈,如图6。
1.4优化电解质溶液(pH1-8缓冲溶液)
将优化好的电极放入pH1-8的缓冲溶液中检测6ppm的瘦肉精,将所得的瘦肉精的峰扣除空白背景,8种峰进行对比,发现在pH1的环境下,瘦肉精的峰电流响应最佳,如图7、8,可以发现,pH越低越有利于检测,证明质子参与到氧化还原中,但考虑到电极以酰胺键结合的稳定性,低pH不利于电极稳定,所以,pH1是合适的条件。
2、碳纳米管修饰电极检测瘦肉精
取5mL pH1空白缓冲溶剂,用循环伏安法(CV法)、方波伏安法(SWV法)(-1.0V~1.2V)扫描,得出空白对照,再加入16ppm瘦肉精分别扫描,得出瘦肉精峰的响应情况,如图9、10、11。碳纳米管修饰电极在pH 1处,瘦肉精在0.42V左右有一对氧化还原峰。采用SWV法,发现SWV法峰的灵敏度大大上升,这是因为使用SWV法扫描的时候噪音较少,因此,选择用SWV法进行检测。
3、检测不同浓度瘦肉精其碳纳米管所出的峰
用SWV法扫描(-0.4V~1.2V),检测10ppb、30ppb、60ppb、90ppb、120ppb瘦肉精,对比其碳纳米管的峰,如图12、13。
4、碳纳米管修饰电极检测不同浓度瘦肉精根据其碳纳米管峰电流响应得出线性关系。
分别检测10ppb、30ppb、60ppb、90ppb、120ppb瘦肉精,碳纳米管峰有以下线性关系,图14、15。
实验结果表明,碳纳米管自身的氧化还原峰会随瘦肉精的加入而增高,且两者呈现良好的线性关系。在10-120ppb的盐酸克伦特罗浓度检测中,峰电流增加,两者的R2值在99.4%以上。
5、GCE、乙二胺/GCE、碳纳米管/乙二胺/GCE修饰电极检测瘦肉精,观察其出峰情况
取pH1空白缓冲溶剂,将三种不同方法修饰的电极用SWV法(-0.4V~1.2V)扫描,得出空白对照,再加入16ppm瘦肉精,将结果进行对比,如图16、17。
实验结果表明,碳纳米管修饰电极检测瘦肉精,其峰电流响应相对于裸电极、乙二胺修饰电极等大大提高,且使用化学合成方式修饰的电极稳定,不易脱落。修饰电极保持在冰箱一个月后,电极对瘦肉精检测结果几乎不变。
6、修饰玻碳电极过程中电极的表征
如图18,裸电极被修饰上乙二胺及碳纳米管后电极表面颜色截然不同。裸电极是金属银颜色,乙二胺链接上电极后呈现暗黄的颜色,而碳纳米管与乙二胺交联后呈现宝蓝色金属光泽。整个颜色变化的过程证明了乙二胺与碳纳米管已链接上电极。为了进一步证实电合成法修饰碳纳米管的有效性,尝试不进行乙二胺链接步骤,直接链接碳纳米管,结果电极表面未能呈现宝蓝色金属光泽。实验结果再次表明,电合成的核心在于酰胺键的形成。
图19是SEM表征碳纳米管/乙二胺/玻碳电极,可见电极表面明显的碳管存在。
虽然,上文中已经用一般性说明及具体实施方案对本发明作了详尽的描述,但在本发明基础上,可以对之作一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。
- 还没有人留言评论。精彩留言会获得点赞!