检测目标生物分子的装置的制作方法
本申请要求南非的申请号为2015/08499、申请日为2015年11月18日的临时专利申请的优先权,其通过引用被结合在本文中。
技术领域:
本发明涉及一种检测目标生物分子的装置。特别的,涉及一种通过测量导电膜的电导率的变化来检测目标生物分子的装置,所述膜附加有被配置与目标生物分子结合的生物识别组分。
背景技术:
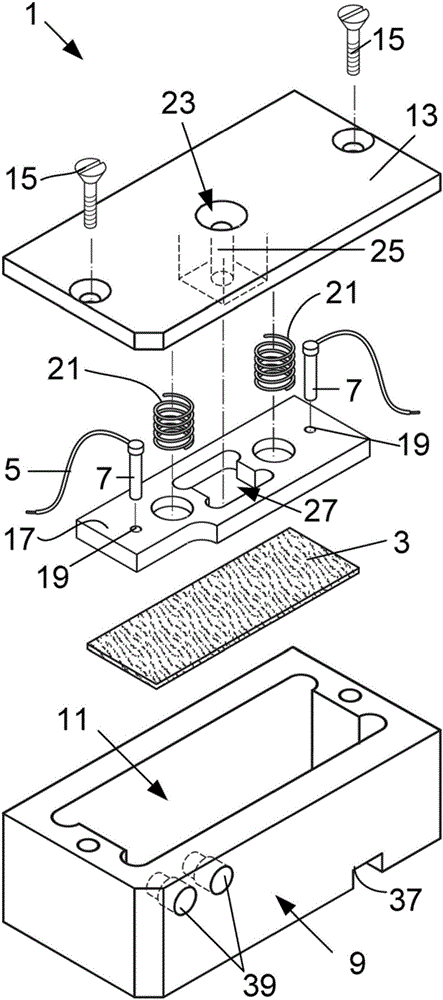
:病原感染的早期诊断可帮助减少由病原感染导致的人类疾病和意外死亡事件的数量。感染可进一步的通过病原体在未消费的水中或食品中的检测而减少。传统的病原检测方法例如聚合酶链反应,免疫学基础的方法,和培养以及菌落计数通常会需要较长的时间来获得精确的结果且在偏远地区会较贵和难以获得。为了解决这个问题,多种检测生物分子的用于诊断和质量控制目的的生物传感器已经被发展。电化学生物传感器是用来通过分子识别检测悬浮于溶液中的目标生物分子的传感器。典型的电化学生物传感器包括至少一个电极,所述电极具有固定于电极表面的生物识别组分其能够与溶液中的目标分子结合或复合。生物识别组分可以是例如病原体或抗原,抗体,酶或核酸。生物传感器被配置用于测量电极的电导率的变化,所述变化是由于溶液中的生物分子与固定于电极上的生物识别组分的结合或复合。实质上,当电极连接于施加了恒定的电位差和电流的电路时,电极的电阻的变化被测量。电化学生物传感领域最近的发展已经实现了所谓“导电织物”的使用,其为由涂有导电高分子涂层聚合物纤维构成的膜,作为电极。超细纤维提供大的表面积用于生物识别组分在电极表面大量的固定。申请人知晓在一个实验室规模的系统内导电织物被浸入缓冲溶液并通过导电金属夹连接电路作为电极。导电织物和金属夹均浸入包括氯化钠,氯化钾,磷酸钠和磷酸钾盐的溶液中。然后包括生物分子的待测样品溶液被加入缓冲溶液且在样品溶液加入后导电织物在电导率上的改变被测量。然而,浸入的电极在溶液中参与与盐的电化学反应,在检测过程中产生了大量的本底效应降低了系统的灵敏度。作为浸入盐溶液的结果,电极也对由在电极表面的氧化还原反应导致的随时间的退化敏感。该系统也需要相当大的缓冲液容积,在实验室环境之外很难容易的得到。总之,现有的使用导电织物用于生物分子检测的系统较复杂,而且是实验室范围的系统其不适于本领域的使用或重复使用,且对非常小的流体样品使用时不够灵敏。因此具有对成本,通用性,灵敏度和鲁棒性好的检测生物分子存在的装置的需求。理想地装置应具有较为简单的结构和容易使用使其能够在本领域使用用来快速的检测连接于病原体或污染物的生物分子。本发明的背景的前述讨论目的仅为帮助对本发明的理解。应注意前述讨论并不确认或承认所引用的材料为本申请的优先权日之前的本领域内的现有技术的一部分。技术实现要素:根据本发明,提供了一种检测目标生物分子的装置,包括导电膜,所述膜上固定有用来结合目标生物分子的生物识别组分,所述膜通过电极被连接到电路;电压源,用来在电路内提供电压;和电阻监控装置,当指定体积的流体样品被输送到膜上时用于监控膜的电阻。进一步的特征为膜安装到不导电支架上,所述不导电支架被配置为可释放的接收和固定导电膜使得它接触电极;支架限定容纳膜的室;延伸进入室内的电极接触容纳在其中的膜;支架包括用于指定体积的流体样品到膜上的传输的入口;流体样品的指定体积为10到1000μl。进一步的特征为膜由固有导电性能的纤维或涂有导电涂层的聚合物纤维制成;导电涂层为选自聚吡咯、聚噻吩、聚苯胺和聚乙炔的可选择地包括掺杂剂的聚合物涂层。进一步的特征为通过交联剂将生物识别组分附加到膜上;生物识别组分可以为有效的结合目标抗体的抗原或有效的结合目标抗原的抗体。进一步的特征为所述装置包括控制器其被配置为发出机器可读的指令到电压源以施加电压,并进一步被配置为发出机器可读的指令到电阻监控装置以监控并读取跨膜电阻的读数。控制器被配置为发出机器可读的指令到发信号的元件,若通过电阻监控装置测量的电阻高于设定的阈值电阻,所述发信号的元件产生目标生物分子的检测信号,所述阈值电阻为没有流体样品传输到膜时膜的电阻;控制器被配置为处理膜的电阻的读数以确定样品中生物分子的数量并确认流体样品污染或感染的级别;控制器具有用户界面和显示屏用来显示信号、生物分子量化的数量和/或污染或感染的级别。进一步的特征为电阻监控装置为跨膜连接的电压测量装置膜且膜的电阻根据跨膜测量的电压降确定。进一步的特征为装置为便携式和电池供电。根据本发明的第二方面为使用上述的装置检测目标生物分子的方法,包括以下步骤:传输指定体积的流体样品到导电膜上,被配置为结合目标生物分子的生物识别组分被固定在所述导电膜上;监控膜的电阻;以及若电阻高于阈值电阻,产生目标生物分子的检测信号。本发明的实施例下面将根据相应的附图仅通过举例被描述。附图说明在附图中:图1为根据本发明的检测目标生物分子的装置的实施例的三维分解图;图2为图1的实施例的各部件在其相应位置的三维分解图;图3为图1的实施例的组装状态的三维分解图;图4为图1的实施例的组装状态的剖视图;图5为图1的实施例的组装状态和控制器的三维分解图;图6为检测生物分子的装置的进一步实施例的三维分解图;图7为具有电极的支架的仰视图;图8为图7的支架的俯视图;图9为装配有盖的支架的三维视图;图10为本发明的实施例的电路示意图;图11为示出相同过程制备的三个不同导电膜的电阻随时间变化的函数图;图12为示出三个不同导电膜的电阻随时间变化的函数图,交联剂戊二醛被附加到所述导电膜;图13为示出三个不同导电膜的电阻随着时间变化的函数图,交联剂戊二醛和溶菌酶蛋白被附加到所述导电膜;图14为示出四个不同的具有溶菌酶的导电膜的电阻随时间变化的函数图,200μl的313.6μl/ml抗体溶液被添加到膜上;图15为示出四个不同的具有溶菌酶的导电膜的电阻随时间变化的四条函数图,200μl的15.8μl/ml抗体溶液被添加到膜上;图16为示出四个不同的具有溶菌酶的导电膜的电阻随时间变化的四条函数图,200μl的0.8μl/ml抗体溶液被添加到膜上;图17为具有溶菌酶的导电膜的电阻随时间变化的函数图,200μl的15.8μl/ml含对溶菌酶非特异性抗体的抗体溶液被添加到膜上;图18为示出膜的电阻随时间变化的组合函数图,每个不同浓度(313.6、15.8和0.8μl/ml)的抗体溶液被应用到膜;进一步包括应用了非特异性抗体和不含抗体溶液的分别作为阳性和阴性对照的组合曲线;图19为示出图18中的电阻在最初5分钟随时间变化的组合函数图;图20为示出在最初5分钟之后电阻随细菌浓度膜的增加的函数图;和图21为随着将抗溶菌酶抗体溶液向固定有溶菌酶的纸基膜添加,纸基膜电阻从基础电阻变化的函数图。具体实施方式本发明提供使用导电膜检测在流体中的目标生物分子的装置,所述导电膜具有被配置为结合目标生物分子的生物识别组分。膜与电路通过由导电金属例如金、铜或铂制成的电极连接。在电路内连接的电压源向膜提供电压,所述电压被指定在通常不会引起固定在膜上的生物识别组分变性或降解的电压范围内。当指定体积的流体样品被传输到膜上时电阻监控装置监控膜的电阻,所述流体样品疑似含有能够与生物识别组分结合的生物分子。电阻监控装置可以是跨膜连接的电压测量装置。从而膜的电阻自跨膜的电压降确定。膜被安装到不导电支架上。支架被配置为可释放的接收和固定导电膜,使得它在电极之间延伸。电极可被附装或可调节地固定到支架上使得它可自支架向膜延伸。膜可夹在电极之间或夹在电极和支架之间。电极被适当地放置以接触膜并可通过合适的偏移方式例如弹簧偏移到它可接触膜的位置。支架可限定容纳膜的室以保护膜免受环境影响并提供相对稳定的测试环境。电极自支架延伸并进入可接触膜的室内。如果需要,支架可包括进入孔用来使电线在室内穿过支架向电极延伸。支架可限定传输指定体积的流体样品到膜上的入口,流体样品优选的在10到1000μl的范围,优选的100到300μl。入口可位于使得指定体积的流体样品被传输到膜的中心区域且可位于电极在支架长度方向的中部。膜可由固有导电聚合物纤维或涂有导电涂层的纤维制成。膜可由非常细、高碳石墨管纳米纤维组成其被加热处理以碳化化学蒸汽沉积存在于纳米管例如的表面上的碳。或者,聚合物纤维可以是涂有导电涂层的天然或合成纤维,例如选自聚吡咯、聚噻吩、聚苯胺、聚乙炔的聚合物涂层。在天然纤维的情况,膜可由涂有导电涂层压制成指定厚度的纸的纤维素纤维制成。或者聚丙烯的合成聚合物纤维可涂有导电涂层。生物识别组分可以是抗原,抗体,酶或核酸或其它类型的生物分子。生物识别组分被配置为能够结合到目标生物分子。因此生物识别组分具有结合部位其与在目标生物分子上的结合部位互补。例如生物识别组分可以是抗体例如抗大肠杆菌抗体其可有效结合抗原例如大肠杆菌细菌以检测在水样品中的大肠杆菌污染。或者生物识别组分可以是抗原例如大肠杆菌其结合抗大肠杆菌抗体以检测在动物性流体样品中的感染。在生物识别组分是核酸的情况下,它可被用于检测目标病毒的存在。生物识别组分用合适的交联剂被附加到导电膜。根据生物识别组分和膜各自的特性和种类,任何合适的交联剂可被用于连接生物识别组分到膜上。交联剂应具有恰当的化学官能团以通过可能已在超细纤维的表面上具有的官能团结合导电纤维,以及结合第二生物识别组分,优选的通过共价键其提供相对稳固的连接。装置可包括控制器其被配置为发出机器可读的指令到电压源以施加电压,并发出机器可读的指令到电阻监控装置以监控并读取膜的电阻的读数。控制器进一步包括发信号的组件,在这种情况下控制器被配置为发出机器可读的指令到发信号的元件,若通过电阻监控装置测量的电阻高于设定的阈值电阻,所述发信号的元件产生目标生物分子的检测信号。所述阈值电阻可设定与没有流体样品传输到膜时膜的电阻相同;基本不含有生物分子的对照流体被传输到膜上时膜的电阻;或含有生物识别组分将不识别或结合的生物分子的对照流体被传输到膜时膜的电阻。装置可包括第二对照膜,其电阻被监控并测量以确定阈值电阻,用来相对于在第二膜上测量的电阻变化更加准确的评价第一膜上的电阻变化。支架可被适当地调整以允许它接收和固定第二膜并向它提供第二组电极和电线。如果需要,支架也可包括第二入口用于传输对照溶液到第二膜上。控制器可被配置为处理跨膜电阻的读数以确定样品中生物分子的数量并确认流体样品污染或感染的级别。控制器可包括用户界面和显示屏例如LCD(LCM1602)显示器用于显示信号、生物分子量化的数量,和/或污染或感染的级别。装置可以是便携的、即时检验装置其由便携电压源例如电池或太阳能电池板供电。电压源可被配置同时向与膜连接的电极提供电压和向控制器和电阻监控装置供电。检测生物分子的装置1的实施例被示出于图1到图5中,包括基本上为矩形的面积约为30mm×15mm的导电膜3,具有选定的生物识别组分例如抗原或抗体固定于其表面。在这个实施例中,膜3由具有50g/m2厚度的聚丙烯超细纤维形成。所述超细纤维被布置形成无纺,纺粘和点融织物膜,膜的超细纤维基本被均匀涂有导电涂层,特别是聚合物涂层,使用水沉积工艺。导电涂层是涂有聚吡咯的涂层,通过膜超细纤维与包含3-噻吩乙酸(3TAA)的吡咯单体溶液的共聚反应得到。3TAA确保可共价连接到交联剂和/或直接连接到生物识别组分的官能团的包含以将生物识别组分固定于膜的超细纤维表面。在共聚作用下,超细纤维在三氯化铁溶液中被涂层5-磺基水杨酸。交联剂,本实施例中为戊二醛,用于将生物识别组分连接到膜。戊二醛可与胺基反应,胺基在例如蛋白质的生物分子上常见。固定了生物识别组分的导电膜3通过连接于导电电极7的电线5连接于电路。在本实施例中,电极为金制成的销形式。膜3被接受于由支架9界定的室11内。室11与膜3形状互补。支架9由非导电材料例如塑料材料制成。支架9包括将膜3封入室11内的盖13。盖13使用合适的紧固件或紧固方式固定于室11的开口末端,在本实施例中为螺丝15。所述支架9包括电极7的可被接收进室11的底座17。所述底座具有孔穴19形式的定位构造,电极7可穿过所述孔19延伸。所述孔穴19之间间隔指定的距离用来定位电极以便所述膜以组合的状态延伸。所述底座17通过弹簧21形式的偏移手段朝向膜3偏移,所述弹簧21在盖13和底座17之间为可操作的。所述弹簧21可操作的朝向膜偏移电极从而保持电极7和位于室11内部的膜3之间的接触。电极7被设置应用或多或少同样的压力到膜3来改善膜3的电阻的读取精度。所述支架9的盖13进一步设定入口23用于流体样品到使用中的膜的中心区域的传输。所述入口23被布置位于电极7在支架9长度方向的中部。所述盖13设定了的通道25,在图1和图2中以虚线示出并在图4中更清楚的示出。所述通道25直接输送流体样品到使用中的膜3上。所述通道25在膜3的方向穿过底座17的窗口27延伸并可操作的终止于膜3上方。检测生物分子的装置31的实施例包括示出于图5的控制器。图1-4中示出的包括膜9和所有装配的元件的所述支架9被插入便携计算装置35的体部所限定的腔33内。支架9和计算装置35上互补的定位构造37确保支架9固定于腔33内。计算装置的体部包括穴41,当支架被接受进入腔33内部时所述穴41与支架9入口23对齐用来给入口23提供通道来传输待测液体样品穿过穴41并进入入口23使得液体样品能够传送到使用中的膜3上。支架9具有两个电触头39用来确保在电极和电阻监控装置之间的电气通讯使得膜的电阻可被监控和记录。控制器,优选的为微控制器,被设置发出机器可读的指令到电压源以施加电压到膜,并发出机器可读的指令到电阻监控装置以在指定体积的流体样品输送到膜之后监控并读取电阻的读数。控制器进一步被设置处理膜的电阻的读数来发出生物分子在样品中存在的信号和/或确定样品中生物分子的数量并确认流体样品污染或感染的级别。控制器也可以包括用户界面43用来给用户进行输入。其具有LCD显示屏45,用来显示信号,生物分子量化的数量,和/或污染或感染的级别。在可替换的实施例中,用户界面可被设置允许用户同时输入和输出。图5的实施例可被用作便携、即时检验装置用来检测目标生物分子并由电池供电。该装置可进一步被设置与另一个装置串联的或无线的通讯,例如个人电脑或手机。检测生物分子的装置的进一步的实施例被示出于图6到9并包括大体上方形的大约30×30mm的导电膜103,其上固定有选定的生物识别组分。生物识别组分所固定的导电膜103通过连接于铜板形式的导电电极107的电线105连接于电路。电极107,以虚线示出于图6,之间分开有17mm并固定于支架109。盖111与支架109配合,且当支架109、膜103和盖111组装时膜103被封闭于盖111和固定于支架109的电极107之间。附装有电极的不导电的支架109被示出于图7和8并优选的由塑料支撑。支架包括进入孔117,如图8所示,具有1mm的半径用于提供通道给电线105以穿过支架109延伸。支架进一步包括均具有2.2mm半径的入口115其位于电极107之间用于流体样品到使用中的方形膜的中部区域的传输。提供了入口的支架109的入口115,与由支架限定的17×17mm的凹处121相通,所述膜在装置组装状态下横跨所述凹处延伸。穿过所述入口115进入由支架限定的凹处121并到达膜上的传输,可由吸管吸取选定体积的流体样品并使用微量吸管注射进入口115实施。若得不到微量吸管,可将若干滴流体样品穿过入口滴到膜上。作为流体样品体积的粗略的参考,可通过逐滴滴加实施,大约四滴液体等于大约200μl。支架109被设置与盖111配合用来可释放的接收和固定导电膜使得它至少部分的在电极上延伸使其与电极实现接触。如图9所示支架109和盖111当处于组装情况下时电线105朝向附装于支架109的电极延伸。支架109的形状和尺寸使其可至少部分的被接收进盖111的内部,使得当支架109和盖111组装时附装到支架109表面的电极实质上毗邻于盖111的与电极相对的内部表面。支架109包括两个在支架109相对的两侧延伸的侧壁125,当与盖111组装时,所述侧壁覆盖盖111的外表面127的一部分延伸用来限定支架插入盖111的程度。盖111确保膜的直接环境是标准的,限制使用者在测量时接触膜。理想状态下,支架的封盖当与支架接合时必须施加同样的力到膜和电极上。在本实施例中,封盖具有18×18的窗口135其允许使用者能够接触到膜用来移除或更换它。在可替换的实施例中,封盖可具有封闭的末端。装置的电线所连接的电路的实施例示出于图10中。电路200包括电压源203其提供电压到电极并因此到达作为电阻器的膜207。由于生物分子和生物细胞的特性,0.2到0.8V之间的电压被施加以避免对生物识别组分的损坏。第二可变电阻器209被串联连接于电压源203。可变电阻器209的电阻是已知的并可被调整为近似与膜207的期望电阻相关。电阻监控装置205被提供作为电路的一部分,当电压被电压源施加到膜上且指定体积的流体样品到膜的中心区域时被设置监控膜的电阻。流体样品为待检测是否存在能够与膜上固定的生物识别组分结合的生物分子的样品。流体样品可以是已被制成提供合适的液态样品的来源于人或动物的生物流体,水样品,或食品样品。流体样品可包括缓冲溶液例如磷酸盐缓冲盐水。在使用中,生物分子与生物识别组分的特异性结合产生了更大的分子络合物,其通常不导电,因此会降低穿过结合区域的膜的电导率。由于增加的电阻和跨膜电阻的增长率的测量,络合物的检测得以实现。膜能够检测的生物分子取决于其类型或固定于膜上的精确的生物识别组分。生物分子检测装置可被使用于检测生物分子的方法中。这样的方法包括:首先,提供可能包含目标生物分子的流体样品。然后流体样品被输送到本文描述的装置的膜上,膜的电阻被监控并记录指定时间。若电阻增加到高于控制器设定的阈值电阻,通过发信号的元件产生信号表示已知能与膜上的选定生物识别组分反应和结合的目标生物分子的检测为阳性。检测样品溶液中的原发性抗溶菌酶抗体的典型方法被描述。在这个装置中生物识别组分为与导电膜交联的溶菌酶。实施例实施例1检测抗溶菌酶抗体的存在的装置的能力使用固定了溶菌酶作为生物识别组分的膜进行测试。方法1、导电膜的制备一张具有50g/m2厚度的无纺、纺粘和点融聚丙烯超细纤维被切割成90×90mm2的正方形薄片。薄片的超细纤维具有包括掺杂聚吡咯共聚物的导电涂层。吡咯单体与具有羧酸官能团的3-噻吩乙酸(3TAA)共聚。浓度为10mg/ml的3TAA溶液与10%的吡咯混合且超细纤维薄片被浸入溶液几秒然后取出。然后超细纤维薄片被置于包含0.1M的氯化铁(FeCl3)的30ml去离子水溶液的玻璃反应釜内。每10ml作为氧化剂的FeCl3中,加入体积为1ml的0.1M的5-磺基水杨酸(5SSA)作为掺杂剂。试剂在室温下反应30分钟,同时轻柔的摇动以实现吡咯单体的氧化聚合的发生。超细纤维薄片然后被去取出并使用去离子水清洗然后放置四小时干燥。2、戊二醛的结合被涂层的导电超细纤维薄片被切割成更小的30mm×30mm膜。更小的膜用蒸馏水清洗并放置干燥5分钟。薄片浸入2.5mM戊二醛溶液中然后在4℃培养一小时,之后超细纤维膜再次用蒸馏水清洗并干燥10分钟。3、溶菌酶固定导电的具有戊二醛涂层的超细纤维膜使用蒸馏水清洗并放置干燥5分钟。溶菌酶溶液在无菌玻璃容器中使用100μg/ml的从鸡蛋清蛋白(Roche,Mannheim,Germany)中得到的溶菌酶在包含137mmol/LNaCl,2.7mmol/LKCl,10mmol/LNa2HPO4和1.8mmol/LKH2PO4的磷酸盐缓冲盐水(1XPBS)被制备。膜用1XPBS漂洗大约10秒然后浸入溶菌酶溶液并在4℃培养2h。在培养后,超细纤维膜用1XPBS清洗然后放置干燥10分钟。固定于膜的生物识别组分,本例中为溶菌酶,其数量与膜的超细纤维上的戊二醛的数量成比例。膜上生物识别组分越多,装置灵敏度越高因为具有更高的生物分子结合的可能性。因此,优选的在膜上固定大量的溶菌酶。然而,如果膜被置于溶菌酶溶液内过长时间,戊二醛可能会由于溶解从膜上分离。结果表明在1XPBS溶液中溶菌酶结合到交联剂的比例通常高于戊二醛的溶解率。4、支架和盖的制造为了支撑膜和为测量膜的电阻提供标准化测试环境,与盖配合的支架使用AutoCadTM设计且支架和盖使用MakerBotTMReplicatorZ183D打印机(2009-2015MakerBotIndustries,LLCOneMetroTechCenter,21stFloor,Brooklyn,NY11201USA)通过三维打印制造。5、流体样品的制备:抗体溶液不同的浓度的原发性抗溶菌酶抗体溶液被制备:313.6,31.6,15.8和0.8μg/ml。抗体溶液通过稀释少量的在10XPBS内的原发性抗体得到预期的浓度。6、测量准备为了确保所有的测量为标准化,300或500μl的PBS被输送到不同的膜上使得在测量前膜均为PBS饱和。然后膜被放置在支架上并用盖封盖。电阻测量通过借助连接到支架的电极来将上述方法制备的膜连接到图10中的电路进行。恒定的电压0.5V被指定,且电压源被设置为这个值。在每个时间点测量的电压可被使用于通过欧姆定律R=V/I计算膜的电阻,其中R为电阻,V为跨膜电势差(或电压),I为电路中的电流。膜的电阻通过施加的电压和电路中测量的电压之间的不同计算得到。使用基尔霍夫(Kirchoff’s)定律下述公式被确定用于上述的实验装置:-Vi+VR+Vf=0其中Vi是源电压,VR是跨过可变电阻器的电压,Vf是膜上施加的电压和测量的电压之差(电压降)。上述公式可被延伸为:Vi=Rs×i+VfVf通过示波器持续的测量。对于唯一的位置变量i,电流,使用欧姆定律(R=V/I),两个公式可被结合在任何指定时间计算电阻:由于预期的膜的电阻值在1000Ω的范围内,可变电阻(Rs)被选定为1000Ω。随着示波器测量膜上的压降,膜电阻可使用下述公式被计算。使用MatlabTM和ControlSystem电阻的测量(压降)被记录和分析。施加电压到膜大约10秒后,200μl的选定浓度的抗体溶液通过支架的开口添加输送溶液到膜上。原发性抗溶菌酶抗体结合溶菌酶形成抗原抗体复合物,其被发现可存在达到一小时。这样在抗体被添加后,电阻被测量和记录一小时。7、数据采集四个不同的数据集从下面的试验中被采集:(a)具有导电涂层的膜的电阻;(b)结合了戊二醛的导电膜的电阻;(c)结合了戊二醛和溶菌酶的导电膜的电阻;(4)结合了戊二醛,溶菌酶和不同浓度的抗体的导电膜的电阻。这些实验每个均在一组三个到四个膜上进行,所述膜通过同样的工艺制备,来评价结果的可重复性和精度。每个测试的数据均被解释且显示电阻随时间变化的图表被绘制。在下文结果部分示出的图表中,在实验开始时和一分钟之间的测量值未被示出,所述实验开始时为溶液被输送到施加了电压的膜上时。结果表明,在这个时间段溶液的添加导致异常的和不稳定的非线性电阻测量值。异常的读数是可被预料到的,因为难以控制溶液到膜上的输送速率。8、旨在确定抗溶菌酶抗体和固定在膜上的溶菌酶的结合的定性测试抗体与蛋白质的阳性结合从而与膜的阳性结合在一个单独试验中通过对膜的超细纤维使用第二荧光抗体的染色而证实。在溶菌酶固定到膜上后,膜被置于包含313.6μg/ml的200μl抗溶菌酶抗体溶液的容器内并在4℃培养一小时。然后膜被1XPBS彻底的清洗来去除任何过量的未与抗溶菌酶结合的溶菌酶抗体。然后由于试剂中荧光染料的光敏性,下述步骤在暗室中实施。200μl的第二抗体,AlexaFluor488(Invitrogen),被输送到膜上,膜在室温下培养一个小时,然后再次使用1XPBS清洗并放置干燥。然后处理的样品保存于光敏的容器内。蛋白质与纤维和原发性抗体与蛋白质的阳性结合的确认通过使用荧光共聚焦显微镜(ZeissLSM780共聚焦显微镜)而确定。阳性和对照图像通过40X的物镜采集且荧光和相衬叠加图被定性的获得。固定于膜的超细纤维上荧光第二抗体在获得的图像上清晰可见。实验结果(a)具有导电涂层的膜的电阻在第一个实验中,从涂有导电涂层的三个膜的跨膜电压降计算得到的电阻被测量超过20分钟。三个膜通过在上文第1步中描述的同样的工艺制备。三个膜的电阻作为时间的函数被绘制于图11中。线性趋势直线可被拟合于每组数据(膜1(1001):y=3.7511x+238.98R2=0.9231,膜2(1002):y=2.4567x+135.48R2=0.9712,膜3(1003):y=2.5994x+217.12R2=0.9336))。每个膜随时间的电阻的增加或电导率的下降可被观察到。图中不同的膜的初始电阻和电阻的增长率基本相同。在薄片涂层导电试剂之后,达到低至每17mm140Ω的膜的电阻值。17mm为测量的标准距离。尽管达到了低电阻,制备的三个膜的电阻在17mm距离内仍在140Ω到300Ω之间彼此不同。可预见的是这个不同可通过膜的制备工艺的自动化而减少。如图11所示,即使在测量中没有额外的溶液和试剂被加到膜上,电阻随时间稳定的增长也会发生。申请人相信电阻的增加由铜电极与膜上存在的盐的相互反应引起,所述盐为例如从在所有的测试之前加到膜上的PBS溶液中获得的氯化铁(III),氯化钠(NaCl),氯化钾(KCl),磷酸氢二钠(Na2HPO4)和磷酸二氢钾(KH2PO4)。观察到的电阻的线性增加,可预期存在于对膜进行的所有的电阻测量中。它可被描述为“基础响应”或背景响应,所有进一步的测量可与其对比。根据图11的数据,电阻的增长率平均为大约每分钟2.935Ω。(b)结合了戊二醛的导电膜的电阻在第二个实验中,从结合了交联剂戊二醛的三个导电膜的跨膜电压降计算得到的电阻被测量超过20分钟且结果被绘制于图12中。线性趋势直线可被拟合于图中(膜1(1101):y=4.9836x+399.43R2=0.9355,膜2(1102):y=6.8606x+441.49R2=0.9752,膜3(1103):y=5.0314x+495.38R2=0.9231)。三个膜的初始电阻不同,但随时间的电阻的增长率非常相似。膜的戊二醛层降低了膜的电导率。戊二醛结合后的导电膜的电阻增加了200Ω到350Ω之间。三个膜的测量的电阻的平均值生成一条直线,y=5.6252x+445.43,具有显示了每分钟电阻的增长的斜率。电阻的增长率高于所观察到的没有戊二醛的膜的增长率,可能是因为导电通路已经被戊二醛交联剂覆盖。进一步的实验示出更长的培养时间和更高的戊二醛浓度进一步由于多重覆盖增加了膜的电阻。因此结果表明最佳的培养时间和戊二醛的浓度为1到2小时,优选的1.5小时和2.5vmM戊二醛的浓度,使最大量戊二醛被结合同时不产生多分子层。(c)结合了戊二醛和溶菌酶的导电膜的电阻在第三个中,从结合了交联剂戊二醛和溶菌酶蛋白的三个导电膜的跨膜电压降计算得到的电阻被测量超过20分钟且结果被绘制于图13中。线性趋势直线可被拟合于图中(膜1(1201):y=7.6702x+598.54R2=0.9661,膜2(1202):y=5.1633x+632.5R2=0.9903,膜3(1203):y=11.826x+638.53R2=0.9889)。在膜上溶菌酶的固定进一步将膜的电阻增加了100Ω到300Ω之间。三个膜的测量的电阻的平均值生成一条直线:y=8.2199x+623.19。(d)结合了戊二醛,溶菌酶和200μl不同浓度的抗体的导电膜的电阻。实验的最初5分钟每两秒进行电阻测量,然后一小时每分钟进行读数。由同样的工艺制备的四个不同的膜的电阻的图示出于图14中,所述膜上结合了200μl的313.6μl/ml的(100x稀释的抗体)抗体。拟合到图中的四条直线总结于表1:表1图14中的数据的线性趋势直线膜图中标记线性方程1(1301)y=15.887x+613.97,R2=0.99712(1302)y=21.273x+837.13,R2=0.98783(1303)y=17.259x+472.15,R2=0.99554(1304)y=22.358x+631.32,R2=0.9803图14示出了在膜被加入了抗体溶液后前五分钟内每个膜电阻的明显的增加。在5分钟后电阻的变化率下降。每个膜的测量的初始电阻具有大约200Ω的区别。电阻在超过60分钟内的增长率在大约每分钟16到22Ω的范围内彼此不同。由同样的工艺制备的四个不同的膜的电阻的图示出于图15中,所述膜上结合了200μl的15.8μl/ml的(10000x稀释)抗体。拟合到图中后55分钟(排除了示出电阻快速增长的前5分钟)的四条直线总结于表2:表2图15中的数据的线性趋势直线膜图中标记线性方程1(1401)y=10.179x+542.12,R2=0.9628,2(1402)y=11.719x+1074.9,R2=0.9023(1403)y=15.066x+447.11,R2=0.99764(1405)y=14.134x+405.47,R2=0.9974由图15可见,即使在如此低浓度的15.8μl/ml的抗体溶液的情况下,在抗体溶液输送到膜上之后膜的电阻仍有立即的、可计量的增长。五分钟后电阻的增加率对于四个不同膜来说相似。接下来,由同样的工艺制备的四个不同的膜的电阻的图示出于图16中,所述膜上结合了200μl的0.8μl/ml的(100000x稀释)抗体。拟合到图中的四条直线总结于表3:表3图16中的数据的线性趋势直线图16中明显可见,即使在如此低浓度的0.8μl/ml的抗体溶液的情况下,在实验的前5分钟膜的电阻仍可观察到快速的增长。此后,电阻的增长率对于四个不同膜来说基本相同。为了证实结果,进行了阳性对照测试。包含对溶菌酶非特异性的抗体的200μl的15.8μl/ml的抗体溶液被施加到固定有溶菌酶的导电膜上,且膜的电阻被测量超过一个小时。阳极对照测试示出于图17。拟合于数据的线性趋势直线(1601)为y=7.9448x+495.41,R2=0.9939。线性趋势直线的斜率接近于戊二醛和溶菌酶已被结合的导电膜的斜率。因此,该图确认了非特异性抗体施加到膜不会如同已观测到的抗溶菌酶抗体与固定于膜上的溶菌酶特异性结合时所导致膜的电阻率的快速增长。由包括将三个不同浓度的抗溶菌酶抗体输送到四个通过同样的工艺制备的不同的膜上的实验得到的结果被结合。每个浓度结合的数据和阳性对照测试的结果,以及阴性对照测试的结果,示出于图18中,所述阴性对照测试为仅不包括生物分子的PBS溶液被输送到膜上。各浓度和对照实验的线性趋势直线列举于表4。表4图18中的数据的线性趋势直线由图18明显可见,对于每种不同浓度的抗体溶液,在抗溶菌酶抗体被施加到膜上之后最初几分钟内,具有膜的电阻大幅度增长的形式的显著的初始响应可被观察到。在这些情况中,在最初的5分钟后整个后面55分钟内,电阻的增长率下降但保持恒定。从图18中清楚可见,在阳性(非特异性抗体溶液)和阴性对照(抗体溶液浓度为零)测试中基本无这样的响应。图18的线性趋势直线的斜率,示出当施加到膜的抗溶菌酶抗体的浓度为313.6μl/m时膜的电阻的增长率最高。当施加到膜上的抗溶菌酶抗体浓度为15.8μl/ml和0.8μl/ml时,膜的电阻的增长率低于浓度为313.6μl/m时膜的电阻的增长率。浓度为0.8μl/ml时测得电阻的斜率与浓度为15.8μl/ml的斜率非常相似其表明了装置的灵敏度。当膜被非特异性抗体(阳性对照)或无任何形式的抗体(阴性对照)处理时,膜的电阻的增长率相似,大约为每分钟8Ω。图19为图18示出的结果的前5分钟的图。在向施加了电压的膜上添加了溶液后的前5分钟内的线性趋势直线的方程和膜的电阻的增长率被总结于表5。表5图19中的数据的线性趋势直线和电阻的增长率在抗溶菌酶抗体溶液被施加到膜上之后的五分钟内膜的电阻的增长率远高于当膜被零抗体浓度(阴性对照)或非特异性抗体溶液(阳性对照)施加时膜的电阻的增长率。结果示出溶液中的抗体可被使用实施例中的检测生物分子的装置检测。相比阴性对照在抗体浓度0.8μl/ml时获得了可测量的电阻响应的事实示出膜对于非常低的抗体浓度是非常灵敏的。阳性对照用于示出电阻的变化率的增长是由于抗溶菌酶抗体和溶菌酶之间发生的特异性结合,而不是由于非特异性抗体结合或吸附于膜的抗体。膜的抗体的施加导致抗体结合到溶菌酶形成了抗原-抗体复合物。在施加抗体溶液后监控电阻的最初几分钟内,相对于监控电阻的其余时间,检测到了电阻的明显增加。进行的阳性和阴性对照测试在最初五分钟内分别具有每分钟14.992Ω和9.4016Ω的电阻增长率。进行的不同抗体浓度的实验示出在最初的5分钟内各自的电阻平均增长率为每分钟26.821,42.852和61.584Ω。这些结果说明抗体和溶菌酶之间的结合在抗体已被以相对快速的加入后立即发生。结果也表明装置似乎在加入样品最初5分钟内或更短时间内具有检测抗体存在的最高效率,而不是将实验进行一整小时。对于其余的6-60分钟,电阻的增长率稍微不好鉴别,尽管仍显著的高于对照测量。通过延长测量的持续时间,能够更精确的确定在样品溶液中的抗体的近似浓度。可预料的是,在样品溶液添加到膜之后,结合到膜上的抗原-抗体复合物(或生物识别组分和生物分子的结合)越大,膜的电阻越大且具有复合物的膜的电阻和无复合物的膜的电阻的差别越明显。在进行的实验中,无纺、纺粘点融聚丙烯超细纤维薄片具有50g/m2的厚度或面密度其提供了足够大的表面积用于生物识别分子在膜上的固定。薄片也具有符合要求的耐用度。可以预见不同厚度或面密度的薄片可被使用于膜的预制备,然而更厚的材料的使用使得输送到使用中的膜上的溶液渗透入超细纤维更慢,导致生物分子与生物识别组分的特异性结合需要更长的时间。若更薄的薄片被使用,溶液会轻易的流入膜的孔穴而没有结合发生的时间。实施例2装置检测大肠杆菌的存在的能力被测试。导电膜的制备根据上述实施例1的步骤进行。然而,取代溶菌酶,抗大肠杆菌杆体抗体ab25823被固定于膜上。方法抗大肠杆菌抗体ab25823到膜上固定的实现首先为使用0.01M的PBS清洗导电膜并干燥10分钟。然后膜在2.5mM的戊二醛内在4℃下培养一小时。然后,膜使用0.01M的PBS再次清洗并干燥10分钟。膜在600mL的抗大肠杆菌抗体(6.67ug/mL)内在37℃下培养一小时然后使用0.01M的PBS清洗并干燥10分钟。然后5%BSABlockerTM被添加到膜中并在室温下放置反应一小时。最终膜使用0.01MPBS清洗三次。具有3.4x108,3.4x105和3.4x102CFU/ml的不同浓度的大肠杆菌溶液被制备,且100μl的每个溶液被输送到膜上。实验使用三个相似制备的固定有抗大肠杆菌抗体的导电膜重复进行。进一步的对照实验被进行,其中100μl的9.67x107,9.67x104和9.67x10CFU/ml的植物乳杆菌(LactoBacillusPlantarumbacteria)被输送到固定有抗大肠杆菌抗体的膜上。结果实验结果被示出于图20,其是每个实验在细菌溶液添加后的前五分钟的膜的电阻变化的数值图。该图示出了当大肠杆菌溶液被添加到膜时,对最高浓度的大肠杆菌膜的电阻的变化率具有明显的增加。与之对比的,当植物乳杆菌输送到膜上时,没有实质的增加被记录。相应的,大肠杆菌与固定在膜上的抗大肠杆菌抗体的特异性结合导致膜的电阻的变化率的显著增加,实现大肠杆菌的检测。大肠杆菌的结合也通过对活菌染色和在共聚焦显微镜下观察染色菌证实。实施例3在这个实施例中,纸基的导电膜被使用作为装置的一部分用来展示其检测抗溶菌酶抗体的能力。溶菌酶蛋白固定于纸基导电膜且膜的电阻被监控和记录。电阻的测量值被处理并证明纸基导电膜具有生物分子的电阻式传感能力。方法由于它们的湿强度,选择WhatmannGrade50(97g/m2)和WhatmannGrade1(87g/m2)的滤纸并从SigmaAldrich获得。Whatmann的滤纸(Grades1,50)切割为180×280mm的标准尺寸用来测试。1、导电涂层滤纸的纤维素纤维通过涂层掺杂有聚吡咯的溶液被制成具有导电性。180×280的纸片首先被浸入吡咯单体并放置浸泡5分钟,这确保纸对吡咯完全饱和。然后吡咯饱和的纸片浸入包含0.3MHCl和5g/100mlFeCl3的蒸馏水溶液并放置聚合90分钟。纸片被轻柔的摇动以实现氧化聚合的发生。纤维从反应釜中取出并用0.3MHCl和去离子(DI)水清洗去除过量的吡咯。然后纸片被置于通风柜并放置干燥一小时。处理的纸片具有表面沉积的过量的吡咯和铁,因此导电纸片进一步的通过机械手段清理。然后机械清理的纸片使用去离子水清洗并放置在通风柜干燥。通过此方法涂层的纸片形成了表现出高导电性(15Scm-1)和好的机械稳定性的导电膜。导电纸(180x280mm)跨过纸片的宽度而不是长度测量,表现出2-5Ω范围的电阻。2、戊二醛交联膜被浸入包括2.5mM戊二醛的去离子水溶液。在4℃持续培养一小时,之后膜被取出,用去离子水清洗并放置干燥。在戊二醛结合到膜上后,膜的电阻增加了1-3Ω。3、结合溶菌酶溶菌酶蛋白,来自鸡蛋清(Roche,Mannheim,Germany),制备于在1XPBS内具有1mg/ml浓度的溶液中,该溶液在无菌玻璃器皿中制备。戊二醛聚吡咯-纸片被浸入1XPBS大约5秒然后转移到溶菌酶溶液容器。纸片在溶菌酶溶液中在4℃下放置培养2小时。培养后,标记的纸片使用1XPBS清洗并放置干燥。4、实验布置电阻式传感通过使用ArduinoUno微处理器和专用电路实施。专用电路示出于图10,当固定有溶菌酶的导电膜的未知电阻通过分压借助测量已知电阻器两端的电压降时,起到欧姆计作用。本实验方法使用Arduino微处理器将信息通过模拟销analogpin(A0)传输到便携动态监控器。输入电压为0.5V。当固定有溶菌酶的膜已干燥,每个膜被置于电极上且单独的膜的基础电阻被测量并记录超过一分钟。电极的结构被选择为使得膜被夹在作为电极的铜板之间。这个电极结构测量整个导电织物宽度的电阻。5、待测抗体溶液的制备抗溶菌酶抗体的浓度在1XPBS内制得:1110.14,111.01,11.01,1.10,0.11,0.01μg/ml。稀释的范围考虑到待被鉴定的检测极限(LOD)。然后100μl体积的抗溶菌酶抗体被添加到纤维,它们在4℃下被放置培养一小时。这保证纸片上的可能的结合部位尽可能多的被利用。培养后,纸片被短暂的浸入1XPBS,以确保没有未结合的抗溶菌酶抗体或其它生物物质留存在表面上并影响电阻读数。在纤维被清洗后,进行风干。然后固定了抗体的干燥的纸片,被置于支架,且单独的电阻测量被记录10分钟。在第一分钟内的测量值被忽略。测试在至少3多可达7张纸片上对每个浓度的抗体重复进行,以证明可重复性和提供较大的数据集。培养后测量的电阻与基础电阻的比值被创建以尝试鉴别是否对每个抗体浓度有个合理的电阻增长。结果溶菌酶和原发性抗体通过使用第二荧光抗体(AlexaFluor488)进行了表征,且荧光图像使用ZeissTMLSM780(共聚焦显微镜)进行了采集。原发性抗溶菌酶抗体被加入固定有溶菌酶的膜。AlexaFluor488被加入到使用原发性抗体处理过的纸片、仅固定了溶菌酶的膜和缺少戊二醛的膜。第二荧光抗体与原发性抗溶菌酶抗体的结合通过共聚焦显微镜被确认。图像中的荧光显示出第二、原发性抗体的存在以及因此溶菌酶蛋白的存在。单独的纤维的均匀的涂层被观察到,单一的纤维由于结合于纤维周围的荧光抗体可被辨认出来。在未被原发性抗体处理的膜和纸片上的对照测试被进行,因为在对照图像中缺少荧光特定的结合被确认。在电阻测试中,对每个膜的合理的电阻增加被计算得到,且这些计算值与抗体浓度,阳性和阴性对照相对比。结果示出于图21。最高浓度的抗体溶液示出了最大的合理的电阻增长。值得注意的是对于更高浓度的抗体电阻剧烈的增长,其后的每个分别的稀释为指数级的下降。阳性(非特异性抗体)和阴性对照(1XPBS)被包括为了看出抗体浓度相对于对照未产生明显的增加的情况。100ng/ml的检测极限(LOD)被计算。这个实施例中的这个电极结构测量了透过膜厚度的电阻。表明考虑到整体装置的小型化,膜的尺寸可以大幅减小。这样的传感纸片可以被集成到微控制器中,提供病原体的芯片上的分析。结果表明目标病原体的特异性抗体可被固定到纤维素纤维的表面且同样的测试方法可被实施,实现跨膜电阻的增长。病原体可以在尺寸上大幅度的大于使用的概念验证的蛋白(溶菌酶)并因此可能相对于溶菌酶测试产生更大的电阻增长。这里描述的装置目的在于提供成本低,效率高和便携式的基于阻抗的生物传感器用来从微流体样品中快速的检测病原体或关联于病原感染的抗体。病原体例如大肠杆菌或结核杆菌可被检测。装置可无需其它装置或较深的技术知识操作。小规模的样品被分析带来了例如更少量的试剂和样品被需要,以及对样品快速通量筛选的优点。大体上装置由传感器和能够检测样品中存在的生物分子的存在或数量的生物识别组分构成。当生物识别组分与样品中的生物分子发生反应时传感器将产生的生物响应转化为可被量化的电信号。这里描述的检测目标生物分子的装置,为现有产品的更小的和更轻的替代品且对于目标生物分子具有更好的鲁棒性、快速反应和高灵敏度。描述的检测方法也能作为现有方法的更廉价的替代方法并因此特别的有助于减轻了特定的病原体的诊断负担例如结核病和大肠杆菌。本装置目的在于提供对目标生物分子例如抗原或抗体的高特异性、快速检测。膜和电极未浸入缓冲溶液的事实带来了膜灵敏度的增强且无需考虑溶液的并联电阻。应注意的是在本发明范围内检测目标生物分子的装置可被进行大量改变。膜和支架可以是任何合适的尺寸和形状且可根据被输送到膜上的样品的体积进行调整。膜可由任何合适的微纤维或纳米纤维制成提供大的表面积用来在表面固定生物识别组分且可被改性为导电。膜可具有任何合适的厚度或面密度,且厚度可例如为5-100g/m2的范围。应被注意的是多于一种生物识别组分可被固定于表面以允许对于不同的病原体、污染物或感染的双重检测。任何类型的以织物形式的微纤维或纳米纤维,若其本身可导电或可被改性为导电,可被用作膜。膜可通过合适的试剂制成导电作为电阻其提供大的表面积用来与生物识别组分结合及潜在的与生物分子结合。取决于形成膜的材料,可具有不同的表面性质。例如,由上述实施例1和2中涂有掺杂聚吡咯的聚丙烯纤维制成的膜具有疏水表面。如实施例3中描述的纤维素纤维制备的膜,更加亲水导致包括生物分子的液体样品与膜的不同的相互作用。已发现在导电膜中使用纸片作为基底具有更好的吸收性借此影响了包含生物分子的流体样品穿透膜的分散。纸作为膜的使用由于其较宽的适用性和可承受性是有利的。纤维素纤维具有高表面积且在纸中可发现大范围的纤维直径。支架可以是任何合适的形状和形式,只要其可被配置成可释放的接收和固定导体膜使得导体膜延伸至少部分的覆盖电极从而与电极接触。支架可包括定位构造例如由不导电材料制成的夹子和皮带(未示出)且从支架的对侧交叉的延伸至少部分的跨过电极表面来固定导体膜在恰当的位置并确保膜和电极的接触。在本发明进一步的实施例中,支架可被修改为具有与支架滑入配合的膜架或膜盖,或具有与支架配合的滑动元件以实现膜快速和容易的更换。电极可以由任何合适的导体材料制成。在描述的实施例中金和铜电极被使用。然而,铂电极反应性更低且可能能够在生物识别组分和样品的生物分子的分子结合的基础上提供更精确的电阻和电阻变化率的读数。然而,铜用来制造电极或与膜的终端连接更便宜。电池可被用作电源提供电流给电路和电压给电路。电池也给控制器供电,理想的所述控制器为微控制器,例如由安装了合适的硬件和软件的计算机构成的Arduino微控制器,其连接于控制电路并被设置控制电压测量装置和从装置中读取读数用来计算膜的电阻。装置可进一步包括无线通讯装置,例如蓝牙,用来将测量值或检测信号传输给手机或其它装置。这些元件可被用于构造一个紧凑且便携的装置用来快速和容易的使用于本领域。说明书和权利要求全文中,除非内容需要,否则“包括”一词应被理解为意味着包含阐明的整体或一组整体但不排除其他整体或成组的整体。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1