基于原子力显微镜氨基酸影响鱼蛋白聚集行为的评价方法与流程
本发明涉及氨基酸类添加剂影响鱼肌球蛋白聚集行为及凝胶类水产制品品质控制领域,尤其涉及水产动物蛋白在不同的氨基酸(浓度5毫摩尔:谷氨酸/半胱氨酸/赖氨酸/组氨酸)、不同热诱导条件下(不加热为对照、90℃加热30min、40℃加热60min、40℃加热60min后再90℃加热30min)聚集行为的变化对水产制品品质的影响。
背景技术:
我国的渔业资源非常丰富,近几年水产品加工业取得长足的发展,但对水产品的加工与综合利用率相对偏低,产品品质参差不齐,目前多采用添加添加剂的方法改善鱼糜凝胶的品质,鱼糜凝胶形成的过程即鱼蛋白发生变形聚集的过程,针对鱼蛋白聚集行为的变化,目前常用浊度、DLS等方法进行测定,测试结果不准确,尤其添加添加剂后聚集行为的变化复杂,很难精确的反应鱼蛋白聚集行为的变化,而应用原子力显微镜技术进行表面形貌的扫描和聚集体粒径的统计能准确的反应添加剂对鱼蛋白聚集行为的影响,目前有关报道较少。有文献曾报道氨基酸类添加剂能够提高鱼蛋白低盐条件下的溶解度,并缓解鱼蛋白的聚集,有利于形成低盐软凝胶产品,氨基酸的加入必然会通过影响鱼蛋白的聚集行为来影响水产凝胶制品的品质。本发明将利用原子力显微镜先进技术从蛋白质微观分子聚集行为变化角度切入,研究游离氨基酸对鱼蛋白聚集行为的影响,通过蛋白聚集体等效粒经的大小客观地评价游离氨基酸对鱼蛋白聚集行为的影响,为凝胶类水产制品品质调控提供理论参考,以满足人们对该类制品的品质需求。
技术实现要素:
本发明根据不同氨基酸存在的条件下蛋白聚集行为的变化,利用原子力显微镜先进技术从蛋白质微观分子聚集行为变化角度切入,研究游离氨基酸对鱼蛋白聚集行为的影响,通过蛋白聚集体等效粒经的大小客观地评价游离氨基酸对鱼蛋白聚集行为的影响,为凝胶类水产制品品质调控提供理论参考,以满足人们对该类制品的品质需求。
本发明包括鱼肉蛋白样品的制备、扫描样品的制备、原子力显微镜扫描、图片处理,具体操作步骤如下:
基于原子力显微镜氨基酸影响鱼蛋白聚集行为的评价方法,按照下述步骤进行:
(1)鱼肉蛋白样品的制备:将新鲜的鱼按照常规处理方法制成鱼肉蛋白溶液,在鱼肉蛋白溶液中加入相应的氨基酸溶液,得到蛋白-氨基酸混合液(P-AA)。
(2)扫描样品的制备:将P-AA溶液按一定的热诱导条件处理后,滴在新剥离的云母片表面使其自然干燥,用纯净水冲洗吸附层(1~5)次,吸走多余液体,再使其自然干燥,待测;
(3)原子力显微镜扫描:原子力显微镜探针型号为TAP 150(MPP-12100-10),操作模式为分子力模式,扫描范围为5μm×5μm;
(4)图片处理:在NanoScope Analysis离线软件上进行,图片进行Flatten平整化处理,消除倾斜、扭曲、跳线等的影响,对每条扫描线进行补偿,使得到的数据更加真实,得到2D、3D图片,对二维图像进行“particle analysis”分析,以其深度直径作为等效粒径;
(5)最后可以从2D图片中观察蛋白在不同氨基酸存不同加热方式下聚集行为表面形貌的变化,从3D图片可以观察聚集体的高度形状等立体形貌的变化,可通过颗粒分析得到聚集体等效粒径的变化范围及均值,并以此为依据对游离氨基酸影响鱼肌球蛋白聚集行为进行评价,未添加氨基酸作为对照。
其中所述的步骤(1)中添加的氨基酸为谷氨酸、半胱氨酸、赖氨酸、组氨酸,氨基酸的浓度为5毫摩尔。
其中所述的步骤(2)所述的一定的热诱导条件为90℃加热30min;40℃加热60min;40℃加热60min后再90℃加热30min。
其中所述的步骤(2)具体按照下述步骤进行:提前将云母片剪成5mm×5mm大小,用双面胶黏在具有铁磁性物质如直径约为1cm×1cm的铁片上,铁片厚度不超过1mm;将蛋白溶液稀释至20μg/mL,用双面胶将云母片外表层剥离,吸取(1~6μL)蛋白溶液滴于新剥离的云母片表面,室温下在超净台内自然干燥,形成蛋白吸附层;为消除盐分的干扰,用纯净水(15~30℃,35μL)冲洗吸附层(1~5)次,超净台内自然干燥,所有操作均在超净台内进行。扫描前样品存放在带盖培养皿中,避免空气中的灰尘落在样品表面干扰扫描。
其中所述的步骤(5)评价标准为:纯蛋白聚集体等效粒径范围为110.1 93-413.482nm,添加半胱氨酸聚集体等效粒径为110.193-371.402nm(未加热);纯蛋白聚集体等效粒径范围为110.1 93-1266.024nm,添加半胱氨酸聚集体等效粒径为110.193-855.543nm(90℃-30min);纯蛋白聚集体等效粒径范围为110.1 93-862.047nm,添加半胱氨酸聚集体等效粒径为110.193-781.984nm(40℃-60min);纯蛋白聚集体等效粒径范围为110.1 93-740.184nm,添加半胱氨酸聚集体等效粒径为110.193-490.329nm(40℃-60min然后90℃-30min)。聚集体等效粒径范围存在明显差异。
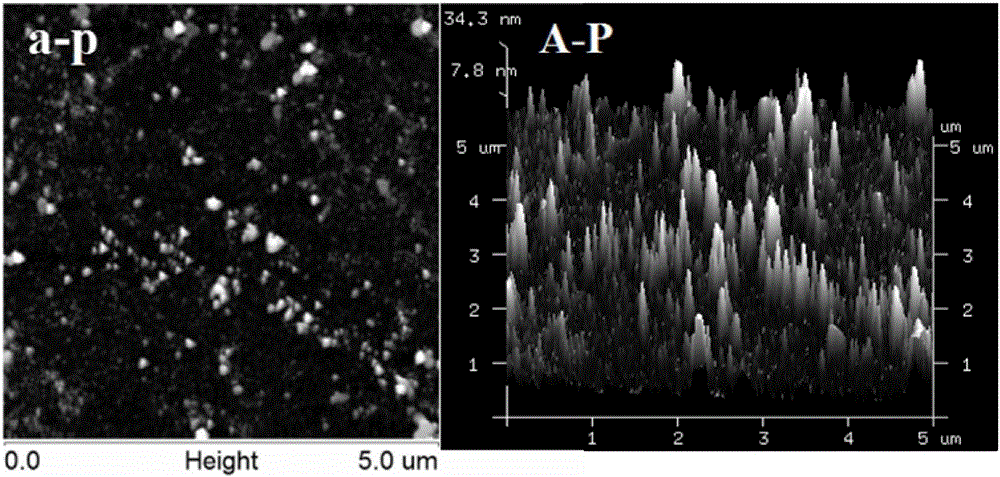
本方法结果可看出半胱氨酸溶液的形貌图无明显颗粒状杂质,无污染、非常平滑,与蛋白溶液的表面形貌图存在明显的区别,因此样品在自然干燥的过程中空气中的尘埃颗粒对样品的影响不大,且盐分和氨基酸的存在对蛋白质的测定也没有影响(图1);P-AA溶液经过以下处理,不加热:以小聚集体的形式存在,蛋白簇之间的交联程度比较低,形成的小的聚集体分散的吸附在云母片的表面;90℃加热30min:出现大的聚集体,由于加热温度过高,蛋白聚集非常剧烈,逐渐产生横向融合,从而形成不规则的簇状聚集体,在云母片表面分散的很不均匀;40℃加热60min:蛋白发生聚集,但聚集较缓慢,聚集体之间横向融合不明显,不均匀的分散在云母片的表面;40℃加热60min后再90℃加热30min:出现较大的聚集体,但仍有大量的小聚集体存在,此时聚集体之间的横向融合不明显,大的聚集体在云母片表面分布不均匀,而小聚集体均匀的遍布在视野内。
聚集体等效粒径的变化范围分别为:
附图说明
图1半胱氨酸溶液表面形貌2D和3D图,图2、4、6、8分别为肌球蛋白溶液不加热、90℃加热30min、40℃加热60min、40℃加热60min,然后90℃加热30min的AFM成像2D和3D图。图3、5、7、9分别为肌球蛋白溶液在半胱氨酸存在条件下不加热、90℃加热30min、40℃加热60min、40℃加热60min后再90℃加热30min的AFM成像2D和3D图。
具体实施方式
实施例1:
本发明包括鱼肉蛋白样品的制备、扫描样品的制备、原子力显微镜扫描、图片处理,具体操作步骤如下:
基于原子力显微镜氨基酸影响鱼蛋白聚集行为的评价方法,其特征在于按照下述步骤进行:
(1)鱼肉蛋白样品的制备:将新鲜的鱼按照常规处理方法制成鱼肉蛋白溶液,在鱼肉蛋白溶液中加入相应的氨基酸溶液(浓度5毫摩尔,半胱氨酸)得到蛋白-氨基酸混合液(P-AA)。
(2)扫描样品的制备:将P-AA溶液按一定的热诱导条件(不加热为对照、90℃加热30min)处理后,滴在新剥离的云母片表面使其自然干燥,用纯净水冲洗吸附层3次,吸走多余液体,再使其自然干燥,待测,提前将云母片剪成5mm×5mm大小,用双面胶黏在具有铁磁性物质如直径约为1cm×1cm的铁片上,铁片厚度不超过1mm;将蛋白溶液稀释至20μg/mL,用双面胶将云母片外表层剥离,吸取(1~6μL)蛋白溶液滴于新剥离的云母片表面,室温下在超净台内自然干燥,形成蛋白吸附层;为消除盐分的干扰,用纯净水(15~30℃,35μL)冲洗吸附层(1~5)次,超净台内自然干燥,所有操作均在超净台内进行。扫描前样品存放在带盖培养皿中,避免空气中的灰尘落在样品表面干扰扫描。
(3)原子力显微镜扫描:原子力显微镜探针型号为TAP 150(MPP-12100-10),操作模式为分子力模式,扫描范围为5μm×5μm;
(4)图片处理:在NanoScope Analysis离线软件上进行,图片进行Flatten平整化处理,消除倾斜、扭曲、跳线等的影响,对每条扫描线进行补偿,使得到的数据更加真实,得到2D、3D图片,对二维图像进行“particle analysis”分析,以其深度直径作为等效粒径;
(5)最后可以从2D图片中观察蛋白在不同氨基酸存不同加热方式下聚集行为表面形貌的变化,从3D图片可以观察聚集体的高度形状等立体形貌的变化,可通过颗粒分析得到聚集体等效粒径的变化范围及均值,并以此为依据对游离氨基酸影响鱼肌球蛋白聚集行为进行评价,未添加氨基酸作为对照。图5添加半胱氨酸90℃加热30min:出现大的聚集体,由于加热温度过高,肌球蛋白聚集非常剧烈。
聚集体等效粒径的分布范围为:110.193-855.543nm均值为:260.396nm,纯蛋白聚集体等效粒径的分布范围为:110.1 93-1266.024nm均值为:258.595nm,此时半胱氨酸对鱼蛋白聚集行为有明显的影响。
实施例2:
本发明包括鱼肉蛋白样品的制备、扫描样品的制备、原子力显微镜扫描、图片处理,具体操作步骤如下:
基于原子力显微镜氨基酸影响鱼蛋白聚集行为的评价方法,其特征在于按照下述步骤进行:
(1)鱼肉蛋白样品的制备:将新鲜的鱼按照常规处理方法制成鱼肉蛋白溶液,在鱼肉蛋白溶液中加入相应的氨基酸溶液(浓度5毫摩尔,半胱氨酸),得到蛋白-氨基酸混合液(P-AA)。
(2)扫描样品的制备:将P-AA溶液按一定的热诱导条件(不加热为对照、40℃加热60min)处理后,滴在新剥离的云母片表面使其自然干燥,用纯净水冲洗吸附层3次,吸走多余液体,再使其自然干燥,待测,提前将云母片剪成5mm×5mm大小,用双面胶黏在具有铁磁性物质如直径约为1cm×1cm的铁片上,铁片厚度不超过1mm;将蛋白溶液稀释至20μg/mL,用双面胶将云母片外表层剥离,吸取(1~6μL)蛋白溶液滴于新剥离的云母片表面,室温下在超净台内自然干燥,形成蛋白吸附层;为消除盐分的干扰,用纯净水(15~30℃,35μL)冲洗吸附层(1~5)次,超净台内自然干燥,所有操作均在超净台内进行。扫描前样品存放在带盖培养皿中,避免空气中的灰尘落在样品表面干扰扫描。
(3)原子力显微镜扫描:原子力显微镜探针型号为TAP 150(MPP-12100-10),操作模式为分子力模式,扫描范围为5μm×5μm;
(4)图片处理:在NanoScope Analysis离线软件上进行,图片进行Flatten平整化处理,消除倾斜、扭曲、跳线等的影响,对每条扫描线进行补偿,使得到的数据更加真实,得到2D、3D图片,对二维图像进行“particle analysis”分析,以其深度直径作为等效粒径;
(5)最后可以从2D图片中观察蛋白在不同氨基酸存不同加热方式下聚集行为表面形貌的变化,从3D图片可以观察聚集体的高度形状等立体形貌的变化,可通过颗粒分析得到聚集体等效粒径的变化范围及均值,并以此为依据对游离氨基酸影响鱼肌球蛋白聚集行为进行评价,未添加氨基酸作为对照。图7添加半胱氨酸40℃加热60min:肌球蛋白发生聚集,但聚集较缓慢,聚集体之间横向融合不明显。
聚集体等效粒径的分布范围为:110.193-781.984nm均值为:202.295nm,纯蛋白聚集体等效粒径的分布范围为:110.193-862.047nm均值为:207.973nm,此时半胱氨酸对鱼蛋白聚集行为有轻微的影响。
实施例3:
本发明包括鱼肉蛋白样品的制备、扫描样品的制备、原子力显微镜扫描、图片处理,具体操作步骤如下:
基于原子力显微镜氨基酸影响鱼蛋白聚集行为的评价方法,其特征在于按照下述步骤进行:
(1)鱼肉蛋白样品的制备:将新鲜的鱼按照常规处理方法制成鱼肉蛋白溶液,在鱼肉蛋白溶液中加入相应的氨基酸溶液(浓度5毫摩尔,半胱氨酸),得到蛋白-氨基酸混合液(P-AA)。
(2)扫描样品的制备:将P-AA溶液按一定的热诱导条件(不加热为对照、40℃加热60min,然后90℃加热30min)处理后,滴在新剥离的云母片表面使其自然干燥,用纯净水冲洗吸附层3次,吸走多余液体,再使其自然干燥,待测,提前将云母片剪成5mm×5mm大小,用双面胶黏在具有铁磁性物质如直径约为1cm×1cm的铁片上,铁片厚度不超过1mm;将蛋白溶液稀释至20μg/mL,用双面胶将云母片外表层剥离,吸取(1~6μL)蛋白溶液滴于新剥离的云母片表面,室温下在超净台内自然干燥,形成蛋白吸附层;为消除盐分的干扰,用纯净水(15~30℃,35μL)冲洗吸附层(1~5)次,超净台内自然干燥,所有操作均在超净台内进行。扫描前样品存放在带盖培养皿中,避免空气中的灰尘落在样品表面干扰扫描。
(3)原子力显微镜扫描:原子力显微镜探针型号为TAP 150(MPP-12100-10),操作模式为分子力模式,扫描范围为5μm×5μm;
(4)图片处理:在NanoScope Analysis离线软件上进行,图片进行Flatten平整化处理,消除倾斜、扭曲、跳线等的影响,对每条扫描线进行补偿,使得到的数据更加真实,得到2D、3D图片,对二维图像进行“particle analysis”分析,以其深度直径作为等效粒径;
(5)最后可以从2D图片中观察蛋白在不同氨基酸存不同加热方式下聚集行为表面形貌的变化,从3D图片可以观察聚集体的高度形状等立体形貌的变化,可通过颗粒分析得到聚集体等效粒径的变化范围及均值,并以此为依据对游离氨基酸影响鱼肌球蛋白聚集行为进行评价,未添加氨基酸作为对照。图9添加半胱氨酸40℃加热60min,然后90℃加热30min:出现较大的聚集体,但仍有大量的小聚集体存在,此时聚集体之间的横向融合不明显。
聚集体等效粒径的分布范围为:110.193-490.329nm均值为:186.933nm,纯蛋白聚集体等效粒径的分布范围为:110.193-740.184nm均值为:226.070nm,此时半胱氨酸对鱼蛋白聚集行为有显著的影响。
实施例4:
本发明包括鱼肉蛋白样品的制备、扫描样品的制备、原子力显微镜扫描、图片处理,具体操作步骤如下:
基于原子力显微镜氨基酸影响鱼蛋白聚集行为的评价方法,其特征在于按照下述步骤进行:
(1)鱼肉蛋白样品的制备:将新鲜的鱼按照常规处理方法制成鱼肉蛋白溶液,在鱼肉蛋白溶液中加入相应的氨基酸溶液(浓度5毫摩尔,半胱氨酸),得到蛋白-氨基酸混合液(P-AA)。
(2)扫描样品的制备:将P-AA溶液按一定的热诱导条件(不加热)处理后,滴在新剥离的云母片表面使其自然干燥,用纯净水冲洗吸附层3次,吸走多余液体,再使其自然干燥,待测,提前将云母片剪成5mm×5mm大小,用双面胶黏在具有铁磁性物质如直径约为1cm×1cm的铁片上,铁片厚度不超过1mm;将蛋白溶液稀释至20μg/mL,用双面胶将云母片外表层剥离,吸取(1~6μL)蛋白溶液滴于新剥离的云母片表面,室温下在超净台内自然干燥,形成蛋白吸附层;为消除盐分的干扰,用纯净水(15~30℃,35μL)冲洗吸附层(1~5)次,超净台内自然干燥,所有操作均在超净台内进行。扫描前样品存放在带盖培养皿中,避免空气中的灰尘落在样品表面干扰扫描。
(3)原子力显微镜扫描:原子力显微镜探针型号为TAP 150(MPP-12100-10),操作模式为分子力模式,扫描范围为5μm×5μm;
(4)图片处理:在NanoScope Analysis离线软件上进行,图片进行Flatten平整化处理,消除倾斜、扭曲、跳线等的影响,对每条扫描线进行补偿,使得到的数据更加真实,得到2D、3D图片,对二维图像进行“particle analysis”分析,以其深度直径作为等效粒径;
(5)最后可以从2D图片中观察蛋白在不同氨基酸存不同加热方式下聚集行为表面形貌的变化,从3D图片可以观察聚集体的高度形状等立体形貌的变化,可通过颗粒分析得到聚集体等效粒径的变化范围及均值,并以此为依据对游离氨基酸影响鱼肌球蛋白聚集行为进行评价,未添加氨基酸作为对照。图3添加半胱氨酸不加热:以小聚集体的形式存在,肌球蛋白簇之间的交联程度比较低,形成的小的聚集体分散的吸附在云母片的表面。
聚集体等效粒径的分布范围为:120.115-371.402nm均值为:165.579nm,纯蛋白聚集体等效粒径的分布范围为:110.193-413.482nm均值为:191.334nm,此时半胱氨酸对鱼蛋白聚集行为有轻微的影响。
实施例5:
本发明包括鱼肉蛋白样品的制备、扫描样品的制备、原子力显微镜扫描、图片处理,具体操作步骤如下:
基于原子力显微镜氨基酸影响鱼蛋白聚集行为的评价方法,其特征在于按照下述步骤进行:
(1)鱼肉蛋白样品的制备:将新鲜的鱼按照常规处理方法制成鱼肉蛋白溶液,在鱼肉蛋白溶液中加入相应的氨基酸溶液(浓度5毫摩尔,谷氨酸),得到蛋白-氨基酸混合液(P-AA)。
(2)扫描样品的制备:将P-AA溶液按一定的热诱导条件(不加热为对照、90℃加热30min、)处理后,滴在新剥离的云母片表面使其自然干燥,用纯净水冲洗吸附层3次,吸走多余液体,再使其自然干燥,待测,提前将云母片剪成5mm×5mm大小,用双面胶黏在具有铁磁性物质如直径约为1cm×1cm的铁片上,铁片厚度不超过1mm;将蛋白溶液稀释至20μg/mL,用双面胶将云母片外表层剥离,吸取(1~6μL)蛋白溶液滴于新剥离的云母片表面,室温下在超净台内自然干燥,形成蛋白吸附层;为消除盐分的干扰,用纯净水(15~30℃,35μL)冲洗吸附层(1~5)次,超净台内自然干燥,所有操作均在超净台内进行。扫描前样品存放在带盖培养皿中,避免空气中的灰尘落在样品表面干扰扫描。
(3)原子力显微镜扫描:原子力显微镜探针型号为TAP 150(MPP-12100-10),操作模式为分子力模式,扫描范围为5μm×5μm;
(4)图片处理:在NanoScope Analysis离线软件上进行,图片进行Flatten平整化处理,消除倾斜、扭曲、跳线等的影响,对每条扫描线进行补偿,使得到的数据更加真实,得到2D、3D图片,对二维图像进行“particle analysis”分析,以其深度直径作为等效粒径;
(5)最后可以从2D图片中观察蛋白在不同氨基酸存不同加热方式下聚集行为表面形貌的变化,从3D图片可以观察聚集体的高度形状等立体形貌的变化,可通过颗粒分析得到聚集体等效粒径的变化范围及均值,并以此为依据对游离氨基酸影响鱼肌球蛋白聚集行为进行评价,未添加氨基酸作为对照。添加谷氨酸90℃-30min:出现大的聚集体,横向交联不明显。
聚集体等效粒径的分布范围为:110.193-450.042nm均值为:196.479nm,纯蛋白聚集体等效粒径的分布范围为:110.193-1266.024nm均值为:258.595nm,此时谷氨酸对鱼蛋白聚集行为有轻微的影响。
实施例6:
本发明包括鱼肉蛋白样品的制备、扫描样品的制备、原子力显微镜扫描、图片处理,具体操作步骤如下:
基于原子力显微镜氨基酸影响鱼蛋白聚集行为的评价方法,其特征在于按照下述步骤进行:
(1)鱼肉蛋白样品的制备:将新鲜的鱼按照常规处理方法制成鱼肉蛋白溶液,在鱼肉蛋白溶液中加入相应的氨基酸溶液(浓度5毫摩尔,谷氨酸),得到蛋白-氨基酸混合液(P-AA)。
(2)扫描样品的制备:将P-AA溶液按一定的热诱导条件(不加热为对照、40℃加热60min,然后90℃加热30min)处理后,滴在新剥离的云母片表面使其自然干燥,用纯净水冲洗吸附层3次,吸走多余液体,再使其自然干燥,待测,提前将云母片剪成5mm×5mm大小,用双面胶黏在具有铁磁性物质如直径约为1cm×1cm的铁片上,铁片厚度不超过1mm;将蛋白溶液稀释至20μg/mL,用双面胶将云母片外表层剥离,吸取(1~6μL)蛋白溶液滴于新剥离的云母片表面,室温下在超净台内自然干燥,形成蛋白吸附层;为消除盐分的干扰,用纯净水(15~30℃,35μL)冲洗吸附层(1~5)次,超净台内自然干燥,所有操作均在超净台内进行。扫描前样品存放在带盖培养皿中,避免空气中的灰尘落在样品表面干扰扫描。
(3)原子力显微镜扫描:原子力显微镜探针型号为TAP 150(MPP-12100-10),操作模式为分子力模式,扫描范围为5μm×5μm;
(4)图片处理:在NanoScope Analysis离线软件上进行,图片进行Flatten平整化处理,消除倾斜、扭曲、跳线等的影响,对每条扫描线进行补偿,使得到的数据更加真实,得到2D、3D图片,对二维图像进行“particle analysis”分析,以其深度直径作为等效粒径;
(5)最后可以从2D图片中观察蛋白在不同氨基酸存不同加热方式下聚集行为表面形貌的变化,从3D图片可以观察聚集体的高度形状等立体形貌的变化,可通过颗粒分析得到聚集体等效粒径的变化范围及均值,并以此为依据对游离氨基酸影响鱼肌球蛋白聚集行为进行评价,未添加氨基酸作为对照。添加谷氨酸40℃-60min然后90℃-30min:大的聚集体之间间距减小,有产生横向交联的趋势。
聚集体等效粒径的分布范围为:110.193-439.670nm均值为:201.85nm,纯蛋白聚集体等效粒径的分布范围为:110.193-740.184nm均值为:226.070nm,此时谷氨酸对鱼蛋白聚集行为有显著的影响。
实施例7:
本发明包括鱼肉蛋白样品的制备、扫描样品的制备、原子力显微镜扫描、图片处理,具体操作步骤如下:
基于原子力显微镜氨基酸影响鱼蛋白聚集行为的评价方法,其特征在于按照下述步骤进行:
(1)鱼肉蛋白样品的制备:将新鲜的鱼按照常规处理方法制成鱼肉蛋白溶液,在鱼肉蛋白溶液中加入相应的氨基酸溶液(浓度5毫摩尔,组氨酸),得到蛋白-氨基酸混合液(P-AA)。
(2)扫描样品的制备:将P-AA溶液按一定的热诱导条件(不加热为对照、40℃加热60min、40℃加热60min)处理后,滴在新剥离的云母片表面使其自然干燥,用纯净水冲洗吸附层3次,吸走多余液体,再使其自然干燥,待测,提前将云母片剪成5mm×5mm大小,用双面胶黏在具有铁磁性物质如直径约为1cm×1cm的铁片上,铁片厚度不超过1mm;将蛋白溶液稀释至20μg/mL,用双面胶将云母片外表层剥离,吸取(1~6μL)蛋白溶液滴于新剥离的云母片表面,室温下在超净台内自然干燥,形成蛋白吸附层;为消除盐分的干扰,用纯净水(15~30℃,35μL)冲洗吸附层(1~5)次,超净台内自然干燥,所有操作均在超净台内进行。扫描前样品存放在带盖培养皿中,避免空气中的灰尘落在样品表面干扰扫描。
(3)原子力显微镜扫描:原子力显微镜探针型号为TAP 150(MPP-12100-10),操作模式为分子力模式,扫描范围为5μm×5μm;
(4)图片处理:在NanoScope Analysis离线软件上进行,图片进行Flatten平整化处理,消除倾斜、扭曲、跳线等的影响,对每条扫描线进行补偿,使得到的数据更加真实,得到2D、3D图片,对二维图像进行“particle analysis”分析,以其深度直径作为等效粒径;
(5)最后可以从2D图片中观察蛋白在不同氨基酸存不同加热方式下聚集行为表面形貌的变化,从3D图片可以观察聚集体的高度形状等立体形貌的变化,可通过颗粒分析得到聚集体等效粒径的变化范围及均值,并以此为依据对游离氨基酸影响鱼肌球蛋白聚集行为进行评价,未添加氨基酸作为对照。添加组氨酸40℃-60min,再90℃-30min,形成的小聚集体抱团形成较大的聚集体,但横向交联不明显。
聚集体等效粒径的分布范围为:110.193-348.462nm均值为:144.762nm,纯蛋白聚集体等效粒径的分布范围为:110.193-740.184nm均值为:226.070nm,此时组氨酸对鱼蛋白聚集行为有显著的影响。
实施例8:
本发明包括鱼肉蛋白样品的制备、扫描样品的制备、原子力显微镜扫描、图片处理,具体操作步骤如下:
基于原子力显微镜氨基酸影响鱼蛋白聚集行为的评价方法,其特征在于按照下述步骤进行:
(1)鱼肉蛋白样品的制备:将新鲜的鱼按照常规处理方法制成鱼肉蛋白溶液,在鱼肉蛋白溶液中加入相应的氨基酸溶液(浓度5毫摩尔,组氨酸),得到蛋白-氨基酸混合液(P-AA)。
(2)扫描样品的制备:将P-AA溶液按一定的热诱导条件(不加热为对照、90℃加热30min)处理后,滴在新剥离的云母片表面使其自然干燥,用纯净水冲洗吸附层3次,吸走多余液体,再使其自然干燥,待测,提前将云母片剪成5mm×5mm大小,用双面胶黏在具有铁磁性物质如直径约为1cm×1cm的铁片上,铁片厚度不超过1mm;将蛋白溶液稀释至20μg/mL,用双面胶将云母片外表层剥离,吸取(1~6μL)蛋白溶液滴于新剥离的云母片表面,室温下在超净台内自然干燥,形成蛋白吸附层;为消除盐分的干扰,用纯净水(15~30℃,35μL)冲洗吸附层(1~5)次,超净台内自然干燥,所有操作均在超净台内进行。扫描前样品存放在带盖培养皿中,避免空气中的灰尘落在样品表面干扰扫描。
(3)原子力显微镜扫描:原子力显微镜探针型号为TAP 150(MPP-12100-10),操作模式为分子力模式,扫描范围为5μm×5μm;
(4)图片处理:在NanoScope Analysis离线软件上进行,图片进行Flatten平整化处理,消除倾斜、扭曲、跳线等的影响,对每条扫描线进行补偿,使得到的数据更加真实,得到2D、3D图片,对二维图像进行“particle analysis”分析,以其深度直径作为等效粒径;
(5)最后可以从2D图片中观察蛋白在不同氨基酸存不同加热方式下聚集行为表面形貌的变化,从3D图片可以观察聚集体的高度形状等立体形貌的变化,可通过颗粒分析得到聚集体等效粒径的变化范围及均值,并以此为依据对游离氨基酸影响鱼肌球蛋白聚集行为进行评价,未添加氨基酸作为对照。添加组氨酸90℃-30min:小的聚集体遍布视野,未产生明显的聚集行为。
聚集体等效粒径的分布范围为:110.193-296.5nm均值为:144.762nm,纯蛋白聚集体等效粒径的分布范围为:110.193-1266.024nm均值为:258.595nm,此时谷氨酸对鱼蛋白聚集行为有显著的影响。
- 还没有人留言评论。精彩留言会获得点赞!