信号增强剂的制作方法
本发明涉及信号增强剂,更详细而言,涉及基于α1-6岩藻糖糖链与α1-6岩藻糖特异性凝集素的反应的信号的增强剂。
背景技术:
已知α1-6岩藻糖转移酶(α1-6fuct)的基因伴随肝细胞的癌变而表达,所述α1-6岩藻糖转移酶使α1-6岩藻糖(也称为核心岩藻糖(corefucose))转移至n连接型糖链的还原末端n-乙酰葡糖胺上。变为肝细胞癌之后,岩藻糖将介由α1-6键转移至被称为α甲胎蛋白(afp)的糖蛋白(分子量约为70,000)的糖链的n-乙酰葡糖胺上。该介由α1-6键而转移有岩藻糖的afp现已被用作肝细胞癌的肿瘤标志物。对受检者的血清实施使用了与岩藻糖具有亲和性的小扁豆凝集素(lca)的凝集素亲和电泳时,将自阳极侧依次出现被称为afp-l1、afp-l2、afp-l3的3条条带。在肝硬化等良性肝病中,凝集素非结合型的afp-l1条带为主体,若变为肝细胞癌,则凝集素结合型的afp-l3条带将增加。如果求出afp-l3相对于总afp的比例(afp-l3%)且其值大于10%,则怀疑是肝细胞癌。若能够准确地识别介由α1-6键而转移有岩藻糖的afp的比例,则肝细胞癌诊断的准确度也会进一步提高。
已知α1-6岩藻糖除了与肝癌有关以外,还与胰腺癌、大肠癌等疾病有关。
以往,作为与α1-6岩藻糖具有亲和性的凝集素,小扁豆凝集素(lca)、豌豆凝集素(psa)、橙黄网胞盘菌凝集素(aleuriaaurantialectin,aal)、黄水仙凝集素(npa)、蚕豆凝集素(vfa)、米曲霉凝集素(aol)等是已知的。但是,aal、aol与α1-2岩藻糖、α1-3岩藻糖等也具有亲和性,lca、psa及vfa与不具有岩藻糖α1-6的n连接型单叉及/或双叉糖链也具有亲和性,这样,这些凝集素对于除了α1-6岩藻糖糖链以外的、具有α1-6键以外的岩藻糖的糖脂系糖链或不具有岩藻糖的高甘露糖型糖链也显示出亲和性。
作为较之以往已知的上述凝集素而言以更高的特异性检测α1-6岩藻糖糖链的凝集素,本申请的发明人已从天然的菇类中新发现了翅鳞伞(pholiotasquarrosa)凝集素(phosl)(非专利文献1)、大球盖菇(strophariarugosoannulata)凝集素(srl)(专利文献1)等凝集素。并且,还进行了这些凝集素的化学合成、重组体制备(专利文献4及5)。此外,使用这些凝集素,在对afp-l3的检测(专利文献1)、对大肠癌的恶化程度的辨别(专利文献2)、及对胰腺癌的检测(专利文献3)方面也取得了成功。
现有技术文献
专利文献
专利文献1:日本专利4514163(岩藻糖α1→6特异性凝集素)
专利文献2:日本专利5263979(大肠癌的辨别方法)
专利文献3:日本专利4900983(胰腺癌的检测方法)
专利文献4:日本特开2011-148736(肽)
专利文献5:日本特开2011-148735(基因)
非专利文献
非专利文献1:yukakobayashi等,“anovelcorefucose-specificlectinfromthemushroompholiotasquarrosa”,j.biol.chem,2012,287,p33973-33982
技术实现要素:
发明要解决的课题
通过本申请的发明人发现的α1-6岩藻糖特异性凝集素,得以实现了对α1-6岩藻糖糖链的特异性检测。而如果能够增强基于α1-6岩藻糖糖链与α1-6岩藻糖特异性凝集素的反应的信号,则可以实现对α1-6岩藻糖糖链的准确检测。因此,本发明的目的在于提供对基于α1-6岩藻糖糖链与能和其结合的α1-6岩藻糖特异性凝集素的反应的信号加以强化的信号增强剂。
用于解决课题的手段
本申请的发明人对上述课题进行了锐意研究,结果发现,通过以下的发明即能够解决上述课题,从而完成了本发明。即,本发明提供一种信号增强剂,其增强基于α1-6岩藻糖糖链与能和其结合的α1-6岩藻糖特异性凝集素的反应的信号,所述增强剂的特征在于,以选自由脲及硫脲组成的组中的至少一种作为有效成分。上述所谓“α1-6岩藻糖糖链”的术语,在本说明书中是指“岩藻糖介由α1-6键键合于n型糖链的还原末端n-乙酰葡糖胺而形成的结构”。另外,上述所谓“α1-6岩藻糖特异性凝集素”的术语,在本说明书中是指“具有下述特征的凝集素:(1)对于α1-6岩藻糖糖链具有结合常数为1.0×104m-1以上(25℃时)的亲和性、且(2)与不含α1-6岩藻糖的高甘露糖型糖链及/或不含α1-6岩藻糖的糖脂糖链实质上不结合”。
日本特开2010-145202中公开了增强抗原抗体反应的方法,所述方法中,使抗原与抗体在聚乙二醇及脲的共存下进行反应。而本发明的信号增强剂所应用的反应并非抗原抗体反应,而是α1-6岩藻糖糖链与能和其结合的α1-6岩藻糖特异性凝集素的反应,另外,在不需要聚乙二醇这一点上与日本特开2010-145202的发明明显不同。
本发明还提供增强基于α1-6岩藻糖糖链与能和其结合的α1-6岩藻糖特异性凝集素的反应的信号的方法,所述方法包括以下步骤:在以选自由脲及硫脲组成的组中的至少一种作为有效成分的信号增强剂的存在下,使所述糖链与所述凝集素反应。
本发明还提供增强基于α1-6岩藻糖糖链与能和其结合的α1-6岩藻糖特异性凝集素的反应的信号的方法,所述方法包括以下步骤:利用包含信号增强剂的洗涤液对上述糖链进行洗涤的步骤,所述信号增强剂以选自由脲及硫脲组成的组中的至少一种作为有效成分;以及,使上述糖链与上述凝集素反应的步骤。
本发明还提供α1-6岩藻糖糖链的检测试剂盒,所述试剂盒包含信号增强剂,以下述物质为有效成分:选自由脲及硫脲组成的组中的至少一种,以及,α1-6岩藻糖特异性凝集素。
发明效果
本发明的信号增强剂必须含有选自由脲及硫脲组成的组中的至少一种(以下称为脲等),如后述的实施例中所示,所述信号增强剂可使α1-6岩藻糖糖链与能和其结合的α1-6岩藻糖特异性凝集素的反应敏化,从而能够强化基于该反应的信号。如后述的比较例1所示,上述脲等不会使不具有α1-6岩藻糖糖链的糖链(例如转铁蛋白)与α1-6岩藻糖特异性凝集素的反应敏化。另外,如比较例2所示,上述脲等不会使具有α1-6岩藻糖糖链的糖链与对α1-6岩藻糖具有亲和性但并非特异性的凝集素(例如aal)的反应敏化。上述脲等也不会使具有α1-6岩藻糖糖链的糖链与对α1-6岩藻糖不具有亲和性的凝集素(例如,荆豆凝集素1(uea-1)、百脉根(lotuscorniculatus)凝集素(lotus)、刀豆凝集素(cona)等)的反应敏化(数据未示出)。因此,含有上述脲等的本发明的信号增强剂适合于α1-6岩藻糖糖链与α1-6岩藻糖特异性凝集素的特异性反应。
利用本发明的信号增强剂,能够准确地对α1-6岩藻糖糖链进行测定。这极大地有助于对与α1-6岩藻糖糖链相关的疾病的检测和判定、α1-6岩藻糖糖链的学术研究。
附图说明
图1为示出在脲的存在下及不存在脲的条件下对α1-6岩藻糖特异性凝集素与各种糖蛋白之间的反应值(s-n)进行调查而得到的结果的柱形图。柱形图左侧示出不存在脲的条件下的结果,并且右侧示出存在5m脲的条件下的结果。在脲的存在下,phosl对于具有α1-6岩藻糖糖链的fhp、afp-l3及igg中任一者的反应性均增加。另一方面,对于不属于α1-6岩藻糖糖链的tf的反应性即使在脲的存在下也没有变化。
图2为示出在脲的存在下及不存在脲的条件下对α1-6岩藻糖特异性凝集素(phosl、phosl肽及srl)、或具有α1-6岩藻糖亲和性但并非α1-6岩藻糖特异性的凝集素(aal)与fhp之间的反应值(s-n)进行调查而得到的结果的柱形图。柱形图左侧示出不存在脲的条件下的结果,并且右侧示出存在5m脲的条件下的结果。所有α1-6岩藻糖特异性凝集素与fhp的反应值(s-n)在脲的存在下均增大。另一方面,虽然具有α1-6岩藻糖亲和性但并非特异性的aal与fhp的反应值(s-n)即使在脲的存在下也没有增大。
图3是在脲及岩藻糖的存在下(实施例7)、或脲及甲状腺球蛋白的存在下(实施例8)对phosl与fhp的反应进行调查而得到的柱形图。岩藻糖或甲状腺球蛋白浓度依赖性地阻碍了脲存在下的phosl与fhp的反应。这表明phosl与fhp的α1-6岩藻糖特异性结合同脲有关。
图4是在变更共存的脲浓度的情况下对fhp与phosl的反应进行测定而得到的反应值(s-n)的图。根据图4可知,在脲浓度为1~9m时,信号被增强至1.2~2.8倍。
图5是在变更共存的硫脲浓度的情况下对fhp与phosl的反应进行测定而得到的反应值(s-n)的图。根据图5可知,在硫脲浓度为0.1~1.5m时,信号被增强至1.2~4.1倍。
具体实施方式
本发明的信号增强剂的特征在于,其增强基于α1-6岩藻糖糖链与能和其结合的α1-6岩藻糖特异性凝集素的反应的信号,所述信号增强剂含有选自由脲及硫脲组成的组中的至少一种。
信号增强剂中的脲浓度通常可为1~9m,优选为2.5~9m,进一步优选为3~8m,特别优选为3.5~7m。另外,信号增强剂中的硫脲浓度通常可为0.1~1.5m,优选为0.6~1.5m,进一步优选为0.8~1.5m,特别优选为1~1.4m。
信号增强剂中的上述脲等优选溶解在溶剂中进行使用。溶剂的例子可举出:水;磷酸缓冲化生理盐水、tris缓冲化生理盐水等生理盐水;磷酸缓冲液、tris缓冲液等缓冲液;溶解有牛血清白蛋白等蛋白质的缓冲液、其水溶液;以及包含tween-20(吐温-20)等表面活性剂的缓冲液、其水溶液。
信号增强剂的ph通常为4~10,优选为5~9。
上述所谓α1-6岩藻糖糖链,是指岩藻糖介由α1-6键键合于n型糖链的还原末端n-乙酰葡糖胺而形成的结构,只要为n连接型糖链,则包含所有游离的寡糖链、糖肽、糖蛋白、细胞等。另外,也包含如进行标记那样对寡糖链等进行化学修饰而得到的产物。上述n连接型的糖链可为高甘露糖型、复合型、杂合型等。此外,上述糖链还可以是:上述糖链被酸、肼等以化学方式部分性地分解而得到的糖链;同时或分步使用唾液酸酶、半乳糖苷酶、n-乙酰氨基己糖苷酶、切割α1-2岩藻糖·α1-3岩藻糖·α1-4岩藻糖的岩藻糖苷酶、甘露糖苷酶中的任一种酶,将上述糖链部分地分解而得到的糖链。另外,也可以是在上述糖链上加成葡萄糖这样的糖、乙酰基、硫酸基、磷酸基这样的官能团等而得到的糖链。
岩藻糖α1-6糖链的代表例如下所示。
[化学式1]
〔式中,man表示甘露糖,glcnac表示n-乙酰葡糖胺,fuc表示岩藻糖〕
α1-6岩藻糖糖链的特别优选的具体例为afp-l3、岩藻糖基化结合珠蛋白等肿瘤标志物。
α1-6岩藻糖特异性凝集素的特征在于,与现有的对α1-6岩藻糖糖链具有亲和性的凝集素(例如aal)相比,其以更高的特异性与α1-6岩藻糖糖链结合。该特征可通过(1)对于α1-6岩藻糖糖链的结合常数的下限、和(2)对于不含α1-6岩藻糖的高甘露糖型糖链及/或不含α1-6岩藻糖的糖脂糖链的结合常数的上限来定义。即,α1-6岩藻糖特异性凝集素的特征在于:
(1)对于α1-6岩藻糖糖链具有结合常数为1.0×104m-1以上(25℃时)的亲和性;
(2)与不含α1-6岩藻糖糖链的高甘露糖型糖链及/或不含α1-6岩藻糖的糖脂糖链实质上不结合。
在本说明书中,上述结合常数是指使用例如前沿亲和色谱(fac法)于分析温度25℃进行测定而得到的数值。fac法的详细信息记载于例如由本申请人提出申请的专利文献1中。基于参考的目的,将专利文献1并入本说明书中。
α1-6岩藻糖特异性凝集素的(1)对于α1-6岩藻糖糖链的结合常数(25℃时)优选为5.0×104m-1以上,更优选为1.0×105m-1以上,进一步优选为1.0×106m-1以上。
在本说明书中,α1-6岩藻糖特异性凝集素的所谓“(2)与不含α1-6岩藻糖糖链的高甘露糖型糖链及/或不含α1-6岩藻糖糖链的糖脂糖链实质上不结合”,是指对于不含α1-6岩藻糖糖链的高甘露糖型糖链及/或不含α1-6岩藻糖的糖脂糖链的结合常数(25℃时)通常为1.0×103m-1以下,优选为1.0×102m-1以下,特别优选为0。
α1-6岩藻糖特异性凝集素的利用sds电泳法测得的分子量通常为4,000~40,000,优选为4,000~20,000。此处,利用sds电泳法测得的分子量是按照例如laemmi的方法(nature,227卷,680页,1976年)进行测定而得到的。α1-6岩藻糖特异性凝集素可以是由通常为2~10个、优选为2~6个、进一步优选为2~3个的亚单位(subunit)结合而形成的。
α1-6岩藻糖特异性凝集素对于在非还原末端具有唾液酸的α1-6岩藻糖糖链也具有高的亲和性。另一方面,lca、npa及psa对于在非还原末端具有唾液酸的α1-6岩藻糖糖链的亲和性较低。
对于α1-6岩藻糖特异性凝集素而言,其还对于结合有α1-6岩藻糖的n连接型的单叉、双叉、三叉及/或四叉糖链具有结合常数(25℃时)优选为1.0×104m-1以上、更优选为5.0×104m-1以上、进一步优选为1.0×105m-1以上的亲和性。
α1-6岩藻糖特异性凝集素可从天然物质中提取及/或纯化。来自天然物质的α1-6岩藻糖特异性凝集素的获得方法详细记载于由本申请人提出申请的专利文献1、及由本申请人投稿的非专利文献1中。需要说明的是,专利文献1中记载的土生鳞伞(pholiotaterrestris)凝集素(ptl)替换记载为翅鳞伞凝集素(phosl)。以下,对从天然物质中获得的α1-6岩藻糖特异性凝集素进行简要说明。
上述天然物质为例如担子菌、子囊菌等菇类。球盖菇科、口蘑科、多孔菌科及捕蝇蕈科属于担子菌。作为球盖菇科,可举出翅鳞伞、土生鳞伞、大球盖菇、亚砖红沿丝伞(naematolomasublateritium)、金毛鳞伞(pholiotaaurivella)、多脂鳞伞(pholiotaadiposa)等。作为口蘑科,可举出花脸香蘑(lepistasordida)等。作为多孔菌科,可举出勺形囊孔菌(trichaptumelongatum)、褐扇小孔菌(microporusvernicipes)等。作为捕蝇蕈科,可举出毒蝇伞(amanitamuscaria)等。
这些担子菌或子囊菌中,从凝集素的α1-6岩藻糖糖链识别特异性和凝集素的回收效率的观点考虑,特别优选球盖菇科、口蘑科或捕蝇蕈科,进一步优选翅鳞伞、土生鳞伞、金毛鳞伞、大球盖菇、亚砖红沿丝伞、花脸香蘑或毒蝇伞。
α1-6岩藻糖特异性凝集素优选为来源于担子菌的凝集素,更优选为翅鳞伞凝集素(phosl)、土生鳞伞凝集素(ptl)、大球盖菇凝集素(srl)、亚砖红沿丝伞凝集素(nsl)、花脸香蘑凝集素(lsl)、及毒蝇伞凝集素(aml),进一步优选为phosl、ptl、srl、nsl及aml。
对于上述α1-6岩藻糖特异性凝集素,可通过将已知的提取方法、分离方法、纯化方法等适宜组合来从例如担子菌、子囊菌中分离。例如,包括使用水性介质作为提取溶剂从而得到担子菌及/或子囊菌的水性介质提取物的工序。上述担子菌及/或子囊菌的使用部位优选为子实体。由上述提取物得到下述凝集素:所述凝集素的利用sds电泳法而得到的分子量通常为4,000~40,000,优选为4,000~20,000,以及,对于α1-6岩藻糖糖链具有结合常数(25℃时)通常为1.0×104m-1以上、优选为5.0×104m-1以上、更优选为1.0×105m-1以上、进一步优选为1.0×106m-1以上的亲和性。
此外,对于α1-6岩藻糖特异性凝集素而言,除了从上述天然物质中提取以外,也可以是基于天然来源的凝集素的氨基酸序列进行化学合成而得到的肽、蛋白质。进而,化学合成的肽、蛋白质还可以是将天然来源的凝集素(例如包含本说明书所附序列号1的氨基酸序列的phosl)的氨基酸序列中的1个或多个氨基酸以赖氨酸及/或精氨酸取代、且具有糖结合活性的肽(例如包含本说明书所附序列号2的氨基酸序列的phosl肽)。其合成方法详细记载于由本申请人提出申请的专利文献4中。基于参考的目的,将专利文献4的说明书并入本说明书。
此外,对于α1-6岩藻糖特异性凝集素而言,除了从上述天然物质中提取以外,也可以是使用编码天然来源的凝集素的氨基酸序列的核酸、在与天然来源不同的已知宿主内进行人工表达而得到的重组体(例如实施例18中所示的phosl重组凝集素)。重组体的表达方法详细记载于专利文献5中。基于参考的目的,将由本申请人提出申请的专利文献5的说明书并入本说明书。
对于α1-6岩藻糖特异性凝集素而言,优选组入有能够进行检测的标记手段。作为上述标记手段,没有特别限制,可应用已知的标记方法,例如,可举出利用放射性同位素的标记、标记化合物的结合等。作为上述放射性同位素,可举出例如14c、3h及32p。
作为上述标记化合物,例如可举出酶标记(辣根过氧化物酶、碱性磷酸酶等)、生物素标记、地高辛标记、荧光标记(异硫氰酸荧光素、cydye(注册商标)、4-氨基苯甲酸乙酯(abee)、氨基吡啶、别藻蓝蛋白、藻红蛋白等)等。这些标记化合物可利用常规方法与凝集素结合。从灵敏度高的观点考虑,特别优选生物素标记。
本发明还提供增强基于α1-6岩藻糖糖链与能和其结合的α1-6岩藻糖特异性凝集素的反应的信号的方法,所述方法包括以下步骤:在以选自由脲及硫脲组成的组中的至少一种作为有效成分的信号增强剂的存在下,使上述糖链与上述凝集素反应。
上述反应步骤中的脲浓度通常可为1~9m,优选为2.5~9m,进一步优选为3~8m,特别优选为3.5~7m。另外,上述反应步骤中的硫脲浓度通常可为0.1~1.5m,优选为0.6~1.5m,进一步优选为0.8~1.5m,特别优选为1~1.4m。
本发明还提供增强基于α1-6岩藻糖糖链与能和其结合的α1-6岩藻糖特异性凝集素的反应的信号的方法,所述方法包括以下步骤:利用包含信号增强剂的洗涤液对上述糖链进行洗涤的步骤,所述信号增强剂以选自由脲及硫脲组成的组中的至少一种作为有效成分;以及,使上述糖链与上述凝集素反应的步骤。
上述洗涤液中的脲浓度通常可为1~9m,优选为2.5~9m,进一步优选为3~8m,特别优选为3.5~7m。另外,上述洗涤液中的硫脲浓度通常可为0.1~1.5m,优选为0.6~1.5m,进一步优选为0.8~1.5m,特别优选为1~1.4m。另外,使上述糖链与上述凝集素反应的步骤可在以选自由脲及硫脲组成的组中的至少一种作为有效成分的信号增强剂的存在下进行。
上述方法中,对与α1-6岩藻糖特异性凝集素反应后的α1-6岩藻糖糖链进行检测的手段没有特别限制。作为检测手段,例如,可使用elisa(直接吸附法、夹心法、及竞争法)、凝集素亲和色谱法、凝集素染色、凝集素芯片、流式细胞术(facs)、凝集法、表面等离子共振法(例如,biacore(注册商标)系统)、电泳、微珠(bead)等。以下,对几种代表性的检测方法进行简要说明。
直接吸附elisa法中,将血液等待测试样添加至平板(plate)中进行固定。接着,将经过生物素标记的凝集素与信号增强剂一同添加,使糖链与凝集素在信号增强剂的存在下反应。或者,也可先添加包含信号增强剂的洗涤液,在弃置后添加不包含信号增强剂的凝集素溶液。添加hrp(辣根过氧化物酶)标记链亲和素的溶液作为2次标记化合物,使生物素与链亲和素反应。接着,添加hrp用显色底物使其显色,用吸光光度计测定显色强度。若预先利用含有已知浓度的糖链的标准试样绘制标准曲线,则还可确定糖链的量。
夹心elisa法中,将能与具有α1-6岩藻糖糖链的抗原结合的抗体添加至平板中进行固定,然后添加血清等待测试样。接着,将经过生物素标记的凝集素与信号增强剂一同添加,使糖链与凝集素在信号增强剂的存在下反应。或者,也可先添加包含信号增强剂的洗涤液,在弃置后添加不包含信号增强剂的凝集素溶液。添加hrp(辣根过氧化物酶)标记链亲和素的溶液作为2次标记化合物,使生物素与链亲和素反应。接着,添加hrp用显色底物使其显色,用吸光光度计测定显色强度。若预先利用已知浓度的标准试样绘制标准曲线,则还可对α1-6岩藻糖糖链进行定量。
凝集素亲和色谱法是利用固定于载体的凝集素与糖链特异性结合的性质的亲和色谱法。通过与hplc组合,可期待实现高通量。
作为固定凝集素的载体,通常为琼脂糖、葡聚糖、纤维素、淀粉、聚丙烯酰胺等凝胶材料。对于这些载体,可不受特别限制地使用市售的材料,例如可举出sepharose4b、sepharose6b(均为gehealthcarebioscienceco.,ltd.制)。作为用于凝集素色谱的柱,也包含将凝集素固定于微孔板、纳米孔(nanowell)而得到的柱。
固定的凝集素的浓度通常为0.001~100mg/ml,优选为0.01~20mg/ml。载体为琼脂糖凝胶的情况下,将其用cnbr等进行活化后,与凝集素偶联(coupling)。也将凝集素固定于导入有活化间隔基团(activationspacer)的凝胶。此外,也可在将凝集素固定于导入有甲酰基的凝胶后用nacnbh3还原。另外,还可使用nhs-sepharose(gehealthcarebioscienceco.,ltd.制)这样的市售活化凝胶。
将待测试样与信号增强剂一同供于柱后,基于洗涤的目的使缓冲液流过。或者,在缓冲液中已添加信号增强剂的状态下将待测试样供于柱。作为缓冲液的一例,有以下缓冲液:摩尔浓度通常为5~500mm,优选为10~500mm,ph通常为4.0~10.0,优选为6.0~9.0,nacl的含量通常为0~0.5m,优选为0.1~0.2m,cacl2、mgcl2、或mncl2的含量通常为0~10mm,优选为0~5mm的缓冲液。
对亲和层析柱进行洗涤后,在能够有效地洗脱糖链的中性的非改性缓冲液中,使用氯化钠、半抗原糖等脱附剂(desorbent)进行糖链的洗脱。该缓冲液可以与上述相同。脱附剂的浓度优选为1~500mm,特别优选为10~200mm的浓度。洗脱缓冲液中优选不包含信号增强剂。
凝集素染色中,从肿瘤组织中切出待测试样薄片,将该薄片贴合于玻璃板上。将板浸入封闭缓冲液中,于室温缓缓进行搅拌。适当进行内源性过氧化物酶的灭活。将板浸入含有信号增强剂的生物素标记凝集素溶液(用封闭缓冲液将该生物素标记凝集素溶液稀释为2~5μg/ml)中,于室温缓缓搅拌1小时。或者,也可先添加包含信号增强剂的洗涤液,在弃置洗涤液后添加不包含信号增强剂的凝集素溶液。将板浸入hrp标记抗生物素蛋白(avidin)溶液中,于室温缓缓搅拌。将板浸入显色液中,于室温使其显色数分钟。在能充分地确认到显色后用水洗涤,终止反应。用光学显微镜观察显色的组织。凝集素染色可使用市售的凝集素染色试剂盒来进行。
facs法中,将细胞(待测试样)悬浮于磷酸缓冲化生理盐水(pbs)中。使用安装有21g的针、容量为2.5ml的注射器,用力抽吸10次左右,使细胞分散,然后使用50μm的筛对细胞进行过滤。将经过荧光标记的凝集素的溶液和信号增强剂一同加入到这样制备的细胞中,使细胞与凝集素在信号增强剂的存在下结合。或者,也可先添加包含信号增强剂的洗涤液,在弃置洗涤液后添加不包含信号增强剂的凝集素溶液。然后,使用流式细胞仪(例如,beckmancoulter,inc.制cytomicsfc500),对结合有凝集素的细胞的量、比例进行分析。
对于用于上述检测手段的待测试样没有特别限制。例如,可举出血液、血浆、血清、泪液、唾液、体液、乳汁、尿液、细胞的培养上清液、来自转基因动物的分泌物等。
本发明还提供α1-6岩藻糖糖链的检测试剂盒,其包含以选自由脲及硫脲组成的组中的至少一种作为有效成分的信号增强剂、及α1-6岩藻糖特异性凝集素。
检测试剂盒可适当包含各种标记化合物、缓冲液、平板、微珠、反应终止液等在检测试剂盒中通用的组成。检测试剂盒优选还包含用于从得自生物体血液的待测试样中提取具有α1-6岩藻糖糖链的糖蛋白的试剂(例如,抗结合珠蛋白抗体、抗α甲胎蛋白抗体等抗体、蛋白a、蛋白g、蛋白l等免疫球蛋白结合蛋白质)。
本发明的α1-6岩藻糖糖链检测试剂盒的用途只要是基于检测α1-6岩藻糖糖链的目的则没有特别限定。以下,对其具体例子进行说明。
对afp-l3条带(经核心岩藻糖转移的α甲胎蛋白的条带)的高准确度检测作为肝硬化并发肝细胞癌的早期临床诊断、肝细胞癌的周密病程观察、治疗效果的准确判定、胚胎瘤的早期发现、急性重型肝炎的肝脏再生的指标等是有用的。另外,作为肝癌诊断的指标,经核心岩藻糖转移的α5β1整合素也被期待。
在恶性程度低的大肠癌、其原发癌中,包括核心岩藻糖在内的所有岩藻糖均增加。另一方面,在恶性程度高的大肠癌、其转移癌中,存在α1-6键合岩藻糖减少的趋势。因此,通过使α1-6岩藻糖特异性凝集素作用于在初步筛选中被诊断为大肠癌的患者的大肠癌肿瘤组织,并对α1-6键合岩藻糖的量进行调查,由此能够辨别恶性程度高的大肠癌、转移癌。
成为胰腺癌后,会生成在作为糖蛋白的结合珠蛋白上加成核心岩藻糖而形成的岩藻糖基化结合珠蛋白。该岩藻糖基化结合珠蛋白伴随胰腺癌的病程进展而增加,并在摘除胰腺癌的肿瘤部位后消失。通过使得在α1-6岩藻糖特异性凝集素与岩藻糖基化结合珠蛋白的反应中共存有本发明的信号增强剂,能够提高利用α1-6岩藻糖特异性凝集素的检测灵敏度。另外,也可以利用包含信号增强剂的洗涤液对岩藻糖基化结合珠蛋白进行洗涤,然后在弃置洗涤液之后添加不包含信号增强剂的凝集素溶液。此外,根据使用了α1-6岩藻糖特异性凝集素和抗结合珠蛋白抗体的分析,能够迅速且简便地检测胰腺癌。此外,通过将胰腺癌标志物ca19-9的抗体和α1-6岩藻糖特异性凝集素组合,能够辨别胰腺癌和胰腺炎。此时,在共存有本发明的信号增强剂的情况下,辨别将会更加容易。
对于本发明的检测试剂盒而言,除了用于上述疾病的诊断、研究以外,还期待将其用于以下疾病的诊断、研究:前列腺癌、乳腺癌、胃癌、小肠癌、结肠直肠癌、肾细胞癌、小细胞肺癌、非小细胞癌、子宫癌、卵巢癌、甲状腺癌、软组织肉瘤、骨肉瘤、黑素瘤、胶质母细胞瘤、星形细胞瘤、髓母细胞瘤、急性淋巴瘤、恶性淋巴瘤、霍奇金病(hodgkin’sdisease)、非霍奇金淋巴瘤、急性髓性白血病(acutemyelogenousleukemia)、慢性淋巴性白血病等肿瘤;变应性疾病;自身免疫性疾病;以及肺气肿等循环器官疾病。
实施例
以下给出本发明的实施例,对本发明更详细地进行说明。但是,本发明不限于以下的实施例。
本发明中使用的试剂按照以下的步骤制备。
(1)磷酸缓冲化生理盐水(pbs)
称量5.75g磷酸氢二钠(和光纯药公司制)、1.0g磷酸二氢钾(和光纯药公司制)、1.0g氯化钾(和光纯药公司制)、40.0g氯化钠(和光纯药公司制),加入400ml水溶解后,移至量筒中,用水定容至500ml,制成10倍浓度的磷酸缓冲化生理盐水(10×pbs)。将10×pbs用水稀释为10倍,制备pbs。
(2)1%牛血清白蛋白(bsa)/pbs
称量1g的bsa(和光纯药公司制),溶解于100ml的pbs中从而进行制备。
(3)0.05%tween/pbs
相对于5l的pbs而言,添加2.5ml聚氧乙烯山梨糖醇酐单月桂酸酯(tween20,nacalaitesque,inc.制)。
(4)生物素标记phosl
作为α1-6岩藻糖特异性凝集素,按照非专利文献1中记载的方法,从翅鳞伞中提纯翅鳞伞凝集素(phosl,序列号1)。量取该翅鳞伞凝集素,添加0.1m碳酸氢钠溶液使其溶解(浓度:5mg/ml)。将生物素化试剂(sigma公司制;型号:b2643)溶解于二甲基亚砜中,添加至凝集素溶液并使其反应。通过超滤(3k的膜,millipore公司制),用水对反应液进行溶剂置换,进行冷冻干燥,得到生物素标记phosl。
(5)生物素标记phosl肽
基于专利文献4的实施例6的记载(其中,将专利文献4的ptl替换记载为phosl),合成phosl肽(序列号2)。经由与生物素标记phosl相同的步骤,对该凝集素进行生物素标记。
(6)生物素标记srl
按照专利文献2中记载的方法,提取srl(序列号3)。经由与生物素标记phosl相同的步骤,对该凝集素进行生物素标记。
(7)生物素标记橙黄网胞盘菌凝集素(生物素标记aal)
准备生物素标记橙黄网胞盘菌凝集素(j-oilmills,inc.制)。
将(4)~(6)的α1-6岩藻糖特异性凝集素(标记前)的序列表示于表1。
[表1]
序列号1的第10及17位的x可以是任意的氨基酸残基,优选为cys,第20、23、27、33、35及39位的x分别为tyr/ser、phe/tyr、arg/lys/asn、asp/gly/ser、asn/ala、及thr/gln。
对于序列号2而言,在序列号1的具体例(apvpvtklvcdgdtykctayldfgdgrwvaqwdtnvfhtg)中,第1位的ala、第20位的tyr、及第39位的thr被lys取代,另外,第40位的gly缺失。
序列号3的第10及17位的x可以是任意的氨基酸残基,优选为cys,第4、7、9、13、20、27、29、33、34及39位的x分别为pro/gly、glu/lys、val/asp、asn/asp/glu、his/ser、lys/his、val/ile、gly/asn/ser、ala/thr、及arg/thr。
〔实施例1~3〕信号增强试验(1)
通过直接吸附elisa法,使具有α1-6岩藻糖糖链的糖蛋白与α1-6岩藻糖特异性凝集素在脲的存在下或不存在脲的条件下反应,对基于糖链与凝集素的结合反应的信号是否增强进行了调查。具体的步骤如下。
作为具有α1-6岩藻糖糖链的糖蛋白,准备了岩藻糖基化结合珠蛋白(以下称为“fhp”)、α-甲胎蛋白l3(以下称为“afp-l3”)、小鼠免疫球蛋白g(sigma公司制,以下称为“igg”)。基于比较目的,还准备了转铁蛋白(sigma公司制,以下称为“tf”)作为并非α1-6岩藻糖糖链的糖蛋白。fhp及afp-l3的制备方法如下。
(1)fhp溶液的制备
按照常规方法培养胰腺癌细胞株(psn-1,从dspharmabiomedicalco.,ltd.获得),得到培养上清液。用超滤过滤器(制品名:vivaspin20‐10k,sartoriusag制)将1000ml培养上清液浓缩为1ml。向上述浓缩液中添加0.5ml下述凝胶,所述凝胶是将抗结合珠蛋白抗体(thebindingsiteltd.制)固定于nhs活化琼脂糖凝胶4ff(nhs-activatedsepharose4fastflow)(gehealthcarebioscienceco.,ltd.制)而得到的。于室温每隔10分钟进行混和,1小时后,将包含上述凝胶的溶液添加至0.45μm过滤器微量管(millipore公司制)中,以400×g、温度4℃的条件离心5分钟,弃置滤液。接着,添加200μl的pbs,以400×g、温度4℃的条件离心5分钟,弃置滤液。重复进行2次上述操作。接着,添加200μl洗脱缓冲液(elutionbuffer)(100mm甘氨酸,0.5mnacl,ph3.0),以400×g、温度4℃的条件离心5分钟,回收滤液。重复进行2次上述操作。用3n的naoh对将这些滤液合并而得到的溶液进行中和,然后添加600μl的pbs,得到fhp溶液。进一步用pbs稀释该fhp溶液,制备1000ng/ml的fhp溶液。
(2)afp-l3溶液的制备
按照常规方法培养肝癌细胞株(hepg2,从理化学研究所获得),得到培养上清液。用超滤过滤器(制品名:vivaspin20‐10k,sartoriusag制)将1000ml培养上清液浓缩为1ml。向上述浓缩液中添加0.5ml下述凝胶,所述凝胶是将抗afp抗体(dako公司制)固定于nhs活化琼脂糖凝胶4ff(gehealthcarebioscienceco.,ltd.制)而得到的。于室温每隔10分钟进行混和,1小时后,将包含上述凝胶的溶液添加至0.45μm过滤器微量管(millipore公司制)中,以400×g、温度4℃的条件离心5分钟,弃置滤液。接着,添加200μl的pbs,以400×g、温度4℃的条件离心5分钟,弃置滤液。重复进行2次上述操作。接着,添加200μl洗脱缓冲液(100mm甘氨酸,0.5mnacl,ph3.0),以400×g、温度4℃的条件离心5分钟,回收滤液。重复进行2次上述操作。用3n的naoh对将这些滤液合并而得到的溶液进行中和,然后添加600μl的pbs,得到afp-l3溶液。进一步用pbs稀释该afp-l3溶液,制备1000ng/ml的afp-l3溶液。
(3)igg及tf溶液的制备
将igg及tf分别用pbs溶解,制备5000ng/ml的igg溶液、及5000ng/ml的tf溶液。
直接吸附elisa法的步骤如下所示。
(1)抗原固定化
向微量滴定板(greinerbio-onegmbh制)的孔中添加50μl的fhp、afp-l3、igg或tf的上述溶液,于4℃放置16小时后,弃置添加的液体。
(2)洗涤
向各孔中添加250μl的0.05%tween/pbs,弃置添加的液体。
(3)封闭
向各孔中添加200μl的1%bsa/pbs,于37℃放置1小时后,弃置添加的液体。
(4)洗涤
向各孔中添加250μl的0.05%tween/pbs,弃置添加的液体。共重复3次该操作。
(5)凝集素反应
用1%bsa/pbs稀释生物素标记phosl,然后添加脲(和光纯药公司制),制备凝集素溶液(生物素标记phosl的最终浓度为1μg/ml,脲的最终浓度为5m)。向孔中添加50μl该凝集素溶液,于4℃放置30分钟后,弃置添加的液体。作为对照,对未添加脲的凝集素溶液(生物素标记phosl的最终浓度为1μg/ml,脲为0m)也进行同样的反应。
(6)洗涤
向各孔中添加250μl的0.05%tween/pbs,弃置添加的液体。共重复3次该操作。
(7)hrp标记链亲和素反应
向孔中添加50μl的hrp标记链亲和素溶液(vector公司制,制备成1μg/mlpbs),于室温放置30分钟后,弃置添加的液体。
(8)洗涤
向各孔中添加250μl的0.05%tween/pbs,弃置添加的液体。共重复3次该操作。
(9)显色反应
向孔中添加50μl的hrp用显色底物(制品名:tmb过氧化物酶底物系统,kpl公司制),于室温放置5分钟。
(10)反应终止
添加50μl的1m磷酸,终止反应。
使用平板读取器(platereader)(制品名:powerscan(注册商标)ht,dspharma公司制),测定波长450nm及630nm处的吸光度。将从450nm处的吸光度值中减去630nm处的吸光度值而得到的值作为检测值(信号:s)。同样地,测定未添加糖蛋白的孔的检测值(背景噪音(noise):n),将从检测值(s)中减去孔自身的检测值(n)而得到的值作为反应值(s-n)脲5m。另外,也求出在不存在脲的条件下使凝集素与糖蛋白反应时的反应值(s-n)脲0m。
信号的增大量及增大率分别利用以下的数学式求出。
[数学式1]
信号增大量=(s-n)脲5m-(s-n)脲om
[数学式2]
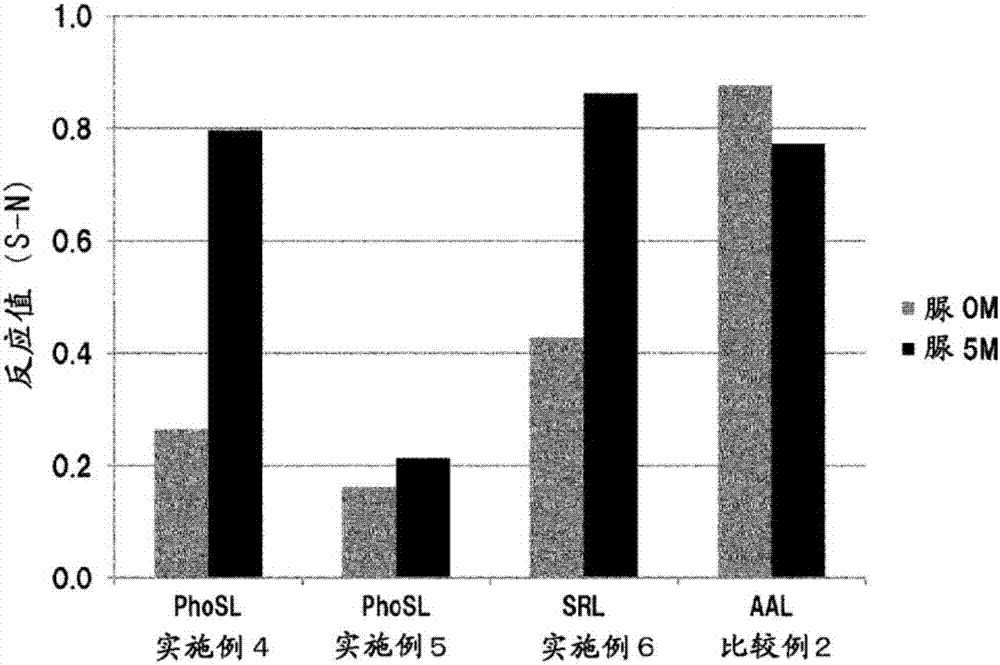
将phosl对于各种糖蛋白的反应值(s-n)示于表2及图1。
[表2]
(s-n)脲0m:在不存在脲的条件下进行反应时的反应值(s-n)
(s-n)脲5m:在5m脲的存在下进行反应时的反应值(s-n)
根据表2及图1可知,就基于在脲存在下的fhp、afp-l3或igg与phosl的反应的信号而言,与不存在脲的情况相比,信号增大量及信号增大率均显著增大。另一方面,就基于并非α1-6岩藻糖糖链的tf与phosl的反应的信号而言,虽然信号增大率高,但信号增大量并没有显著增大。
〔实施例4~6〕信号增强试验(2)
通过夹心elisa法,在脲的存在下或不存在脲的条件下,使作为具有α1-6岩藻糖糖链的糖蛋白的fhp与各种α1-6岩藻糖特异性凝集素进行反应,对基于糖蛋白与凝集素的结合反应的信号是否增强进行了调查。具体的步骤如下。
作为α1-6岩藻糖特异性凝集素,使用了生物素标记phosl、生物素标记phosl肽、及生物素标记srl。基于比较目的,使用了也能与具有α1-6以外的岩藻糖的糖链结合的生物素标记aal。
夹心elisa法的步骤如下所示。
(1)抗体固定化
将除去糖链后的抗结合珠蛋白抗体(nipponbio-testlaboratoriesinc.制)用pbs稀释为5μg/ml,向微量滴定板(greinerbio-onegmbh制)的各孔中分别添加50μl,于4℃放置16小时后,弃置添加的液体。
(2)洗涤
向各孔中添加250μl的0.05%tween/pbs,弃置添加的液体。
(3)封闭
向各孔中添加200μl的1%bsa/pbs,于37℃放置1小时后,弃置添加的液体。
(4)洗涤
向各孔中添加250μl的0.05%tween/pbs,弃置添加的液体。共重复3次该操作。
(5)抗原抗体反应
向各孔中添加50μl用1%bsa/pbs稀释而得到的200ng/ml的fhp,于室温放置1小时后,弃置添加的液体。
(6)洗涤
向各孔中添加250μl的0.05%tween/pbs,弃置添加的液体。共重复3次该操作。
(7)凝集素反应
用1%bsa/pbs溶液稀释生物素标记phosl、生物素标记phosl肽、生物素标记srl或生物素标记aal,然后添加脲(和光纯药公司制),制备各凝集素溶液(生物素标记凝集素的最终浓度为1μg/ml,脲的最终浓度为5m)。向孔中添加50μl该凝集素溶液,于4℃放置30分钟后,弃置添加的液体。作为对照,对未添加脲的凝集素溶液(生物素标记凝集素的最终浓度为1μg/ml,脲为0m)也进行同样的反应。
(8)洗涤
向各孔中添加250μl的0.05%tween/pbs,弃置添加的液体。共重复3次该操作。
(9)hrp标记链亲和素反应
向孔中添加50μl的hrp标记链亲和素溶液(1μg/ml),于室温放置30分钟后,弃置添加的液体。
(10)洗涤
向各孔中添加250μl的0.05%tween/pbs,弃置添加的液体。共重复3次该操作。
(11)显色反应
向孔中添加50μl的hrp用显色底物(制品名:tmb过氧化物酶底物系统,kpl公司制),于室温放置5分钟。
(12)反应终止
添加50μl的1m磷酸,终止反应。
使用上述平板读取器,与实施例1同样地测定波长450nm及630nm处的吸光度,进而求出反应值(s-n)脲5m。并且,求出在不存在脲的条件下使凝集素与糖蛋白反应时的反应值(s-n)脲0m。将在脲存在下和不存在脲的条件下的反应值(s-n)、其增大量及增大率示于表3及图2。
[表3]
(s-n)脲0m:在不存在脲的条件下进行反应时的反应值(s-n)
(s-n)脲5m:在5m脲的存在下进行反应时的反应值(s-n)
根据图2及表3可知,较之不存在脲的情况而言,在5m(最终浓度)脲的存在下,phosl、phosl肽或srl与fhp的反应的信号增大量及信号增大率均显著改善。另一方面,对于也能与α1-6岩藻糖以外的岩藻糖结合的aal而言,即使在反应体系中添加脲,信号也没有增强。
如实施例1~6所示,本发明的信号增强剂能够对基于α1-6岩藻糖糖链与能和其结合的α1-6岩藻糖特异性凝集素的反应的信号加以强化。脲不会使不具有α1-6岩藻糖糖链的转铁蛋白与α1-6岩藻糖特异性凝集素的反应敏化(比较例1)。脲也不会使具有α1-6岩藻糖糖链的糖链与具有α1-6岩藻糖亲和性但并非特异性的aal的反应敏化(比较例2)。脲不会使α1-6岩藻糖糖链与不具有α1-6岩藻糖亲和性的uea-1、lotus、cona等的反应敏化(数据未示出)。根据以上结果,可得出结论,由本发明的信号增强剂实现的信号增强是仅在α1-6岩藻糖糖链与α1-6岩藻糖特异性凝集素的反应中发生的现象。
〔实施例7~8〕信号增强作用的阻碍试验
为了调查本发明的信号增强剂的信号增大效果是否来自于α1-6岩藻糖糖链与α1-6岩藻糖特异性凝集素的特异性结合,使用夹心elisa法进行了阻碍试验(inhibitiontest)。
实施例7中,使在5m脲的存在下的fhp与phosl的反应中共存有最终浓度为20mm或100mm的岩藻糖(nacalaitesque,inc.制)。实施例8中,代替实施例7的岩藻糖,使反应中共存有最终浓度为0.01mg/ml或0.1mg/ml的甲状腺球蛋白(sigma公司制,以下称为“tg”)。已知使作为单糖的岩藻糖以20~100mm左右的浓度共存时,fhp与phosl的糖链特异性结合会受到阻碍。另外,已知具有α1-6岩藻糖糖链的tg也同样地能够阻碍fhp与phosl的糖链特异性结合。
与实施例1同样地,使用上述平板读取器测定波长450nm及630nm处的吸光度,进而求出反应值(s-n)。将添加岩藻糖或tg时的检测结果示于图3。
根据图3可知,反应值(s-n)伴随岩藻糖或tg的添加浓度的增大而降低。由此确认到,基于凝集素与糖蛋白的结合的信号在脲的存在下增大的效果是由于α1-6岩藻糖特异性凝集素与α1-6岩藻糖糖链的特异性结合而产生的。
〔实施例9〕脲浓度的变更试验
通过夹心elisa法,调查作为信号增强剂的脲的优选范围。在实施例4中使用fhp(50ng/ml),以及使脲在凝集素溶液中的最终浓度为0~9m,除此以外,按照与实施例4相同的步骤实施试验。
与实施例1同样地操作,使用上述平板读取器测定波长450nm及630nm处的吸光度,进而求出反应值(s-n)。将脲的各最终浓度下的、相对于未添加脲时的信号增大率示于图4。
根据图4可知,在最终浓度为1~9m的脲的存在下,信号被增强至1.2~2.8倍。脲的最终浓度优选为3~9m,进一步优选为3~8m,特别优选为3~7m。
〔实施例10~11〕使用硫脲的试验
通过直接吸附elisa法,使具有α1-6岩藻糖糖链的糖蛋白(fhp或afp-l3)与α1-6岩藻糖特异性凝集素(phosl)在硫脲的存在下或不存在硫脲的条件下反应,对基于糖链与凝集素的结合反应的信号是否增强进行了调查。除了以1.2m硫脲(和光纯药公司制)代替实施例1中的5m脲以外,按照与实施例1相同的步骤实施试验。
根据得到的吸光度,与实施例1同样地求出反应值(s-n)。另外,也求出在不存在硫脲的条件下使凝集素与糖蛋白反应时的反应值(s-n)。
信号的增大量及增大率分别利用以下的数学式求出。
[数学式3]
信号增大量=(s-n)硫脲1.2m-(s-n)硫脲0m
[数学式4]
将phosl对于各种糖蛋白的反应值(s-n)示于表4。
[表4]
(s-n)硫脲0m:在不存在硫脲的条件下进行反应时的反应值(s-n)
(s-n)硫脲1.2m:在1.2m硫脲的存在下进行反应时的反应值(s-n)
就基于fhp及afp-l3与phosl在硫脲存在下的反应的信号而言,与不存在硫脲的情况相比,信号增大量及信号增大率均显著增大。
〔实施例12〕硫脲浓度的变更试验
通过夹心elisa法,调查作为信号增强剂的硫脲的优选范围。使用硫脲代替实施例4中的脲,并使硫脲在凝集素溶液中的最终浓度为0~1.5m,除此以外,按照与实施例4相同的步骤实施试验。
与实施例1同样地操作,使用上述平板读取器测定波长450nm及630nm处的吸光度,进而求出反应值(s-n)。与实施例10同样地,求出硫脲的各最终浓度下的、相对于不存在硫脲时的信号增大率,将其结果示于图5。
根据图5可知,在最终浓度为0.1~1.5m的硫脲的存在下,信号被增强至1.2~4.1倍。硫脲的最终浓度通常可为0.1~1.5m,优选为0.6~1.5m,进一步优选为0.8~1.5m,特别优选为1~1.4m。
〔实施例13~14〕向洗涤液中添加信号增强剂的试验
通过夹心elisa法,添加具有α1-6岩藻糖糖链的糖蛋白(fhp)后,用含有脲或硫脲的溶液进行洗涤,弃置溶液后,使其与凝集素溶液反应,对基于糖链与凝集素的结合反应的信号是否增强进行了调查。
具体而言,相对于实施例4中“(6)洗涤”的洗涤液(0.05%tween/pbs),添加最终浓度为5m的脲或最终浓度为1.2m的硫脲,并且,不向“(7)凝集素反应”的凝集素溶液中添加脲,除此以外,按照与实施例4相同的步骤实施试验。
使用上述平板读取器,与实施例1同样地测定波长450nm及630nm处的吸光度,进而求出反应值(s-n)。此外,与上述同样地算出向洗涤液中添加脲或硫脲的情况下的、相对于未添加脲及硫脲时的信号增大量及增大率,将其示于表5。
[表5]
(s-n)0m:在不存在脲及硫脲的条件下进行反应时的反应值(s-n)
(s-n)脲5m:在5m脲的存在下进行反应时的反应值(s-n)
(s-n)硫脲1.2m:在1.2m硫脲的存在下进行反应时的反应值(s-n)
由表5可以判明,在利用含有脲或硫脲的洗涤液对具有α1-6岩藻糖糖链的糖蛋白进行洗涤后,使其与α1-6岩藻糖特异性凝集素反应时,也能够实现对基于糖链与凝集素的结合反应的信号的增强。
〔实施例15~17〕
与翅鳞伞凝集素同样地,从土生鳞伞、亚砖红沿丝伞及毒蝇伞中提纯土生鳞伞凝集素(ptl)、亚砖红沿丝伞凝集素(nsl)、及毒蝇伞凝集素(aml)。经由与生物素标记phosl相同的步骤对得到的凝集素进行生物素标记,得到生物素标记ptl、生物素标记nsl及生物素标记aml。
除了将生物素标记phosl置换为生物素标记ptl、生物素标记nsl或生物素标记aml以外,通过与实施例4相同的方法实施夹心elisa。将结果示于表6。
[表6]
(s-n)脲0m:在不存在脲的条件下进行反应时的反应值(s-n)
(s-n)脲5m:在5m脲的存在下进行反应时的反应值(s-n)
如表6所示,可知在脲的存在下,任一种α1-6岩藻糖特异性凝集素的信号均被增强。
〔实施例18〕使用了微珠的检测方法
按照磁性微珠(invitrogencorporation制,14204)的说明书,将除去糖链后的抗结合珠蛋白抗体固定,由此制备抗体固定化磁性微珠。
按照常规方法实施使用了微珠的检测。具体而言,将岩藻糖基化结合珠蛋白(fhp)(最终浓度:0μg/ml或0.45μg/ml)、脲(最终浓度为0m或5m)、序列号4所示的phosl重组凝集素(向专利文献5:日本特开2011-148735的序列号1中添加dykdddk标签而得到的凝集素,最终浓度为5μg/ml)混合,形成复合体。将包含复合体的上述溶液稀释成10倍,添加抗体固定化磁性微珠,使用磁石洗涤后,添加hrp标记抗flag抗体(sigma公司制),与检测抗体形成复合体。使用上述hrp用显色底物,使其显色,使用1m磷酸终止显色反应。与上述同样地用平板读取器测定得到的溶液的吸光度。
将从fhp存在下的450nm处的吸光度值中减去630nm处的吸光度值而得到的值作为检测值(信号:s),同样地求出在不存在fhp的条件下的检测值(背景噪音:n)。将从5m脲存在下的检测值(s)中减去孔自身的检测值(n)而得到的值作为反应值(s-n)脲5m。另外,同样地求出不存在脲时的反应值(s-n)脲0m。另外,将用5m脲存在下的检测值s除以检测值n而得到的值作为反应值(s/n)脲5m。同样地求出不存在脲时的反应值(s/n)脲0m。与实施例1同样地,算出信号的增大量及增大率。将其结果示于表7。
[表7]
(s-n)脲0m:在不存在脲的条件下进行反应时的反应值(s-n)
(s-n)脲5m:在5m脲的存在下进行反应时的反应值(s-n)
(s/n)脲0m:在不存在脲的条件下进行反应时的反应值(s/n)
(s/n)脲5m:在5m脲的存在下进行反应时的反应值(s/n)
根据表7可知,就基于在脲存在下的fhp与重组凝集素的反应的信号而言,与不存在脲的情况相比,信号增大量及信号增大率均显著增大。同样地,反应值(s/n)较之不存在脲的情况而言也显著增大。确认到在使用了微珠的检测方法中也能够得到本发明的效果。
序列表
<110>j-制油株式会社
<120>信号增强剂
<130>np2293pct
<150>jp2015-37717
<151>2015-02-27
<160>4
<170>patentinversion3.5
<210>1
<211>40
<212>prt
<213>翅鳞伞
<220>
<221>misc_feature
<222>(10)..(10)
<223>x表示任意的氨基酸,优选cys。
<220>
<221>misc_feature
<222>(17)..(17)
<223>x表示任意的氨基酸,优选cys。
<220>
<221>misc_feature
<222>(20)..(20)
<223>x表示tyr/ser。
<220>
<221>misc_feature
<222>(23)..(23)
<223>x表示phe/tyr。
<220>
<221>misc_feature
<222>(27)..(27)
<223>x表示arg/lys/asn。
<220>
<221>misc_feature
<222>(33)..(33)
<223>x表示asp/gly/ser。
<220>
<221>misc_feature
<222>(35)..(35)
<223>x表示asn/ala。
<220>
<221>misc_feature
<222>(39)..(39)
<223>x表示thr/gln。
<400>1
alaprovalprovalthrlysleuvalxaaaspglyaspthrtyrlys
151015
xaathralaxaaleuaspxaaglyaspglyxaatrpvalalaglnthr
202530
xaathrxaavalphehisxaagly
3540
<210>2
<211>39
<212>prt
<213>人工序列
<220>
<223>修饰序列1
<400>2
lysprovalprovalthrlysleuvalcysaspglyaspthrtyrlys
151015
cysthralalysleuasppheglyaspglyargtrpvalalaglntrp
202530
aspthrasnvalphehislys
35
<210>3
<211>39
<212>prt
<213>大球盖菇
<220>
<221>misc_feature
<222>(4)..(4)
<223>x表示pro/gly。
<220>
<221>misc_feature
<222>(7)..(7)
<223>x表示glu/lys。
<220>
<221>misc_feature
<222>(9)..(9)
<223>x表示val/asp。
<220>
<221>misc_feature
<222>(10)..(10)
<223>x表示任意的氨基酸,优选cys。
<220>
<221>misc_feature
<222>(13)..(13)
<223>x表示asn/asp/glu。
<220>
<221>misc_feature
<222>(17)..(17)
<223>x表示任意的氨基酸,优选cys。
<220>
<221>misc_feature
<222>(20)..(20)
<223>x表示his/ser。
<220>
<221>misc_feature
<222>(27)..(27)
<223>x表示lys/his。
<220>
<221>misc_feature
<222>(29)..(29)
<223>x表示val/ile。
<220>
<221>misc_feature
<222>(33)..(33)
<223>x表示gly/asn/ser。
<220>
<221>misc_feature
<222>(34)..(34)
<223>x表示ala/thr。
<220>
<221>misc_feature
<222>(39)..(39)
<223>x表示arg/thr。
<400>3
alaprovalxaavaltyrxaaleuxaaxaaaspglyxaaserthrlys
151015
xaathralaxaaleuasptyrglyaspglyxaatrpxaaalaglntrp
202530
xaaxaaasnvalphehisxaa
35
<210>4
<211>252
<212>dna
<213>人工序列
<220>
<223>重组phosl
<400>4
atggccccggtcccggttaccaagctcgtctgcgacggtgacacctacaagtgcaccgcc60
tacttggactacggcgatggaaagtgggtcgctcagtgggacactgccgtcttccacacc120
accgattataaagatcatgatggtgattataaagatcatgatattgattataaagatgat180
gatgataaaggagctccgggcttctcctcaatttccgctcatcaccaccatcatcaccat240
caccaccactaa252
5
- 还没有人留言评论。精彩留言会获得点赞!