十面体纳米银探针在利用表面等离子共振成像技术筛选核酸适配体中的应用的制作方法
本发明属于生物监测技术领域,具体涉及一种适配体修饰的纳米银对spri信号放大技术及其在乳铁蛋白实时筛选中的应用。
背景技术:
相比纳米金,纳米银具有优良的光化学性质,它能够产生更强和更窄的等离子共振峰。因此,纳米银表面的局域等离子体能够更好的与表面等离子共振(spr)芯片表面的等离子波进行耦合,产生更强的信号输出。
表面等离子共振成像(surfaceplasmonresnonace-imaging)是一种具有对样品无需标记、实时、高通量的光学检测仪器。能够对芯片表面多个靶标样品进行实时定量测定。因此可以通过将筛选靶标负载到芯片表面,通入核酸文库,能够对正筛/负筛靶标进行实时采集,观察适配体筛选过程中正筛/负筛通道文库的结合情况,从而筛选出高亲和、高特异性的核酸适配体。
技术实现要素:
本发明要解决的技术问题是提供一种十面体纳米银探针用于对spri进行信号放大,有利于观察适配体筛选过程中正筛/负筛通道文库的结合情况,从而筛选出高亲和、高特异性的核酸适配体。
本发明还要解决的技术问题是,提供上述十面体纳米银探针的制备方法。
本发明还要解决的技术问题是,提供一种用于筛选乳铁蛋白核酸适配体的十面体纳米银探针。
本发明还要解决的技术问题是,提供上述用于筛选乳铁蛋白核酸适配体的十面体纳米银探针的制备方法。
本发明最后要解决的技术问题是,提供上述十面体纳米银探针在筛选乳铁蛋白核酸适配体中的应用。
为解决上述技术问题,本发明采用的技术方案如下:
十面体纳米银探针在利用表面等离子共振成像技术筛选核酸适配体中的应用。
十面体纳米银表面的局域等离子体能够与传感芯片表面的等离子激元进行电磁耦合,能够加强spri光源与表面等离子体的耦合作用;因此产生更强的反射光前后的差异性,进而能提升传感的灵敏度。
当核酸适配体筛选过程中,在核酸文库上修饰十面体纳米银颗粒,能够增加检测目标的分子量,以及对十面体纳米银颗粒与表面的电磁耦合加强,增加核酸文库的检测灵敏度,进而缩短适配体筛选轮数。
其中,所述的十面体纳米银探针为:以50~60nm的十面体纳米银为内核,纳米银的外表面有两条核苷酸链;
a链为文库反向引物互补链,所述文库反向引物互补链键合在纳米银的外表面;
b链为核酸文库序列,所述核酸文库序列与文库反向引物互补链互补配对结合;
其中,所述文库反向引物互补链为的结构如下:3’端为文库反向引物互补序列,中间为10~18个a碱基作为间隔臂,5’端为巯基修饰。3’端为文库反向引物互补序列用于与核酸文库序列互补结合,由于互补链与文库杂交发生于十面体纳米银表面,因此会存在一定的空间位阻作用,将杂交链段与十面体纳米银之间增加10个a碱基,能够降低空间位阻作用,提高杂交效率,5’端为巯基用于与纳米银的外表面键合,互补序列的长度优选10个a碱基。
其中,所述的十面体纳米银探针的制备方法如下:
(1)十面体纳米银的合成:将柠檬酸钠、聚乙烯吡咯烷酮、l-精氨酸、硝酸银按照摩尔比为(0.1~70):(0.1~10):(0.2~30):(0.2~30)加入到100~300ml去离子水中,然后加入0.1~1m的硼氢化钠水溶液,使硼氢化钠与硝酸银的摩尔比为(1~100):1,在蓝光灯照射下反应16~72h,得到十面体纳米银溶液;
(2)十面体纳米银的修饰:取步骤(1)得到的十面体纳米银溶液,加入文库反向引物互补链、氯化钠,
其中,纳米银、文库反向引物互补链、氯化钠的摩尔比为(0.1~10pmol):(0.1~10nmol):(10~200μmol),滴加吐温-20,吐温-20与纳米银溶液的体积比为(0.001~0.01):1,混匀,37℃震荡1~5h;
(3)将步骤(2)得到的混合体系静置10~24小时,优选24h;
(4)离心步骤(3)得到的溶液,取沉淀加入1×pbs缓冲液重悬,重复离心与重悬的步骤2~4次,1×pbs缓冲溶液每次加入体积为沉淀体积0.1~5倍;最后离心得到的沉淀使用1×pbsm缓冲溶液重悬;
所述的离心条件为10000~20000rpm条件下离心10~30分钟,优选15000rpm条件下离心15分钟;
(5)向步骤(4)得到的混合体系中加入核酸文库溶液,使核酸文库与修饰有反向引物互补链的十面体纳米银的摩尔比为(100~2000):1,震荡反应10~60min,得到十面体纳米银探针。
步骤(1)中,优选将15ml、50mm柠檬酸钠,15ml(6%)聚乙烯吡咯烷酮(pvp),2.5ml,10mml-精氨酸,10ml,10mm硝酸银加入到175ml去离子水中,然后再加入0.8ml,0.5m的硼氢化钠水溶液。
步骤(2)中,优选取1ml合成十面体纳米银(ag10)溶液,往里加入70μl浓度10μm文库反向引物杂交链和寡核苷酸链,再加入64μl浓度2m氯化钠水溶液,再加入1滴吐温-20。
用于筛选乳铁蛋白核酸适配体的十面体纳米银探针,它是以50~60nm的十面体纳米银为内核,纳米银的外表面键合有文库反向引物互补链,所述的文库反向引物互补链与核酸文库序列互补配对,
其中,所述文库反向引物互补链为:
5’-sh-(ch2)6-aaaaaaaaaagaagaggagggaggt-3’
所述核酸文库序列为:
5’-gacaggcaggacaccgtaac-n40-ctgctacctccctcctcttc-3’,其中n40表示40个随机碱基。
用于筛选乳铁蛋白核酸适配体的十面体纳米银探针的制备方法,包括如下步骤:
(1a)十面体纳米银的合成:将柠檬酸钠、聚乙烯吡咯烷酮、l-精氨酸、硝酸银按照摩尔比为(0.1~70):(0.1~10):(0.2~30):(0.2~30)加入到100~300ml去离子水中,然后加入0.1~1m的硼氢化钠水溶液,使硼氢化钠与硝酸银的摩尔比为(1~100):1,在蓝光灯照射下反应16~72h,得到十面体纳米银溶液;
(2a)十面体纳米银的修饰:取步骤(1)得到的十面体纳米银溶液,加入文库反向引物互补链、氯化钠,
其中,纳米银、文库反向引物互补链、氯化钠的摩尔比为(0.1~10pmol):(0.1~10nmol):(10~200μmol),滴加吐温-20,吐温-20与纳米银溶液的体积比为(0.001~0.01):1,混匀,37℃震荡1~5h;
所述文库反向引物互补链为:
5’-sh-(ch2)6-aaaaaaaaaagaagaggagggaggt-3’
(3a)将步骤(2a)得到的混合体系静置10~24小时;
(4a)离心步骤(3a)得到的溶液,取沉淀加入1×pbs缓冲液重悬,重复离心与重悬的步骤2~4次,1×pbs缓冲溶液每次加入体积为沉淀体积0.1~5倍;最后离心得到的沉淀使用1×pbsm缓冲溶液重悬;
(5a)向步骤(4a)得到的混合体系中加入核酸文库序列溶液,使核酸文库序列与修饰有反向引物互补链的十面体纳米银的摩尔比为100~2000:1,震荡反应10~60min,得到十面体纳米银探针;
所述核酸文库序列为:
5’-gacaggcaggacaccgtaac-n40-ctgctacctccctcctcttc-3’,其中n40表示40个随机碱基。
步骤(1a)中,柠檬酸钠、聚乙烯吡咯烷酮、l-精氨酸、硝酸银的摩尔比优选为(0.1~70):(0.1~10):(0.2~30):(0.2~30)。
步骤(2a)中,纳米银、文库反向引物互补链、氯化钠的摩尔比优选为(0.1~10pmol):(0.1~10nmol):(10~200μmol)。
用于筛选乳铁蛋白核酸适配体的十面体纳米银探针在筛选乳铁蛋白核酸适配体中的应用。
其中,利用十面体纳米银探针筛选核酸适配体的步骤如下:
(1b)spri传感芯片表面巯基烷基酸自主装:
将金膜厚度为45~52nm的金片浸泡在浓度为0.5~10mm的11-巯基烷基酸的乙醇溶液中反应12~36h;使用大量的乙醇和超纯水冲洗芯片表面,最后n2吹干备用;
(2b)配制溶液:
正筛蛋白溶液:乳铁蛋白溶于1×pbsm缓冲溶液中,其中乳铁蛋白的浓度为250μg/ml;
负筛蛋白溶液:bsa、α-乳白蛋白、β-乳球蛋白、酪蛋白溶于10mm醋酸钠溶液中,ph4.5,其中bsa、α-乳白蛋白、β-乳球蛋白、酪蛋白的浓度为160μg/ml;
筛选缓冲液:1×pbs中加入mgcl2·6h2o固体,形成1×pbsm作为筛选缓冲液;
芯片活化试剂:0.8medc水溶液、0.2mnhs水溶液;
封闭试剂:1m乙醇胺溶液;
(3b)移取200μl,0.8medc与200μl,0.2mnhs混合,形成400μl浓度为0.4medc、0.1mnhs混合溶液,使用10μl/min流速在芯片表面进行活化反应40min;然后分别在两个通道内以10μl/min流速分别反应正筛蛋白与负筛蛋白40min;最后将200μl,1m乙醇胺以20μl/min的流速封闭10min;再使用1×pbs缓冲液平衡芯片30min;
(4b)待基线平稳后,将正筛通道与负筛通道进行串联,六通阀接入至负筛通道入口,使用恒流注射泵以20μl/min的流速对筛选缓冲液进行传输,使用六通阀对200μl十面体纳米银负载文库进样,同时对正筛通道与负筛通道进行信号采集并存储,反应时间为40min;
(5b)将正筛通道与负筛通道分离,使用筛选缓冲液清洗正筛通道15min,然后使用90μl、50mmnaoh溶液以流速10~50μl/min冲洗正筛通道,并对洗脱样品进行收集,再加入37.5μl浓度为120mm盐酸溶液进行中和;
(6b)pcr扩增与ssdna提纯:
pcr扩增:将收集并中和后的产物进行7~9轮预扩增,再将溶液分为40份进行扩增9轮,得到产物后,将40份溶液进行合并;
磁珠清洗:使用0.1mg/ml的bsa溶液对粒径为3μm的链霉亲和素标记的磁珠(sa-mb)清洗两次,再除去上层清液;
ssdna提纯并测序,即得到乳铁蛋白核酸适配体。
步骤(1b)中,金膜的最佳厚度选为48nm,11-巯基烷基酸的浓度选为1mm,金片的
反应时间选为24h。
有益效果:本发明的十面体纳米银对核酸文库进行负载,能够大大的增加spri的传感信号,并结合高通量实时成像适配体筛选技术对乳铁蛋白进行核酸适配体筛选,能够对核酸文库与靶标之间的亲和力状态进行实时监控,为适配体筛选技术提供了一种全新的高效筛选平台。
本发明利用十面体纳米银对spri信号进行放大增强技术,能对spri信号增强约128倍,是一种简单快速的放大技术。
附图说明
图1十面体纳米银的透射电子显微镜形貌图。
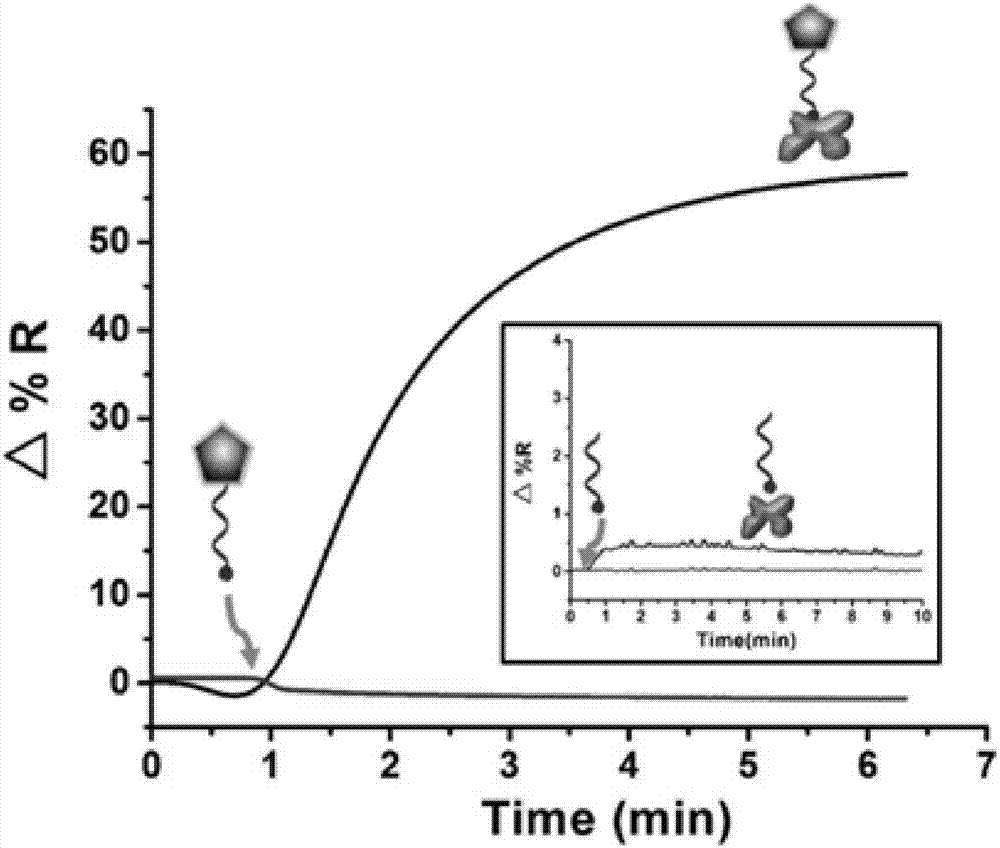
图2使用十面体纳米银对spri信号放大的效果图。大图展示为将含有有生物素的核酸链修饰到十面体纳米银表面与spri芯片表面固定的链霉亲和素(streptavidin)反应的spr传感图,插图为未修饰十面体纳米银的生物素核酸链与spri芯片表面固定的链霉亲和素反应的spr传感图。通过响应值对比,修饰了十面体纳米银的信号为未修饰信号的128倍。
图3使用spri筛选曲线以及成像图。图3中r1~r5代表1~5轮;图3a为1~5轮的正筛曲线,图b为1~5轮的负筛曲线。成像图代表的为1~5轮筛选过程的spri成像图,图的左侧通道代表负筛通道,右侧代表正筛通道。
具体实施方式
根据下述实施例,可以更好地理解本发明。然而,本领域的技术人员容易理解,实施例所描述的内容仅用于说明本发明,而不应当也不会限制权利要求书中所详细描述的本发明。
实施例1:十面体纳米银探针的制备。
(1)十面体纳米银的合成:将15ml,50mm柠檬酸钠,15ml(6%)聚乙烯吡咯烷酮(pvp),2.5ml,10mml-精氨酸,10ml,10mm硝酸银加入到175ml去离子水中,然后再加入0.8ml,0.5m的硼氢化钠水溶液,溶液颜色会立即成为暗黄色,使用4盏24w的蓝光灯从4个面照射反应瓶48小时;
(2)将寡核苷酸链或乳铁蛋白筛选的文库反向引物杂交链加入到步骤(1)得到的十面体纳米银溶液中,静置18小时。寡核苷酸链或乳铁蛋白筛选文库反向引物杂交链的总摩尔量与十面体纳米银摩尔量之比为288:1;
所述的寡核苷酸链为:
5’-sh-(ch2)6-tttgggtttgggtttgggttt-biotin,其5’端由巯基修饰,其3’端由生物素修饰;
所述的反向引物杂交链为:
5’-sh-(ch2)6-aaaaaaaaaagaagaggagggaggt-3’,其5’端由巯基修饰,且末端有10个a碱基作为间隔臂。
(3)向步骤(2)得到的混合体系中加入1×pbs(137mmnacl,2.7mmkcl,10mm,na2hpo4·12h2o,2mmkh2po4)溶液,静置6小时。
(4)向步骤(3)得到的混合体系中加入2mol/l氯化钠溶液,使得氯化钠的最终浓度为0.2mol/l,再加入5μl吐温-20。
(5)将步骤(4)得到的混合体系静置48小时。
(6)将步骤(5)得到的溶液经离心去除上清,沉淀加入1×pbs溶液重悬,重复离心与重悬的步骤3次,pbs缓冲液每次的加入体积为待加入的混合体系体积的1倍;最后离心得到沉淀经1×pbsm重悬即得适配体修饰的十面体纳米银探针。
对十面体纳米银的修饰:取1ml步骤(1)合成十面体纳米银(ag10)溶液,往里加入70μl浓度10μm乳铁蛋白筛选文库反向引物杂交链或寡核苷酸链,再加入64μl浓度2m氯化钠水溶液,再加入1滴吐温-20,混匀后在37℃恒温震荡仪中震荡2h,静置18小时。
实施例2:负载乳铁蛋白核酸文库十面体纳米银探针的制备。
(1)十面体纳米银的合成:将15ml,50mm柠檬酸钠,15ml(6%)聚乙烯吡咯烷酮(pvp),2.5ml,10mml-精氨酸,10ml,10mm硝酸银加入到175ml去离子水中,然后再加入0.8ml浓度为0.5m的硼氢化钠水溶液,溶液颜色会立即成为暗黄色,使用4盏24w的蓝光灯从4个面照射反应瓶48小时。
(2)反向引物互补链加入到步骤(1)制备的十面体纳米银溶液中,静置18小时,反向引物互补链的总摩尔量与十面体纳米银摩尔量之比为288:1。
所述的反向引物互补链为:
5’-sh-(ch2)6-aaaaaaaaaagaagaggagggaggt-3’其5’端由巯基修饰,且末端有10个a碱基作为间隔臂;
(3)向步骤(2)得到的混合体系中加入1×pbs(137mmnacl,2.7mmkcl,10mm,na2hpo4·12h2o,2mmkh2po4)缓冲液,静置6小时。
(4)向步骤(3)得到的混合体系中加入2mol/l氯化钠溶液,使得氯化钠的终浓度为0.2mol/l,再加入5μl吐温-20。
(5)将步骤(4)得到的混合体系静置48小时。
(6)将步骤(5)得到的溶液经离心去除上清,取沉淀加入1×pbsm缓冲溶液重悬,重复离心与重悬的步骤3次,1×pbsm缓冲溶液每次的加入体积为待加入的混合体系体积的1倍;最后离心得到的沉淀用1×pbsm缓冲溶液重悬。
(7)将溶于1×pbsm缓冲溶液的乳铁蛋白核酸文库加入步骤(6)的溶液中,在37℃恒温震荡摇床内震荡反应0.5h即得备用文库负载探针;
所述乳铁蛋白核酸文库为:
5’-gacaggcaggacaccgtaac-n40-ctgctacctccctcctcttc-3’,其中n40为40个随机碱基。
实施例3:使用十面体纳米银对spri信号放大
(1)spri传感芯片表面巯基烷基酸自主装:
将金膜厚度为48nm的金片浸泡在浓度为1mm的11-巯基烷基酸的乙醇溶液中反应24h;使用大量的乙醇和超纯水冲洗芯片表面,最后n2吹干备用;
(2)配制溶液:
链霉亲和素蛋白溶液:移取2.5μl浓度为10mg/ml的sa溶液,加入247.5μl,10mm醋酸钠缓冲溶液(ph4.5),形成250μl浓度为100μg/mlsa蛋白溶液;
牛血清白蛋白溶液:移取10μl浓度为10mg/ml的bsa,加入240μl,10mm醋酸钠溶液(ph4.5),最后形成400μlbsa蛋白溶液;
运行缓冲液:将20×pbs用二次水稀释20倍至1×pbs,往1×pbs中加入mgcl2·6h2o固体,形成1×pbsm作为筛选缓冲液
芯片活化试剂:称量1.52g1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(edc),溶于10ml超纯水中,形成10ml,0.8medc水溶液;称量0.23gn-羟基丁二酰亚胺,溶于10ml超纯水中,形成10ml浓度为0.2mnhs水溶液;
封闭试剂:称量0.98g乙醇胺盐酸盐粉末,溶于10ml超纯水中,形成10ml浓度为1m乙醇胺溶液。
(3)蛋白的固定:
移取200μl,0.8medc与200μl,0.2mnhs混合,形成400μl浓度为0.4medc/0.1mnhs混合溶液,使用10μl/min流速在芯片表面进行活化反应40min;然后分别在两个通道内以10μl/min流速分别反应sa蛋白与bsa蛋白25min;最后将200μl,1m乙醇胺以20μl/min的流速对芯片表面进行封闭10min;接着使用1×pbsm缓冲液进行芯片平衡30min;
(4)使用自己开发的labview和livegraph软件对芯片基线进行监测,待基线平稳后,将正筛通道与负筛通道进行串联;
(5)六通阀接入至负筛通道入口,使用恒流注射泵以50μl/min的流速对运行缓冲液进行传输,使用六通阀对200μl上述寡核苷酸链修饰的十面体纳米银进样,同时对阳性通道与阴性通道进行信号采集并存储,反应时间为4min。
最后对得到的数据进行处理,得到了寡核苷酸与修饰在十面体纳米银表面与sa蛋白的结合曲线,结果见图2。
实施例4:使用负筛乳铁蛋白筛选文库的十面体纳米银探针运用于spri实时适配体筛选技术
试验方法:
(1)spri传感芯片表面巯基烷基酸自主装:
将金膜厚度为48nm的金片浸泡在浓度为1mm的11-巯基烷基酸的乙醇溶液中过夜反应;使用大量的乙醇和超纯水冲洗芯片表面,最后n2吹干备用;
(2)配制溶液:
正筛蛋白溶液:往瓶装规格为1mg的乳铁蛋白粉末中加入200μl超纯水,形成200μl浓度为5mg/ml的乳铁蛋白水溶液;移取12.5μl该溶液,加入237.5μl1×pbsm缓冲溶液,形成250μl浓度为250μg/ml乳铁蛋白溶液;
负筛蛋白溶液:移取2μl浓度为20mg/ml的bsa和α-乳白蛋白,以及移取8μl浓度为5mg/ml的β-乳球蛋白和酪蛋白,最后往里移取230μl10mm醋酸钠溶液(ph4.5),最后形成250μlbsa和α-乳白蛋白,5mg/ml的β-乳球蛋白和酪蛋白4种浓度均为160μg/ml的负筛蛋白溶液;
筛选缓冲液:将20×pbs用二次水稀释20倍至1×pbs,往1×pbs中加入mgcl2·6h2o固体,形成1×pbsm作为筛选缓冲液;
芯片活化试剂:称量1.52g1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(edc),溶于10ml超纯水中,形成10ml浓度为0.8medc水溶液;称量0.23gn-羟基丁二酰亚胺,溶于10ml超纯水中,形成10ml浓度为0.2mnhs水溶液;
封闭试剂:称量0.98g乙醇胺盐酸盐粉末,溶于10ml超纯水中,形成10ml浓度为1m乙醇胺溶液。
(3)蛋白的固定:
移取200μl,0.8medc与200μl,0.2mnhs混合,形成400μl浓度为0.4medc/0.1mnhs混合溶液,使用10μl/min流速在芯片表面进行活化反应40min;然后分别在两个通道内以10μl/min流速分别反应负筛蛋白与乳铁蛋白25min;最后将200μl,1m乙醇胺以20μl/min的流速对芯片表面进行封闭10min;接着使用1×pbsm缓冲液进行芯片平衡30min;
(4)使用自己开发的labview和livegraph软件对芯片基线进行监测,待基线平稳后,将正筛通道与负筛通道进行串联;
(5)六通阀接入至负筛通道入口,使用恒流注射泵以20μl/min的流速对筛选缓冲液进行传输,使用六通阀对200μl十面体纳米银负载文库进样,同时对正筛通道与负筛通道进行信号采集并存储,反应时间为40min。
(6)将正筛通道与负筛通道分离,使用筛选缓冲液清洗正筛通道15min,然后使用90μl,50mmnaoh溶液以流速10~50μl/min冲洗正筛通道,并对洗脱样品进行收集,再加入37.5μl浓度为120mm盐酸溶液进行中和;
(7)pcr扩增与ssdna提纯:
pcr扩增:先将收集并中和后的产物进行7~9轮预扩增,pcr扩增条件为(95℃,5min;60℃,30s;72℃,30s;4℃,10min)。再将溶液分为40份进行扩增9轮,得到产物后,将40份溶液进行合并;
磁珠清洗:使用0.1mg/ml的bsa溶液对粒径为3μm的链霉亲和素标记的磁珠(sa-mb)清洗两次,再除去上层清液;
ssdna提纯:将上述40份合并后的产物加入到上述已清洗好的磁珠内,在37℃的恒温震荡摇床内震荡反应30min,然后使用磁分离除去上层清液,并使用1×pbs对磁珠清洗2~3次,再除去上层清液。再往里加入5ul浓度为50mm的naoh溶液,分离上清后,加入50μl浓度为50mm盐酸溶液进行中和。
然后重复步骤(1)~(7),来进行接下来的几轮筛选,再将第3,4,5轮样品送样进行克隆测序,得到了数条高重复性的核酸序列。并使用表面等离子体共振仪(spr)对其与乳铁蛋白的亲和力常数(kd)进行了表征。最终,得到了5条高亲和力的乳铁蛋白适配体链。spri筛选曲线与成像图见图3。
本发明将十面体纳米银应用于spri对传感信号放大,能够对spri信号增强128倍,具有良好的信号增强功能。在同等的条件下,我们将该十面体纳米银负载乳铁蛋白筛选文库使用一种实时无标记进行对乳铁蛋白的筛选,在5轮筛选轮数下,获得了6条具有高亲和力的核酸适配体链。
sequencelisting
<110>南京大学
<120>十面体纳米银探针在利用表面等离子共振成像技术筛选核酸适配体中的应用
<130>sg20170112001
<160>4
<170>patentinversion3.5
<210>1
<211>25
<212>dna
<213>artificialsequence
<220>
<223>文库反向引物互补链
<400>1
aaaaaaaaaagaagaggagggaggt25
<210>2
<211>20
<212>dna
<213>artificialsequence
<220>
<223>核酸文库序列5'端序列
<400>2
gacaggcaggacaccgtaac20
<210>3
<211>20
<212>dna
<213>artificialsequence
<220>
<223>核酸文库序列的3'端序列
<400>3
ctgctacctccctcctcttc20
<210>4
<211>21
<212>dna
<213>artificialsequence
<220>
<223>寡核苷酸链
<400>4
tttgggtttgggtttgggttt21
- 还没有人留言评论。精彩留言会获得点赞!