凝血酶原时间的测定方法、测定用试剂及其制造方法与流程
【
技术领域:
】本发明涉及凝血酶原时间测定用试剂及其制造方法。
背景技术:
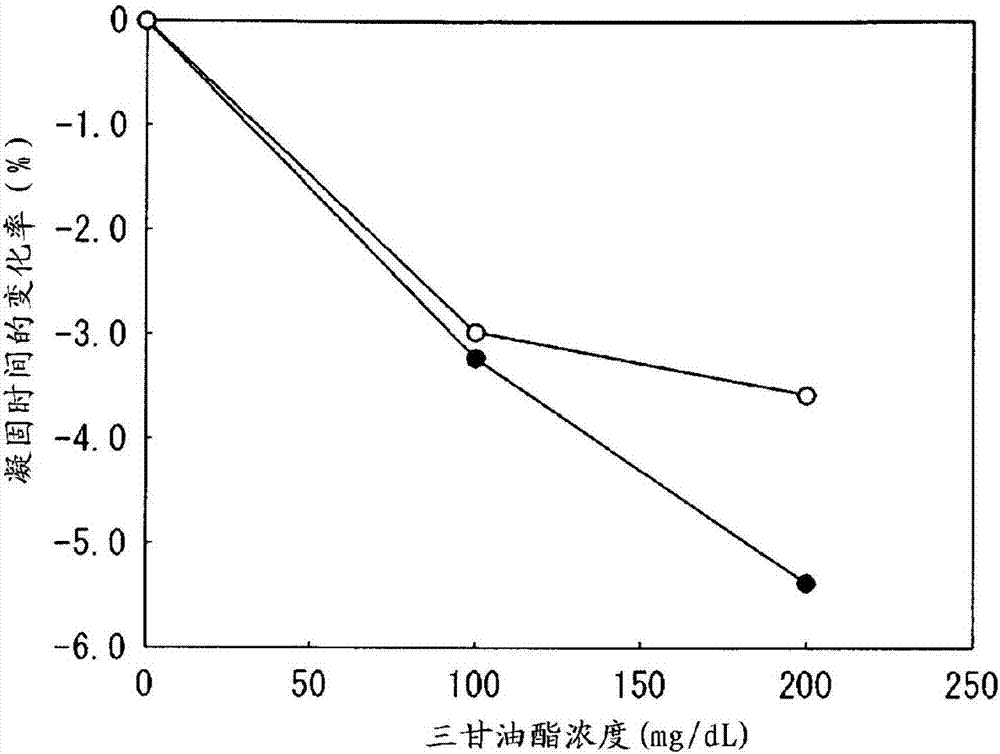
:在凝血酶原时间的测定中,例如,使用含使重组组织因子缔合于由磷脂酰胆碱和磷脂酰丝氨酸构成的脂质体的含有组织因子的脂质体的凝血酶原时间测定用试剂等(参照例如,国际公开第98/48283号)。一方面,近年,从凝固检查的标准化的观点来看,提倡对于在凝血酶原时间的评价中使用的凝血酶原时间测定用试剂定适当的范围的凝固时间及适当的国际感受性指标。技术实现要素:【发明要解决的技术课题】但是,在使用以往的凝血酶原时间测定用试剂测定正常血浆的凝固时间时,期望满足适当的范围的凝固时间及适当的国际感受性指标的双方。本发明提供在正常血浆的凝固的测定时可确保适当的范围的凝固时间和适当的国际感受性指标的新的凝血酶原时间测定用试剂及其制造方法。【解决课题的技术方案】本发明之一的侧面包括凝血酶原时间测定用试剂,其特征在于,含有含具有磷脂层的第1脂质体和有与第1脂质体不同的组成的磷脂层的第2脂质体和组织因子的脂质体组合物,组织因子与第1脂质体及第2脂质体的至少一方的磷脂层缔合,第1脂质体是含磷脂酰胆碱化合物、磷脂酰乙醇胺化合物和磷脂酰丝氨酸化合物的脂质体,第2脂质体是含选自磷脂酰胆碱化合物及磷脂酰乙醇胺化合物的至少1种磷脂的脂质体。本发明的别的侧面包括凝血酶原时间测定用试剂的制造方法,其包括(a)使用磷脂酰胆碱化合物、磷脂酰乙醇胺化合物和磷脂酰丝氨酸化合物而形成具有磷脂层的第1脂质体的工序、(b)使用选自磷脂酰胆碱化合物及磷脂酰乙醇胺化合物的至少1种磷脂而使有与第1脂质体不同的组成的磷脂层的第2脂质体形成的工序、及(c)使工序(a)中得到的第1脂质体及工序(b)中得到的第2脂质体的至少一方的磷脂层与组织因子缔合的工序。【发明效果】由本发明可提供在正常血浆的凝固的测定时可确保适当的范围的凝固时间和适当的国际感受性指标的新的凝血酶原时间测定用试剂及其制造方法。【附图说明】【图1】是说明试剂盒的构成的图。【图2】是显示使用实施例2及比较例2的凝血酶原时间测定用试剂之时的凝固时间的变化率和三甘油酯的浓度的关系的坐标图。【图3】是显示使用实施例2及比较例2的凝血酶原时间测定用试剂之时的凝固时间的变化率和胆红素f的浓度的关系的坐标图。【实施方式】【1.凝血酶原时间测定用试剂】本实施方式涉及的凝血酶原时间测定用试剂(以下,被称为“试剂”)含有含具有磷脂层的第1脂质体和有与第1脂质体不同的组成的磷脂层的第2脂质体和组织因子的脂质体组合物。组织因子与第1脂质体及第2脂质体的至少一方的磷脂层缔合。第1脂质体是含磷脂酰胆碱化合物、磷脂酰乙醇胺化合物和磷脂酰丝氨酸化合物的脂质体。另外,第2脂质体是含选自磷脂酰胆碱化合物及磷脂酰乙醇胺化合物的至少1种磷脂的脂质体。再者,在本说明书中,磷脂酰胆碱化合物是指任选有取代基的磷脂酰胆碱。磷脂酰乙醇胺化合物是指任选有取代基的磷脂酰乙醇胺。磷脂酰丝氨酸化合物是指任选有取代基的磷脂酰丝氨酸。作为任选有取代基的磷脂酰胆碱的取代基,例如,可举出碳原子数8~20、优选为14~18的酰基等,但不特别限定。作为任选有取代基的磷脂酰乙醇胺的取代基,例如,可举出碳原子数8~20、优选为14~18的酰基等,但不特别限定。作为任选有取代基的磷脂酰丝氨酸的取代基,例如,可举出碳原子数8~20、优选为14~18的酰基等,但不特别限定。作为碳原子数8~20的酰基,例如,可举出月桂酰基、肉豆蔻酰基、棕榈酰基、硬脂酰基、油酰基等,但不特别限定。作为磷脂酰胆碱化合物,例如,可举出磷脂酰胆碱、二月桂酰磷脂酰胆碱、二肉豆蔻酰磷脂酰胆碱、二棕榈酰磷脂酰胆碱、二硬脂酰磷脂酰胆碱、二油酰磷脂酰胆碱等的酰基的碳原子数8~20、优选为14~18的二酰基磷脂酰胆碱等,但不特别限定。在这些磷脂酰胆碱化合物之中,优选酰基的碳原子数为8~20的二酰基磷脂酰胆碱,更优选二油酰磷脂酰胆碱。作为磷脂酰乙醇胺化合物,例如,可举出磷脂酰乙醇胺、二月桂酰磷脂酰乙醇胺、二肉豆蔻酰磷脂酰乙醇胺、二棕榈酰磷脂酰乙醇胺、二硬脂酰磷脂酰乙醇胺、二油酰磷脂酰乙醇胺等的酰基的碳原子数8~20、优选为14~18的二酰基磷脂酰乙醇胺等,但不特别限定。在这些磷脂酰乙醇胺化合物之中,优选酰基的碳原子数为8~20的二酰基磷脂酰乙醇胺,更优选二油酰磷脂酰乙醇胺。作为磷脂酰丝氨酸化合物,例如,可举出磷脂酰丝氨酸、二月桂酰磷脂酰丝氨酸、二肉豆蔻酰磷脂酰丝氨酸、二棕榈酰磷脂酰丝氨酸、二硬脂酰磷脂酰丝氨酸、二油酰磷脂酰丝氨酸等的酰基的碳原子数8~20、优选为14~18的二酰基磷脂酰丝氨酸等,但不特别限定。在这些磷脂酰丝氨酸化合物之中,优选酰基的碳原子数为8~20的二酰基磷脂酰丝氨酸,更优选二油酰磷脂酰丝氨酸。在第1脂质体中,作为磷脂酰胆碱化合物的质量相对于磷脂酰乙醇胺化合物的质量的比例的[磷脂酰胆碱化合物/磷脂酰乙醇胺化合物],从确保适当的凝固时间及灵敏度的观点,优选为2.0以上,从确保适当的凝固时间及灵敏度的观点来看,优选为不足3.0、更优选为2.9以下。第1脂质体的粒径,从确保适当的凝固时间及灵敏度的观点来看,通常,优选为400~600nm。再者,在本说明书中,“粒径”的值是通过以粒径测定模式使用粒径测定装置〔spectris(株)制、商品名:zetasizernanozsp〕,由动态光散射法,于25℃测定而求出的值。在本实施方式涉及的试剂中,第2脂质体有含选自磷脂酰胆碱化合物及磷脂酰乙醇胺化合物的至少1种磷脂作为磷脂的磷脂层。第2脂质体可为实质上含磷脂酰胆碱化合物单独或磷脂酰乙醇胺化合物单独作为磷脂的脂质体,也可为实质上含磷脂酰胆碱化合物和磷脂酰乙醇胺化合物作为磷脂的脂质体。在第2脂质体中使用的磷脂酰胆碱化合物及磷脂酰乙醇胺化合物与在第1脂质体中使用的磷脂酰胆碱化合物及磷脂酰乙醇胺化合物同样。当第2脂质体是实质上含磷脂酰胆碱化合物单独作为磷脂的脂质体时,第2脂质体中的磷脂酰胆碱化合物的量,从确保适当的凝固时间及灵敏度的观点来看,优选为20mg/ml以上、更优选为40mg/ml以上,从确保适当的凝固时间及灵敏度的观点来看,优选为100mg/ml以下。当第2脂质体是实质上含磷脂酰乙醇胺化合物单独作为磷脂的脂质体时,第2脂质体中的磷脂酰乙醇胺化合物的量,从确保适当的凝固时间及灵敏度的观点来看,优选为20mg/ml以上、更优选为40mg/ml以上,从确保适当的凝固时间及灵敏度的观点来看,优选为100mg/ml以下。当第2脂质体是实质上含磷脂酰胆碱化合物和磷脂酰乙醇胺化合物作为磷脂的脂质体时,第2脂质体中的磷脂的合计量,从确保适当的凝固时间及灵敏度的观点来看,优选为20mg/ml以上、更优选为40mg/ml以上,从确保适当的凝固时间及灵敏度的观点来看,优选为100mg/ml以下。在本实施方式涉及的试剂中,组织因子与第1脂质体及第2脂质体的至少一方的磷脂层缔合。第1脂质体的磷脂层及第2脂质体的磷脂层通常被认为是脂质双层。组织因子通常被认为在贯通磷脂层的状态下与磷脂层缔合。在本实施方式涉及的试剂中,包含以下的实施方式:·含组织因子缔合于第1脂质体的磷脂层,组织因子未缔合于第2脂质体的磷脂层的脂质体组合物的试剂、·含组织因子未缔合于第1脂质体的磷脂层,组织因子缔合于第2脂质体的磷脂层的脂质体组合物的试剂、·含组织因子缔合于第1脂质体的磷脂层及第2脂质体的磷脂层的双方的脂质体组合物的试剂。组织因子是促凝血酶原激酶(也被称为“凝血因子的第iii因子”)。作为组织因子,可举出天然来源的组织因子及重组组织因子。在本实施方式涉及的试剂中,优选重组组织因子。这是因为原料的筹备容易,稳定地供给及批间的性能的差小,测定结果的再现性优良。作为天然来源的组织因子,例如,可由惯用的方法,使用自各种动物种的脑、胎盘等单离的组织因子等。作为动物种,例如,可举出人、兔、牛、猴等,但不特别限定,在这些动物种之中,从更确切地测定人的血液凝固时间的观点来看,优选人。重组组织因子,例如,可通过在保持编码期望的动物种的组织因子的cdna的基因重组生物内表达等得到。另外,重组组织因子也可为市售的重组组织因子。在重组组织因子之中,从更确切地测定人的血液凝固时间的观点来看,优选重组人组织因子。作为编码组织因子的cdna,可举出编码人组织因子的cdna(genbank登录编号:nm_001993)、编码牛组织因子的cdna(genbank登录编号:nm_173878)等,但不特别限定。基因重组生物,例如,通过向宿主导入保持编码组织因子的cdna的载体等得到。作为载体,例如,可举出杆状病毒载体abv及bevs等,但不特别限定。载体可根据宿主适宜选择。作为宿主,例如,蚕虫体;例如,可举出sf9、sf21等的昆虫细胞等,但不特别限定。向宿主导入载体可由对应于载体的种类的方法进行。当载体是病毒载体时,向宿主导入病毒载体可通过向宿主感染从病毒载体得到的重组病毒来进行。表达的重组组织因子,例如,可通过进行以下的操作等从基因重组生物取得。首先,破碎基因重组生物而得到破碎液。将得到的破碎液供于离心分离而得到含重组组织因子的级分。接下来,可使得到的级分增溶而得到含重组组织因子的溶液。本实施方式涉及的试剂中所含的磷脂每1mg的组织因子的量,通常,从确保适当的凝固时间及灵敏度的观点来看,优选为1.6μg以上、更优选为5.0μg以上,从确保适当的凝固时间及灵敏度的观点来看,优选为16.7μg以下,更优选为12.0μg以下。本实施方式涉及的试剂中的钙离子的量只要是对于使第vii因子活化,使凝固反应进行适宜的量即可。本实施方式涉及的试剂中的钙离子的量,通常,从确保适当的凝固时间及灵敏度的观点来看,优选为8mm以上、更优选为15mm以上,从确保适当的凝固时间及灵敏度的观点来看,优选为45mm以下,更优选为30mm以下。本实施方式涉及的试剂从稳定保持所述试剂中所含的组织因子、钙离子的观点来看,可还含缓冲液。作为缓冲液,例如,可举出4-(2-羟基乙基)-1-哌嗪乙磺酸〔hepes〕缓冲液、tris缓冲液等,但不特别限定。缓冲液的ph只要是对于稳定保持本实施方式涉及的试剂中所含的组织因子、钙离子适宜的ph即可。缓冲液的ph,从确保适当的凝固时间的同时提高稳定性的观点来看,优选为7以上、更优选为7.5,从确保适当的凝固时间的同时提高稳定性的观点来看,优选为8.5以下。本实施方式涉及的试剂可还含助剂。作为助剂,例如,可举出防腐剂、抗氧化剂、赋形剂等,但不特别限定。作为防腐剂,例如,可举出叠氮化钠等,但不特别限定。作为抗氧化剂,例如,可举出丁基羟基苯甲醚等,但不特别限定。作为赋形剂,例如,可举出丙氨酸、蔗糖、甘露糖醇等,但不特别限定。本实施方式涉及的试剂可为冷冻干燥物,也可为冷冻干燥物溶解在溶剂中的溶液。本实施方式涉及的试剂中的、相对于总脂质体的含量的第2脂质体的含量,从确保适当的凝固时间及灵敏度的观点来看,优选为20~70质量%、更优选为30~50质量%。本实施方式涉及的试剂含第1脂质体和由第1脂质体中所含的选自磷脂酰胆碱化合物及磷脂酰乙醇胺化合物的至少1种磷脂构成的第2脂质体作为脂质体。从而,由本实施方式涉及的试剂在正常血浆的凝固的测定时可确保适当的范围的凝固时间、具体而言10.0~13.0秒钟及适当的国际感受性指标、具体而言1.0±0.2的两方。另外,本实施方式涉及的试剂有在凝固时间的测定时难以受到共存物质的影响的益处。【2.凝血酶原时间测定用试剂的制造方法】本实施方式涉及的凝血酶原时间测定用试剂的制造方法(以下也称为“试剂的制造方法”)包括凝血酶原时间测定用试剂的制造方法,其包括(a)使用磷脂酰胆碱化合物、磷脂酰乙醇胺化合物和磷脂酰丝氨酸化合物而形成具有磷脂层的第1脂质体的工序、(b)使用选自磷脂酰胆碱化合物及磷脂酰乙醇胺化合物的至少1种磷脂而使有与第1脂质体不同的组成的磷脂层的第2脂质体形成的工序、及(c)使工序(a)中得到的第1脂质体及工序(b)中得到的第2脂质体的至少一方的磷脂层与组织因子缔合的工序。在工序(a)中,使用磷脂酰胆碱化合物、磷脂酰乙醇胺化合物和磷脂酰丝氨酸化合物形成具有磷脂层的第1脂质体。在工序(a)中,首先,将磷脂酰胆碱化合物、磷脂酰乙醇胺化合物和磷脂酰丝氨酸化合物添加到氯仿中而使溶解,得到磷脂的氯仿溶液。磷脂的氯仿溶液中的[磷脂酰胆碱化合物/磷脂酰乙醇胺化合物](质量比),从确保适当的凝固时间及灵敏度的观点来看,优选为2.0以上,从确保适当的凝固时间及灵敏度的观点来看,优选为不足3.0、更优选为2.9以下。接下来,通过从得到的磷脂的氯仿溶液蒸发氯仿,使磷脂的薄膜形成。使得到的磷脂的薄膜在hepes缓冲液a〔组成:150mm氯化钠及25mmhepes(ph7.35)〕中膨润,使有磷脂双层的第1脂质体形成。氯仿的蒸发,例如,可通过使用蒸发器等进行。接下来,将含得到的第1脂质体的混合物,例如,由搅拌器等搅拌。搅拌速度,从对混合物的成分进行充分混合的观点来看,通常是400rpm以上、更优选为450rpm以上,从抑制脂质体的破碎的观点来看,优选为650rpm以下,更优选为600rpm以下。搅拌时间只要是对于达成脂质体的膨润充分的时间即可。搅拌时间通常优选为45分钟以上、更优选为60分钟以上,优选为120分钟以下,更优选为90分钟以下。其后,对于混合物照射超声波,得到分散液。由此,得到有含磷脂酰胆碱化合物、磷脂酰乙醇胺化合物和磷脂酰丝氨酸化合物的磷脂双层的第1脂质体的分散液。再者,也可根据需要,对于分散液,使用有对于得到期望的粒径的第1脂质体适宜的孔径的膜,实施挤出机处理使第1脂质体的粒径均一化。超声波的频率只要是可对于混合物的液体成分,使第1脂质体充分地分散的频率即可。超声波的频率通常是37~40khz。超声波的照射时间只要是可对于混合物的液体成分,使第1脂质体充分地分散的时间即可。超声波的照射时间通常是5~20分钟。在工序(b)中,作为磷脂,使用选自磷脂酰胆碱化合物及磷脂酰乙醇胺化合物的至少1种磷脂形成具有与上述第1脂质体不同的组成的磷脂层的第2脂质体。在工序(b)中,首先,将选自磷脂酰胆碱化合物及磷脂酰乙醇胺化合物的至少1种磷脂添加到氯仿中而使溶解,得到磷脂的氯仿溶液。工序(b)中磷脂的薄膜的形成后第2脂质体的形成的操作与工序(a)中的磷脂的薄膜的形成后第1脂质体的形成的操作同样。由此,得到有含选自磷脂酰胆碱化合物及磷脂酰乙醇胺化合物的至少1种磷脂的磷脂双层的第2脂质体的分散液。在工序(c)中,使工序(a)中得到的第1脂质体及工序(b)中得到的第2脂质体的至少一方的磷脂层与组织因子缔合。在工序(c)中,首先,将第1脂质体的分散液及/或第2脂质体的分散液与含有组织因子的溶液混合,得到脂质体和组织因子的混合液。再者,在工序(c)中,也可使组织因子溶液接触于工序(a)中得到的第1脂质体的分散液和工序(b)中得到的第2脂质体的分散液的混合物。或者,在工序(c)中,也可使组织因子溶液接触于工序(a)中得到的第1脂质体的分散液或工序(b)中得到的第2脂质体的分散液之后,使得到的产物和未使与组织因子溶液接触的脂质体的分散液接触。作为在含有组织因子的溶液中使用的溶剂,例如,可举出tris盐酸缓冲液a〔组成:150mm氯化钠、10质量%甘油及20mmtris盐酸缓冲液(ph8.0)〕等,但不特别限定。含有组织因子的溶液中的组织因子的量可根据期望的试剂的种类适宜决定。含有组织因子的溶液中的组织因子的量通常从确保适当的凝固时间及灵敏度的观点来看,优选为0.1μg/ml以上、更优选为0.3μg/ml以上,从确保适当的凝固时间及灵敏度的观点来看,优选为1.0μg/ml以下,更优选为0.7μg/ml以下。当使组织因子与第1脂质体的磷脂层缔合时,第1脂质体的分散液每1ml的组织因子溶液的容量只要是相对于每1mg第1脂质体的组织因子的量成1.6~16.7μg的容量即可。当使组织因子与第1脂质体的磷脂层及第2脂质体的磷脂层的两方缔合时,第1脂质体的分散液每1ml的组织因子溶液的容量只要是相对于每1mg第1脂质体的组织因子的量成1.6~16.7μg的容量即可。其后,在工序(c)中,将脂质体和组织因子的混合液,例如,由搅拌器等,搅拌。由此,得到组织因子与第1脂质体的磷脂层及第2脂质体的磷脂层的至少一方缔合的脂质体组合物。搅拌速度,从确保适当的凝固时间及灵敏度的观点来看,优选为850rpm以上、更优选为900rpm以上,从确保适当的凝固时间及灵敏度的观点来看,优选为1050rpm以下,更优选为1000rpm以下。搅拌时间只要是脂质体和组织因子充分地缔合的时间即可。搅拌时间通常优选为100小时以上、更优选为140小时以上,优选为300小时以下,更优选为200小时以下。在工序(c)中得到的脂质体组合物中,进一步添加钙溶液,搅拌得到的混合物。由此,得到前述的凝血酶原时间测定用试剂。另外,在工序(c)中得到的脂质体组合物中,也可根据需要,还添加稳定化剂等。得到的凝血酶原时间测定用试剂可适宜冷冻干燥。作为钙溶液,例如,可举出氯化钙水溶液等,但不特别限定。钙溶液中的钙离子的浓度从确保适当的凝固时间及灵敏度的观点来看,通常优选为37.5mm以上、更优选为50mm以上,从确保适当的凝固时间及灵敏度的观点来看,优选为75mm以下,更优选为62.5mm以下。相对于脂质体组合物的钙溶液的添加量只要是试剂中的钙离子的量成优选8mm以上、更优选15mm以上,成优选45mm以下,更优选30mm以下的量即可。在本实施方式涉及的试剂中,从稳定保持所述试剂中所含的组织因子、钙离子的观点来看,可还混合缓冲液。【3.试剂盒】前述的试剂可作为封入容器中的试剂盒提供。本实施方式涉及的试剂盒的一例示于图1。图1所示的试剂盒10含放入试剂21的容器22、附带文书31和箱41。试剂21含第1脂质体101和第2脂质体102。在第1脂质体101的磷脂层200中,在组织因子210贯通的状态下缔合。在本实施方式中,第1脂质体101的磷脂层200由二油酰磷脂酰乙醇胺201、二油酰磷脂酰胆碱202和二油酰磷脂酰丝氨酸203构成。在本实施方式中,第2脂质体102由二油酰磷脂酰胆碱202构成的磷脂层构成。再者,在图1所示的实施方式中,也可为在第2脂质体102的磷脂层中组织因子210不缔合,但组织因子210在第2脂质体102的磷脂层结合。在试剂盒10中,例如,也可含稀释用的水系溶剂、对照血浆等。水系溶剂可从在血液凝固能的临床检查中通常使用的水系溶剂适宜选择。作为水系溶剂,例如,可举出水、生理盐水等,但不特别限定。作为对照血浆,例如,可举出正常血浆等,但不特别限定。附带文书31含使用试剂盒10进行凝血酶原时间的测定的操作顺序等的记载。箱41收容放入试剂21的容器22和附带文书31。【实施例】在下文中,“脂质体a”表示前述的第1脂质体。另外,“脂质体b”表示前述的第2脂质体。再者,在以下的实施例等中,各略语的含意如下所述。<略语>dope:二油酰磷脂酰乙醇胺dopc:二油酰磷脂酰胆碱dops:二油酰磷脂酰丝氨酸pe:磷脂酰乙醇胺化合物pc:磷脂酰胆碱化合物ps:磷脂酰丝氨酸化合物hepes:4-(2-羟基乙基)-1-哌嗪乙磺酸〔4-(2-hydroxyethyl)-1-piperazineethanesulfonicacid〕isi:国际感受性指标(internationalsensitivityindex)【实施例1及比较例1】(1)脂质体a1的调制将25mg/ml磷脂-氯仿溶液a〔dope510mg、dopc1020mg及含有dops510mg的〕添加到茄型瓶中。接下来,一边使放入磷脂-氯仿溶液a的茄型瓶在旋转蒸发器中旋转,一边使氯仿蒸发。由此,在茄型瓶的内壁面形成磷脂的薄膜。使用hepes缓冲液a〔组成:150mm氯化钠及25mmhepes(ph7.35)〕850ml使磷脂的薄膜膨润,得到含脂质体的混合物。接下来,使用搅拌器将混合物以500rpm搅拌60分钟。其后,使用水浴型超声波装置〔锐利(株)制、商品名:ut-306h〕,对于混合物照射15分钟37khz的超声波而得到含有脂质体a1的液。得到的脂质体a1中的dope、dopc及dops各自的浓度是0.6mg/ml(dope浓度)、1.2mg/ml(dopc浓度)及0.6mg/ml(dops浓度)。(2)脂质体b1的调制除了代替使用dope510mg、dopc1020mg、dops510mg而使用dopc1280mg及使用hepes缓冲液a800ml使磷脂的薄膜膨润之外,进行与(1)同样的操作,得到含有脂质体b的液。脂质体b中的dopc浓度是1.6mg/ml。(3)凝血酶原时间测定用试剂的调制将(1)的含有脂质体a1的液775ml、(2)的含有脂质体b1的液775ml、50μg/ml组织因子溶液310ml和hepes缓冲液b〔组成:22mm氯化钙、1mm氯化镁、1质量%蔗糖、0.1质量%叠氮化钠及25mmhepes(ph7.5)〕1240ml混合。通过一边将得到的混合物于37℃加温,一边以950rpm搅拌8天,使脂质体和组织因子再构成,得到脂质体组合物。将得到的脂质体组合物3l和hepes缓冲液c〔组成:0.75mm丙氨酸、0.075mm蔗糖、2.5mm氯化镁、60mm氯化钙及25mmhepes(ph7.5)〕12l混合。向瓶分注各2ml得到的混合物。使瓶中的混合物冷冻干燥,得到实施例1的凝血酶原时间测定用试剂。实施例1的试剂中的、相对于总脂质体的含量的脂质体b1的含量是40质量%。另外,将(1)的含有脂质体a1的液775ml、hepes缓冲液a775ml、50μg/ml组织因子溶液310ml和hepes缓冲液b1240ml混合。通过一边将得到的混合物于37℃加温,一边以950rpm搅拌8天,使脂质体和组织因子再构成,得到脂质体组合物。将得到的脂质体组合物3l和hepes缓冲液c12l混合。向瓶分注各2ml得到的混合物。使瓶中的混合物冷冻干燥,得到比较例1的凝血酶原时间测定用试剂。(4)凝固时间的测定及isi的算出将(3)的凝血酶原时间测定用试剂的3批各自再溶解于纯化水4ml,得到试剂溶液。在凝固测定装置〔sysmex(株)制、商品名:cs-2000i〕内,将待测样品50μl于37℃温育1~2分钟。接下来,将试剂溶液100μl添加到凝固测定装置内的待测样品中之后,对于得到的测定试样,使用凝固测定装置测定在波长660nm处的透射光量的变化。再者,作为待测样品,使用对照血浆〔precisionbiologicinc.(precisionbiologicinc.)制、商品名:cryocheckpoolednormalplasma〕及校准品〔technoclone制、商品名:akcalibrant〕。使用校准品的凝固时间的测定值,根据式(i)求出isi。式(i):isi=[使用标准试剂之时的isi]×[标绘(使用评价对象的试剂之时的校准品的凝固时间的对数)和(使用标准试剂之时的校准品的凝固时间的对数)而得到的直线的斜率]研究使用实施例1及比较例1的凝血酶原时间测定用试剂之时的凝固时间及isi的结果示于表1。【表1】凝固时间(sec)isi实施例110.71.01比较例18.41.34从表1所示的结果知,使用实施例1的凝血酶原时间测定用试剂之时的对照血浆的凝固时间是适当的凝固时间的范围(10.0~13.0)。与此相比,从表1所示的结果知,使用比较例1的凝血酶原时间测定用试剂之时的对照血浆的凝固时间是从适当的凝固时间的范围(10.0~13.0)脱离的范围的时间。实施例1的凝血酶原时间测定用试剂的脂质体a的磷脂的组成与比较例1的凝血酶原时间测定用试剂中脂质体的磷脂的组成相同。但是,在实施例1的凝血酶原时间测定用试剂中,含磷脂的组成不同的2种脂质体。与此相比,在比较例1的凝血酶原时间测定用试剂中,含1种脂质体。从而,从这些结果知,即使单独使用有与实施例1的凝血酶原时间测定用试剂的脂质体a相同的磷脂的组成的脂质体,也无法确保适当的凝固时间。另外,从表1所示的结果知,使用实施例1的凝血酶原时间测定用试剂之时的isi是适当的isi的范围(1.0±0.2)。与此相比,从表1所示的结果知,使用比较例2的凝血酶原时间测定用试剂之时的isi是1.34,从适当的isi的范围大大脱离。从而知,比较例2的凝血酶原时间测定用试剂无适宜于实用的性质。从这些结果知,实施例1的凝血酶原时间测定用试剂可确保适当的范围的凝固时间及适当的isi。【实施例2及比较例2】(1)脂质体a2的调制将含dope15mg、dopc30mg和dops15mg的磷脂-氯仿溶液a放入玻璃制容器。接下来,一边使放入磷脂-氯仿溶液a的玻璃制容器在旋转器〔asone(株)制、商品名:mixrotorvmr-5r〕中旋转,一边使氯仿蒸发。由此,在玻璃制容器的内壁面形成磷脂的薄膜。使用hepes缓冲液a25ml使磷脂的薄膜膨润,得到含脂质体a2的混合物。接下来,使用搅拌器将混合物以500rpm搅拌60分钟。其后,使用水浴型超声波装置〔锐利(株)制、商品名:ut-306h〕,对于混合物照射15分钟超声波而得到含有脂质体a2的液。得到的脂质体a2中的dope、dopc及dops各自的浓度是0.6mg/ml(dope浓度)、1.2mg/ml(dopc浓度)及0.6mg/ml(dops浓度)。(2)脂质体b2的调制除了代替使用dope15mg、dopc30mg及dops15mg而使用dopc40mg之外,进行与(1)同样的操作,得到含有脂质体b2的液。脂质体b2中的dopc浓度是1.6mg/ml。(3)凝血酶原时间测定用试剂的调制将(1)的含有脂质体a2的液20ml、(2)的含有脂质体b2的液20ml、50μg/ml组织因子溶液8ml和hepes缓冲液b32ml混合。通过一边将得到的混合物于37℃加温,一边以650rpm搅拌,使脂质体和组织因子再构成,得到脂质体组合物。得到得到的脂质体组合物。将得到的脂质体组合物80ml和hepes缓冲液c320ml混合。向瓶分注各2ml得到的混合物。使瓶中的混合物冷冻干燥,得到实施例2的凝血酶原时间测定用试剂。实施例2的试剂中的、相对于总脂质体的含量的脂质体b2的含量是40质量%。另外,将(1)的含有脂质体a2的液20ml和50μg/ml组织因子溶液8ml添加到hepes缓冲液b32ml中。通过一边将得到的混合物于37℃加温,一边以650rpm搅拌,使脂质体和组织因子再构成,得到脂质体组合物。得到得到的脂质体组合物。将得到的脂质体组合物60ml、hepes缓冲液a20ml和hepes缓冲液c320ml混合。向瓶分注各2ml得到的混合物。使瓶中的混合物冷冻干燥,得到比较例2的凝血酶原时间测定用试剂。(4)三甘油酯对凝固时间的影响除了使用实施例2的凝血酶原时间测定用试剂及比较例2的凝血酶原时间测定用试剂,使用含三甘油酯的待测样品或不含三甘油酯的待测样品之外,进行与实施例1及比较例1的(4)同样的操作,测定凝固时间。接下来,求出相对于不含三甘油酯的待测样品的凝固时间的含三甘油酯的待测样品的凝固时间的变化率。再者,含三甘油酯的待测样品如下所述调制。首先,将正常血浆〔sysmex(株)制、商品名:coagtrolix〕和含有三甘油酯的液〔日本制药(株)制、商品名:intrafat注20%〕混合至正常血浆/三甘油酯(体积比)成9.5/0.5,得到样品a。另外,将正常血浆和生理盐水混合至正常血浆/生理盐水(体积比)成9.5/0.5,得到样品b。接下来,将样品a和样品b混合至样品a/样品b(体积比)成1/9,得到三甘油酯浓度100mg/dl的待测样品。另外,将样品a和样品b混合至样品a/样品b(体积比)成1/4,得到三甘油酯浓度200mg/dl的待测样品。再者,将样品b作为不含三甘油酯的待测样品(三甘油酯浓度0mg/dl的待测样品)。研究使用实施例2及比较例2的凝血酶原时间测定用试剂之时的凝固时间的变化率和三甘油酯浓度的关系的结果示于图2。图中,白色圆点表示使用实施例2的凝血酶原时间测定用试剂之时的凝固时间的变化率和三甘油酯浓度的关系、黑色圆点表示使用比较例2的凝血酶原时间测定用试剂之时的凝固时间的变化率和三甘油酯浓度的关系。从图2所示的结果得知,使用实施例2的凝血酶原时间测定用试剂之时的凝固时间的变化率比使用比较例2的凝血酶原时间测定用试剂之时的凝固时间的变化率小。从而,从这些结果知,含脂质体a和由脂质体a中所含的pc构成的脂质体b作为脂质体的凝血酶原时间测定用试剂难以受血浆中所含的共存物质的三甘油酯的影响。(5)胆红素f浓度对凝固时间的影响除了使用实施例2的凝血酶原时间测定用试剂及比较例2的凝血酶原时间测定用试剂,使用含胆红素f的待测样品之外,进行与实施例1及比较例1的(4)同样的操作,测定凝固时间。接下来,求出相对于不含胆红素f的待测样品的凝固时间的含胆红素f的待测样品的凝固时间的变化率。再者,含胆红素f的待测样品如下所述调制。首先,将正常血浆〔sysmex(株)制、商品名:coagtrolix〕和含有胆红素f的液〔sysmex(株)制、商品名:干涉check_a_plus〕混合至正常血浆/胆红素f(体积比)成8/2,得到样品a。另外,将正常血浆和生理盐水混合至正常血浆/生理盐水(体积比)成8/2,得到样品b。接下来,将样品a和样品b混合至样品a/样品b(体积比)成表2所示的体积比,得到含胆红素f的待测样品。将样品b作为不含胆红素f的待测样品(胆红素f浓度0mg/ml的待测样品)。【表2】胆红素f浓度(mg/ml)014.829.644.459.274.0样品a/样品b(体积比)0/102/84/66/48/210/0研究使用实施例2及比较例2的凝血酶原时间测定用试剂之时的凝固时间的变化率和胆红素f浓度的关系的结果示于图3。图中,白色圆点表示使用实施例2的凝血酶原时间测定用试剂之时的凝固时间的变化率和胆红素f浓度的关系、黑色圆点表示使用比较例2的凝血酶原时间测定用试剂之时的凝固时间的变化率和胆红素f浓度的关系。从图3所示的结果得知,使用实施例2的凝血酶原时间测定用试剂之时的凝固时间的变化率比使用比较例2的凝血酶原时间测定用试剂之时的凝固时间的变化率小。从而,从这些结果知,含脂质体a和由脂质体a中所含的pc构成的脂质体b作为脂质体的凝血酶原时间测定用试剂难以受血浆中所含的共存物质的胆红素f的影响。【实施例3~7及比较例3】(1)脂质体a3及a4的调制将含dope15mg、dopc30mg和dops15mg的磷脂-氯仿溶液a放入玻璃制容器。接下来,一边使放入磷脂-氯仿溶液a的玻璃制容器在旋转器〔asone(株)制、商品名:mixrotorvmr-5r〕中旋转,一边使氯仿蒸发。由此,在玻璃制容器的内壁面形成磷脂的薄膜。使用hepes缓冲液a25ml使磷脂的薄膜膨润,得到含脂质体a3的混合物。接下来,使用搅拌器将混合物以500rpm搅拌60分钟。其后,使用水浴型超声波装置〔锐利(株)制、商品名:ut-306h〕,对于混合物照射15分钟超声波而得到含有脂质体a3的液。得到的脂质体a3中的dope、dopc及dops各自的浓度是0.6mg/ml(dope浓度)、1.2mg/ml(dopc浓度)及0.6mg/ml(dops浓度)。另外,除了代替使用dope15mg、dopc30mg及dops15mg而使用dope15mg、dopc70mg及dops15mg之外,进行与脂质体a3的调制同样的操作,得到含有脂质体a4的液。脂质体a4中的dope、dopc及dops各自的浓度是0.6mg/ml(dope浓度)、2.8mg/ml(dopc浓度)及0.6mg/ml(dops浓度)。(2)脂质体b3~b7的调制除了代替使用dope15mg、dopc30mg及dops15mg而使用dopc20mg之外,进行与(1)的脂质体a3的调制同样的操作,得到含有脂质体b3的液。脂质体b3中的dopc浓度是0.8mg/ml。除了代替使用dope15mg、dopc30mg及dops15mg而使用dopc40mg之外,进行与(1)的脂质体a3的调制同样的操作,得到含有脂质体b4的液。脂质体b4中的dopc浓度是1.6mg/ml。除了代替使用dope15mg、dopc30mg及dops15mg而使用dopc60mg之外,进行与(1)的脂质体a3的调制同样的操作,得到含有脂质体b5的液。脂质体b5中的dopc浓度是2.4mg/ml。除了代替使用dope15mg、dopc30mg及dops15mg而使用dopc80mg之外,进行与(1)的脂质体a3的调制同样的操作,得到含有脂质体b6的液。脂质体b6中的dopc浓度是3.2mg/ml。除了代替使用dope15mg、dopc30mg及dops15mg而使用dopc100mg之外,进行与(1)的脂质体a3的调制同样的操作,得到含有脂质体b7的液。脂质体b7中的dopc浓度是4.0mg/ml。(3)凝血酶原时间测定用试剂的调制将含有脂质体a1的液20ml、50μg/ml组织因子溶液8ml和hepes缓冲液b32ml混合。通过一边将得到的混合物于37℃加温,一边以650rpm搅拌,使脂质体和组织因子再构成,得到脂质体组合物。将得到的脂质体组合物60ml、含有脂质体b3的液20ml和hepes缓冲液c320ml混合。向瓶分注各2ml得到的混合物。使瓶中的混合物冷冻干燥,得到实施例3的凝血酶原时间测定用试剂。实施例3的试剂中的、相对于总脂质体的含量的脂质体b3的含量是25质量%。除了代替使用含有脂质体b3的液而使用含有脂质体b4的液(实施例4)、含有脂质体b5的液(实施例5)、含有脂质体b6的液(实施例6)或含有脂质体b7的液(实施例7)之外,进行与实施例3同样的操作,得到实施例4~7的凝血酶原时间测定用试剂。实施例4的试剂中的、相对于总脂质体的含量的脂质体b4的含量是40质量%。实施例5的试剂中的、相对于总脂质体的含量的脂质体b5的含量是50质量%。实施例6的试剂中的、相对于总脂质体的含量的脂质体b6的含量是57质量%。实施例7的试剂中的、相对于总脂质体的含量的脂质体b7的含量是63质量%。将含有脂质体a2的液20ml、50μg/ml组织因子溶液8ml、hepes缓冲液a20ml和hepes缓冲液b32ml混合。通过一边将得到的混合物于37℃加温,一边以650rpm搅拌,使脂质体和组织因子再构成,得到脂质体组合物。得到得到的脂质体组合物。将得到的脂质体组合物80ml和hepes缓冲液c320ml混合。向瓶分注各2ml得到的混合物。使瓶中的混合物冷冻干燥,得到比较例3的凝血酶原时间测定用试剂。(4)凝固时间的测定及isi的算出除了使用实施例3~7及比较例3的凝血酶原时间测定用试剂之外,进行与实施例1及比较例1的(4)同样的操作,进行凝固时间的测定及isi的算出。研究使用实施例3~7及比较例3的凝血酶原时间测定用试剂之时的凝固时间及isi的结果示于表3。【表3】凝固时间(sec)isi实施例310.71.07实施例410.71.061实施例510.71.064实施例6111.058实施例7111.072比较例315.60.904从表3所示的结果得知,使用包括含dopc作为磷脂的脂质体b的实施例3~7的凝血酶原时间测定用试剂之时的凝固时间及isi,不管脂质体b中的dopc的含量如何,均是适当的凝固时间及isi。但是得知,不包括含dopc作为磷脂的脂质体b,脂质体a中的dopc的含量多的比较例3的凝血酶原时间测定用试剂的isi从适当的isi的范围脱离。从而,从这些结果得知,如果由含脂质体a和由脂质体a中所含的pc构成的脂质体b作为脂质体的凝血酶原时间测定用试剂,可确保适当的凝固时间及isi。【实施例8~10及比较例4】(1)脂质体a5的调制将含dope15mg、dopc30mg和dops15mg的磷脂-氯仿溶液a放入玻璃制容器。接下来,一边使放入磷脂-氯仿溶液a的玻璃制容器在旋转器〔asone(株)制、商品名:mixrotorvmr-5r〕中旋转,一边使氯仿蒸发。由此,在玻璃制容器的内壁面形成磷脂的薄膜。使用hepes缓冲液a25ml使磷脂的薄膜膨润,得到含脂质体a5的混合物。接下来,使用搅拌器将混合物以500rpm搅拌60分钟。其后,使用水浴型超声波装置〔锐利(株)制、商品名:ut-306h〕,对于混合物照射15分钟超声波而得到含有脂质体a5的液。得到的脂质体a5中的dope、dopc及dops各自的浓度是0.6mg/ml(dope浓度)、1.2mg/ml(dopc浓度)及0.6mg/ml(dops浓度)。(2)脂质体b8~b11的调制除了代替使用dope15mg、dopc30mg及dops15mg而使用dope40mg之外,进行与(1)的脂质体a5的调制同样的操作,得到含有脂质体b8的液。脂质体b8中的dope浓度是1.6mg/ml。除了代替使用dope15mg、dopc30mg及dops15mg而使用dope20mg及dopc20mg之外,进行与(1)的脂质体a5的调制同样的操作,得到含有脂质体b9的液。脂质体b9中的dope及dopc各自的浓度是0.8mg/ml及0.8mg/ml。除了代替使用dope15mg、dopc30mg及dops15mg而使用dopc40mg之外,进行与(1)的脂质体a5的调制同样的操作,得到含有脂质体b10的液。脂质体b10中的dopc浓度是1.6mg/ml。除了代替使用dope15mg、dopc30mg及dops15mg而使用dops40mg之外,进行与(1)的脂质体a5的调制同样的操作,得到含有脂质体b11的液。脂质体b11中的dops浓度是1.6mg/ml。(3)凝血酶原时间测定用试剂的调制将(1)的含有脂质体a5的液20ml、(2)的含有脂质体b8的液20ml、50μg/ml组织因子溶液8ml和hepes缓冲液b32ml混合。通过一边将得到的混合物于37℃加温,一边以950rpm搅拌8天,使脂质体和组织因子再构成,得到脂质体组合物。将得到的脂质体组合物80ml和hepes缓冲液c320ml混合。向瓶分注各2ml得到的混合物。使瓶中的混合物冷冻干燥,得到实施例8的凝血酶原时间测定用试剂。实施例8的试剂中的、相对于总脂质体的含量的脂质体b8的含量是40质量%。除了代替使用含有脂质体b8的液而使用含有脂质体b9的液(实施例9)、含有脂质体b10的液(实施例10)或含有脂质体b11的液(比较例4)之外,进行与实施例8同样的操作,得到实施例9~10及比较例4的凝血酶原时间测定用试剂。实施例9的试剂中的、相对于总脂质体的含量的脂质体b9的含量是40质量%。实施例10的试剂中的、相对于总脂质体的含量的脂质体b10的含量是40质量%。比较例4的试剂中的、相对于总脂质体的含量的脂质体b11的含量是40质量%。(4)凝固时间的测定及isi的算出除了使用实施例8~10及比较例4的凝血酶原时间测定用试剂之外,进行与实施例1及比较例1的(4)同样的操作,进行凝固时间的测定及isi的算出。研究使用实施例8~10及比较例4的凝血酶原时间测定用试剂之时的凝固时间及isi的结果示于表4。【表4】凝固时间(sec)isi实施例812.91.096实施例911.11.042实施例10111.058比较例49.21.376从表4所示的结果得知,构成脂质体b的磷脂是dope单独(实施例8)、dopc和dope的混合物(实施例9)或dopc单独(实施例10)的凝血酶原时间测定用试剂的凝固时间及isi均是适当的凝固时间及isi。从而,从这些结果得知,如果由含脂质体a和由脂质体a中所含的选自pe及pc的至少1种磷脂构成的脂质体b作为脂质体的凝血酶原时间测定用试剂,可确保适当的凝固时间及isi。如以上说明,如果由本实施方式涉及的凝血酶原时间测定用试剂,含第1脂质体和由第1脂质体中所含的选自磷脂酰胆碱化合物及磷脂酰乙醇胺化合物的至少1种磷脂构成的第2脂质体作为脂质体,由此提示在正常血浆的凝固时间的测定时可确保适当的凝固时间及isi,而且难以受共存物质的影响。【符号的说明】10:试剂盒21:试剂22:容器31:附带文书41:箱101:第1脂质体102:第2脂质体200:磷脂201:二油酰磷脂酰乙醇胺202:二油酰磷脂酰胆碱203:二油酰磷脂酰丝氨酸210:组织因子当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1