一种检测生物样本中的蛋白质复合体的方法与流程
本发明属于生化分析技术领域,尤其属于蛋白质分析技术领域,具体涉及一种检测生物样本中的蛋白质复合体的方法,该方法可以研究蛋白质相互作用。
背景技术:
生物体内存在众多的蛋白质(包括酶类),各种蛋白质以及蛋白质之间的相互作用,对于维持生物体的正常生理功能都起到重要的作用。蛋白质相互作用是指两个或两个以上的蛋白质分子通过非共价键形成蛋白质复合体的过程。蛋白质相互作用涉及几乎所有的生命活动,包括dna的复制与转录、蛋白质的合成与分泌、信号转导和代谢等等。而且,许多具有重要功能的蛋白质分子常以二聚体、三聚体或寡聚体的形式发挥作用,这些蛋白间的相互作用对其生理功能的实现十分重要。研究蛋白相互作用,不仅可以从分子水平上揭示蛋白质的功能,而且对于研究生物体的生长、发育、分化和凋亡等生命活动规律至关重要,为探讨重大疾病的机理、疾病治疗、疾病预防和新药开发提供重要的理论基础。研究蛋白质结构与相互作用的传统技术包括核磁共振技术、x射线晶体衍射技术等,对于蛋白质的纯度、结晶性和绝对量均有比较高的要求,限制了其广泛应用。
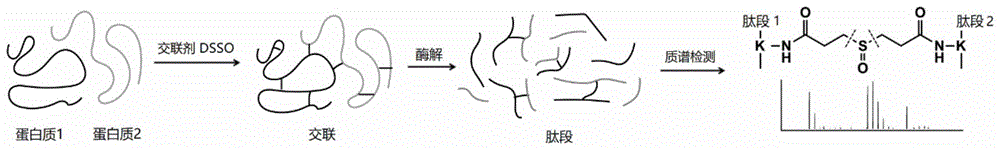
化学交联结合质谱技术,简称交联质谱技术(英文缩写cxms或xl-ms),是近年来发展起来的一种获取蛋白质结构信息的新方法。它利用化学交联剂处理蛋白质样品,将空间距离足够接近、可以与交联剂反应的两个氨基酸以共价键连接起来,然后利用基于高精度质谱的蛋白质组学手段分析交联产物。以小分子交联剂dsso为例,参见图1,蛋白质1和蛋白质2在交联剂dsso作用下发生交联反应,然后利用自下而上的蛋白质组学流程,将交联蛋白质酶解成肽段后进行质谱分析,因dsso小分子设计有质谱裂解位点,可以得到交联肽段质谱图,进而解析出交联的蛋白质。交联质谱技术的交联反应发生在溶液态,反映了蛋白质的溶液构象。交联质谱技术可以获取蛋白质的结构信息,表征蛋白质动态,在蛋白质复合体的蛋白相互作用研究中发挥作用。
免疫共沉淀技术(co-ip)可将目标蛋白质复合体从复杂样本中纯化出来,是一种常用的蛋白相互作用研究手段。目标蛋白质复合体包含目标蛋白及与目标蛋白结合的结合蛋白。图2显示了免疫共沉淀技术的流程,首先采用抗目标蛋白的特异性抗体与蛋白样本进行孵育,通过免疫亲和使得特异性抗体与目标蛋白结合在一起,从而与目标蛋白质复合体结合在一起,进一步采用蛋白a或蛋白g包被的磁珠,可特异性地结合抗体的fc区域,经过清洗和洗脱后获得目标蛋白质复合体。
目前在蛋白相互作用研究以及结构蛋白质组学研究中,日益将交联质谱技术与免疫共沉淀技术相结合,先采取化学交联反应将蛋白质复合体稳定,进而使用免疫共沉淀通过捕获蛋白质复合体中的目的蛋白来捕获蛋白质复合体,然后进行质谱分析(参见例如cross-linkingproteomicsindicateseffectsofsimvastatinonthetlr2interactomeandrevealsactr1aasanovelregulatorofthetlr2signalcascade.molcellproteomics.2019sep;18(9):1732-1744)。
但是,这种方法忽略了这样一种可能,即蛋白质复合体的肽链通过交联反应共价连接在一起,会形成空间位阻效应,可能会阻碍特异性抗体与目标蛋白的免疫亲和反应,使得特异性抗体无法捕获到蛋白质复合体。另外,可用于免疫共沉淀的抗体是抗天然蛋白的抗体,通常制备较困难且生产周期长,而且商品化的此类抗体也较缺乏,不方便研究工作的开展。
技术实现要素:
本发明的目的在于解决现有技术中将交联质谱技术与免疫共沉淀技术相结合时,使用化学交联剂稳定蛋白质复合体之后出现的空间位阻问题以及用于免疫共沉淀的抗体缺乏的问题,有利于开展蛋白质复合体和蛋白质相互作用的研究。
本发明通过下述技术方案来实现上述目的:
一种检测生物样本中的蛋白质复合体的方法,其中该蛋白质复合体包含目标蛋白和与该目标蛋白相互作用的结合蛋白,该方法包括以下步骤:
共价交联:用化学交联剂使该蛋白质复合体在非蛋白质变性条件下发生共价交联反应,以使该蛋白质复合体稳定化;
变性处理:将该蛋白质复合体进行蛋白变性处理,以破坏维持蛋白三维结构的弱相互作用力;
溶液置换:使经变性处理的蛋白质复合体处于适合进行免疫共沉淀的溶液体系中;
免疫共沉淀:用针对该目标蛋白的特异性抗体与经过溶液置换处理的该蛋白质复合体进行免疫共沉淀,以捕获该蛋白质复合体,并通过捕获该特异性抗体使该蛋白质复合体与该生物样本分离,并将该特异性抗体从该蛋白质复合体洗脱,得到纯化的该蛋白质复合体;
质谱分析:将纯化的该蛋白质复合体进行酶解形成肽段,然后进行质谱分析。
进一步地,该蛋白质复合体位于细胞内,该共价交联反应在该细胞内原位进行;或者,该蛋白质复合体在细胞提取液中,该共价交联反应在该细胞提取液中进行。
更进一步地,该化学交联剂为二琥珀酰亚胺亚砜(dsso,disuccinimidylsulfoxide)或者二琥珀酰亚胺二丁酸(dsbu,disuccinimidyldibutyricacid)。
进一步地,该变性处理采用化学变性方法或者物理变性方法。更进一步地,该化学变性方法采用尿素沉淀方法如8m尿素沉淀方法、丙酮沉淀方法或者改变缓冲液中的渗透质的方法。进一步地,该物理变性方法采用加热变性方法。
进一步地,在该免疫共沉淀步骤中,该特异性抗体为针对天然形式的该目标蛋白的抗体,或者为针对该目标蛋白中的线性表位的抗体。
进一步地,在该溶液置换步骤中,该适合进行免疫共沉淀的溶液体系为非变性蛋白裂解液。
进一步地,该适合进行免疫共沉淀的溶液体系为非变性蛋白裂解液。
进一步地,该分离纯化步骤使用蛋白a包被的磁珠或蛋白g包被的磁珠来进行。
本发明首先通过化学交联剂使蛋白质复合体发生共价交联反应以稳定蛋白质复合体,然后通过对蛋白质复合体进行变性处理,破坏维持蛋白三维结构的弱相互作用力,破坏蛋白三维结构而使肽链散开,以减少肽链的空间位阻效应。一些可能因为蛋白相互作用而埋藏于肽链疏水中心的抗原决定簇将重新暴露在溶液中,使得抗体抗原反应可以发生,解决了因交联反应引起的空间位阻效应造成蛋白质复合体不能被特异性抗体识别的问题。这样,与未经变性处理相比,变性处理可以使特异性抗体捕获到更多的蛋白质复合体,使得交联质谱与免疫共沉淀技术的联用更为有效。
同时,由于经过变性处理,埋藏于肽链疏水中心的抗原决定簇暴露出来,因此不仅可以采用针对天然形式的目标蛋白的抗体进行免疫共沉淀,而且可以采用针对该目标蛋白中的线性表位的抗体进行免疫共沉淀,为免疫共沉淀提供了新颖的思路。抗线性表位抗体易于生产且有大量商业化抗体产品,丰富了特异性抗体的来源,方便了蛋白质实验研究的开展。
附图说明
图1是以小分子交联剂二琥珀酰亚胺亚砜(dsso)为例说明交联质谱技术流程的示意图;
图2是显示免疫共沉淀和蛋白质复合体洗脱技术流程的示意图;
图3是显示本发明的检测方法中,变性处理使得抗原决定簇(加粗部分)暴露出来以便特异性抗体能够识别的示意图。
具体实施方式
下面通过具体实施方式并结合附图对本发明作进一步详细说明。应指出的是,本文所用的词语“包含”或“包括”具有包括性或开放性的含义,不排除其它未描述的元素或方法步骤。然而,在本文每次提及“包含”中,也意指其包括作为替代的较窄实施方案的词语“基本由...组成”或“由...组成”,其中“由...组成”排除未规定的任何成分或步骤,“基本由...组成”允许包括不在实质上影响所考虑的组合物或方法的基本和新特征的额外的未列举成分或步骤。
如前文所述,本领域已将交联质谱技术与免疫共沉淀技术相结合,先采取化学交联反应将蛋白质复合体稳定,进而使用特异性抗体进行免疫共沉淀,通过捕获蛋白质复合体中的目的蛋白来捕获蛋白质复合体,然后进行质谱分析,以研究蛋白质复合体中的蛋白质相互作用。但是,蛋白质复合体的肽链通过交联反应共价连接在一起,会形成空间位阻效应,可能会阻碍特异性抗体与目标蛋白的免疫亲和反应,使得特异性抗体无法捕获到蛋白质复合体。这一问题会降低交联质谱技术的检测效果。本发明人经过研究,创新性地在免疫共沉淀处理步骤之前先进行蛋白变性步骤,破坏蛋白质复合体的三维结构,克服空间位阻效应。
因此,本发明人开发了一种检测生物样本中的蛋白质复合体的方法,其中该蛋白质复合体包含目标蛋白和与该目标蛋白相互作用的结合蛋白,该方法包括以下步骤:
共价交联:使该蛋白质复合体在非蛋白质变性条件下发生共价交联反应,以使该蛋白质复合体稳定化;
变性处理:将该蛋白质复合体进行蛋白变性处理,以破坏维持蛋白三维结构的弱相互作用力;
溶液置换:使经变性处理的蛋白质复合体处于适合进行免疫共沉淀的溶液体系中;
免疫共沉淀:用针对该目标蛋白的特异性抗体与经过溶液置换处理的该蛋白质复合体进行免疫共沉淀,以捕获该蛋白质复合体,并通过捕获该特异性抗体使该蛋白质复合体与该生物样本分离,并将该特异性抗体从该蛋白质复合体洗脱,得到纯化的该蛋白质复合体;
质谱分析:将纯化的该蛋白质复合体进行酶解形成肽段,然后进行质谱分析。
应该指出的是,上述检测方法中的各个步骤是一个整体,最终实现生物样本中的蛋白质复合体的检测,可以研究蛋白质复合体中的蛋白质相互作用,但核心步骤在于变性处理步骤。通过对蛋白质复合体进行变性处理,破坏维持蛋白三维结构的弱相互作用力,以减少肽链的空间位阻效应,一些可能因为蛋白相互作用而埋藏于肽链疏水中心的抗原决定簇将重新暴露在溶液中,使得抗体抗原反应可以发生。这样,与未经变性处理相比,变性处理可以使特异性抗体捕获到更多的蛋白质复合体,提高检测的灵敏度。
而且,本领域在进行免疫共沉淀时,通常采用抗天然形式的目的蛋白的抗体,而这种抗体通常制备较困难且生产周期长,而且商品化的此类抗体也较缺乏,不方便研究工作的开展。本发明人意外地发现,通过对蛋白质复合体进行变性处理,使一些可能因为蛋白相互作用而埋藏于肽链疏水中心的抗原决定簇暴露出来,这些抗原决定簇成为了线性的表位。这为免疫共沉淀提供了新颖的思路,因为抗线性表位抗体易于生产且有大量商业化抗体产品,丰富了特异性抗体的来源,方便了实验和研究的进行。
本文所用的术语“蛋白质复合体”是指两个或两个以上的蛋白质分子通过非共价键发生相互作用所形成的复合物,因此蛋白质复合体包含了蛋白质相互作用的信息,可以以蛋白质复合体为对象研究蛋白质相互作用。为了方便后续描述免疫共沉淀步骤的起见,将蛋白质复合体中的被特异性抗体捕获的那个蛋白质称为目的蛋白,而将通过蛋白质相互作用与该目的蛋白结合在一起的其他蛋白质称为结合蛋白。
本文所用的术语“生物样本”是指取自生物体的包含蛋白质复合体的样本。生物样本可以为完整的器官、组织或细胞,而器官和组织由细胞组成,蛋白质复合体位于在细胞中。或者,生物样本可以为器官、组织或细胞的裂解液,蛋白质复合体从裂解的细胞中游离出来而位于细胞裂解液中。
在蛋白质复合体位于细胞中的情况下,共价交联反应在细胞内原位进行。在蛋白质复合体位于细胞裂解液中的情况下,共价交联反应在细胞提取液中进行。蛋白质复合体无论位于细胞中还是细胞裂解液中,都处于其天然的、非变性的状态下,因此共价交联反应是在非蛋白质变性条件下,将天然状态的蛋白质复合体三维结构中的肽链以共价键连接而稳定化。
共价交联反应用化学交联剂来进行。化学交联剂是能够与蛋白质反应的带有双功能团的化学试剂,通过功能团和氨基酸残基反应,偶联两个蛋白质或者更多的蛋白质形成网状交联。常用的化学交联剂包括包括例如琥珀酰亚胺亚砜(dsso)和二琥珀酰亚胺二丁酸(dsbu)。dsso和dsbu都具有细胞膜透过性,可以进入细胞内进行蛋白质原位共价交联。
琥珀酰亚胺亚砜(dsso)的结构式如下所示,其中虚线表示质谱裂解位点:
二琥珀酰亚胺二丁酸(dsbu)的结构式如下所示:
进行共价交联反应的条件和操作是本领域技术人员公知的,或者通过有限的试验得知。市售的化学交联剂也会提供关于共价交联反应的条件和操作的说明。例如thermofisher的dsso和dsbu的产品说明书提供了在细胞内和细胞外进行共价交联反应的操作程序。
在进行共价交联反应步骤后进行变性处理步骤。如上所述,这一步骤对于实现本发明的目的是一个关键步骤,尽管变性处理的方法可以采用本领域公知的各种蛋白质变性方法。例如,变性处理方法可以是化学变性方法或者物理变性方法。化学变性方法可以采用加强酸、强碱、重金属盐、尿素、丙酮或者改变缓冲液中的渗透质等方法。物理变性方法可以采用加热、紫外线或x射线照射、超声波、剧烈振荡或搅拌等方法。在本发明的一个优选实施方案中,采用尿素沉淀变性方法,更优选地8m尿素沉淀方法。在本发明的另一个优选实施方案中,采用加热变性方法。具体的变性条件和操作是本领域技术人员公知的,或者通过有限的试验得知。
在变性处理之后,需要使经变性处理的蛋白质复合体处于适合进行免疫共沉淀的溶液体系中,如非变性蛋白裂解液中。例如在采用化学变性方法如尿素变性方法的实施方案中,需要将经变性处理的蛋白质复合体进行溶液置换,使其从例如尿素裂解液体系中置换为例如非变性蛋白裂解液体系。
接着进行免疫共沉淀步骤,这通过使用针对蛋白质复合体中的目的蛋白的特异性抗体与该蛋白质复合体孵育来进行。该特异性抗体可以设计为针对天然形式的该目标蛋白的抗体。由于在变性处理后,蛋白质复合体三维结构被破坏,埋藏于肽链疏水中心的抗原决定簇暴露出来,这些抗原决定簇成为了线性的表位。因此,该特异性抗体也可以为针对该线性表位的抗体。特异性抗体的设计是本领域技术人员公知的,可以根据目的蛋白的氨基酸序列(包括线性表位的氨基酸序列)、结构等性质进行设计。加入该特异性抗体后,蛋白质复合体被特异性抗体结合形成免疫复合物。此免疫复合物仍存在于所处理的生物样本中,需要将其与生物样本分离,然后将特异性抗体从免疫复合物洗脱下来,以得到纯化的蛋白质复合体。分离免疫复合物的方法是本领域技术人员公知的,包括例如凝胶过滤法和亲和色谱法。亲和色谱法最为常用,其通常涉及使用能与该特异性抗体结合的试剂,通过与该试剂结合可将免疫复合物从生物样本中分离出来。洗脱抗体的方法也是本领域技术人员公知的,通常涉及在洗脱缓冲液存在下进行洗脱。在本发明的优选实施方案中,使用蛋白a包被的磁珠或蛋白g包被的磁珠进行免疫复合物的分离纯化。这种磁珠是可以市售获得的,并且市售产品提供了操作条件和程序。例如,这种磁珠的操作程序一般涉及样品(例如免疫复合物)处理、磁珠预处理、抗体(免疫复合物)吸附、磁珠洗涤、抗体洗脱、抗体透析等操作。
最后将纯化得到的蛋白质复合体进行质谱分析。蛋白质质谱分析通常涉及将蛋白质进行酶解形成肽段,然后用质谱仪对肽段进行脆裂检测,后经过相应的软件进行数据库匹配分析,从而获得肽段及其对应蛋白的信息,这是本领域公知的。
下面通过具体实施例和试验例对本发明作进一步详细的描述,但本发明的实施方式不限于此。其他任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。实施例和试验例中用到的试剂都可市售获得或者现配,除非另有说明。
实施例1
本实施例以hela细胞为例,以热休克蛋白90为目标蛋白,在细胞内原位进行热休克蛋白复合体的检测,具体操作如下。
(1)共价交联
将1×107个hela细胞用450μl磷酸盐缓冲液重悬,加入50μl的50mmdsso储液,使其终浓度为5mm,置于4℃反应1h后,加入1mnh4hco3至终浓度为20mm以终止反应,500×g离心5min获得交联细胞。
(2)变性处理
将交联细胞分成两份,向其中一份交联细胞直接加入细胞体积3倍的8m尿素裂解液,冰上超声处理5min(开2s停3s),进行变性蛋白提取,得到变性蛋白液(下文称为本发明方法处理组),另一份交联细胞不进行变性处理,用非变性裂解液(20mmhepes,150mmnacl,1%tritonx-100,ph7.4)提取得天然非变性蛋白液作为对照(下文称为常规方法处理组)。
(3)溶液置换
将本发明方法处理组的变性蛋白液用30kd超滤管进行溶液置换,非变性细胞裂解液(25mmhepes,150mmnacl,1%tritonx-100,ph7.4)清洗超滤管3次,然后用其溶解蛋白,得到本发明方法处理组的经溶液置换的变性蛋白液。
(4)免疫共沉淀
然后分别向该经溶液置换的变性蛋白液和常规方法处理组的变性蛋白液中加入10μl的针对热休克蛋白的特异性抗体(采用abcam公司的anti-hsp90antibody,抗天然表位货号:ab13495;抗线性表位货号:ab109248)置于4℃缓慢震荡孵育过夜,进行免疫共沉淀反应。用蛋白a包被的磁珠与免疫共沉淀反应后得到的两个处理组的溶液孵育3h。然后用前述非变性裂解液及清洗磁珠3次,最后用20mm甘氨酸洗脱缓冲液洗脱,得到热休克蛋白复合体。
(5)质谱分析
然后将两个处理组的热休克蛋白复合体在10mm二硫苏糖醇溶液中置于37℃反应45min进行二硫键的还原,再加入终浓度为55mm碘代乙酰胺暗室反应30min封闭巯基,反应完成后使用trypsin进行酶解步骤。最后进行质谱分析,对于dsso交联肽段的质谱分析,可采用三级质谱采集模式(ms2-ms3)的出发方式,也可采用逐级能量脆裂模式(steeped-nce)的方式进行数据采集。最后用xlinkx软件对质谱数据进行分析,所得的交联肽段数质谱鉴定结果如表1所示。表1.以热休克蛋白为目标蛋白,用常规方法和本发明方法进行质谱分析的结果比较
表1的结果显示,本发明方法测出的热休克蛋白分子内交联肽段数目为24对,热休克蛋白与其相互作用蛋白之间的交联肽段数目为90对,远高于常规方法所测出的13对和35对。表明本发明方法可以使热休克蛋白复合体更好地被热休克蛋白抗体识别。
实施例2
本实施例以a549细胞为例,以甘油醛-3-磷酸脱氢酶(gapdh)为目标蛋白,在细胞裂解液中进行gapdh蛋白复合体的检测,具体操作如下。
(1)共价交联
将1×107个a549细胞用450μl磷酸盐缓冲液重悬,加入非变性细胞裂解液(25mmhepes,150mmnacl,1%tritonx-100,ph7.4)提取细胞全蛋白液,定量得到4.4mg/ml的蛋白液0.5ml。然后加入50mmdsbu储液使其终浓度为5mm,置于4℃反应1h后,加入1mnh4hco3至终浓度为20mm以终止反应,500×g离心5min获得交联蛋白液。
(2)变性处理
将交联蛋白液分成两份,用非变性细胞裂解液(25mmhepes,150mmnacl,1%tritonx-100,ph7.4)稀释到2.2mg/ml。向其中一份交联蛋白液加入高浓度的尿素裂解液,使尿素终浓度为8m,冰上超声处理5min(开2s停3s),进行变性反应,得到变性蛋白液(下文称为本发明方法处理组),另一份交联蛋白液不进行变性处理,作为对照(下文称为常规方法处理组)。
(3)溶液置换
将本发明方法处理组的变性蛋白液用30kd超滤管进行溶液置换,用非变性细胞裂解液(25mmhepes,150mmnacl,1%tritonx-100,ph7.4)清洗超滤管3次,然后用其溶解蛋白,得到本发明方法处理组的经溶液置换的变性蛋白液。
(4)免疫共沉淀
然后分别向该经溶液置换的变性蛋白液和常规方法处理组的变性蛋白液中加入10μl的针对gapdh蛋白的特异性抗体(抗天然表位抗体货号ab181602,抗线性表位抗体货号ab8245),置于4℃缓慢震荡孵育过夜,进行免疫共沉淀反应。用蛋白a包被的磁珠与免疫共沉淀反应后得到的两个处理组的溶液孵育3h。然后用前述非变性裂解液及清洗磁珠3次,最后用20mm甘氨酸洗脱缓冲液洗脱,得到gapdh蛋白复合体。
(5)质谱分析
然后将两个处理组的热休克蛋白复合体在10mm二硫苏糖醇溶液中置于37℃反应45min进行二硫键的还原,再加入终浓度为55mm碘代乙酰胺暗室反应30min封闭巯基,反应完成后使用trypsin进行酶解。最后进行质谱分析,对于dsso交联肽段的质谱分析,可采用三级质谱采集模式(ms2-ms3)的出发方式,也可采用逐级能量脆裂模式(steeped-nce)的方式进行数据采集。最后用xlinkx软件对质谱数据进行分析,所得的交联肽段数质谱鉴定结果如表2所示。
表2.以gapdh为目标蛋白,用常规方法和本发明方法进行质谱分析的结果比较
由表2可见,采用本发明方法鉴定出22个结合蛋白与gapdh蛋白相互作用,比常规方法鉴定出的17个结合蛋白多,尽管增加的数目不是很显著。对这些鉴定到的结合蛋白进行分析,发现大部分由抗天然表位的抗体进行的实验组所鉴定到的gapdh结合蛋白大都是未经报道的,如转录相关调节蛋白等。采用抗线性表位抗体的实验组中有1个结合蛋白是具有转运功能的蛋白,这样的相互作用通常是瞬时的,且该类结合蛋白存在于细胞内的丰度较低,而通过本发明的方法可以挖掘这一类结合蛋白。这不仅验证了本发明的方法所起到的效果,而且说明本发明的方法还有对于蛋白质组的研究还有更多潜在的应用。
以上应用了具体实例对本发明进行了阐述,只是用于帮助理解本发明,并不用以限制本发明。本发明所属技术领域的技术人员依据本发明的构思,还可以做出若干简单推演、变形或替换。这些推演、变形或替换方案也落入本发明的权利要求范围内。
- 还没有人留言评论。精彩留言会获得点赞!