提高博落回血根碱和白屈菜红碱含量的诱导培养基及方法与流程
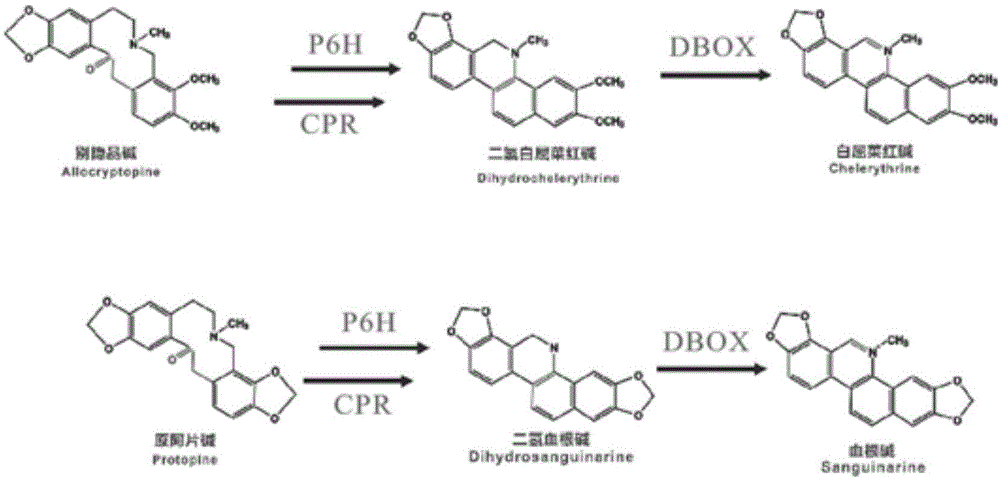
本发明涉及一种提高博落回血根碱和白屈菜红碱含量的诱导培养基及方法。技术背景博落回[macleayacordata(willd)r.b]是罂粟科博落回属多年生植物,是一种重要的传统药用植物,活性成分主要为异喹啉类生物碱。苯并菲啶生物碱(简称bias)是一类种类多样的生物碱,这些化合物具有广泛的生物活性,包括血根碱、白屈菜红碱、原阿片碱、别隐品碱等。其中血根碱具有广泛的生物活性,包括强抗肿瘤,抗菌和抗炎等。此外,血根碱和白屈菜红碱作为天然生长促进剂,已广泛用于替代畜牧业中的抗生素生长促进剂。2006年,随着欧盟全面禁止在饲养中添加抗生素生长促进剂,因此植物源的天然生长促进剂被广泛用作畜牧生产中抗生素的替代品。其市场逐年增加。目前,含血根碱的产品在70多个国家和地区广泛销售。除此以外,血根碱还是一种抗血吸虫的有效药物。目前,血根碱和白屈菜红碱主要从博落回中提取。然而,博落回是一种野生资源且还未被人工驯化,目前还无法大规模人工种植。因此,当今收集资源的方式给博落回资源带来了越来越大的压力,导致资源逐年萎缩。此外,血根碱的含量受遗传组成和环境的影响很大。因此,建立一种新的稳定和可持续发展的资源开发方式具有十分重要的意义。植物组织培养已成为工业规模生产次级代谢产物的可持续和有效替代策略。药用植物组织培养有以下优点:(1)不受环境或地理条件的影响。(2)能严格控制生产过程和产品质量。(3)缩短植物的生长周期。(4)避免占用大量土地资源。目前已经有许多植物次生代谢产物在过去几十年中通过该种方式生产,如紫草素、人参皂苷和紫杉醇。在植物组织培养基础上,再通过一些诱导子诱导能够进一步增强植物中的次级代谢物。如,茉莉酸甲酯处理增强了蛇根草中喜树碱的含量。而水杨酸则可以增加丹参细胞中次级代谢物的积累。又例如:cn107360971a公开一种促进罗汉果ss基因表达的方法,将罗汉果组培苗接种在茉莉酸甲酯浓度为260~345μmol/l的诱导培养基中培养28~30d。能诱导罗汉果组培苗中的ss基因表达,进而促进罗汉果甜苷v的合成。但是目前还没有关于诱导子对博落回组织培养中bias产生影响的报道。技术实现要素:本发明要解决的技术问题是提供一种提高博落回血根碱和白屈菜红碱含量的诱导培养基及方法,该培养基及方法能促进博落回中p6h(普罗托品-6-羟基化酶)基因和dbox(二氢苯并菲啶氧化酶)基因的表达,进而促进血根碱和白屈菜红碱的合成,进而提高博落回组培苗中血根碱和白屈菜红碱及其他苯并菲啶生物碱(简称bias)的含量。为了解决上述技术问题,本发明采用以下技术方案:提供一种提高博落回血根碱和白屈菜红碱含量的诱导培养基,所述诱导培养基主要由ms培养基和诱导子组成,所述诱导子为茉莉酸甲酯(methyljasmonate,简称mj)、水杨酸(salicylicacid,简称sa)中的一种或两种,所述诱导子的浓度为50~150μmol/l。进一步地,所述茉莉酸甲酯的浓度优选为100μmol/l。进一步地,所述水杨酸的浓度优选为100μmol/l。本发明还提供一种利用上述诱导培养基提高博落回血根碱和白屈菜红碱含量的方法,具体包括如下步骤:(1)培育无菌组培苗:选取按照16小时光培养和8小时暗培养,光照强度为4500~9000lx,培养60天的无菌组培苗备用;(2)将步骤(1)培育的无菌组培苗置于诱导培养基上,25℃下在16小时光周期下诱导培育24~120h;所述诱导培养基主要由ms培养基和诱导子组成,所述诱导子为茉莉酸甲酯、水杨酸中的一种或两种;诱导子过滤灭菌,并使用二甲基亚砜(methylsulfoxide,简称dmso)稀释诱导子,诱导培养基中诱导子的浓度为50~150μmol/l;(3)提取步骤(2)经过诱导培育后的无菌组培苗中的代谢产物并进行定量分析。进一步地,步骤(2)中所述茉莉酸甲酯的浓度优选为100μmol/l。进一步地,步骤(2)中所述水杨酸的浓度优选为100μmol/l。进一步地,步骤(2)经过诱导培育后的无菌组培苗在提取代谢产物之前应当立刻置于液氮中-70℃下冷冻储存,待用。进一步地,所述方法还包括步骤(4)提取步骤(2)经过诱导培育后的无菌组培苗的rna,然后合成cdna并进行pcr定量分析。进一步地,步骤(1)具体为:将采摘的博落回外植体先用75%酒精浸泡,再用0.1%升汞进行消毒处理,完成消毒灭菌处理;在无菌工作台中,用无菌解剖刀在外植体上轻划2~3道伤口,最后接种到ms固体培养基(市场上直接购买的ms加水调节成4.42g/l,加30g/l蔗糖,调节ph=5.8,加入0.3%植物凝胶调成固体培养基)上,置于25℃暗培养箱中培养,待长出愈伤,再置于25℃,16小时光培养和8小时暗培养后长出无菌组培苗。进一步地,步骤(1)还包括对获得的无菌组培苗通过继代培养或植株再生或外植体引发愈伤的手段进行扩繁。进一步地,所述博落回外植体包括叶片、茎段,在无菌工作台中,用无菌剪刀将消毒后的叶片剪至5mm×5mm大小,将茎段斜切成长度0.4~0.6cm的小段,然后做划伤处理。本发明的有益效果:本发明提供的诱导培养基,通过在培养基中添加诱导子茉莉酸甲酯(mj)或水杨酸(sa),能促进博落回中p6h(普罗托品-6-羟基化酶)基因和dbox(二氢苯并菲啶氧化酶)基因的表达,进而促进血根碱和白屈菜红碱的合成,进而提高博落回组培苗中血根碱和白屈菜红碱的含量。经检测,诱导培养后的博落回组培苗中p6h基因和dbox基因的表达量相对未处理组对照最高能分别提高9倍和80倍;血根碱和白屈菜红碱的含量最高能分别增加10倍和14倍。附图说明为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。图1为博落回中血根碱和白屈菜红碱的合成途径;图2为诱导培育不同培育时间,不同诱导子与对照组的博落回组培苗中别隐品碱的含量对比图;图3为诱导培育不同培育时间,不同诱导子与对照组的博落回组培苗中原阿片碱的含量对比图;图4为诱导培育不同培育时间,不同诱导子与对照组的博落回组培苗中二氢白屈菜红碱的含量对比图;图5为诱导培育不同培育时间,不同诱导子与对照组的博落回组培苗中二氢血根碱的含量对比图;图6为诱导培育不同培育时间,不同诱导子与对照组的博落回组培苗中白屈菜红碱的含量对比图;图7为诱导培育不同培育时间,不同诱导子与对照组的博落回组培苗中血根碱的含量对比图;图8为诱导培育不同培育时间,不同诱导子与对照组的博落回组培苗中p6h基因表达量对比图;图9为诱导培育不同培育时间,不同诱导子与对照组的博落回组培苗中dbox基因表达量对比图。具体实施方式为了更好地阐述该发明的内容,下面通过具体实施例对本发明进一步的验证。特在此说明,实施例只是为更直接地描述本发明,它们只是本发明的一部分,不能对本发明构成任何限制。1、培育无菌组培苗:基于申请人之前的研究发现:实验操作过程,使用嫩枝比叶片更方便操作,且嫩枝组更容易、更快产生愈伤组织,也能更快生长获得整棵植株。本发明采用博落回茎段作为无菌组培苗培育的外植体。将采摘的博落回茎段先用75%酒精浸泡,再用0.1%升汞进行消毒处理,完成消毒灭菌处理;在无菌工作台中,首先将茎段斜切成长度0.4~0.6cm的小段,然后用无菌解剖刀在茎小段上轻划2~3道伤口,最后接种到ms固体培养基(市场上直接购买的ms加水调节成4.42g/l,加30g/l蔗糖,调节ph=5.8,加入0.3%植物凝胶调成固体培养基)上,置于25℃暗培养箱中培养,待长出愈伤,再置于25℃,光照强度为4500~9000lx,16小时光培养和8小时暗培养后长出无菌组培苗;无菌组培苗通过继代培养或植株再生或外植体引发愈伤的手段进行扩繁;选取培养60天的无菌组培苗,待用。2、配制ms培养基及诱导培养基将市面上买到的ms培养基粉末,按照标准配比,4.42克ms培养基粉末加1l水调成基础培养基,然后加蔗糖:30g/l+植物凝胶:3g/l,调ph值为5.8,即得ms培养基;将诱导子茉莉酸甲酯(mj)、水杨酸(sa)分别使用0.22μm膜过滤器(millipore,usa)过滤灭菌,并使用二甲基亚砜稀释诱导子,并分别加入ms培养基中,分别配制含有100μmol/lmj的ms培养基以及含有100μmol/lsa的ms培养基。并以无添加的ms培养基作为对照组。诱导子mj和sa均购买自sigma,usa。3、诱导培育将无菌组培苗分别置于含有100μmol/lmj的ms培养基,含有100μmol/lsa的ms培养基以及无添加的ms培养基上,25℃下在16小时光周期下诱导培育,并分别收集0h,24h,72h和120h的组培苗样品。经过诱导培育后的无菌组培苗在提取代谢产物之前应当立刻置于液氮中-70℃下冷冻储存,待用。4、分别将收集的不同培养基培育及不同时间点(0h,24h,72h和120h)收集的冷冻干燥的各组培苗样品(0.5mg)与甲醇(25ml)混合。然后,通过超声提取样品30分钟,并以14000rpm离心15分钟,并通过0.22mm膜滤器过滤。最后,溶液使用behc18柱通过ultra-hplcagilent1290仪器进行色谱分离。自动进样器温度设定为6℃。uhplc与qqq质谱仪(6460a,agilent)偶联。使用5个点产生校准曲线,并用于评估目标化合物的绝对定量。5、将收集的不同培养基培育及不同时间点(0h,24h,72h和120h)收集的各组培苗接种组织(100mg)用于rna提取。将所有组织在液氮中研磨,并采用rna提取试剂盒(takara,minibestplantgenomicdna,china)提取总rna。同时,采用primescripttmrtmastermix(takara,china)合成cdna。通过qpcr在基因表达中使用的引物列于下表1所示。采用abi7300和sybrpremix(roche,switzerland)进行定量pcr(qpcr)。在所有应用中,一对18s用作管家基因。表1引物核算序列6、统计分析所有实验重复三次并在不同时间点(0h,24h,72h和120h)记录数据;使用graphpadprism软件进行单因素方差分析,然后使用事后检验tukey的显着性差异(hsd)进行均值比较。7、结论及分析(1)组培苗中bais含量测定结果及分析表2不同培养基不同时间点的组培苗中别隐品碱的含量(mg/g)时间0h24h72h120hms培养基0.3±0.06///含100μmol/lmj/1.1±0.20.92±0.120.67±0.2含100μmol/lsa/1.62±0.241.47±0.320.66±0.13表3不同培养基不同时间点的组培苗中原阿片碱的含量(mg/g)时间0h24h72h120hms培养基1.57±0.2///含100μmol/lmj/2.17±0.111.32±0.171.08±0.23含100μmol/lsa/2.28±0.352.46±0.231.18±0.04表4不同培养基不同时间点的组培苗中二氢白屈菜红碱的含量(mg/g)表5不同培养基不同时间点的组培苗中二氢血根碱的含量(mg/g)时间0h24h72h120hms培养基0.027±0.004///含100μmol/lmj/0.03±0.0060.025±0.0030.027±0.001含100μmol/lsa/0.016±0.0030.039±0.0060.027±0.004表6不同培养基不同时间点的组培苗中白屈菜红碱的含量(mg/g)表7不同培养基不同时间点的组培苗中血根碱的含量(mg/g)时间0h24h72h120hms培养基0.26±0.016///含100μmol/lmj/0.57±0.0911.71±0.572.54±0.51含100μmol/lsa/0.41±0.180.44±0.10.19±0.04上述表2~7及图2~7的结果显示:与未处理组相比,经过mj处理后的博落回组培苗中的血根碱和白屈菜红碱的含量分别增加10倍和14倍,且其含量在处理120小时达到最高值,血根碱和白屈菜红碱产量分别达到2.54±0.51mg/g和0.827±0.104。结果表明,mj对血根碱含量的影响在实验时间(120h以内)是随着时间的推移而增加;mj诱导下的别隐品碱和原阿片碱在24小时达到最大值;mj在处理72小时后可以显着增加(p<0.05)二氢白屈菜红碱和二氢血根碱的含量。(2)组培苗中基因表达结果及分析从图1所示的博落回中血根碱和白屈菜红碱的合成途径可知:从原阿片碱(pro)到二氢血根碱(dhsan)再到血根碱(san)分别需要由原阿片碱6位羟基化酶(p6h)和二氢苯并菲啶氧化酶(dbox)催化;从别隐品碱(all)生成二氢白屈菜红碱(dhche)再到生成白屈菜红碱(che),也需要6位羟基化酶(p6h)和二氢苯并菲啶氧化酶(dbox)催化。因此可以通过检测这两种基因的表达水平来进一步分析诱导模式对内容物的影响。通过分析p6h和dbox基因的基因表达水平,可以进一步分析诱导子mj及sa对基因表达的作用。检测结果如下表8~9所示,图8~9分别为不同时间和不同处理的博落回组培苗中p6h基因、dbox基因的表达量对比图。与0h组相比,*号表示显著变化(tukey's检验,*表示p<0.05,**表示p<0.01,***表示p<0.005,****表示p<0.001)。表8不同培养基不同时间点的组培苗中p6h基因的表达量时间0h24h72h120hms培养基13.14±0.69///含100μmol/lmj/2.94±0.1134.53±0.47224.97±4.64含100μmol/lsa/1.01±0.02435.98±3.64127.29±5.19表9不同培养基不同时间点的组培苗中dbox基因的表达量时间0h24h72h120hms培养基1.32±0.1///含100μmol/lmj/3.23±0.4214.68±0.72107.3±2.85含100μmol/lsa/1.36±0.0633±5.5660.6±7.09从图8~9,及上表8~9可知:与未处理组比较,经诱导子sa处理后,组培苗中p6h基因表达水平在24小时达到峰值并随时间降低,而dbox基因表达水平在120h时最高。诱导子mj处理后,组培苗中p6h基因表达水平在24h、72h甚至还有抑制作用,到120小时才超过未处理组的水平;而dbox基因表达水平在120h时最高,是未处理组的80倍,是sa组的将近2倍。综上,不同的诱导子对不同的酶基因有不同的影响,但是最终,通过诱导子sa、mj处理都能提高博落回组培苗中的血根碱和白屈菜红碱的含量,也能不同程度提高其他bais的含量。以上所述为本发明的具体实施方式,但不能对本发明构成任何限制,因此需特别指出,凡是以本发明为基础,做得任何修改与改进均落在本发明保护范围之内。seqidno.1~6分别为引物mcp6h-qp-f、mcp6h-qp-r、mcdbox-qp-f、mcdbox-qp-r、18s-qp-f、18s-qr-r的序列。sequencelisting<110>湖南美可达生物资源股份有限公司<120>提高博落回血根碱和白屈菜红碱含量的诱导培养基及方法<130>20181210<160>6<170>patentinversion3.5<210>1<211>20<212>dna<213>mcp6h-qp-f序列<400>1catcaaggacgttcgagcct20<210>2<211>20<212>dna<213>mcp6h-qp-r序列<400>2ctcctcaccacgcacaatct20<210>3<211>20<212>dna<213>mcdbox-qp-f序列<400>3actgttgccacggtcgatag20<210>4<211>20<212>dna<213>mcdbox-qp-r序列<400>4tggaggagcttgtcaacacc20<210>5<211>20<212>dna<213>18s-qp-f序列<400>5cttcgggatcggagtaatga20<210>6<211>20<212>dna<213>18s-qr-r序列<400>6gcggagtcctagaagcaaca20当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1