一种悬浮培养白及细胞的方法与流程
本发明涉及中药材药物研究技术领域,具体涉及一种悬浮培养白及细胞的方法。
背景技术:
白及(bletillastriata(thunb.)rchb.f.)兰科白及属多年生草本植物,是我国传统的名贵中草药,并被广泛应用于工业、和花卉绿化等产业,作为天然的粘胶和美容佳品,具有很好的开发和应用前景,且用途仍然在不断拓展。其假鳞茎具有止血收敛、消肿生肌之功效,主治内外出血、肿瘤、溃疡等症,外用可治烧烫伤、手足皲裂、促进伤口愈合。现代药理研究也发现,白及具有代血浆、骨髓造血、延缓衰老、增加机体免疫力等保健作用。
随着市场需求的急剧增加和白及野生生境的严重破坏,传统的白及生产模式已远远不能满足其用途的不断拓展和市场需求的急速增长。而植物细胞悬浮培养技术通过完全人为可控地满足细胞生长分化最佳条件,高效促进细胞增殖,目前利用植物细胞培养生产次生代谢物最有前景的生物合成方式,在药用植物的药用成分合成中具有重要的意义。国内外已建立了包括红豆杉、人参、长春花等多种药用植物的细胞悬浮培养技术,但是关于白及细胞悬浮培养的研究却鲜有报道,且其在组织培养过程中易褐化死亡也增加了悬浮培养生产白及的难度。
技术实现要素:
本发明意在提供一种悬浮培养白及细胞的方法,以解决现有白及主要以固体培养,增殖速率较低,容易褐化,培养周期长,且不能实现规模化生产等的技术问题,(用增殖率来评价,即增殖率=(目标量-初始量)/初始量x100%)。
本方案中的一种悬浮培养白及细胞的方法,包括以下步骤:
步骤一、取成熟的白及蒴果进行无菌消毒,并获取白及种子;
步骤二、诱导白及种子萌发获取愈伤组织:将白及种子放于无菌的诱导培养基中在黑暗条件下培养,培养温度为25±2℃,培养时间为60~90天;诱导培养基为:ms+6-苄氨基嘌呤1.5±0.5mg/l+2,4-二氯苯氧乙酸2.5±0.5mg/l+30±20g/l蔗糖+7±1g/l琼脂,诱导培养基的ph为5.9±0.1;
步骤三、接种:将步骤二培养获取的愈伤组织接种到继代培养基中在黑暗条件下培养,继代培养基为:ms+6-苄氨基嘌呤1.5±0.5mg/l+2,4-二氯苯氧乙酸2.5±0.5mg/l+30±20g/l蔗糖+7±1g/l琼脂,继代培养基的ph为5.9±0.1;接种培养的温度为25±2℃,时间为25~45天后得到外植体;
步骤四、悬浮培养:将步骤三得到的外植体接种到悬浮培养基中进行悬浮培养,悬浮培养基为ms+6-苄氨基嘌呤1.5±0.45mg/l+2,4-二氯苯氧乙酸2.5±0.5mg/l+30±20g/l蔗糖;悬浮培养基的ph为5.9±0.1;外植体的接种量与培养基的体积比例为1/80~1/20g/ml;接种后在转速为110±10r/min、温度为25±2℃的黑暗条件下进行振荡悬浮培养,悬浮培养时间为40~50天。
本方案的有益技术效果是:本方案采用细胞组织悬浮培养的方法,白及种子进行诱导培养得到白及的愈伤组织,再将愈伤组织进行接种继代培养,得到外植体,最后利用白及的外植体进行悬浮培养,可以克服目前白及组织培养主要以固体培养,增殖速率较低,容易褐化,培养周期长,且不能实现规模化生产等的技术问题。
采用上述方法,为白及生物质的工业化生产和化学成分的高效生物合成奠定实验依据和理论基础;同时,该方法为人们在细胞水平上的遗传操作提供了理想的条件、方法简便、培养周期短、重复性好、短时间内可在细胞水平筛选出预期的突变体、可直接用来进行原生质体的分离、培养与杂交、基因转移和次生代谢产物的生产等优点。
进一步,步骤一中,白及蒴果的无菌消毒方法为:先将蒴果应用酒精消毒,然后无菌水润洗,再然后用氯化汞溶液进行消毒,最后再用无菌水润洗数次,用无菌吸水纸吸干蒴果表面水分。进一步,步骤四中悬浮培养45天。
附图说明
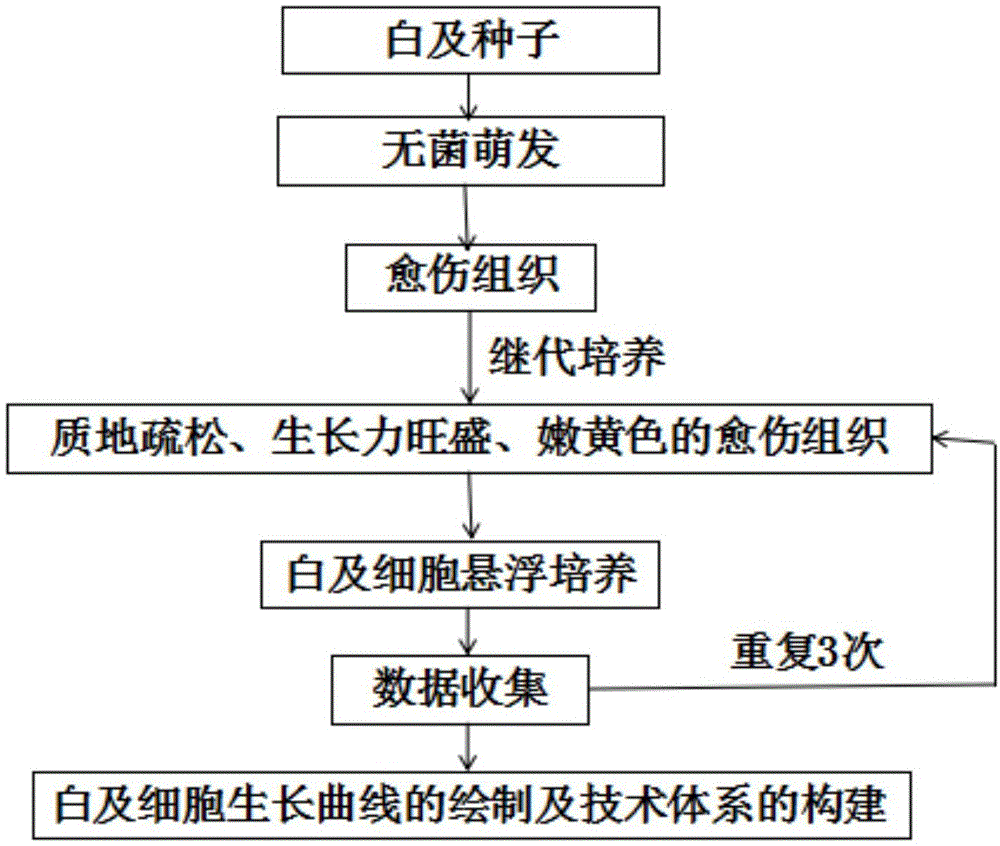
图1为实施例中建立悬浮培养白及细胞生长方法及细胞生长曲线构建的流程图;
图2为悬浮培养细胞生长曲线图;
图3为logistic非线性生长模型对悬浮培养细胞干湿重变化的生长动力学拟合特征图。
具体实施方式
下面通过具体实施方式进一步详细的说明:
一种悬浮培养白及细胞的方法,包括以下步骤:
步骤一、取成熟的白及蒴果进行无菌消毒,并获取白及种子;消毒方法是先将蒴果应用酒精消毒,然后无菌水润洗,再然后用氯化汞溶液进行消毒,最后再用无菌水润洗4或5次,用无菌吸水纸吸干蒴果表面水分;
步骤二、诱导白及种子萌发获取愈伤组织:将白及种子放于无菌的诱导培养基中在黑暗条件下培养,培养温度为25±2℃,优选25℃,培养时间为60~90天,优选培养70天;诱导培养基为:ms+6-苄氨基嘌呤1.5±0.5mg/l+2,4-二氯苯氧乙酸2.5±0.5mg/l+30±20g/l蔗糖+7±1g/l琼脂,诱导培养基的ph为5.9±0.1,优选ph为5.8;
步骤三、接种:将步骤二培养获取的愈伤组织接种到继代培养基中在黑暗条件下培养,继代培养基为:ms+6-苄氨基嘌呤1.5±0.5mg/l+2,4-二氯苯氧乙酸2.5±0.5mg/l+30±20g/l蔗糖+7±1g/l琼脂,继代培养基的ph为5.9±0.1,优选ph为5.8;接种培养的温度为25±2℃,优选25℃,时间为25~45天后得到外植体,优选培养45天;
步骤四、悬浮培养:选择步骤三中质地疏松、生长力旺盛、嫩黄色的外植体接种到悬浮培养基中进行悬浮培养,悬浮培养基为ms+6-苄氨基嘌呤1.5±0.45mg/l+2,4-二氯苯氧乙酸2.5±0.5mg/l+30±20g/l蔗糖;悬浮培养基的ph为5.9±0.1,优选ph为5.8;外植体的接种量与培养基的体积比例为1/80~1/20g/ml;接种后在转速为110±10r/min,优选120r/min、温度为25±2℃的黑暗条件下进行振荡悬浮培养,悬浮培养时间为40~50天;优选温度为25℃,悬浮培养时间为45天。
试验记录:
自开始悬浮培养当日起,每3天进行一次干、湿重测量,45天为一个周期,测量三组数据进行对比。测量时把在摇床上振荡培养装有悬浮细胞液的容器取下,全部培养液转至抽滤瓶中,抽滤直至无培养液滴下时,将滤渣进行称量即为湿重;而后置于50℃的烘箱中烘至恒重,称量即为干重。每个数据采集点取3个样进行测量,每个实验数据测量3次取平均值。分别记录干、湿重变化,以培养时间为横坐标,干、湿重为纵坐标绘制细胞的生长曲线。
根据悬浮细胞干、湿重的测量数据,采用logistic、boltzmann和doseresp三种非线性生长模型对生长曲线进行拟合与分析,从而评估悬浮培养的白及细胞生长情况。
测量数据见表1。
表1:悬浮培养细胞湿重和干重的生长曲线数学模型拟合结果
从白及蒴果消毒、白及细胞的悬浮培养及生长曲线的全过程中可以得到以下结果:
图2为悬浮培养细胞生长曲线图,可以看到2种不同生长指标(细胞干重和细胞鲜重)的生长曲线基本一致,均呈“s”型。logistic非线性生长模型对悬浮培养细胞干湿重变化的生长动力学拟合后,图3显示悬浮培养细胞的整个培养周期可分为6个时期,滞后期、指数期、线性期、减速期、静止期和衰退期。其中,0-6天为滞后期,在此期间悬浮培养细胞的干湿重变化比较缓慢,这是一个细胞逐渐适应环境的过程;6-12天为指数期在此期间细胞生长速度逐渐加快,细胞增殖速度达到最大;12-24天为线性期,在此期间愈伤组织增殖率逐渐稳定,干湿重变化量与时间呈线性相关;24-36天为减速期,在此期间细胞增长速率逐渐放缓;在36天,细胞的干湿重达到最大值;36-39天为静止期,培养细胞的干湿重不再发生明显变化。39天后细胞的干重和湿重均开始呈逐渐下降趋势。
表1为悬浮培养细胞湿重和干重的生长曲线数学模型拟合结果,可见悬浮培养细胞的湿重与培养天数的logistic、boltzmann和doseresp拟合方程决定系数分别为0.9817、0.9231、0.9780;悬浮培养细胞干重与培养天数的3种拟合方程的决定系数分别为0.9761、0.8878、0.9453。由拟合结果中可知,用logistic模型悬浮细胞生物量的增长更为合适。经过进一步的显著性检验,logistic方程的f值(721.56294和613.94951)也均高于boltzmann方程与doseresp方程,说明logistic方程曲线与试验数据更为接近。在接种后培养7d时细胞增长的加速度达到最大,在13-14d时细胞的生长速率达到最大,在36d时细胞的生长量达最大。
培养基的优选方案(以增殖率为评价指标,即(目标鲜重-起始鲜重)/起始鲜重×100%),ph值为5.8,温度25℃,黑暗条件培养。通过添加诱导子能够促进细胞的增长,相关培养基配方如下:
d1:ms+1.0mg/l6-ba+3.0mg/l2,4-d+30g/l蔗糖+7g/l琼脂;
d2:ms+1.0mg/l6-ba+3.0mg/l2,4-d+30g/l蔗糖+7g/l琼脂+5g/l酵母膏;
d3:ms+1.0mg/l6-ba+3.0mg/l2,4-d+30g/l蔗糖+7g/l琼脂+10mg/l水杨酸;
d4:ms+1.0mg/l6-ba+3.0mg/l2,4-d+30g/l蔗糖+7g/l琼脂(铁盐是d1的10倍);
实验结果:d1的增殖率为99.50%;d2的增殖率为94.43%;d3的增殖率为73.95%;d4的增殖率为70.21%。所以d1为本发明方案优选的配方。
培养条件的优选(以增殖率为评价指标,增殖率算法同上)ph值为5.8,转速120r/min,温度25℃,黑暗条件培养。
1).以蔗糖浓度(10g/l、30g/l、15g/l、70g/l)为自变量,ms+1.0mg/l6-ba+3.0mg/l2,4-d为基本培养基。
实验结果:10g/l的增殖率为96.71%;30g/l的增殖率为163.82%;50g/l的增殖率为98.66%;70g/l的增殖率为68.59%。
2).以培养基体积(20ml、35ml、50ml、65ml)为自变量,ms+1.0mg/l6-ba+3.0mg/l2,4-d+30g/l蔗糖为基本培养基。
实验结果:20ml的增殖率为90.02%;35ml的增殖率为132.00%;50ml的增殖率为95.78%;65ml的增殖率为118.17%。
3)以添加量(0.5g/40ml、1.0g/40ml、1.5g/40ml、2.0g/40ml)为自变量,ms+1.0mg/l6-ba+3.0mg/l2,4-d+30g/l蔗糖为基本培养基。
实验结果:0.5g/40ml的增殖率为167.56%;1.0g/40ml的增殖率为139.48%;1.5g/40ml的增殖率为178.96%;2.0g/40ml的增殖率为112.22%。
- 还没有人留言评论。精彩留言会获得点赞!