一种提高适口性和保健功效的银杏茶饮料及其制备方法和应用与流程
本发明属于银杏茶饮料技术领域,尤其涉及一种提高适口性和保健功效的银杏茶饮料及其制备方法和应用。
背景技术:
茶饮料在国际上被称为“新时代饮料”。其特点是天然、保健且能解渴,符合现代人崇尚天然、追求健康保健的消费心理需求。
银杏茶饮料是以银杏叶为原料制成的保健茶饮料,自上世纪90年代初逐渐兴起,在多个国家和地区均有销售。银杏茶含有丰富的蛋白质、氨基酸、矿物质和维生素等多种营养成分,有助于增强人体体力,提高免疫功能,而且银杏叶中富含黄酮和内酯类活性物质,因此,银杏茶还具备一定的抗氧化、抗炎、抗肿瘤、防治心脑血管疾病等功效。目前市场上的银杏茶类产品均存在一些共同的问题:茶叶冲泡后茶水香气淡,味苦涩,适口性不好,而且银杏叶中固有的有效成分不能得到充分释放,生物利用度也不高。
为了有效提高银杏叶中有效活性成分的溶出率,银杏茶饮品在制备过程中,通常采用较高温度浸提。但目前大多数生物酶都存在不耐热和稳定性差的问题,在特别是高温下很容易失活,因此,银杏茶饮品的制备过程中使用的酶要具有耐高温的优良性能。
技术实现要素:
解决的技术问题:本发明提供了一种操作简单,能够提高银杏茶适口性、有效成分浸出率、抗氧化、抗炎和抗肿瘤活性的银杏茶饮料及其制备方法和应用。
技术方案:一种提高适口性和保健功效的银杏茶饮料的制备方法,在银杏茶饮料制备过程中的浸提步骤,添加β-葡萄糖苷酶和α-l-鼠李糖苷酶。
上述β-葡萄糖苷酶是经微生物发酵或重组菌表达并纯化制得;α-l-鼠李糖苷酶是经微生物发酵或重组菌表达并纯化制得。
优选的,上述β-葡萄糖苷酶优选来源于嗜热菌thermotogapetrophiladsm13995。
优选的,上述α-l-鼠李糖苷酶优选来源于土曲霉aspergillusterreusccf3059。
具体制备方法为:将商品化的银杏茶或银杏叶按1wt.%-5wt.%比例在80~95℃水中保温浸提10-15min,依次加入β-葡萄糖苷酶和α-l-鼠李糖苷酶,用酶量分别为7.5u/ml和2u/ml,保温10-40min;过滤除渣,收集滤液,调配,超滤,灌装,封口,杀菌,获得茶饮料。
所述方法制备得到的银杏茶饮料。
所述银杏茶饮料在制备清除体内自由基、防治炎症或阻止恶性细胞增殖产品中的应用
作为本发明的银杏茶饮品能够有效抑制abts的氧化,抑制lps诱导的巨噬细胞炎症,抑制肝癌和结肠癌细胞增殖。
有益效果:银杏茶可浸出总黄酮含量约0.4~0.8%,总内酯含量约0.03~0.15%,特征香气物质约占8~12%。作为本发明制备的银杏茶饮品,具有银杏黄酮浸出率高,香气物质释放量多,抗氧化、抗炎和抗肿瘤活性强的特点。本发明中运用生物酶制备银杏茶饮品,总黄酮浸出率提高约38%,黄酮苷元的比例大幅提高,特征香气物质的释放量提高约264%。在同等饮用量下,本发明制备的银杏茶饮品与不运用生物酶制备的银杏茶饮品相比,抗氧化活、抗炎和抗肿瘤活性的分别可提高约59%、175%和160%。通过本发明技术可提升银杏茶饮品的食用品质和保健功效,能显著提高银杏茶适口性、有效成分浸出率、抗氧化、抗炎和抗肿瘤活性。
附图说明
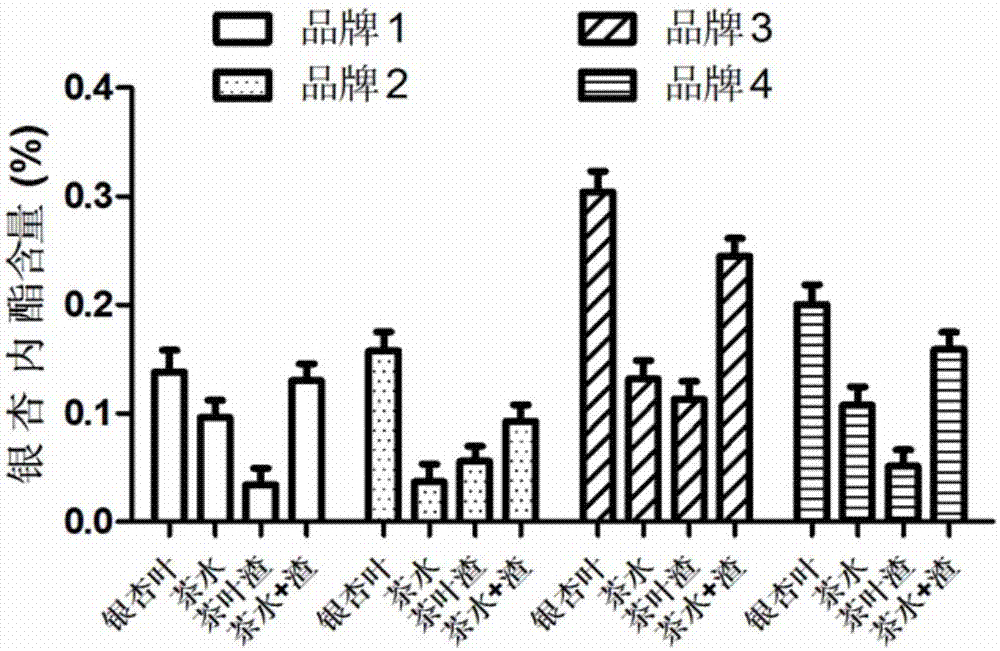
图1:银杏茶饮品中总黄酮含量图。
图2:银杏茶饮品中总内酯含量图。
图3:添加不同酶量后银杏茶饮品浸出总黄酮的含量图。
图4:两种糖苷酶的最适酶用量条件优化结果图。
图5:两种糖苷酶单独添加、复合使用及添加顺序对银杏茶饮品浸出黄酮量的影响图。
图6:银杏茶饮品添加糖苷酶冲泡前后抗氧化、抗炎和抗肿瘤活性的差异图。
具体实施方式
下面结合附图及具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明,而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件,或按照制造厂商所建议的条件。
本发明的目的在于提供一种通过添加复合糖苷酶制备银杏茶饮品的方法,旨在改善银杏茶适口性,增强银杏茶的保健效果。
在本发明的实施例中,添加复合糖苷酶制备的银杏茶饮品可浸出总黄酮约0.8%,释放出的特征香气物质约占35%。与不加复合糖苷酶制备的银杏茶饮品相比,总黄酮浸出率提高约35%,黄酮苷元的比例大幅提高,特征香气物质的释放量提高约264%。
在本发明的实施例中,将银杏茶按1%-5%比例在80~95℃中保温浸提10-15min,依次加入β-葡萄糖苷酶和α-l-鼠李糖苷酶,用酶量分别为7.5u/ml和2u/ml,保温10-40min。过滤除渣,收集茶水,调配,超滤,灌装,封口,杀菌,获得茶饮料。
在本发明实施例中,经添加糖苷酶后,银杏茶水能够更好地抑制abts的氧化,抑制lps诱导的巨噬细胞炎症,抑制肝癌和结肠癌细胞增殖。
下面结合附图及具体实施例对本发明的应用原理作进一步描述。
实施例1:
1.实验目的
比较在银杏茶饮品制备过程中,添加不同的糖苷酶后浸出茶水中活性成分含量。
2.实验材料
2.1受试样品
银杏茶:产于湖北安陆。
2.2重组糖苷酶
β-葡萄糖苷酶:pet20b-tpebgl3(来源于gh3thermotogapetrophiladsm13995);pet20b-tthbgl3(来源于gh3thermotogathermarumdsm5069);ppiczαa-anibgl3(来源于gh3aspergillusnigernl-1)。
α-鼠李糖苷酶:ppiczαa-aterha78(来源于gh78aspergillusterreusccf3059);pet20b-anirha78(来源于gh78aspergillusnigernl-1);pet28a-bthrha(来源于bacteroidesthetaiotaomicronvpi5482)。
3.实验方案
3.1β-葡萄糖苷酶的制备
3.1.1thermotogapetrophiladsm13995的培养
thermotogapetrophiladsm13995购于dsmz菌种保藏中心(www.dsmz.de)编号为13995。其培养基配方为:10g/l淀粉starch,5g/l蛋白胨tryptone,3g/l酵母提取物yeastextract,5g/l肉膏meatextract,10g/l2-马啉乙磺酸(2-morpholinoethanesulfonic),10mg/lfeso4·7h2o,1mg/l刃天青resazurin,调整ph为7.2。用注射器按照0.5%接种量接种,85℃静止培养24h,收集细胞。
3.1.2基因组dna的提取
(1)静置培养thermotogapetrophiladsm13995约24小时,取30ml菌液4,000g离心10min收集细胞。
(2)用9.5mlte缓冲液重悬菌体,加入0.5ml10%十二烷基硫酸钠(sds)和50μl蛋白酶k(20mg/ml),混合均匀,37℃保温1h。
(3)加入1.8ml5mol/lnacl,1.5ml十六烷基三乙基溴化铵(ctab)/nacl,混匀,65℃温育20min。
(4)加入等体积氯仿/异戊醇,混匀,6,000g离心10min。
(5)为防止剪切力造成基因组dna断裂,用粗口吸管将上清转入另一离心管中,加入等体积酚/氯仿/异戊醇混匀,6,000g离心10min。
(6)另一离心管中,加入0.6倍体积异丙醇,轻轻晃动至白色丝状dna沉淀清晰可见。
(7)用吸管将dna缠绕其上,在70%酒精中清洗。
(8)用无菌牙签将dna从吸管上刮下,转入1.5ml离心管中。
(9)室温下风干,加500μlte缓冲液溶解。
(10)取50μl用核酸蛋白检测仪检测dna浓度。
3.1.3重组质粒pet-tpebgl3的构建
按照已知的thermotogapetrophiladsm13995耐高糖β-葡萄糖苷酶基因设计引物,引物由上海生物工程有限公司合成。p1:cgccatatgatgggaaagatcgatgaaa,含ndei位点。p2:ccgctcgagtggtttgaatctcttctct,含xhoi位点,并去除终止密码子。以提取的thermotogapetrophiladsm13995的基因组dna为模板,用合成的引物进行pcr扩增,扩增的条件是95℃,5min;暂停计时,加pyrobest聚合酶,加40μl石蜡油密封;35次循环(94℃,50s;51℃,90s;72℃,1min);72℃,10min;反应停止,4℃保温。通过凝胶回收试剂盒对pcr扩增产物进行纯化。得到thermotogapetrophiladsm13995耐高温β-葡萄糖苷酶基因。
将得到的thermotogapetrophiladsm13995耐高温β-葡萄糖苷酶基因和pet-20b分别用ndei和xhoi进行双酶切,并分别割胶回收,浓缩后16℃连接过夜,将连接产物转化大肠杆菌jm109感受态细胞,筛选阳性克隆,进行序列分析;挑选序列正确的克隆提取质粒,获得含有耐高糖β-葡萄糖苷酶基因的重组质粒pet-tpebgl3。
3.1.4重组耐高温β-葡萄糖苷酶tpebgl3的制备
将重组质粒pet-tpebgl3-cbd转化大肠杆菌jm109(de3)宿主菌(novagen),在含有氨苄青霉素(50μg/ml)的lb平板(lb培养基:胰蛋白胨10g/l,酵母提取物5g/l,nacl5g/l,琼脂15g/l)上经过37℃培养过夜,挑转化子到200ml的lb培养基中(50μg/ml氨苄青霉素)37℃,200rpm振荡培养至od600为0.6时,加入终浓度为0.5mm异丙基β-d-硫代吡喃半乳糖苷(iptg)诱导剂,30℃培养6h,用高速冷冻离心机将培养液在4℃下,以13,000rpm离心15min,收集菌体。
由于重组质粒pet-tpebgl3中含有his-tag标签,通过hisbindpurificationkit(novagen)进行纯化,得到纯化的重组酶。具体操作过程:
a.样品的处理
(1)将洗涤过的菌体,用1×bindingbuffer8ml重悬,超声波破壁。
(2)破壁后,13,000g离心30min,取上清即为样品。
b.处理柱子
(1)取1ml填料装柱。
(2)用3ml的无菌水洗柱子。
(3)用5ml的1×chargebuffer洗柱子。
(4)用3ml的1×bindingbuffer洗柱子。
c.上样
(1)将样品加入柱子,控制流速约每分钟6滴。
(2)用3ml1×bindingbuffer洗柱子,除去未结合的蛋白质。
(3)用4ml含有20mm咪唑的洗脱液洗柱子,除去杂蛋白。
(4)用80mmol/l咪唑的洗脱液洗柱子,将目的蛋白洗脱下来。
(5)用4ml1×stripbuffer洗柱子。
通过此过程可得到纯化的重组β-葡萄糖苷酶tpebgl3。
3.1.5重组质粒ppiczαa-aterha78的构建
全基因合成并通过酵母密码子偏好性优化aspergillusterreusccf3059α-l-鼠李糖苷酶基因,将其连接到ppiczαa质粒上,获得的重组质粒命名为ppiczαa-aterha78。
3.1.6重组α-l-鼠李糖苷酶的制备
提取重组质粒ppiczαa-aterha78,经sacⅰ线性化后,采用电转化法将其导入pichiapastoriskm71h(novagen)中,筛选阳性克隆。接种在ypd培养基中进行活化后,转入bmgy培养基中继续活化,收集od600为2.0-3.0的菌体,转入到bmmy培养基中,置于30℃,180rpm摇床进行α-l-鼠李糖苷酶的诱导表达。每隔24h按照体积比0.6%向诱导的菌液中补加无菌的甲醇,培养15天后离心取上清得粗酶液。
重组蛋白的纯化:
(1)向粗酶液中加终浓度为80%的硫酸铵沉淀蛋白,离心弃上清,用ph7.550mmtris-hcl缓冲液溶解沉淀的蛋白;
(2)用ph7.550mmtris-hcl缓冲液于4℃下透析四次,每次8h,以去除盐溶液;
(3)将透析后的酶液加到装好的deaesff柱子中,用浓度20-300mm的nacl梯度洗脱;
(4)取合适浓度的nacl洗脱下的酶液,用ph6.510mmpb缓冲液于4℃下透析四次,每次8h,以去除盐溶液得纯酶。
3.2银杏茶饮品的制备
取产地为湖北安陆的银杏茶4g,精密称定,装入保温杯,加入95℃开水200ml保温15min,随后依次添加β-葡萄糖苷酶7.5u/ml和α-鼠李糖苷酶2u/ml,继续保温30min。过滤除渣,收集茶水,超滤,杀菌,获得茶饮料。同时设置不添加糖苷酶的对照。银杏茶饮品的常规制备过程同上,但没有添加糖苷酶过程,泡茶保温时间为45min。
3.3银杏茶香气物质的提取和测定
银杏茶保温结束,过滤除渣,收集茶水,并快速将茶水转移至分液漏斗中,盖好塞子,保持密闭环境。待茶水冷却,用乙醚萃取,于40℃沙浴上使乙醚挥发,直至溶剂不再减少,收集,备用。
气相条件:色谱柱为tr-5ms毛细管柱,柱温箱升温程序:50℃保持2min,20℃/min升高至260℃,维持5min;进样口分流,温度为250℃,载气:99.999%高纯度氦气,载气流速为1ml/min。
质谱条件:ei离子源,离子源温度为250℃,电离电压为70ev,接口温度为250℃,四级杆温度为150℃。
3.4银杏茶饮品中黄酮和内酯的含量测定
银杏茶保温结束,过滤除渣,收集茶水,用旋转蒸发仪将水溶液蒸干,用适量甲醇溶解后均分两份,一份直接用于hplc检测,另一份经甲醇-25%盐酸溶液(体积比4:1)混合液加热酸水解后用于hplc检测。使用agilent1260series高效液相色谱仪,分别检测黄酮(紫外检测器,uv)和内酯(蒸发光散射检测器,elsd)。
4.实验结果
4.1常规银杏茶饮品中黄酮和内酯的含量测定
市场随机购买4种品牌的银杏茶或银杏叶,按照3.2中的方法,将同一份茶叶冲泡3次后合并制备成银杏茶饮品,并收集茶叶渣。参照2015版《中国药典》中银杏叶总黄酮和内酯的测定方法,分别检测银杏茶叶、茶水和茶叶渣中的总黄酮和内酯含量。结果如图1和图2所示,银杏茶可浸出总黄酮含量约0.4~0.8%,总内酯含量约0.03~0.15%。按照3.3中的方法,测定茶饮品中香气物质的组成及含量,结果如表1所示,银杏茶饮品中的特征香气成分约占8~12%。
表1银杏茶饮品的特征香气成分
4.2糖苷酶的筛选
生物酶具有较强的专一性,复合酶在水解过程中又具有协同作用,为比较不同来源的糖苷酶选择性切断糖苷键能力的大小,实验选择了含量较多的典型的黄酮类化合物芦丁为底物。另一方面,银杏茶饮品在制备过程中,通常采用较高温度浸提。但目前大多数生物酶都存在不耐热和稳定性差的问题,特别是高温下很容易失活,所以应优选耐高温的生物酶。为此,实验比较在70℃、同等酶量的水相体系中,2.2中所述的6种糖苷酶将其转化为槲皮素的转化率。结果(表2)表明,选择tpebgl3和aterha78用于银杏茶饮品的制备可以实现最优转化效果。
表2两种糖苷酶的组合将银杏茶饮品中芦丁转化为槲皮素的转化率
4.3添加tpebgl3和aterha78对银杏茶浸出总黄酮含量的影响
在茶饮品的制备过程中,分别添加18u/mltpebgl3和5u/mlaterha78、90u/mltpebgl3和25u/mlaterha78,以不加tpebgl3和aterha78为空白对照,参照2015版《中国药典》,对银杏饮品的浓缩物进行酸水解,通过hplc检测并计算各银杏茶饮品中总黄酮的含量。结果(图3)显示,添加tpebgl3和aterha78制备的银杏茶浸出总黄酮含量显著提高。
4.4银杏茶饮品制备过程中糖苷酶添加量的优化
选定tpebgl3和aterha78用于银杏茶饮品制备后,以苷元生成量为标准,优化确定两种糖苷酶的最适酶用量。参照2015版《中国药典》中银杏黄酮的测定方法,分别检测银杏茶饮品中银杏黄酮的组成及含量。结果(图4)表明,银杏茶用量为2%时,β-葡萄糖苷酶tpebgl3的最适酶用量为7.5u/ml,α-鼠李糖苷酶aterha78的最适酶用量为2u/ml。
4.5单独添加和同时添加tpebgl3和aterha78及其添加顺序对银杏茶饮品中银杏黄酮含量的影响在茶饮品的制备过程中,分别单独添加tpebgl3和aterha78,先添加tpebgl3后添加aterha78。以不加tpebgl3和aterha78为空白对照,参照2015版《中国药典》,对银杏饮品的浓缩物进行酸水解,通过hplc检测并以黄酮苷元的生成量为标准,实验结果表明(图5),添加两种糖苷酶的效果显著优于仅添加一种糖苷酶,两种酶的添加顺序也对银杏黄酮转化有一定的影响,其中先添加tpebgl3后添加aterha78效果较好。
4.6添加糖苷酶后银杏茶释放的香气物质的变化
针对银杏茶香气物质成分及含量的研究结果表明,添加tpebgl3(β-g)和aterha78(α-r)后,银杏茶释放出的特征香气物质含量有所增加。如表3所示,添加两种糖苷酶冲泡后,茶水中醛类香气物质(如香草醛、对羟基苯甲醛等)以及醇类香气物质(苯甲醇、对羟基苯甲醇、苯乙醇、对羟基苯乙醇等)的含量均有提高,银杏茶释放的特征香气物质总量增加了2.64倍。
表3添加糖苷酶制备银杏茶饮品对其中香气成分的影响
实施例2
1.实验目的
考察在银杏茶制备过程中添加糖苷酶对茶饮品抗氧化、抗炎、抗肿瘤活性的改善情况。
2.实验材料
2.1受试样品
实施例1中提到的银杏茶及添加tpebgl3和aterha78后制备的茶饮品。
2.2细胞
人肝癌细胞hepg2,小鼠结肠癌细胞ct26,鼠腹腔巨噬细胞raw264.7购于中国科学院典型培养物保藏委员会细胞库。hepg2和ct26选用dmem(含10%胎牛血清)培养基,raw264.7选用1640(含10%胎牛血清)培养基,于37℃、5%co2条件下培养。
3.实验方案
3.1抗氧化活性检测
参照碧云天公司总抗氧化能力检测试剂盒(abts法)的说明,进行如下操作。配制abts工作液,向96孔板的每个检测孔中加入200μlabts工作液。空白对照孔中加入10μl蒸馏水;标准曲线检测孔内加入10μl各种浓度的trolox标准溶液;样品检测孔内加入10μl不同稀释倍数的银杏茶水,轻轻混匀。室温孵育2-6min后测定a734。以对照的a734为100%,计算各孔吸光值占对照的百分比数值。
3.2抗炎活性检测
参照碧云天公司一氧化氮检测试剂盒的说明,进行如下操作。取对数生长期raw264.7细胞,计数,以2×105/ml的密度接种于96孔培养板中,每孔100μl。培养24h后,以不同浓度的银杏茶饮品及500ng/mllps处理细胞。实验组每个浓度设3个复孔,以含dmso的培养液作对照。银杏茶水浓缩液作用48h后,吸取细胞上清100μl至酶标板中,加入混匀后的griess试剂100μl,显色10min后540nm处测吸光度。计算银杏茶对raw264.7释放no的抑制作用。
3.3抗肿瘤活性检测
在96孔板中每孔接种3000个细胞,放入37℃培养,待细胞贴壁6h后,每孔加入不同浓度的银杏茶饮品浓缩液培养72h,于实验终点前4h向每孔加入20μlmtt(4mg/ml),实验终点时取出96孔板,于1000rcf离心,然后吸去上清,加入200μldmso,570nm处测吸光值。根据以下公式计算待测样品对肿瘤细胞体外增殖的抑制率:
抑制率=[100-(od570(实验孔)-od570(空白对照))/(od(不加药对照空)-od570(空白对照)×100]%
4.实验结果
添加tpebgl3和aterha78制备后的银杏茶抗氧化活性、抗炎活性和抗肿瘤活性均有所提高
分别收集不添加和添加糖苷酶制备的银杏茶水,过滤除去杂质。将银杏茶饮品及其适当稀释后的样品用于总抗氧化活性(abts法)的测定,将银杏茶饮品浓缩到特定浓度后用于抗炎和抗肿瘤活性的测定。结果(图4)显示,银杏茶水本身具有一定的抗氧化、抗炎和抗肿瘤活性,添加糖苷酶后制备的银杏茶饮品,抗氧化、抗炎和抗肿瘤活性均得到不同程度的提高,且具有统计学意义。在同等饮用量下,本发明制备的银杏茶饮品与不运用生物酶制备的银杏茶饮品相比,抗氧化(1/4稀释)、抗炎(1.3mg/ml)和抗肿瘤(6.4mg/ml)活性的分别可提高约59%、175%和160%。
结论
本发明实施例公开了一种提高银杏茶饮品适口性和保健功效的制备方法。选用的两种糖苷酶均为耐热酶,在4g/200ml的泡茶体系中,β-葡萄糖苷酶tpebgl3的最适温度为85℃,最佳酶用量为7.5u/ml;α-鼠李糖苷酶aterha78的最适温度为65℃,最适酶用量为2u/ml。两种酶共同添加可以大幅度提高茶浸出银杏总黄酮、黄酮苷元和释放出香气物质的含量。活性研究结果表明,在银杏茶制备过程中加入tpebgl3和aterha78可以提高其抗氧化、抗炎和抗肿瘤的保健功效。综上结果表明,本发明采用的两种耐热糖苷酶制备银杏茶饮品,操作简单,功效显著,为银杏茶饮料的质量和功效提升提供了方法。
以上仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
sequencelisting
<110>南京林业大学
<120>一种提高适口性和保健功效的银杏茶饮料及其制备方法和应用
<130>
<160>2
<170>patentinversion3.3
<210>1
<211>28
<212>dna
<213>人工序列
<400>1
cgccatatgatgggaaagatcgatgaaa28
<210>2
<211>28
<212>dna
<213>人工序列
<400>2
ccgctcgagtggtttgaatctcttctct28
- 还没有人留言评论。精彩留言会获得点赞!