Shh信号通路抑制剂的新用途的制作方法
本发明属于生物医药领域,涉及Shh(sonic hedgehog)信号通路抑制剂的新用途,特别涉及Shh信号通路抑制剂—Vismodegib在治疗常染色体显性遗传性多囊肾中的应用。
背景技术:
Vismodegib是一种具有选择性Hedgehog信号通路抑制作用的新型口服类药物,已经由FDA批准用于治疗基底细胞癌。
Vismodegib有效抑制hedgehog通路,是一种新型及特定合成的小分子抑制剂,IC50为3nM。Vismodegib作用于Hedgehog信号通路,阻断Hedgehog配位体,即细胞表面受体PTCH及SMO的活性,从而阻断Hedgehog信号通路。在组织生长和修复方面,Hedgehog信号通路意义重大。Hedgehog通路信号的异常激活及不受控制的细胞增殖,可能与Hedgehog配位体,即细胞表面受体PTCH及SMO的突变有关。在体外,Vismodegib在不抑制胰脏细胞增殖的前提下阻止原代胰脏移植物的生长,这项结果最近已经应用到临床。Vismodegib也抑制ABCG2、P-糖蛋白,及和MDR有关联的重要MRP1ABC载体。Vismodegib也阻断其他多种ABC载体。ABC载体属于一个膜蛋白家族,它的过量表达和耐药性有关,这也是治疗癌症的一个重大障碍。Vismodegib强抑制两种ABC载体,ABCG2/BCRP和ABCB1/P-糖蛋白,也温和抑制ABCC1/MRP1。在ABCG2过量表达的HEK293细胞中,Vismodegib可以提高荧光ABCG2底物BODIPY-哌唑嗪的保持力,也可用米托蒽醌再次处理这些细胞,产生抗肿瘤的ABCG2底物。实验使Madin-Darby犬的肾脏细胞中过量表达P糖蛋白或者MRP1,Vismodegib提高了钙黄绿素-AM的保持力,然后载用秋水仙素处理这些细胞。另外,用米托蒽醌、托泊替康、SN-38处理的过量表达ABCG2的人类非小细胞肺癌细胞NCI-H460/par和NCI-H460/MX20,用Vismodegib再次处理。Vismodegib作用于ABCG2和Pgp的IC50值分别为1.4μM和3.0μM。Vismodegib改变细胞内Ca2+平衡,且作用于抗cisplatin的肺癌细胞,抑制细胞生长。
Vismodegib已经用于治疗动物模型的成髓细胞瘤。Vismodegib抑制原代胰腺移植瘤生长,但是不抑制细胞增殖。Vismodegib按25mg/kg以上剂量口服给药髓母细胞瘤Ptch(+/-)异体移植物模型,引起细胞衰退,按92mg/kg剂量处理两种配位体依赖的结肠直肠癌模型D5123和1040830,每天处理两次,抑制肿瘤生长。分析Hh通路活性和PK/PD模型显示Vismodegib抑制Gli1,IC50值与Vismodegib作用于髓母细胞瘤和D5123模型的IC50值差不多(分别为0.165μM±11.5%和0.267μM±4.83%)。
常染色体显性遗传性多囊肾(Autosomal Dominant Polycystic Kidney Disease,ADPKD)疾病是最常见的单基因遗传性肾病之一。其主要临床症状为双侧肾脏形成大量大小不等的球形液性囊肿,并进行性增大,破坏肾脏的结构和功能,最终导致肾功能衰竭。ADPKD通常在成人中发病,其发病率为1:400-1000,是目前世界上终末肾衰竭的第三大病因。除肾病表型外,ADPKD患者的非肾脏部位病变表型也十分明显:83%的ADPKD患者出现肝囊肿,16%的患者出现脑动脉瘤。其他病理表型包括主动脉根,胸部动脉异常,二尖瓣脱垂以及腹壁疝气。约50%的患者年满60岁后将出现终末肾衰竭。正常人的尿素氮(BUN)参考范围为2.14-7.14mmol/L,血肌酐(CRE)参考范围为44-133μmol/L,当血肌酐超过133μmol/L为炎症损伤期,超过186μmol/L为肾功能损伤期,超过451umol/L为肾功能衰竭期。
技术实现要素:
本发明的目的是提供Shh信号通路抑制剂的新用途。
本发明所提供的Shh信号通路抑制剂的新用途,可为Shh信号通路抑制剂在制备治疗常染色体显性遗传性多囊肾(ADPKD)的产品中的应用。
进一步,Shh信号通路抑制剂在制备如下任一产品中的应用也属于本发明的保护范围:
(1)减弱患病机体肾囊肿程度的产品;
(2)降低患病机体肾脏体重比的产品;
(3)降低患病机体血液中肌酐和/或尿素氮含量的产品
(4)降低患病机体肾脏纤维化程度的产品。
在本发明中,所述Shh信号通路抑制剂具体为Vismodegib。
所述患病机体为具有常染色体显性遗传性多囊肾(ADPKD)临床症状的机体,如常染色体显性遗传性多囊肾(ADPKD)患者。在本发明中,以Vil-Cre:Pkd2f3/f3小鼠作为ADPKD动物模型,即为具有常染色体显性遗传性多囊肾(ADPKD)临床症状的机体,上述(1)则具体表现为减弱Vil-Cre:Pkd2f3/f3小鼠的肾囊肿程度;上述(2)则具体表现为降低Vil-Cre:Pkd2f3/f3小鼠的肾脏体重比;上述(3)则具体表现为降低Vil-Cre:Pkd2f3/f3小鼠血液中的肌酐和/或尿素氮含量;上述(4)则具体表现为降低Vil-Cre:Pkd2f3/f3小鼠的肾脏纤维化程度。
本发明的再一个目的是提供一种产品。
本发明所提供的产品的活性成分为Shh信号通路抑制剂,该产品具有如下用途中的至少一种:
(a)治疗常染色体显性遗传性多囊肾;
(b)减弱患病机体肾囊肿程度;
(c)降低患病机体肾脏体重比;
(d)降低患病机体血液中肌酐和/或尿素氮含量;
(e)降低患病机体肾脏纤维化程度。
在本发明中,所述Shh信号通路抑制剂具体为Vismodegib。
所述患病机体为具有常染色体显性遗传性多囊肾(ADPKD)临床症状的机体,如常染色体显性遗传性多囊肾(ADPKD)患者。在本发明中,以Vil-Cre:Pkd2f3/f3小鼠作为ADPKD动物模型,即为具有常染色体显性遗传性多囊肾(ADPKD)临床症状的机体,上述(b)则具体表现为减弱Vil-Cre:Pkd2f3/f3小鼠的肾囊肿程度;上述(c)则具体表现为降低Vil-Cre:Pkd2f3/f3小鼠的肾脏体重比;上述(d)则具体表现为降低Vil-Cre:Pkd2f3/f3小鼠血液中的肌酐和/或尿素氮含量;上述(e)则具体表现为降低Vil-Cre:Pkd2f3/f3小鼠的肾脏纤维化程度。
在以上所述的各应用或产品中,所述产品具体可为药物。
以上所有的所述Vil-Cre:Pkd2f3/f3小鼠均按照包括如下步骤的方法构建得到:
(I)将Pkd2f3/f3小鼠(记载于“lngyu Kim,Tianbing Ding,Yulong Fu,et al.Conditional Mutation of Pkd2Causes Cystogenesis and Upregulatesβ-Catenin.J Am Soc Nephrol,2009(20):2556-2569”一文)与带有Vil-Cre重组酶的转基因小鼠(购自The Jackson Laboratory,Strain Name:B6.SJL-Tg(Vil-cre)997Gum/J,Stock Number:004586,详见网址:http://jaxmice.jax.org/strain/004586.html)进行杂交,得到F1代(其中理论上有1/2后代的基因型为Vil-Cre:Pkd2+/f3;1/2后代的基因型为Pkd2+/f3);
(II)将步骤(I)得到的F1代(Vil-Cre:Pkd2+/f3)与所述Pkd2f3/f3小鼠进行回交,得到回交后代;
(III)从步骤(II)得到的回交后代中筛选出Pkd2基因纯合,同时表达Vil-Cre的小鼠,即为Vil-Cre:Pkd2f3/f3小鼠。
其中,步骤(III)中所述“从步骤(II)得到的回交后代中筛选出Pkd2基因纯合,同时表达Vil-Cre的小鼠”,可按照如下方法实现:以所述回交后代的小鼠基因组为模板,采用针对Pkd2基因的引物(三条:5’-TCT GAC TTG CAG ACT GTG GG-3’,5’-AGG TAG GGG AAG GTC AGG GTT GG-3’,5'-TTTACGTCCAGCCAAGCT-3')和针对Cre基因的引物(两条:5’-CCA GGT TAC GGA TAT AGT TCA TG-3’,5’-TGC CAC GAC CAA GTG ACA GC-3’)分别进行PCR扩增;针对Pkd2基因进行PCR扩增得到大小为650bp的单一条带(Pkd2基因纯合),同时针对Cre基因进行PCR扩增得到大小为650bp的条带(表达Vil-Cre)的小鼠即为所述Vil-Cre:Pkd2f3/f3小鼠。
本发明以Vil-Cre:Pkd2f3/f3小鼠作为ADPKD动物模型,进行了Shh信号通路抑制剂—Vismodegib对常染色体显性遗传性多囊肾(ADPKD)治疗的效果研究,结果表明, Shh信号通路抑制剂—Vismodegib对于治疗常染色体显性遗传性多囊肾具有一定的效果,具体体现在:(1)可减弱Vil-Cre:Pkd2f3/f3小鼠的肾囊肿程度;(2)可降低Vil-Cre:Pkd2f3/f3小鼠的肾脏体重比;(3)可降低Vil-Cre:Pkd2f3/f3小鼠的血液中肌酐和/或尿素氮的含量;(4)可降低Vil-Cre:Pkd2f3/f3小鼠的肾脏纤维化程度。本发明对于常染色体显性遗传性多囊肾(ADPKD)发病机制的分析,对于治疗常染色体显性遗传性多囊肾(ADPKD)的药物的研发均具有重要意义。
附图说明
图1为回交后代小鼠基因型的PCR检测结果。其中,A为针对Pkd2基因PCR检测结果,Pkd2f3/f3为Pkd2基因纯合,Pkd2+/f3为Pkd2基因杂合;B为针对Cre基因的PCR检测结果,Vil-cre为表达Vil-Cre;WT为不表达Vil-Cre。
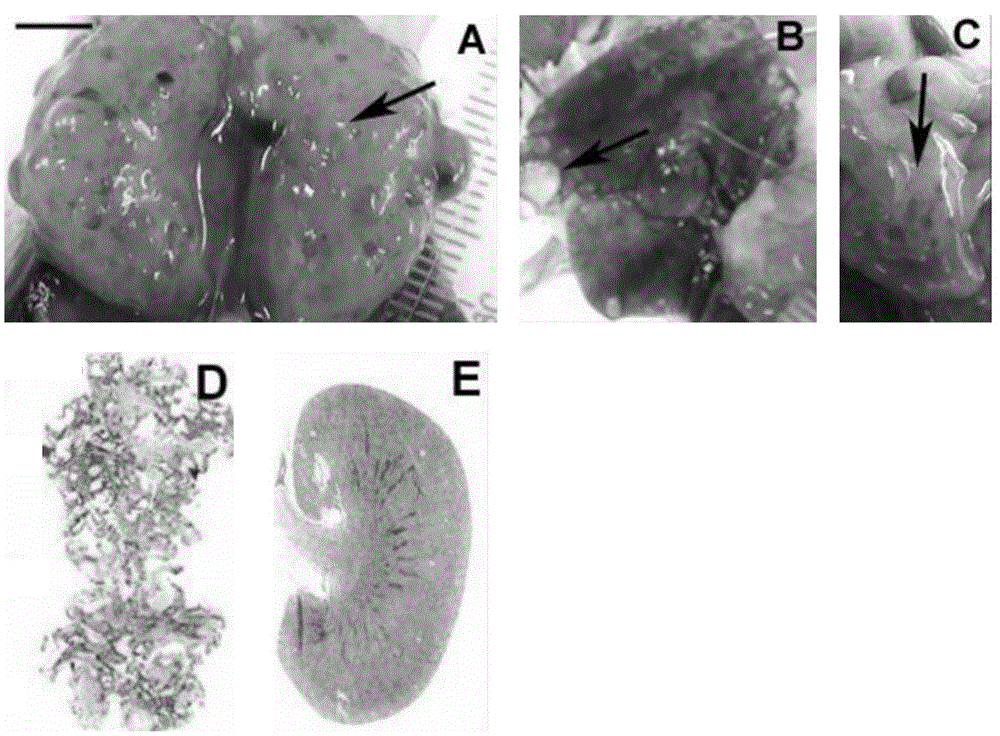
图2为Vil-Cre:Pkd2f3/f3小鼠模拟人类ADPKD的疾病表型。其中,A为Vil-Cre:Pkd2f3/f3小鼠肾脏形态;B为Vil-Cre:Pkd2f3/f3小鼠肝脏形态;C为Vil-Cre:Pkd2f3/f3小鼠胰腺形态;D为Vil-Cre:Pkd2f3/f3小鼠的肾脏横切面;E为Pkd2f3/f3小鼠的肾脏横切面。
图3为两组小鼠的肾脏HE染色结果。其中,A表示对照组;B表示治疗组。A和B中,1、2、3、4均表示两组不同个体小鼠的肾脏HE染色结果。
图4为两组小鼠的肾脏体重比测定结果。
图5为两组小鼠的血液中尿素氮(BUN)与肌酐(CRE)的含量测定结果。其中,A表示肌酐含量;B表示尿素氮含量。
图6为两组小鼠的肾脏纤维化程度测定结果。其中,A表示治疗组小鼠肾脏Masson纤维化染色结果;B表示对照组小鼠肾脏纤维化面积的比较;C表示对照组和治疗组小鼠肾脏纤维化面积的比较。
具体实施方式
下述实施例中所使用的实验方法如无特殊说明,均为常规方法。
下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
Pkd2f3/f3小鼠:记载于“lngyu Kim,Tianbing Ding,Yulong Fu,et al.Conditional Mutation of Pkd2Causes Cystogenesis and Upregulatesβ-Catenin.J Am Soc Nephrol,2009(20):2556-2569”一文中。其构建及鉴定过程大体如下:首先,在Pkd2基因的3号外显子两侧插入两个loxP位点,在阳性选择性Neo的两侧有FRT位点,由于该结构没有完全阻断正常Pkd2基因的表达,所以用这种载体通过基因打靶技术产生的Pkd2nf3小鼠可避免死于胚胎期。再将Pkd2nf3小鼠与ACTB-Flep小鼠杂交,即产生没有Neo元件的Pkd2f3/f3小鼠。鉴于在Pkd2f3/f3小鼠中没有观察到多囊表型,PC2的表达也没有发生改变,认为这种Pkd2f3等位基因不会导致Pkd2的表达失活。
带有Vil-Cre重组酶的转基因小鼠:购自The Jackson Laboratory,Strain Name:B6.SJL-Tg(Vil-cre)997Gum/J,Stock Number:004586,详见网址:http://jaxmice.jax.org/strain/004586.html。
Vismodegib(GDC-0449):Chemie Tek公司,产品目录号ctg0449。分子量:421.3;化学式:C19H14Cl2N2O3S;CAS号:879085-55-9;溶解性(25℃):DMSO 84mg/mL,水<1mg/mL,乙醇4mg/mL;稳定性:2年-20℃粉状,2周4℃溶于DMSO,6月-80℃溶于DMSO。
实施例1、Vil-Cre:Pkd2f3/f3小鼠模型的构建及鉴定
Vil-Cre:Pkd2f3/f3小鼠是利用Cre-loxP系统建立的可以条件性敲除Pkd2的小鼠模型,可产生与人类常染色体显性遗传性多囊肾(Autosomal Dominant Polycystic Kidney Disease,ADPKD)类似临床表型,并早期死于肾衰竭,可作为ADPKD动物模型。其构建及鉴定过程如下:
一、Vil-Cre:Pkd2f3/f3小鼠模型的构建
将Pkd2f3/f3小鼠与带有Vil-Cre重组酶的转基因小鼠(B6.SJL-Tg(Vil-cre)997Gum/J)进行杂交,得到F1代(理论上有1/2后代的基因型为Vil-Cre:Pkd2+/f3;1/2后代的基因型为Pkd2+/f3);将F1代中Vil-Cre:Pkd2+/f3小鼠(针对Cre基因进行PCR鉴定,具体方法参见下文,经鉴定得到大小为650bp目的条带的F1代小鼠)与Pkd2f3/f3小鼠进行回交,得到回交后代。
从以上所得回交后代中,筛选得到Pkd2基因纯合,同时可表达Vil-Cre的小鼠,具体操作如下:
提取回交后代鼠尾基因组,以其为模板,分别对Pkd2基因以及Cre基因进行PCR鉴定,其中针对Pkd2基因的PCR所用引物序列为如下三条:5’-TCT GAC TTG CAG ACT GTG GG-3’,5’-AGG TAG GGG AAG GTC AGG GTT GG-3’,5'-TTTACGTCCAGCCAAGCT-3';针对Cre基因的PCR所用引物序列为如下两条:5’-CCA GGT TAC GGA TAT AGT TCA TG-3’,5’-TGC CAC GAC CAA GTG ACA GC-3’。当采用针对Pkd2基因的三条引物在同一反应体系中进行PCR扩增时,如果得到大小分别为650bp和350bp的两个条带,则对应的回交后代小鼠为Pkd2基因杂合(Pkd2+/f3),如果得到大小为650bp的单一条带,则对应的回交后代小鼠为Pkd2基因纯合(Pkd2f3/f3);当采用针对Cre基因的两条引物进行PCR扩增时,如果得到大小为650bp的目的条带,则对应的回交后代小鼠表达Vil-Cre,如果没有得到大小为650bp的目的条带,则对应的回交后代小鼠不表达Vil-Cre。
结果如图1所示,图1中A中的Pkd2f3/f3为Pkd2基因纯合,图1中B中的Vil-cre 为可表达Vil-Cre。经过以上鉴定,从回交后代中得到的Pkd2基因纯合,同时可表达Vil-Cre的小鼠,即为Vil-Cre:Pkd2f3/f3小鼠。Vil-Cre为受控于Villin1启动子的Cre酶,其中villin1启动子表达于小鼠胚胎期第12.5天的肠上皮细胞,小鼠在Cre酶的作用下,可在细胞水平上产生Pkd2d3/d3,由于Pkd2d3/d3等位基因上的3号外显子已被剪切掉,进而产生移码突变,导致3号外显子下游不远处产生终止子,进而使Pkd2基因产物PC2成为截断蛋白。
二、Vil-Cre:Pkd2f3/f3小鼠模型的鉴定
常规饲养步骤一得到的Vil-Cre::Pkd2f3/f3小鼠,观察其存活状态。待小鼠四月龄,取其肾脏、肝脏、胰腺,观察病变情况;另外对肾脏进行HE染色分析(具体操作参见实施例2相关步骤)。同时设置Pkd2f3/f3小鼠作为对照。
结果显示:步骤一得到的Vil-Cre:Pkd2f3/f3小鼠在第4~5月左右死亡,其肾脏、肝脏、胰腺均出现严重的囊肿,而且肾脏的HE染色结果进一步表明肾脏无肾实质,肾功能严重受损,判定Vil-Cre:Pkd2f3/f3小鼠死于肾囊肿导致的肾衰竭,而同窝同龄的Pkd2f3/f3小鼠则表型正常。具体结果如图2所示。
以上结果表明,步骤一得到的Vil-Cre:Pkd2f3/f3小鼠表型与人类ADPKD患者相似,可作为ADPKD动物模型。
实施例2、Vismodegib在治疗常染色体显性遗传性多囊肾中的应用
本实施例以Vil-Cre:Pkd2f3/f3小鼠作为ADPKD动物模型,研究分析Vismodegib在治疗常染色体显性遗传性多囊肾中的应用。具体如下:
一、实验方法
1、实验分组及处理
Vismodegib溶液:将Vismodegib用DMSO溶解,至其浓度为80mg/mL,后用生理盐水稀释至2mg/ml。
分组及处理:分为治疗组和对照组,每组各10只Vil-Cre:Pkd2f3/f3小鼠。从小鼠出生后第十天开始,进行连续一周的皮下注射,后改为腹腔注射,每天给药直至小鼠两月龄停药,治疗组每只小鼠按50mg/kg(每kg体重给50mg Vismodegib)的剂量给药;对照组每只小鼠每天注射等体积的含有等量DMSO的生理盐水。
2、各组小鼠治疗情况分析
(1)HE染色分析两组小鼠的肾囊肿表型
在小鼠两月龄停药后,每组随机选取5只小鼠,处死后,摘除双侧肾脏。在电子天平上精确称重,计算肾脏体重比(g/g),即双侧肾脏重量(g)/体质量(g)。后将双侧肾脏沿着矢状面切开,用10%中性福尔马林溶液固定24小时,后梯度乙醇脱水, 然后用石蜡包埋机常规包埋,蜡块待后行切片及HE染色。
A.脱水包埋
具体步骤:①脱水:70%乙醇1h→75%乙醇1h→80%乙醇1h→85%乙醇1h→90%乙醇1h→95%乙醇1h→100%乙醇1h→二甲苯15min×2;②包埋:石蜡包埋机进行包埋。
B.切片
将肾脏蜡块在轮转式切片机上做成3μm厚度的连续肾组织切片,用毛笔轻轻扶起,在温水中将其充分展开,再用多聚赖氨酸处理过的玻片捞起肾组织切片,电热干燥机烤干,然后放于电热恒温鼓风干燥箱里中,70℃恒温烘烤1小时,以使组织切片与玻片紧密粘连,置于盒中备用。
C.HE病理染色
原理:苏木精(hematoxylin)染液为碱性,主要使细胞核内的染色质与胞质内的核糖体着紫蓝色;伊红(eosin)为酸性染料,主要使细胞质和细胞外基质中的成分着红色。
步骤:
①二甲苯脱蜡,后用100%乙醇洗去;
②不同浓度的乙醇依次水化;
③磷酸缓冲液摇床缓洗5分钟;
④苏木精浸提8次;
⑤流水冲洗5分钟;
⑥盐酸酒精浸提8次;
⑦流水冲洗2分钟;
⑧伊红染色10分钟;
⑨不同浓度的乙醇依次脱水;
⑩二甲苯透明,后用中性树胶封片;显微镜观察。
⑾结果显示:细胞浆红色,细胞核蓝紫色。
(2)两组小鼠ADPKD相关生化指标的测定
本发明的发明人为了准确反应出治疗组小鼠肾肝功能的改善程度,进一步对两组小鼠血液中尿素氮(BUN)与肌酐(CRE)的含量进行了测定,以此确切反应肾功能的变化情况,反映出囊肿的严重程度。具体操作如下:
在小鼠两月龄时,将实验组及对照组小鼠乙醚麻醉,从下腔静脉抽取小鼠血液,离心后获取上清即为血清。对血清进行化验即可测得肌酐及尿素氮含量。
(3)Masson染色分析两组小鼠的肾纤维化表型
在小鼠两月龄停药后,每组随机选取5只小鼠,处死后,摘除双侧肾脏。将双侧肾脏沿着矢状面切开,用Bouin氏液固定12小时,后流水冲洗一晚,梯度乙醇脱水,然后用石蜡包埋机常规包埋,蜡块待后行切片及Masson染色。Masson染色的肾脏切片拍照后计算纤维化面积。
A.Masson染色
原理:Masson染色时胶原纤维被苯胺蓝所染呈蓝色,肌纤维被酸性品红所染呈红色。
步骤:
①组织固定于Bouin氏液,流水冲洗一晚,常规脱水包埋;
②切片脱蜡至水;
③Weiger氏铁苏木素染5-10分钟;
④流水稍洗,1%盐酸酒精分化;
⑤丽春红酸性品红液染5-10分钟;
⑥蒸馏水稍冲洗,1%磷钼酸水溶液处理约5分钟;
⑦不用水洗,直接用苯胺蓝液复染5分钟;
⑧1%冰醋酸处理1分钟;
⑨95%酒精脱水多次;
⑩无水酒精脱水,二甲苯透明,中性树胶封固
⑾结果显示:胶原纤维呈蓝色,肌纤维呈红色。
B.纤维化面积计算
Masson染色的肾脏切片拍照后,图片运行于GNU Image Manipulation Program。调整图片像素至800×598。将调整后的图片运行添加网格程序,设定每个网格为大小为22×22像素。计算纤维化区域网格数量和肾脏区域总网格数量比例即可得到纤维化面积比例。
二、实验结果
1、两组小鼠的肾囊肿表型
HE染色结果如图3所示,从图中可以看出,治疗组较对照组具有更多的肾实质,且治疗组小鼠的肾囊肿表型明显少于对照组。另外,对治疗组与对照组小鼠的肾脏体重比(g/g)测定结果如图4所示,结果显示治疗组的肾脏体重比(g/g)显著小于对照组(p=0.0099),具有统计学意义。
2、两组小鼠ADPKD相关生化指标的测定
两组小鼠的血液中尿素氮(BUN)与肌酐(CRE)的含量测定结果如图5所示,结果显示,治疗组小鼠的血液中尿素氮(BUN)与肌酐(CRE)的含量较对照组相比, 均有下降趋势,其中尿素氮含量有显著差异,p=0.048。
3、两组小鼠的肾纤维化表型
两组小鼠的肾脏纤维化程度测定结果如图6中Masson染色结果所示。从图6中A和图6中B可以看出,治疗组较对照组纤维化程度明显降低。图6中C为对照组和治疗组小鼠肾脏纤维化面积的比较。从图6中C可以看出,治疗组小鼠的肾纤维化面积明显少于对照组(p=0.021),具有统计学意义。
综合本实施例的实验结果,可见Vismodegib在治疗常染色体显性遗传性多囊肾(ADPKD)中具有一定作用。
- 还没有人留言评论。精彩留言会获得点赞!