用于治疗乳腺癌的方法和组合物与流程
相关申请的交叉引用
本申请要求2014年9月25日提交的南非临时专利申请2014/06975的优先权,其通过引证并入本文。
本发明提供了用于乳腺癌治疗的植物提取物。
背景技术:
乳腺癌是全球女性中最常见的癌症,占2012年诊断的新病例总数的25%以上(ferlay等,2013)。在南非,到2050年,发病率预计将达到目前水平的六倍,非洲的总死亡率是世界上最高的(bateman,2012)。
然而,目前使用的标准癌症疗法大大损害了正常细胞的稳态,从而限制了其临床有效性(gerl,2005)。蒽环霉素多柔比星(dox)是用于治疗乳腺癌和各种其他癌症的最有效的抗肿瘤药物之一(octavia等,2012)。然而,其临床有效性由于其副作用而受限,其副作用包括累积的和剂量依赖性心脏毒性(gharib和burnett,2001;takemura和fijuwara,2007;zhang等,2009)。此外,癌细胞对常规治疗变得越来越耐抗。
因此,需要开发具有靶向乳腺癌肿瘤细胞而不伤害正常细胞的能力并且规避化学抗性表型的新型治疗策略。
技术实现要素:
根据本发明的第一实施方式,提供了用于乳腺癌治疗的车桑子(dodonaeaviscosa)提取物。
提取物可以来自植物的叶子或根部。
植物提取物可以使用水和/或如二氯甲烷、己烷、石油醚、氯仿、己烷、丙酮、甲醇、乙醇、异丙醇、乙酸乙酯、二甲基亚砜、丁醇、甲苯、甲酸或乙腈的有机溶剂得到。例如,可以使用水/乙腈/甲酸混合物作为溶剂得到提取物。
提取物可以是植物的全部提取物。或者,提取过程可以进行一个或多个分离步骤,以便从提取物中去除对乳腺肿瘤细胞没有活性的化合物。
提取物可以与其他抗癌剂一起使用,例如药物组合物(例如化学治疗剂)。提取物可以是其他抗癌剂的辅助物。提取物和其它抗癌剂可以单独或一起施用。
提取物可以来自车桑子l.jacq.、车桑子亚种angustifolia、车桑子亚种angustissima、车桑子亚种burmanniana、车桑子亚种cuneata、车桑子亚种mucronata或车桑子亚种spatulata。更优选地,车桑子是车桑子l.jacq.,甚至更优选地,车桑子植物来自斯泰伦博斯地区。
根据本发明的第二个实施方式,提供了一种用于乳腺癌治疗的组合物,该组合物包含如上所述来自车桑子的提取物和一种或多种药学上可接受的赋形剂和/或佐剂。
组合物可以是口服给药制剂的形式,例如胶囊、片剂或液体。
根据本发明的第三个实施方式,提供了如上所述提取物在制备用于乳腺癌治疗的药物的方法中的用途。
药物可以包括提取物和一种或多种药学上可接受的赋形剂和/或佐剂。
根据本发明的第四个实施方式,提供了一种用于制备用于乳腺癌治疗的具有抗乳腺肿瘤细胞活性的植物提取物的方法,该方法包括以下步骤:
干燥车桑子的材料;
粉碎干燥的材料;
将粉碎的材料与溶剂混合,使得来自所述材料的化合物溶解到溶剂中;和
将粉碎的材料从溶剂中去除,使得植物提取物保留在溶剂中。
材料可以是车桑子的叶或根材料。
溶剂可以选自水和/或有机溶剂,例如二氯甲烷、己烷、石油醚、氯仿、己烷、丙酮、甲醇、乙醇、异丙醇、乙酸乙酯、二甲基亚砜、丁醇、甲苯、甲酸或乙腈。例如,可以使用水/乙腈/甲酸混合物作为溶剂来得到提取物。
提取物可以配制成口服剂型,例如胶囊、片剂或液体。
根据本发明的第五实施方式,提供了一种治疗乳腺癌的方法,该方法包括向有需要的受试者施用治疗有效量的如上所述提取物或组合物。
提取物或组合物可以口服给药到受试者。
提取物或组合物可以与如化学治疗剂或其它药物组合物的其他抗癌剂一起施用。
附图说明
图1示出从斯泰伦博斯(左)、德霍普(中间)和赛德堡(右)收集的车桑子照片。由carlorandall先生拍摄;
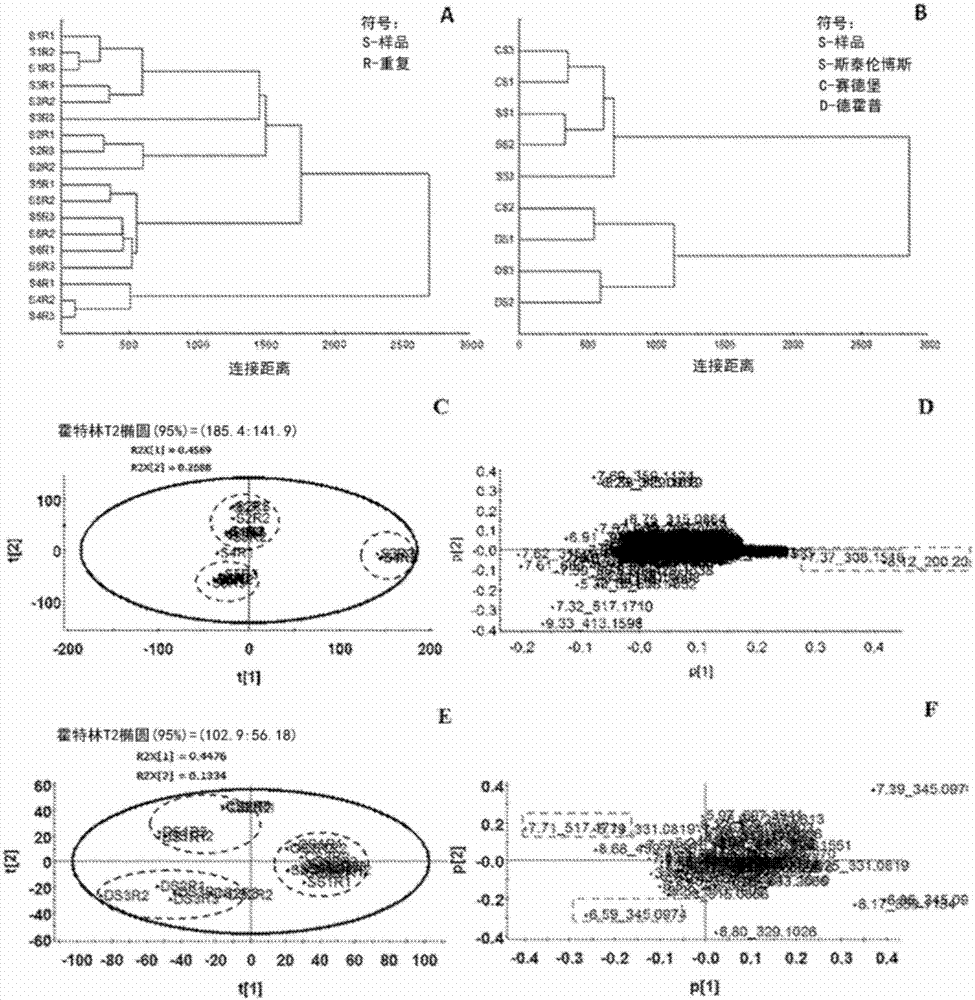
图2示出了(a)德霍普收集的样品的种群内化学变异的分级聚类和(b)来自德霍普、斯泰伦博斯和赛德堡的样品的种群内化学变异。来自德霍普样本1到6的种群内研究的数据的pca评分(c)和载荷图(d)。来自德霍普、赛德堡和斯泰伦博斯的种群内研究的数据的pca评分(e)和载荷图(f)。d=德霍普;s=斯泰伦博斯;c=赛德堡;s=样品;r=重复;
图3示出了来自德霍普的样品5(a)、4(b)和1(c)的色谱图,说明导致簇形成的代谢物分布差异。
图4示出了来自德霍普(a)、赛德堡(b)和斯泰伦博斯(c)样品的色谱图,说明导致簇形成的代谢物分布差异。
图5示出了斯泰伦博斯中细胞毒性研究的mtt测定,显示了经下列浓度2.1、4.2、8.3、16.7、25和41.6mg/ml的提取物和dox(1μm)处理24小时后,不同浓度(2.1、4.2、8.3、16.7、25和41.6mg/ml)车桑子提取物和dox(1μm)对mda-mb-231细胞(a)和mcf-12a细胞(b)的mtt还原能力的影响。来自代谢组学研究的mtt测定显示2.1mg/ml取自不同群的车桑子提取物对mcf-12a细胞(c)和mcf-7细胞(d)mtt还原能力的影响。dmem用作对照,乙醇用作载体对照。所有值均表示为平均值±sem(n=3),相对于对照*p<0.05,**p<0.01,***p<0.001。dox=多柔比星;s4=来自德霍普的样品4;ss1=来自斯泰伦博斯的样品1;cs2=来自赛德堡的样品2;ds1=来自德霍普的样品1;
图6示出了dox和车桑子处理7天对肿瘤体积(a)和接种处理后小鼠体重(b)的影响。数值表示为平均值±sem(n=3),p<0.05;
图7示出mda-mb-231细胞中相对量化的裂解半胱天冬酶-3(a)、裂解parp(b)、磷酸-p53(c)的体外蛋白质印迹分析。用dox或车桑子处理小鼠7天后的phospho-ser15-p53(d)(表示为phospho-ser15-p53与总p53的比例)。数值表示为相对于对照组(n=3)的成倍增加。ns-不显著(p>0.05),与对照组相比*p<0.05。
具体实施方式
本文描述了用于治疗乳腺癌的车桑子,其独立地或在其它乳腺癌治疗之外使用。例如,提取物可以用作癌症治疗(例如化疗处理)的辅助物。
车桑子是南非西开普省的研究较少的植物之一。它属于无患子科(getie等,2003)。有七种已识别的亚种,即车桑子亚种angustifolia、车桑子亚种angustissima、车桑子亚种burmanniana、车桑子亚种cuneata、车桑子亚种mucronata、车桑子亚种spatulata和车桑子亚种viscosa(车桑子l.jacq).。亚种之间存在的主要差异是形态和叶子特征和地理分布(图1)(mcdowell,2009)。该植物是热带和亚热带地区沙壤土中常见的常绿灌木(naidoo,2012)。一般来说车桑子含有皂苷、二萜和三萜、类黄酮和其他酚类化合物的复杂混合物。鉴于此,这种药草中观察到的任何治疗活性很可能与来自许多组分的协同组合而不是任何单独的孤立组分的多价药理作用相关(wagner,2005)。
来自车桑子l.jacq的根提取物已经用于治疗各种疾病的传统药物。澳大利亚土著居民已经使用车桑子作为传统治疗方法来治疗牙痛、割伤和黄貂鱼刺伤(mcdowell,2009)。车桑子的最近研究还表现出免疫调节(jagtap等,2011)和对a2780人类卵巢癌细胞系的抗增殖活性(cao等,2009)。最近,rashed等人(2013)发现车桑子的石油醚提取物具有潜在的抗hiv-1药剂活性。
在这项研究中,代谢组学方法用于评估车桑子种群内差异,因为草药提取物的活性受环境的影响。植物提取物的作用在非侵入性雌激素受体阳性人类癌细胞系(mcf-7)、转移性雌激素受体阴性人类癌细胞系(mda-mb-231)和正常乳腺上皮细胞系(mcf-12a)中表征,然后在荷瘤小鼠模型中体内检测其抗肿瘤作用。
提取物可以来自植物的任何部分,例如叶、根、果实或种子。在本发明的一个具体实施方式中,提取物来自叶。可以使用有机溶剂和/或水来得到植物材料的提取物。合适的有机溶剂包括二氯甲烷、己烷、石油醚、氯仿、己烷、丙酮、甲醇、乙醇、异丙醇、乙酸乙酯、二甲基亚砜、丁醇、甲苯、甲酸和乙腈。
提取物可来自任何车桑子亚种,即车桑子l.jacq.、车桑子亚种angustifolia、车桑子亚种angustissima、车桑子亚种burmanniana、车桑子亚种cuneata、车桑子亚种mucronata或车桑子亚种spatulata。在一个具体实施方式中,提取物来自车桑子l.jacq.。在另一个实施方式中,提取物来自南非(开普省酒乡直辖市)的斯泰伦博斯地理区域。
现在将参考以下非限制性实施例更详细地描述本发明。
实施例
方法和材料
植物材料和野外采集
对于细胞毒性研究,由开普省灌木医生协会(cbd)的成员在2012年4月20日从斯泰伦博斯山(33°93'614”s,18°,86',019”e)的最高斜坡收集了车桑子样品。cbd是交易、管理和/或利用植物药物的集体代表成员的非营利组织。他们自己的本地知识(i.k.)基于khoi-san实践(philander,2012)。
对于代谢组学研究,样品在2013年4月至5月期间在三个不同部点从车桑子种群收集。该研究与开普省灌木医生协会合作,且该组织成员协助植物收集。在第一个种群中,收集了6个样本以测试种群内的变异:将样品等分,以在两个不同高度取样。使用三个种群中的九个样本来分析种群间变异。从开普自然协会(capenature)获得收获濒危植物的许可证(许可证号:0028-aaa008-00095),以在斯泰伦博斯山、赛德堡山流域和德霍普自然保护区采集植物。
鉴定植物物种并将它作为凭证标本在斯泰伦博斯大学植物标本馆存放。样品在40℃干燥后保存,并在植物学和动物学系(斯泰伦博斯大学)避光保存。
提取步骤
种群化学型代谢组学研究
在初始筛选中,将二十克植物粉碎并用三种不同的溶剂萃取:甲醇,水,49.5%水:49.5%乙腈:1%甲酸混合物(w:a:f;v/v)。许多溶剂因为其提高提取物产率的能力而被广泛使用,且水提取是制备传统药物的常规方法。每克植物材料加入10ml溶剂。将每个提取物置于超声浴中45分钟,然后用whatman1号滤纸过滤这些提取物。提取过程重复两次。然后将提取物在真空离心蒸发器
体外和体内细胞毒性研究
提取过程与代谢组学研究相同,但为了本研究的目的,使用乙醇作为溶剂。萃取后,将样品冷冻干燥。冷冻干燥得到3.35g提取物,将其储存在干燥器中。将提取物溶于100%乙醇中并悬浮于生长培养基中以得到50mg/ml的物料浓度(naidoo,2012;pengelly,2008:4)。提取物制剂中的乙醇浓度限制在1.7%,以尽量减少溶剂对细胞生长的潜在影响。
植物提取物的代谢物分析
将干燥的提取物重悬于100%(v/v)甲醇中以得到50mg/ml的物料浓度(naidoo,2012;pengelly,2008:4),然后交替涡旋1分钟,超声处理10分钟直到完全重悬。
用液相色谱质谱(lc/ms)测定不同溶剂提取作用,来评价这些溶剂。对于种群内变异分析,对来自德霍普的六个样本进行了近亲种群个体变异测试。对于种群间变异分析,从每个种群抽取了三个样本,总共9个样本用于测试种群间化学变异。色谱分离和测定是在装有watersacquity超高效液相色谱(uplclg50nm)、acquity光电二极管阵列(pda)检测器和自动采样器的waterssynaptg2四极飞行时间质谱(milford,ma,usa)上进行的。在watersbehc18,2.1×100mm柱上以0.4ml/min流速的watersuplc,使用具有0.1%甲酸(溶剂a)和乙腈(溶剂b)的h2o梯度分离代谢物。每个样品重复注射三次,每次运行15分钟。采用15v的锥电压和2.5kv的毛细管电压下的正负模式用于分析物的质量分离。
生理学研究
细胞系
对于斯泰伦博斯种群的细胞毒性研究,使用人类转移性乳腺癌细胞系(americantypeculturecollection,rockville,usa)mda-mb-231和人非致瘤性乳腺上皮细胞系(universityofcapetown)mcf-12a。细胞系在补充有10%胎牛血清(invitrogengibco,10270-106)和1%penstrep(invitrogengibco,15140-122)的无菌dulbecco改进的eagle培养基(dmem)(sigma-aldrich,d5796)中在37℃和5%co2下培养。将细胞等分至50ml离心管中。在mcf-12a细胞系中进一步补充(一天用量)50%营养物ham-f12(invitrogengibco,21765-029)、500ng/ml氢化可的松(sigma-aldrich,h0888)、10μg/ml胰岛素(药用)、100ng/ml霍乱毒素(sigma-aldrich,c8052)和20ng/ml表皮生长因子(egf)(invitrogengibco,10450-013)。细胞系最初在t75烧瓶中的5ml生长培养基中生长,达到所需的融合(70-80%)后,通过与trypletmexpress(invitrogengibco,12604-013)培养来传代细胞。
对于种群化学型研究,使用人乳腺癌细胞系(americantypeculturecollection,rockville,usa)mcf-7和mcf-12a。按照与上述相同的过程将这两种细胞系培养在24孔板中。一旦达到所需的融合(70-80%),通过与胰蛋白酶edtatm(lifetechnologies)培养来传代细胞。
分裂和接种细胞
当达到约80%的融合时(20倍物镜下观察),细胞分裂。生长培养基、trypleexpress/胰蛋白酶edta和pbs在37℃水浴中加热。弃去旧的培养基,细胞单层用pbs冲洗一次。然后弃去pbs,加入4mltrypleexpress,将细胞置于震荡培养箱中约4分钟。对于胰蛋白酶,用两倍量的培养基中和细胞。一旦细胞松动,将容纳物转移到离心管中,然后以1500rpm离心3分钟。倾析出上清液,只剩下一团细胞。将4ml温培养基加入细胞团中并轻轻重悬(使用1000μl移液管)。使用血细胞计数器计数重悬细胞。分裂和播种后,将细胞粘附48小时,然后再更换培养基。
细胞系的处理
一旦达到所需的融合,重新更换培养基。将提取物溶解在100%etoh和完全培养基中至50mg/ml的终浓度。将溶液涡旋,然后以1500rpm离心3分钟,然后将上清液转移到新管中,弃去沉淀。对于斯泰伦博斯种群的细胞毒性研究,用不同浓度的提取物(2.1、4.2、8.3、16.7、25和41.6mg/ml)处理细胞,并在37℃下培养24小时。此外,将1m多柔比星(dox)(sigma-aldrich,d1515)加入到mcf-12a和mcf-7细胞中,并用作比较性癌症治疗。使用含有乙醇的载体对照物来确定溶剂是否对细胞生长和/或活力有任何影响。种群化学型的代谢组学研究遵循了相同的过程,但是以2.1mg/ml的标准浓度(最终浓度为0.7%的etoh)处理细胞。
mtt细胞活性测定-体内和体外细胞毒性研究
将细胞在96孔板中以约8×103个mcf-12a细胞和5×103个mda-mb-231细胞的密度进行培养,并使其在100μl生长培养基中增殖。一旦融合,弃去旧的培养基,用pbs冲洗细胞单层,在处理开始后更换培养基。处理后,弃去培养基,向各孔中加入50μl的mtt(sigma-aldrich,m2128)工作溶液(0.01gmtt/500μlpbs)和150μlpbs,并在37℃下培养1小时。培养后,小心吸出上清液,并向每个孔中加入200μl异丙醇-hcl/triton-x-100(50:1)溶液。将样品在振荡器上轻轻搅拌5分钟以溶解甲
体内模型
重16-21g的八周龄雌性c57bl6小鼠(tygerbergbreedingfacility)在斯泰伦博斯大学生理系的动物舍中的ehret笼子(emmedingen,德国)中以6-8只一组饲养。环境温度和湿度可控,且伴随12小时明/暗循环。这部分研究按照斯泰伦博斯大学的用于护理和使用实验动物的指南进行。小鼠喂食标准食物且可随意饮食。将小鼠随机分为(i)对照组、(ii)dox组和(iii)植物提取物组,记录初始重量。
肿瘤构建
鼠转移性乳腺癌细胞系(e0771)由fengzhili(roswellparkcancerinstitute,newyork,usa)赠送。以与mda-mb-231细胞相同的方式维持这些细胞。一旦达到70%融合,使用23号针将体积为200μl的2.5×105个细胞皮下注射到下腹部,接近或在每只小鼠的第四个乳腺脂肪垫(方案来自ewens等人,2006)中。三周后肿瘤变得明显,此时测量肿瘤大小。
小鼠治疗
在给小鼠称重和分组后,开始使用车桑子提取物进行处理。每两天通过使用数字卡尺在两个垂直维度上进行测量来测量肿瘤大小。车桑子提取物通过覆盆子风味的果冻块施用。小鼠在治疗开始前四天适应果冻的味道。使用人体用量(5.24mg/kg/天)和km因子,基于体表面积的剂量转化以计算待施用的动物剂量(reagan-shaw等人,2007)。在治疗当天,将小鼠放在单独的笼中,并在每天黄昏时给予1厘米×1厘米的果冻块,每块果冻注射有146μl提取物(0.065毫克/克平均体重),持续7天。在最后一次治疗后的第二天,通过斩首处死小鼠,之后获得肿瘤并在-80℃冷冻直至需要。
蛋白质印记分析
在24小时治疗期后,从细胞中提取蛋白质。吸出培养基并将烧瓶置于冰上。用冰冷的pbs冲洗细胞单层三次。通过将细胞在300μl经改变的放射免疫沉淀(ripa)缓冲液(ph7.4)中培养±10分钟来提取全细胞蛋白质,缓冲液(t25)含有:tris-hcl2.5mm、edta1mm、naf50mm、nappi50mm、二硫苏糖醇1mm、苯甲基磺酰氟(pmsf)0.1mm、苯甲脒1mm、4mg/mlsbti、10mg/ml亮抑酶肽、1%np40、0.1%sds和0.5%脱氧胆酸钠。使用无菌橡胶淀帚刮掉细胞单层,并转移至冷冻的微量离心管中。使用超声波液体处理器对全细胞裂解物进行超声处理。然后将细胞裂解物在室温下以8000rpm离心10分钟,其后使用bradford方法(bradford,1976)测定每个裂解物的蛋白质含量。制备蛋白质样品并储存在-80℃直至需要。通过从每个肿瘤切下一小块并将其放入具有1mlripa和5μlpmsf的试管中来从肿瘤中提取蛋白质。然后将样品均化并放在冰上沉降泡沫,然后以8000rpm消旋10分钟,其后将上清液置于干净的微量离心管中。提取后,用bradford方法(bradford,1976)测定蛋白质含量,并储存于-80℃直至分析。
将准备的样品解冻,然后在95℃下煮沸5分钟,然后离心几秒钟。将20μg蛋白质加载到4-15%tris-甘氨酸预制凝胶(bio-rad,4561085)的孔中,并通过十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sds-page)在250v,400ma下分离25分钟。将blueye预染蛋白阶梯(genedirex,pm007-0500)装载到每个凝胶的第一个孔中以确定特定条带的分子量并使凝胶定向。在15v,2.5a下使用
数据分析
每个样品三种不同的提取物使用lc/ms分析并绘图。多变量统计用来分析lc/ms分析后获得的所有代谢组学结果。应用pca来识别对不同组的分离有重要影响的特征成分。因此,该方法不仅在样本中有效地区分,而且特征成分的鉴定提供了新的有效的化学标记,这些标记已经被提出用于车桑子样品的鉴别和质量控制。分级聚类分析(hca)也被应用,以将复杂数据集减少到一系列优化的和可理解的视图。hca提供了一个有洞察力的方法来查看大型数据集以方便理解。这些观点强调数据中的自然分组,并显示哪些变量最强烈地影响这些模式,从而允许识别用于此效应的配方的可能的主成分。因此,hca本质上用于通过测量样品之间的相似性将样品分组。样本之间的相似性和差异性以树形图表示以方便理解。
对于测试细胞活性的mtt测定,进行三次重复以测试可重复性。用于
结果与讨论
不同种群的代谢物分析
w:a:f和甲醇提取物得到相似的代谢物曲线(图4)。为了进一步的实验,因为甲醇在干燥和储存期间可能导致化学酯化,所以使用w:a:f。因为水提取得到的化学物质与其他溶剂相比较少,没有测试水提取物的进一步药理作用。此外,醇制酊剂在植物药剂行业中很受欢迎。来自德霍普的样品(图2a)使用hca根据高度进行区分。来自斯泰伦博斯和赛德堡的样品的聚类表明化学相似性,而来自德霍普的样品形成了独特的一组。德霍普样品的种群内差异明显,表明竞争和高度(例如温度和风的差异)可能会影响次级代谢。有几项研究说明热带植物中沿着高度相关的生态梯度的基于化学的适应性(goldstein等,1985;ziska等,1992;rada等,1998;cabrera等,1998)。alonso-amelot等(2004)指出,与高度相关的新型热带蕨菜(蕨类植物)中的低分子量酚类物质的合成可能是对生物和适应性压力的综合响应。植物天然产物特别是与生物环境相互作用时具有关键作用。他们吸引传粉者或种子分散器,保护植物对抗天敌或作为针对竞争对手的化感物质(kroymann,2011)。
pca模型由5个部分组成。图中解释了种群内分析中86%的差异(r2(pc1)=0.4589;r2(pc2)=0.2688(图2c))和种群间分析中的65%的差异(r2(pc1)=0.4476;r2(pc2)=0.1334(图2e))。来自德霍普的样品形成了三个簇。来自德霍普的s3和s4分子量分别为308.1518和200.20(图2d和3),在保留时间7.37和8.12时分别具有鉴别峰。在种群间研究中,ds3r2和ds1分子量分别为345.09和517.17(图2f和4),在保留时间6.59和7.71时表现出差异。
位于namakaroo的赛德堡在中部地区呈现典型的地中海气候(温和,潮湿的冬天和温暖的夏天),而西部和东部地区更干。沿海的年降水量从100毫米不等上升到西部山脉的400毫米,再到中部的最高山脉的700毫米以上(low等,2004:8)。由于地形变化,气候条件范围很广。在冬季,最低温度范围为-3至3℃,有时会在高山上发生严重的霜冻,而夏天的温度可能会升高到39-44℃。斯泰伦博斯有地中海气候,最近年降水量为993.9毫米(lacolline天文台,斯泰伦博斯气象台,2014)。冬季寒冷潮湿,七月份气温可能会下降到3.02℃,周围的山上会有降雪。夏天是温暖和干燥的,温度几天上升到大约40℃(meijers,j.p.,2014)。斯泰伦博斯也容易受到人为的干扰。德霍普自然保护区离海岸不远。它具有温和的地中海气候,具有温暖的夏季和温和的冬季,7月份最低气温约为6摄氏度,1-2月最高气温为27℃。年降雨量约为564毫米,降雨量通常在四月/八月最高(欧盟,2010a)。这些环境条件的差异很重要。
自然的次级代谢具有非常高的遗传可塑性和多样性,使植物能够灵活适应动态环境的困难。在每个植物种群中发现了独特的一系列对植物生态位的特定菌株适应良好的次级化合物(hartmann,2007)。与德霍普相比,赛德堡和斯泰伦博斯的冬季更为寒冷和潮湿,且这两个地方位于内陆地区。这些生态差异可以解释导致德霍普簇在主成分1(pc1)负向量上分离的化学特征的差异(图2e)。分析鉴定峰上的感兴趣的化合物,并将其与报道的ms数据(yagudaev等,1968;shakirov和avazmukhamedov,1969年;sultanov等,1969)和massbank数据库(horai等,2010)(表1)进行比较。
mtt细胞活性测定-体内和体外细胞毒性研究
不同剂量处理后,使用mtt测试研究了来自斯泰伦博斯的车桑子的酒精提取物对mda-mb-231细胞活性的影响(图5a)。处理24小时后,与dox(47.88±0.83%,44.33±0.73%,50.10±0.39%,62.30±1.94%,70.04±0.87,p<0.001)和对照组(100%)相比,除41.6mg/ml以外的所有浓度均有效降低mda-mb-231细胞系的活性。出乎意料的是,在41.6mg/ml的最高剂量时,提取物诱导细胞增殖(112.7±4.74%,p<0.01)。与对照组相比,商业上使用的dox也降低了细胞活性(89.77±1.23%,p<0.01),但不如浓度为2.1至25mg/ml的车桑子提取物有效。结果显示(图5b),当施用2.1至8.3mg/ml时,提取物对mcf-12a细胞的生长具有相似的作用(p<0.01)。与对照组和所有剂量的提取物相比,用dox处理导致细胞活性极大的降低(75.58±1.26%,p<0.001)。与dox相比,车桑子对乳腺癌细胞的细胞毒性明显更高,但对正常细胞的细胞毒性却较低,因此表明浓度为2.1到4.2mg/ml的车桑子提取物对乳腺癌细胞的效力最好,同时对非癌细胞几乎没有伤害。
表1:使用ms/ms方法暂时确定的感兴趣化合物的保留时间和离子碎片
mtt细胞活性测试–种群化学型的代谢组学研究
对于mcf-12a细胞系(图5c),没有一个样品在经24小时处理后显著降低了细胞活性(114±4.67%,110±3.01%,101±6.33%和92.7±2.02%,p>0.05)。来自德霍普的样品1和样品4对于mcf-12a和mcf-7细胞系(bonferroni的多重比较试验)的还原能力有显著差异。这些差异证实了来自德霍普的样品4和样品1的分组为单独的簇。化学成分的差异与体外药理活性相关。在所有测试的样品中,斯泰伦博斯提取物在mcf-7细胞系的生长中产生最显著的降低频率(图5d)(84.9±2.35%,p<0.05)。几项研究表明了研究用于抗癌细胞毒性作用的草药疗法的重要性。据报道,苦瓜提取物对mda-mb-231有效(ray等,2010)。南非醉茄的叶提取物也显示出对癌细胞的选择性细胞毒性(widodo等,2007)。浓度较低时,车桑子提取物在mda-md-231细胞系中很有效,且对正常mcf-12乳腺上皮细胞系毒性很低(图5a和5b)。车桑子已经显示出对癌症有效(cao等,2009),但这是首次对乳腺癌细胞系显示出这种活性。由于疾病的性质和/或在植物提取物中表现出癌症抑制的化学物质,对不同癌症的作用可能是物种依赖性的。众所周知,在包括车桑子的许多植物中发现的多酚化合物因为它们的自由基清除活性而具有抗氧化性质(fiorentino等人,2007;pietta,1999;wang等人,2004)。如在许多其他植物(saleem等,2002)中,类黄酮,一种多酚类化合物,是车桑子中最丰富的化合物之一(cao等,2009;venkatesh,2008)。然而,这些类黄酮也在hl-60早幼粒细胞白血病细胞中表现出促氧化诱导的毒性和细胞凋亡(sergediene等,1999;saleem等,2002)。
类黄酮在水性介质中自动氧化并可形成高反应性的基团。hirano等人的一项研究(1995)发现柑橘类黄酮诱导hl-60细胞凋亡,wei等(1994)证实,在几种细胞系中,类黄酮引起细胞凋亡相关的细胞形态学变化。类黄酮诱导的对几种癌细胞系的抗增殖作用或细胞凋亡与磷脂酰肌醇3-激酶(pi3k)抑制、细胞周期阻滞和p53积累有关(sergediene等,1999)。细胞凋亡受pi3k和akt信号的负调节。这些途径容易结合几种生存因子(kasibhatla,2003),因此pi3k/akt的抑制将诱导细胞凋亡。氧化损伤在衰老和几种如心脏病和癌症的退行性疾病中起重要作用(pietta,1999;fiorentino等,2007)。
体内模型
在7天的治疗期间用车桑子的酒精提取物(0.065mg/g平均体重)和dox(5mg/g平均体重)治疗减少了肿瘤体积,而对照组小鼠的肿瘤继续生长(图6a)。对照组、dox和提取物组在研究结束时的平均肿瘤体积分别为370,106.51和130.94mm2。widodo等(2007)的研究报道了其体内模型中的相似发现;尽管使用了恶性的人纤维肉瘤细胞,但是南非醉茄的提取物导致肿瘤抑制。虽然dox和车桑子治疗能够或多或少地减少肿瘤体积到相同程度,但值得注意的是,在治疗过程中,用提取物处理的小鼠持续增重,这强调了车桑子的低毒性(图6b)。车桑子具有许多可以协同地作用以促进生物活性和体重增加和/或维持的化学物质。作为一个整体提取物,各种氨基酸、碳水化合物和一些亲脂性生物化学品可发挥有益健康的作用。这对于使用草药疗法作为有利于肿瘤减少的免疫调节剂(jagtap等,2011)也是重要的。
c57bl6小鼠mda-mb-231细胞和肿瘤的蛋白质印迹分析
基于其在mda-mb-231细胞中诱导细胞死亡的能力,选择2.1mg/ml剂量作为所需浓度(图6)。为了评估该浓度对细胞死亡的影响,研究了细胞凋亡。车桑子(2.1mg/ml)在mda-mb-231细胞中显著诱导了parp裂解(图6b)。从小鼠获得的肿瘤中parp裂解也增加到与dox诱导的相同程度,尽管由于n值小而不显著。有趣的是,在mda-mb-231细胞中的裂解的半胱天冬酶和从小鼠获得的肿瘤中没有检测到显著的差异(图7a)。这可能归因于组织采集的时间,因为半胱天冬酶-3裂解先于parp裂解;可能是在收集细胞和组织时,这个事件已经完成并通过泛素降解去除(suzuki,2001)。
另一方面,chan等(2011)报道了用r.rohituka处理后,在乳腺癌中通过半胱天冬酶活性诱导细胞凋亡。类似地,ray等人(2010)在用苦瓜提取物处理后检测到mda-mb-231细胞和mcf-7细胞中活化的半胱天冬酶-3。这些数据表明,治疗24小时后;半胱天冬酶-3被裂解并活化,从而促进mda-mb-231细胞的凋亡。来自体外和体内实验的结果表明,车桑子触发细胞凋亡途径,导致parp裂解。parp在细胞凋亡早期被半胱天冬酶-3裂解,以防止atp消耗(boulares等,1999)。
在用植物提取物处理后,用2.1mg/ml植物提取物处理的所有细胞中ser15上p53的磷酸化显著增加(2.85±0.22,p<0.01)(图7d)。p53的表达受到与促进p53快速降解的e3泛素连接酶mdm-2相关性的负调控(kasibhatla,2003)。已经开发了许多能够结合mdm-2,置换和激活p53的药剂。由于p53的半衰期短,总p53的水平可能较低,而磷酸化的p53(丝氨酸15)更显著地表达。研究表明,磷酸-ser15-p53转位到线粒体中,其与bcl-2生理上相互作用并抑制bcl-2,从而促进细胞凋亡(park,2005)。在这个阶段,车桑子提取物的提取机理需要深入研究。然而,这些数据一起暗示了通过丝氨酸15的p53的磷酸化起作用,并且负调节与激活p53的mdm-2活性相关。
hui等(2006)已经显示mda-mb-231细胞不含有野生型p53,但含有表达突变体p53。处理后细胞中p53表达的低水平可能是由于mda-mb-231细胞表达与野生型p53相互作用并灭活野生型p53的突变型p53的事实。如mtt测定中低细胞活性所见(lowe,2000),支持这一点的事实是,虽然突变体p53失去其凋亡功能,但仍然能够启动细胞周期停滞。shin(2011)还观察到用irisnertschinskia的乙醇提取物处理mcf-7细胞后丝氨酸15的p53磷酸化。p53诱导凋亡细胞死亡,并引起半胱天冬酶裂解和bax的过度表达。在c57bl6小鼠中用车桑子处理后,很清楚的是,提取物能够诱导凋亡,parp裂解显示出与dox诱导相同的程度(图7b)。用提取物处理的小鼠肿瘤也显示出显著更高水平的磷酸化p53(7.093±2.964,p<0.05)。与对照组相比,dox处理组的p53水平也显著升高(5.3±1.016,p<0.05),然而dox与提取组无差异。
结论
已经证明车桑子对乳腺癌细胞具有细胞毒性,但显示对正常乳腺上皮细胞的有限的毒性。提取物在诱导细胞凋亡中是有效的,这通过蛋白质印迹分析检测的凋亡标记物是显而易见的,但是与dox治疗组相比,它在体内保持无毒性并且导致对肿瘤生长相似的抑制,并且在治疗过程中防止小鼠的体重减轻。斯泰伦博斯种群具有最好的抗癌活性,并且与赛德堡种群的化学特征相似。这种提取物可以证明是新型植物疗法,作为辅助治疗方法可单独使用或与其他商业药物一起使用,以协助减少肿瘤增殖。
参考文献
1.alonso-amelot,m.e.,oliveros,a.,calcagno-pisarelli,m.p.,2004.phenolicsandcondensedtanninsinrelationtoaltitudeinneotropicalpteridiumspp.afieldstudyinthevenezuelanandes.biochemicalsystematicsandecology32,969–981.
2.americancancersociety,2013.cancerfacts&figures2013.http://www.cancer.org/acs/groups/content/@epidemiologysurveilance/documents/document/acspc-036845.pdf.accessedoctober29,2013.
3.bateman,c.,2012.pink-thecolourofhopeforuninsuredwomen.southafricanmedicinaljournal102,902-903.
4.boulares,a.h.,yakovlev,a.g.,ivanova,v.,stoica,b.a.,wang,g.,iyer,s.&smulson,m.,1999.roleofpoly(adp-ribose)polymerase(parp)cleavageinapoptosis.thejournalofbiologicalchemistry274,22932-22940.
5.bradford,m.m.,1976.arapidandsensitivemethodforthequantitationofmicrogramquantitiesofproteinutilizingtheprincipleofprotein-dyebinding.analyticalbiochemistry72,248-254.
6.briskin,d.p.,2000.medicinalplantsandphytochemistry.linkingbiochemistryandphysiologytohumanhealth.plantphysiology124,507-541.
7.buchanan,b.,gruissem,w.,jones,r.,2000.biochemistry&molecularbiologyofplants.americansocietyofplantphysiologists,rockville,md.
8.cabrera,h.m.,rada,f.,cavieres,l.,1998.effectsoftemperatureonphotosynthesisoftwomorphologicallycontrastingplantspeciesalonganaltitudinalgradientinthetropicalhighandes.oecologia114,145–152.
9.cao,s.,brodie,p.,callmander,m.,randrianaivo,r.,razafitsalama,j.,rakotobe,e.,rasamison,v.e.,tendyke,k.,shen,y.,suh,e.m.,kingston,d.g.i.,2009.antiproliferativetriterpenoidsaponinsofdodonaeaviscosafromthemadagascardryforest.journalofnaturalproducts72,1705-1707.
10.cederbergmunicipality:waterservicesdevelopmentplan2009/2010.http://www.cederbergmunicipality.co.za/documents/2013031372227_item_240920v01.pdf.accessedmarch14,2014.
11.chan,l.l.,george,s.,ahmad,i.,gosangari,s.l.,abbasi,a.,cunninghamd,b.t.&watkin,k.l.,2011.cytotoxicityeffectsofamoorarohitukaandchittagongaonbreastandpancreaticcells.evidence-basedcomplementaryandalternativemedicine2011.
12.europeanunion,2010a.overviewofcederberg.http://bioval.jrc.ec.europa.eu/apaat/.accessedmarch14,2014.
13.europeanunion,2010b.overviewofdehoop.http://bioval.jrc.ec.europa.eu/apaat/.accessedmarch14,2014.
14.ewens,a.,luo,l.&berleth,e.,2006.doxorubicinplusinterleukin-2chemoimmunotherapyagainstbreastcancerinmice.cancerresearch66,5419-5426.
15.ferlay,j,soerjomataram,i.,ervik,m.,dikshit,r.,eser,s.,mathers,c.,rebelo,m.,parkin,d.m.,forman,d.,bray,f.,2013.globocan2012v1.0,cancerincidenceandmortalityworldwide:iarccancerbaseno.11.lyon,france:internationalagencyforresearchoncancer.http://globocan.iarc.fr.accessedjune9,2013.
16.fiorentino,a.,d’abrosca,b.,pacifico,s.,golino,a.,mastellone,c.,oriano,p.,monaco,p.,2007.reactiveoxygenspeciesscavengingactivityofflavoneglycosidesfrommelilotusneapolitana.molecules12,263-270.
17.gautam,r.,saklani,a.,jachak,s.m.,2007.indianmedicinalplantsasasourceofantimycobacterialagents.journalofethnopharmacology110,200-234.
18.gerl,r.,vaux,d.l.,2005.apoptosisinthedevelopmentandtreatmentofcancer.carcinogenesis26,263-270.
19.getie,m.,gebre-mariama,t.,rietz,r.,hohne,c.,huschkad,c.,schmidtkee,m.,abatef,a.,neubertb,r.h.h.,2003.evaluationoftheanti-microbialandanti-inflammatoryactivitiesofthemedicinalplantsdodonaeaviscosa,rumexnervosusandrumexabyssinicus.fitoterapia74,139-143.
20.gharib,m.i.,burnett,a.k.,2001.chemotherapy-inducedcardiotoxicity:currentpracticeandprospectsofprophylaxis.europeanjournalofheartfailure4,235-242.
21.goldstein,g.,rada,f.,
22.hartmann,t.,2007.fromwasteproductstoecochemicals:fiftyyearsresearchofplantsecondarymetabolism.phytochemistry68,2831–2846.
23.hirano,t.,abe,k.,gotoh,m.&oka,k.,1995.citrusflavonetangeretininhibitsleukaemichl-60cellgrowthpartiallythroughinductionofapoptosiswithlesscytotoxicityonnormallymphocytes.britishjournalofcancer72,1380-1388.
24.horai,h.,arita,m.,kanaya,s.,nihei,y.,ikeda,t.,suwa,k.,ojima,y.,tanaka,k.,tanaka,s.,aoshima,k.,oda,y.,kakazu,y.,kusano,m.,tohge,t.,matsuda,f.,sawada,y.,hirai,m.y.,nakanishi,h.,ikeda,k.,akimoto,n.,maoka,t.,takahashi,h.,ara,t.,sakurai,n.,suzuki,h.,shibata,d.,neumann,s.,iida,t.,tanaka,k.,funatsu,k.,matsuura,f.,soga,t.,taguchi,r.,saito,k.andnishioka,t.,2010.massbank:apublicrepositoryforsharingmassspectraldataforlifesciences.journalofmassspectrometry45,703–714.
25.hui,l.,zheng,y.,yan.y.,bargonetti,j.&foster,d.a.,2006.mutantp53inmda-mb-231breastcancercellsisstabilisedbyelevatedphospholipasedactivityandcontributestosurvivalsignalsgeneratedbyphospholipased.oncogene25,7305-7310.
26.jagtap,a.,vyawahare,n.,shinde,n.,kakade,s.,pujari,r.,2011.immunomodulatoryactivityofethanolicextractofdodonaeaviscosel.f.pharmacologyonline1,685-701.
27.jeggo,p.a.,1998.dnarepair:parp–anotherguardianangel?currentbiology8,49-51.
28.kasibhatla,s.&tseng,b.,2003.whytargetapoptosisincancertreatment?molecularcancertherapeutics2,573-580.
29.kim,y.s.,maruvada,p.,milner,j.a.,2008.metabolomicsinbiomarkerdiscovery:futureusesforcancerprevention.futureoncology4,93-102.
30.kroymann,j.,2011.naturaldiversityandadaptationinplantsecondarymetabolism.currentopinioninplantbiology14,246–251.
31.lacollineobservatory,stellenboschweatherstation,2014.http://weather.lcao.co.za/index.php/special_currentweather.accessedmarch13,2014.
32.low,a.b.,mustart,p.,vandermerwe,h.,2004.greatercederbergbiodiversitycorridor:provisionofbiodiversityformanagement.coastec,rondebosch
33.lowe,s.w.&lin,a.w.,2000.apoptosisincancer.carcinogenesis21,485-495.
34.makunga,n.p.,philander,l.e.,smith,m.,2008.currentperspectivesonanemergingformalnaturalproductssectorinsouthafrica.journalofethnopharmacology119,365-375.
35.mcdowell,m.,2009.dodonaeaviscosa.australiannationalbotanicalgardens.http://www.anbg.gov.au/gnp/interns-2007/dodonaea-viscosa.html.accessedmarch7,2013.
36.meijers,j.p.,2014.stellenboschweather.http://weather.sun.ac.za/.accessedmarch14,2014.
37.middleton,e.,kandaswami,c.,theoharides,t.c.,2000.theeffectsofplantflavonoidsonmammaliancells:implicationsforinflammation,heartdiseaseandcancer.pharmacologicalreviews52,673-751.
38.naidoo,r.,patel,m.,gulube,z.,fenyvesi,i.,2012.inhibitoryactivityofdodonaeaviscosavar.angustifoliaextractagainststreptococcusmutansanditsbiofilm.journalofethnopharmacology144,171-174.
39.o’donovan,n.,crown,j.,stunell,h.,2003.caspase3inbreastcancer.clinicalcancerresearch9,738-742.
40.octavia,y.,tocchetti,c.g.,gabrielson,k.l.,janssens,s.,2012.doxorubicin–inducedcardiomyopathy:frommolecularmechanismstotherapeuticstrategies.journalofmolecularandcellularcardiology52,1213-1225.
41.park,b.,2005.phospho-ser15-p53translocatesintomitochondriaandinteractswithbcl-2andbcl-xlineugenol-inducedapoptosis.apoptosis10,193-200.
42.pengelly,a.,2008.medicinalactivityofdodonaeaviscosa:apreliminarystudy.ruralindustriesresearchanddevelopmentcorporation,kingston.
43.philander,l.e.a.,2012.huntingknowledgeandgatheringherbs:rastafaribushdoctorsinthewesterncape,southafrica.journalofethnopharmacology32,134-156.
44.pietta,p.g.,1999.flavonoidsasantioxidants.journalofnaturalproducts63,1035-1042.
45.rada,f.,
46.rashed,k.,luo,m.t.,zhang,l.t.,zheng,y.t.,2013.dodonaeaviscosa(l.)extractsasantihumanimmunodeficiencyvirustype-1(hiv-1)agentsandphytoconstituents.peakjournalofmedicinalplantresearch1,19-25.
47.ray,r.b.,raychoudhuri,a.,steele,r.,nerurkar,p.,2010.bittermelon(momordicacharantia)extractinhibitsbreastcancercellproliferationbymodulatingcellcycleregulatorygenesandpromotesapoptosis.cancerresearch70,1925-1931.
48.reagan-shaw,s.,nihal,m.,ahmad,n.,2007.dosetranslationfromanimaltohumanstudiesrevisited.federationofamericansocietiesforexperimentalbiology22,659-661.
49.saleem,a.,husheem,m.,
50.sergediene,e.,
51.shakirov,t.t.,avazmukhamedov,l.t.,1969.isolationofperforineandfoliosidine.chemistryofnaturalcompounds5,385-386.
52.sharma,h.,parihar,l.,parihar,p.,2011.reviewoncancerandanticancerouspropertiesofsomemedicinalplants.journalofmedicinalplantsresearch5,1818-1835.
53.shin,j.s.,2011.anethanolextractofirisnertschinskiainducesp53-dependentapoptosisinthemcf7humanbreastcancercellline.internationaljournalofmolecularmedicine27,401-405.
54.street,r.a.,stirk,w.a.,vanstaden,j.,2008.southafricantraditionalmedicinalplanttrade-challengesinregulatingquality,safetyandefficacy.journalofethnopharmacology119,705-710.
55.sultanov,s.a.,yunusov,s.yu.,1969.alkaloidsofhaplophyllumdubiumaccompanyingfoliosidine.chemistryofnaturalcompounds5,114-115.
56.suzuki,y.,nakabayashi,y.,takahashi,r.,2001.ubiquitin-proteinligaseactivityofx-linkedinhibitorofapoptosisproteinpromotesproteasomaldegradationofcaspase-3andenhancesitsanti-apoptoticeffectinfas-inducedcelldeath.proceedingsofthenationalacademyofsciences98,8662-8667.57.takemura,g.,fujiwara,h.,2007.doxorubicin-inducedcardiomyopathy:fromthecardiotoxicmechanismstomanagement.progressincardiovasculardiseases49,330-352.
58.venkatesh,s.,reddy,y.s.r.,ramesh,m.,swamy,m.m.,mahadevan,n.,suresh,b.,2001.pharmacognosticalstudiesondodonaeaviscosaleaves.africanjournalofpharmacyandpharmacology2,83-88.
59.wagner,h.,2005.inhandbookofmedicinalplants(ed,yaniv,z.b.,u.)haworthpress,newyork.
60.wang,s.,konorev,e.a.,kotamraju,s.,joseph,j.,kalivendi,s.,kalyanaraman,b.,2004.doxorubicininducesapoptosisinnormalandtumorcellsviadistinctlydifferentmechanisms.journalofbiologicalchemistry279,25535-25543.
61.wei,y.,zhao,x.,kariya,y.,fukata,h.,teshigawara,k.,uchida,a.1994.,inductionofapoptosisbyquercetin:involvementofheatshockprotein.cancerresearch54,4952-4957.
62.widodo,n.,2007.selectivekillingofcancercellsbyleafextractofashwagandha:identificationofatumor-inhibitoryfactorandthefirstmolecularinsightstoitseffect.clinicalcancerresearch13,2298-2306.
63.yagudaev,m.r.,yunusov,s.yu.,1968.nmrspectrumoffoliosidine.chemistryofnaturalcompounds4,74-175.
64.zhang,y-w.,shi,j.,li,y-j.,wei,l.,2009.cardiomyocytedeathindoxorubicin-inducedcardiotoxicity.archivumimmunologiaeettherapiaeexperimentalis57,435-445.
65.ziska,l.h.,teramura,a.h.,sullivan,j.h.,1992.physiologicalsensitivityofplantsalonganelevationalgradienttouv-bradiation.americanjournalofbotany29,863–871.
权利要求书(按照条约第19条的修改)
1.一种用于乳腺癌治疗的来自车桑子的植物提取物,其来自车桑子植物的叶子。
2.根据权利要求1所述的植物提取物,其是车桑子植物的叶子的全部提取物。
3.根据权利要求1所述的植物提取物,其在一个或多个用来去除来自车桑子的叶子的对乳腺肿瘤细胞无活性的化合物的分离步骤之后获得。
4.根据权利要求1至3中任一项所述的植物提取物,其用于与其他的抗癌剂一起施用。
5.根据权利要求1至4中任一项所述的植物提取物,其由车桑子亚种l.jacq得到。
6.一种用于乳腺癌治疗的组合物,所述组合物包含如权利要求1至5中任一项所述的来自车桑子的植物提取物和一种或多种药学上可接受的赋形剂和/或佐剂。
7.根据权利要求6所述的组合物,其用于与另外的抗癌剂一起施用。
8.根据权利要求6或7所述的组合物,其为口服剂型。
9.根据权利要求8所述的组合物,其中所述口服剂型选自胶囊、片剂、粉末和液体。
10.一种制备用于乳腺癌治疗的具有抗乳腺肿瘤细胞活性的植物提取物的方法,所述方法包括以下步骤:
i.干燥车桑子的叶子材料;
ii.粉碎干燥的材料;
iii.将粉碎的材料与溶剂混合,以使来自干燥材料的化合物溶解到溶剂中;和
iv.将粉碎的材料从溶剂中去除,使得植物提取物保留在溶剂中。
11.根据权利要求10所述的方法,其中所述溶剂选自二氯甲烷、己烷、石油醚、氯仿、己烷、丙酮、甲醇、乙醇、异丙醇、乙酸乙酯、二甲基亚砜、丁醇、甲苯、甲酸、乙腈和水或其混合物。
12.根据权利要求11所述的方法,其中所述溶剂是水、乙腈和甲酸的混合物。
13.根据权利要求10至12中任一项所述的方法,还包括将所述提取物配制成口服剂型的步骤。
14.根据权利要求1到5中任一项所述的植物提取物在制造治疗乳腺癌的药物的方法中的用途。
15.一种治疗乳腺癌的方法,所述方法包括向有需要的受试者施用治疗有效量的权利要求1-9中任一项所述的植物提取物或组合物。
16.根据权利要求15所述的方法,其中所述植物提取物或组合物与其他抗癌剂一起施用于患者。
- 还没有人留言评论。精彩留言会获得点赞!