高分子纳米粒子冷冻干燥物及其制备方法与流程
本发明涉及易于重建的高分子纳米粒子冷冻干燥粉末或块状物及其制备方法,更详细地,涉及在大气压下以注射用稀释液进行重建时,在5分钟内容易得到重建的高分子纳米粒子冷冻干燥粉末或块状物及其制备方法,所述高分子纳米粒子冷冻干燥粉末或块状物是通过包括对高分子纳米粒子水溶液进行退火的步骤的冷冻干燥过程来处理而获得,所述高分子纳米粒子水溶液包含两亲性嵌段共聚物、具有羧基端基的聚乳酸衍生物及冷冻干燥助剂。
背景技术:
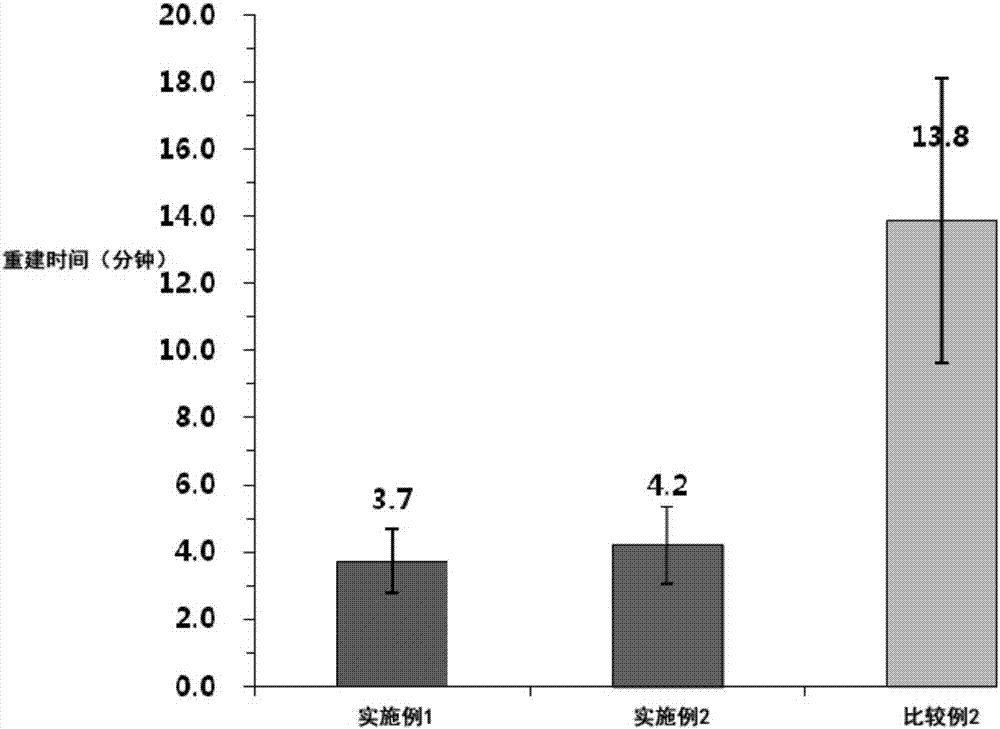
:已知高分子纳米粒子是用于将药物特异性地输送到患者的病灶部位的有效手段。尤其,由生物降解性高分子组成的纳米粒子在体内缓慢分解并消失,因此,其生物相容性优异,从而实际上正适用于纳米医药品中。但是,这种生物降解性高分子的纳米粒子在水溶液中不稳定,从而通常使用时以需要重建的冷冻干燥剂型制备。此时,与普通冷冻干燥注射剂相比,由于高分子的特性,将高分子纳米粒子重新分散到注射介质等中时需要相对更长时间,导致实际使用中具有困难。公知的制备高分子纳米粒子的方法有透析法、乳化法、有机溶剂蒸发法等各种方法。韩国第10-2009-0049239号公开专利中公开了一种高分子胶束的制备方法,所述方法为将溶于有机溶液的氨甲喋呤滴加到甲氧基聚乙二醇与壳聚糖的共聚物水溶液中,并用蒸馏水透析该混合溶液后进行冷冻干燥。此外,美国us2009/0036389a1号公开专利中公开了以下方法,即,用与水具有混溶性且沸点低于水的沸点的溶剂(即,乙腈、甲醇、乙醇及丙酮)溶解两亲性嵌段共聚合物和疏水性药物,并以恒定的速度将充分量的水加到其中以形成胶束,并添加冷冻干燥助剂后去除有机溶剂,再次进行冷冻干燥。此外,韩国第10-0421451号授权专利中提供了含有药物的高分子胶束组合物的制备方法,所述方法包括:a)将两亲性嵌段共聚物和疏水性药物溶解在有机溶剂中,然后蒸发有机溶剂来制备药物-高分子基体,其中,所述两亲性嵌段共聚物为由亲水性嵌段(a)和疏水性嵌段(b)组成且疏水性嵌段(b)的末端被用于提高与疏水性药物的亲和性的官能团取代;b)将药物-高分子基体溶解于水,从而制备封装有药物的高分子胶束水溶液;c)将高分子胶束水溶液进行冷冻干燥后进行灭菌。韩国第10-0531269号授权专利和美国us7,311,901b2号授权专利中提出了一种制备高分子纳米粒子的方法,所述方法为将两亲性嵌段共聚物、聚乳酸衍生物的一价金属盐及疏水性药物一起溶解在挥发性有机溶剂中,从而制备均质的溶液,然后通过减压蒸馏去除有机溶剂,再向其中添加水来制备混合胶束,然后添加二价金属阳离子。然而,上述专利均没有涉及关于具体的冷冻干燥方法和冷冻干燥后的重建时间的内容。国际wo2003/005992a1号公开专利中提出了一种改善冷冻干燥后的再溶解性的方法,所述方法为在由两亲性嵌段共聚物组成的含有药物的高分子胶束中添加选自糖类和聚乙二醇中的一种以上的稳定剂。然而,该方法具有在作为常规的冷冻干燥剂的糖类中添加额外的作为赋形剂的聚乙二醇的问题。优选地,希望在不使用这种额外的赋形剂的情况下,仅通过特定构成的冷冻干燥条件来改善再溶解性。另外,虽然在美国us2014/0199286a1号公开专利、日本jp2008-231067号公开专利及日本jp2007-526329a号公开专利中公开了冷冻干燥循环对冷冻干燥制剂的影响,但是us2014/0199286a1号中是以由蛋白质、磷酸钠、甘露醇,海藻糖及聚山梨醇酯组成的制剂为对象,jp2008-231067a号中是以仅由喹诺酮类抗菌剂与ph调节剂组成的制剂为对象,jp2007-526329a号中是以含有蛋白质或核酸、病毒的制剂为对象等,并不是以使用两亲性嵌段共聚物等的高分子制剂为对象。到目前为止,尚未公开改善高分子制剂的冷冻干燥方法的方法。技术实现要素:要解决的技术问题本发明是为了解决如上所述的现有技术的问题,本发明的目的在于提供高分子纳米粒子的冷冻干燥粉末或块状物及其制备方法,所述高分子纳米粒子的冷冻干燥粉末或块状物为生物相容性优异的生物降解性高分子纳米粒子的冷冻干燥物,在大气压状态下用注射用稀释液进行重建时,在5分钟内容易地得到重建。技术方案为了解决上述技术问题,本发明提供高分子纳米粒子的冷冻干燥物的制备方法,所述通过对高分子纳米粒子溶液进行冷冻干燥处理来制备高分子纳米粒子冷冻干燥物的制备方法中,所述高分子纳米粒子溶液包含:包含亲水性嵌段(a)和疏水性嵌段(b)的a-b、a-b-a或b-a-b形态的两亲性嵌段共聚物、具有羧基端基的聚乳酸衍生物及冷冻干燥助剂;所述高分子纳米粒子溶液的高分子浓度为120mg/ml以下;所述冷冻干燥处理包括:a)第一冷冻步骤,在-10~-45℃的温度范围内将高分子纳米粒子溶液进行冷冻,b)退火步骤,将所述第一冷冻产物升温至-25~0℃的温度范围,c)第二冷冻步骤,在-10~-45℃的温度范围内将所述退火产物进行冷冻,d)第一干燥步骤,在低于0℃的温度且减压条件下将所述第二冷冻产物进行干燥,以及e)第二干燥步骤,在0℃以上的温度且减压条件下将所述第一干燥产物进行干燥;其中,所述高分子纳米粒子的冷冻干燥物在大气压下通过水性溶剂进行重建时,在5分钟内得到重建。根据本发明的优选具体例,所述冷冻干燥处理中,所述第一冷冻步骤是在初始温度为0~25℃、最终温度为-10~-45℃、降温时间为0.5~24小时及降温后的维持时间为0.5~24小时的条件下进行,所述退火步骤是在初始温度为-10~-45℃、最终温度为-25~0℃、升温时间为0.5~24小时及升温后的维持时间为0.2~8小时的条件下进行,所述第二冷冻步骤是在初始温度为-25~-0℃、最终温度为-10~-45℃、降温时间为0.5~24小时及降温后的维持时间为1~24小时的条件下进行,所述第一干燥步骤是在真空度为50~500毫托、干燥温度为-45~低于0℃及干燥时间为24~96小时的条件下进行,所述第二干燥步骤是在真空度为50~500毫托、干燥温度为0~50℃及干燥时间为24~96小时的条件下进行。根据本发明的另一方面,提供高分子纳米粒子的冷冻干燥物,其包含:包含亲水性嵌段(a)和疏水性嵌段(b)的a-b、a-b-a或b-a-b形态的两亲性嵌段共聚物、具有羧基端基的聚乳酸衍生物及冷冻干燥助剂;孔隙率(%)为70~99.9%;平均孔隙大小为70μm以上;在大气压下通过水性溶剂进行重建时,在5分钟以内得到重建。根据本发明的另一方面,提供高分子纳米粒子的冷冻体,其包含:包含亲水性嵌段(a)和疏水性嵌段(b)的a-b、a-b-a或b-a-b形态的两亲性嵌段共聚物、具有羧基端基的聚乳酸衍生物及冷冻干燥助剂;崩溃(collapse)温度为-25℃以上。发明效果根据本发明,能够获得在大气压状态下以注射用稀释液进行重建时,能够在5分钟以内,更优选为3分钟以内容易地得到重建,并且生物相容性优异的生物降解性高分子纳米粒子的冷冻干燥物,其中,可以适当地含有药物,尤其是水难溶性药物。附图说明图1为示出实验例1中测量的实施例1和比较例1的重建时间的图表。图2为示出实验例2中测量的实施例1及2和比较例2的重建时间的图表。图3为示出实验例3中测量的实施例1在真空状态和大气压状态下的重建时间的图表。图4为实施例3中得到的冷冻干燥物的电子显微镜照片。图5为比较例1中得到的冷冻干燥物的电子显微镜照片。最佳实施方式以下更详细地说明本发明。本发明中使用的高分子纳米粒子溶液包含:包含亲水性嵌段(a)和疏水性嵌段(b)的a-b、a-b-a或b-a-b形态的两亲性嵌段共聚物、具有羧基端基的聚乳酸衍生物及冷冻干燥助剂,该溶液中的高分子浓度为1mg/ml以上且120mg/ml以下,更优选为10mg/ml以上且100mg/ml以下。当高分子纳米粒子溶液中的高分子浓度超过120mg/ml时,存在冷冻干燥物的重建时间变长的问题。以重建时间为基准,虽然高分子浓度的下限越低越优选,但是,当高分子浓度过低时,冷冻干燥后难以维持块状形态,因此,为了维持块状形态,需要添加充分的冷冻干燥助剂。就本发明的一个实施例而言,所述两亲性嵌段共聚物的特征在于,其为亲水性嵌段(a)与疏水性嵌段(b)以a-b形态连接的二嵌段共聚物,并且是非离子性的。此外,所述两亲性嵌段共聚物在水溶液中形成核-壳(core-shell)形态的高分子胶束(micelle),其中,疏水性嵌段(b)形成核(core),亲水性嵌段(a)形成壳(shell)。所述两亲性嵌段共聚物的亲水性嵌段(a)为溶于水的高分子,具体为聚亚烷基二醇(polyalkyleneglycol),例如,聚乙二醇(polyehtyleneglycol)、聚乙烯-丙二醇共聚物(polyethylene-co-propyleneglycol)等;聚亚烷基二醇衍生物,例如,单甲氧基聚亚烷基二醇(monomethoxypolyalkyleneglycol)、单乙酰氧基聚乙二醇(monoacetoxypolyethyleneglycol)等;聚乙烯醇(polyvinylalcohol);聚乙烯吡咯烷酮(polyvinylpyrrolidone);或者聚丙烯酰胺(polyacrylamide)等,更具体地,选自聚乙二醇、单甲氧基聚乙二醇、聚乙烯吡咯烷酮、聚乙烯醇及聚丙烯酰胺。优选地,所述亲水性嵌段(a)的数均分子量为500~50000道尔顿,更具体为500~20000道尔顿,进一步具体为1000~20000道尔顿。所述两亲性嵌段共聚物的疏水性嵌段(b)为不溶于水且生物相容性优异的生物降解性高分子,具体为聚酯(polyester)、聚酸酐(polyanhydride)、聚氨基酸(polyaminoacid)、聚原酸酯(polyorthoester)或聚磷腈(polyphosphazine)等,更具体地可以选自聚丙交酯(polylactide)、聚乙交酯(polyglycolide)、聚二氧杂环己烷-2-酮(polydioxan-2-one)、聚己内酯(polycaprolactone)、聚丙交酯-乙交酯共聚物(polylactic-co-glycolide)、聚丙交酯-己内酯共聚物(polylactic-co-caprolactone)、聚丙交酯-二氧杂环己烷-2-酮共聚物(polylactic-co-dioxan-2-one)、聚乙交酯-己内酯共聚物(polyglycolic-co-caprolactone)及其羧酸末端被脂肪酸基团取代的它们的衍生物。此外,可以取代所述疏水性嵌段(b)的羧酸端基的脂肪酸基团可以举例为丁酸基、丙酸基、乙酸基、硬脂酸基或棕榈酸基。优选地,所述疏水性嵌段(b)的数均分子量为500~50000道尔顿,更具体为500~20000道尔顿,进一步具体为1000~20000道尔顿。根据本发明的一个实施例,以重量比为基准,用于在水溶液相中形成稳定的高分子胶束的所述两亲性嵌段共聚物的亲水性嵌段(a)和疏水性嵌段(b)的组成比(亲水性嵌段(a):疏水性嵌段(b))为2:8~8:2,更具体为3:7~7:3,进一步具体为4:6~6:4。当亲水性嵌段(a)的比率过低时,高分子无法在水溶液中形成高分子胶束,另一方面,当亲水性嵌段(a)的比率过高时,由于亲水性过度增加而有可能会降低稳定性。在本发明的一个实施例中,就所述具有羧基端基的聚乳酸衍生物而言,例如,可以在选自聚乳酸、聚丙交酯、聚乙交酯、聚扁桃酸(polymandelicacid)、聚己内酯、聚二氧杂环己烷-2-酮、聚氨基酸、聚原酸酯、聚酸酐及它们的共聚物中的一种以上,更具体地,可以在选自d,l-聚乳酸、d-聚乳酸、聚扁桃酸、d,l-乳酸和乙醇酸的共聚物、d,l-乳酸和扁桃酸的共聚物、d,l-乳酸和己内酯的共聚物及d,l-乳酸和1,4-二氧杂环己烷-2-酮的共聚物中的一种以上的末端上具有羧酸基或羧基上结合有碱金属离子的基团。一个实施例中,所述碱金属离子可以为钠、钾或锂的一价金属离子。所述聚乳酸衍生物的非羧基末端的另一末端可以为选自羟基(hydroxy)、甲氧基、乙氧基、乙酰氧基(acetoxy)、苯甲酰氧基(benzoyloxy)、癸酰氧基(decanoyloxy)、棕榈酰氧基(palmitoyloxy)中的一种以上。在所述聚乳酸衍生物中,结合有碱金属离子的羧基末端在ph4以上的水溶液中作用为亲水性基团,从而在水溶液中形成高分子胶束。此外,所述聚乳酸盐或其衍生物在室温下以固体状态存在,即使暴露于空气中的水分,由于其ph为中性,因此,显示为非常稳定的形态。所述在羧基末端结合有碱金属离子形态的聚乳酸衍生物被添加到由两亲性嵌段共聚物组成的胶束中,从而加固胶束核的内部,因此,起到提高药物封装效率的作用。所述聚乳酸衍生物溶解在水溶液中使存在于聚乳酸衍生物分子内的亲水性部分和疏水性部分达到均衡而形成胶束。因此,当显示疏水性的酯部分的分子量变大时,显示亲水性的末端的羧基阴离子之间难以汇合,从而无法很好地形成胶束,当显示疏水性的酯部分的分子量变低时,由于完全溶解在水中,从而难以形成胶束。一个实施例中,能够在ph4以上形成胶束的适当的聚乳酸衍生物的数均分子量为500~5000道尔顿,更具体为500~2500道尔顿。当分子量过小时,由于完全溶于水中,从而难以形成胶束,另一方面,当分子量过大时,疏水性变得过大,导致难以溶解在水溶液中,从而不能形成胶束。这种聚乳酸衍生物的分子量可以通过适当地调整制备时的反应温度和时间等来实现。在一个实施例中,在所述羧基末端结合有碱金属离子形态的聚乳酸衍生物可由下述化学式1来表示。[化学式1](所述化学式1中,a为其中,z为氢、甲基或苯基,b为其中,y为氢、甲基或苯基,r为氢、乙酰基、苯甲酰基、癸酰基、棕榈酰基、甲基或乙基,m为钠、钾或锂,n为1~30的整数,m为0~20的整数。)更具体地,所述在羧基末端结合有碱金属离子的聚乳酸盐或其衍生物可由下述化学式2来表示。[化学式2](所述化学式2中,z、r及m与化学式1中的定义相同,x为甲基,y'为氢或苯基,p为0~25的整数,q为0~25的整数,但是p+q为5~25的整数。)另一个实施例中,在所述羧基末端结合有碱金属离子形态的聚乳酸衍生物可以由下述化学式3或化学式4来表示。[化学式3](所述化学式3中,w-m为pla为d,l-聚乳酸、d-聚乳酸、聚扁桃酸、d,l-乳酸和乙醇酸的共聚物、d,l-乳酸和扁桃酸的共聚物、d,l-乳酸和己内酯的共聚物或d,l-乳酸和1,4-二氧杂环己烷-2-酮的共聚物。)[化学式4](所述化学式4中,s为其中,l为-nr1-或-o-(其中,r1为氢或c1~c10的烷基),a为0~4的整数,b为1~10的整数,m为钠、钾或锂,q为ch3、ch2ch3、ch2ch2ch3、ch2ch2ch2ch3或ch2c6h5,pla为d,l-聚乳酸、d-聚乳酸、聚扁桃酸、d,l-乳酸和乙醇酸的共聚物、d,l-乳酸和扁桃酸的共聚物、d,l-乳酸和己内酯的共聚物或d,l-乳酸和1,4-二氧杂环己烷-2-酮的共聚物。)所述两亲性嵌段共聚物和具有羧基端基的聚乳酸衍生物可以在水中一起形成混合胶束水溶液。一个实施例中,所述高分子纳米粒子溶液可进一步包含水难溶性药物,其结果,所述混合胶束中可以含有水难溶性药物。在混合胶束中包含水难溶性药物的方法为,举例如下:将水难溶性药物、两亲性嵌段共聚物和具有羧基端基的聚乳酸衍生物溶解于有机溶剂中,并去除有机溶剂后,添加水来制备混合胶束;或者,将水难溶性药物和具有羧基端基的聚乳酸衍生物溶解于有机溶剂中,并去除有机溶剂后,在其干燥物中添加将两亲性嵌段共聚物添加到水中并溶解的水溶液,从而制备混合胶束。在一个实施例中,所述有机溶剂具体可以为醇类、二氯甲烷、氯仿、丙酮、四氢呋喃、乙酸、乙腈及二氧杂环己烷中的一种以上。在一个实施例中,以组合物的总重量为基准,所述有机溶剂的含量可以为0.5~30重量%,具体可以为0.5~15重量%,更具体可以为1~10重量%。当有机溶剂的含量小于0.5重量%时,难以溶解药物,当有机溶剂的含量超过30重量%时,在重建时会析出药物。所述水难溶性药物可以与高分子同时或依次溶解在有机溶剂中。可以将药物和有机溶剂同时添加到有机溶剂中进行溶解,或者先将高分子溶解在有机溶剂中,再溶解药物,或者先将药物溶解在有机溶剂后,再添加高分子进行溶解。将水难溶性药物溶解于有机溶剂时的温度,虽不限于此,但为了防止药物的分解,可以为0~60℃,更具体为10~50℃,进一步具体为10~40℃。有机溶剂的去除可以通过减压蒸馏法、气力输送干燥法(pneumaticconveyingdrying)、加热干燥法等来进行。此外,当使用少量有机溶剂时,可以省略有机溶剂去除工序。所述水溶液可以为常规的水、蒸馏水、注射用蒸馏水、生理盐水、5%的葡萄糖,缓冲液等。所述胶束化工序的特征为,在0~80℃,更具体在10~60℃,进一步具体在10~40℃的温度下添加水溶液来形成高分子胶束。所述水难溶性药物可以选用对水的溶解度(25℃)为100mg/ml以下的药物。此外,所述水难溶性药物可以选自抗癌剂(antineoplasticagents)、抗真菌剂(antifungalagents)、免疫抑制剂(immunosuppressants)、麻醉剂(analgesics)、消炎止痛剂(anti-inflammatoryagents)、抗病毒剂(antiviralagents)、镇静剂(anxiolyticsedatives)、造影剂(contrastingagents)、皮质类固醇(corticosteroids)、诊断试剂(diagnosticagents)、诊断造影剂(diagnosticimagingagents)、利尿剂(diuretics)、前列腺素(prostaglandins)、放射性药物(radio-pharmaceuticals)、包含类固醇(steroid)的性激素(sexhormones)和它们的组合,但并不限定于此。在一个实施例中,所述水难溶性药物可以选自抗癌剂,具体可以为紫杉烷抗癌剂。例如,所述紫杉烷抗癌剂可以为选自紫杉醇(paclitaxel)、多西紫杉醇(docetaxel)、卡巴他赛(carbazitaxel)、7-表紫杉醇(7-epipaclitaxel)、t-乙酰基紫杉醇(t-acetylpaclitaxel)、10-脱乙酰基-紫杉醇(10-desacetyl-paclitaxel)、10-脱乙酰基-7-表紫杉醇(10-desacetyl-7-epipaclitaxel)、7-木糖基紫杉醇(7-xylosylpaclitaxel)、10-脱乙酰基-7-戊二酰紫杉醇(10-desacetyl-7-glutarylpaclitaxel)、7-n,n-二甲基甘氨酰紫杉醇(7-n,n-dimethylglycylpaclitaxel)及7-l-丙氨酰紫杉醇(7-l-alanylpaclitaxel)中的一种或两种以上的混合物,更具体地,为紫杉醇或多西紫杉醇。在另一实施例中,所述水难溶性药物可选自抗真菌剂,具体可以为唑(azole)类抗真菌剂。例如,所述唑类抗真菌剂为选自伏立康唑(voriconazole)、泊沙康唑(posaconazole)、雷夫康唑(rravuconazole)、氟康唑(fluconazole)、益康唑(econazol)、酮康唑(ketoconazole)及伊曲康唑(itraconazole)中的一种或两种以上的混合物,更具体地,为伏立康唑。一个实施例中,相对于两亲性嵌段共聚物和具有羧基端基的聚乳酸衍生物的总100重量%,可以使用0.1~99.9重量%的两亲性嵌段共聚物和0.1~99.9重量%的聚乳酸衍生物,优选可以使用20~95重量%的两亲性嵌段共聚物和5~80重量%的聚乳酸衍生物,更优选地,可以使用50~90重量%的两亲性嵌段共聚物和10~50重量%的聚乳酸衍生物。在另一个实施例中,相对于两亲性嵌段共聚物、具有羧基端基的聚乳酸衍生物和水难溶性药物的总100重量%,可以使用0.1~20重量%的难溶性药物。在一个实施例中,所述高分子纳米粒子溶液可以进一步包含二价或三价金属离子的盐,其结果,所述混合胶束水溶液中可以添加二价或三价金属离子的盐。添加这种二价或三价金属离子是为了进一步提高混合两亲性嵌段共聚物和具有羧基端基的聚乳酸衍生物而形成的高分子胶束的稳定性,二价或三价金属离子与聚乳酸衍生物的末端羧基结合,从而形成结合有二价或三价金属离子的高分子胶束。例如,在羧基末端结合有碱金属离子的聚乳酸盐或其衍生物中,二价或三价金属离子与羧基端基的一价金属阳离子发生取代反应而形成离子键,并且,由于这种离子键的强的结合力,从而起到更加提高高分子胶束的稳定性的作用。在一个实施例中,所述二价或三价金属离子可以选自钙(ca2+)、镁(mg2+)、钡(ba2+)、铬(cr3+)、铁(fe3+)、锰(mn2+)、镍(ni2+)、酮(cu2+)、锌(zn2+)及铝(al3+)。在另一个实施例中,二价或三价金属离子以硫酸盐、氯盐、碳酸盐、磷酸盐或氢氧化物的形态添加到所述两亲性嵌段共聚物和聚乳酸衍生物的混合高分子组合物中,具体以氯化钙(cacl2)、氯化镁(mgcl2)、氯化锌(zncl2)、氯化铝(alcl3)、氯化铁(fecl3)、碳酸钙(caco3)、碳酸镁(mgco3)、磷酸钙(ca3(po4)2)、磷酸镁(mg3(po4)2)、磷酸铝(alpo4)、硫酸镁(mgso4)、氢氧化钙(ca(oh)2)、氢氧化镁(mg(oh)2)、氢氧化铝(al(oh)3)或氢氧化锌(zn(oh)2)的形态添加。此外,相对于所述聚乳酸衍生物的羧基端基的当量,二价或三价金属离子可以添加0.001~10当量,具体可以添加0.5~2.0当量。在一个实施例中,所述冷冻干燥助剂(也被称为冷冻干燥化剂)可以选自糖、糖醇及它们的混合物。所述糖可以为选自乳糖、麦芽糖、蔗糖及海藻糖中的一种以上,所述糖醇可以为选自甘露醇、山梨醇、麦芽糖醇、木糖醇及乳糖醇中的一种以上。添加所述冷冻干燥助剂是为了使经过冷冻干燥的组合物能够维持块状形态。此外,所述冷冻干燥助剂在高分子纳米粒子组合物的冷冻干燥后进行重建(reconsitution)的过程中起到帮助其在短时间内均匀地溶解的作用。一个实施例中,以冷冻干燥组合物总干燥重量为100%计,冷冻干燥助剂的含量为1~90重量%,更具体为10~60重量%。在一个实施例中,需经冷冻干燥处理的高分子纳米粒子溶液原液的高分子浓度(即,包含所述两亲性嵌段共聚物和具有羧基端基的聚乳酸衍生物的高分子的浓度)为1mg/ml以上,更优选为10mg/ml以上且120mg/ml以下,更优选为100mg/ml以下,进一步优选为50mg/ml以下。当溶液内高分子的浓度过高时,在冷冻干燥后进行重建时形成高分子块的可能性大,因此完全溶解需要很长时间。当高分子浓度过低时,由于使用时溶液的体积过大而使用不便。高分子纳米粒子溶液的冷冻干燥处理包括:a)第一冷冻步骤,在-10~-45℃的温度范围内将高分子纳米粒子溶液进行冷冻,b)退火(annealing)步骤,将所述第一冷冻产物升温至-25~0℃的温度范围,c)第二冷冻步骤,在-10~-45℃的温度范围内将所述退火产物进行冷冻,d)第一干燥步骤,在低于0℃的温度且减压条件下将所述第二冷冻产物进行干燥,以及e)第二干燥步骤,在0℃以上的温度且减压条件下将所述第一干燥产物进行干燥。通过这种冷冻干燥处理,使冰晶变大,因此,使得冷冻干燥块状物的孔隙变大,由此在重建时水容易透过,从而缩短了重建时间。更具体地,在所述冷冻干燥处理中,第一冷冻步骤是在初始温度为0~35℃(更优选为0~25℃,最优选为0~15℃),最终温度为-10~-45℃(更优选为-20~-40℃,最优选为-30~-40℃),降温时间为0.5~24小时(更优选为0.5~12小时,最优选为0.5~6小时)及降温后的维持时间为0.5~24小时(更优选为0.5~12小时,最优选为0.5~6小时)的条件下进行;所述退火步骤是在初始温度为-10~-45℃(更优选为-20~-40℃,最优选为-30~-40℃),最终温度为-25~0℃(更优选为-25~-10℃,最优选为-25~-15℃),升温时间为0.5~24小时(更优选为0.5~12小时,最优选为0.5~6小时)及升温后的维持时间为0.2~12小时(更优选为0.5~8小时,最优选为0.5~4小时)的条件下进行;所述第二冷冻步骤是在初始温度为-25~-0℃(更优选为-25~-10℃,最优选为-25~-15℃),最终温度为-10~-45℃(更优选为-20~-40℃,最优选为-30~-40℃),降温时间为0.5~24小时(更优选为0.5~12小时,最优选为0.5~6小时)及降温后的维持时间为1~24小时(更优选为0.5~12小时,最优选为0.5~6小时)的条件下进行;所述第一干燥步骤是在真空度为50~500毫托(更优选为50~150毫托,最优选为50~100毫托),干燥温度为-45~低于0℃(更优选为-5~-40℃,最优选为-10~-30℃)及干燥时间为24~96小时(更优选为24~72小时,最优选为48~72小时)的条件下进行;所述第二干燥步骤是在真空度为50~500毫托(更优选为50~150毫托,最优选为50~100毫托),干燥温度为0~50℃(更优选为5~40℃,最优选为15~35℃)及干燥时间为6~48小时(更优选为6~24小时,最优选为12~24小时)的条件下进行。一个例子中,第一干燥步骤可以包括以下步骤:在-45~低于-20℃下维持1~5小时;从-45~低于-20℃的温度升温至-20~低于-10℃,升温时间为2~6小时;在-20~低于-10℃温度下维持10~40小时;从-20~低于-10℃的温度升温至-10~低于0℃,升温时间为1~5小时;以及,在-10~低于0℃温度下维持10~40小时。一个例子中,第二干燥步骤可以包括以下步骤:从-10~低于0℃的温度升温至0~20℃,升温时间为0.5~3小时;在0~低于20℃的温度下维持0.5~6小时;从0~低于20℃的温度升温至20~50℃,升温时间为2~9小时;以及,在20~50℃的温度下维持3~30小时。本发明的高分子纳米粒子的冷冻干燥物的制备方法可以进一步包括将如上述经过冷冻干燥处理的产物投入到小瓶中后填充氮气并进行密封或在真空状态下密封的步骤。在一个实施例中,如上述制备而获得的高分子纳米粒子的冷冻干燥物包含0.1~78.9重量%的两亲性嵌段共聚物、20.0~98.8重量%的在羧基末端结合有二价或三价的金属离子的聚乳酸衍生物、0.1~20.0重量%的水难溶性药物及1~79.8重量%的冷冻干燥助剂。根据本发明的高分子纳米粒子的冷冻干燥物的制备方法制备的高分子纳米粒子的冷冻干燥物的特征为,在大气压下用水性溶液进行重建时,在5分钟以内,更优选在3分钟以内得到重建。另外,根据本发明的另一方面,提供高分子纳米粒子的冷冻干燥物,其包含:包含亲水性嵌段(a)和疏水性嵌段(b)的a-b、a-b-a或b-a-b形态的两亲性嵌段共聚物、具有羧基端基的聚乳酸衍生物及冷冻干燥助剂;孔隙率(%)为70~99.9%,平均孔隙大小(μm)为70μm以上(例如,70~200μm),更优选为90μm以上(例如,90~200μm),最优选为100μm以上(例如,100~200μm);在大气压下用水性溶剂进行重建时,在5分钟以内,更优选在3分钟以内得到重建。如果孔隙率过低或孔隙过小,则在进行重建时,延迟水溶液的透过,从而延长重建时间。一个例子中,孔隙率n(%)可根据下述数学式1来计算得出。[数学式1]n=(v-vs)/v×100(%)其中,vs仅为固体部分的体积(冷冻干燥块状物的体积-水的体积),v为包含孔隙的总体积(冷冻干燥块状物的体积)。根据本发明的另一方面,提供高分子纳米粒子的冷冻体,其包含:包含亲水性嵌段(a)和疏水性嵌段(b)的a-b、a-b-a或b-a-b形态的两亲性嵌段共聚物、具有羧基端基的聚乳酸衍生物及冷冻干燥助剂;崩溃(collapse)温度优选为-25~-5℃,更优选为-20~-5℃,最优选为-15~-5℃。所述崩溃(collapse)温度是指所述第一干燥步骤(primarydrying)期间可接受的试料的最高温度,是指在该温度以上的温度下进行第一干燥步骤时,引起块状物的形状扭曲或崩溃的温度。崩溃温度的测量利用冷冻干燥显微镜(freeze-dryingmicroscope)。崩溃温度越高,在不影响冷冻干燥块状物的成形的情况下,可以维持更高的第一干燥步骤的温度,因此,能够缩短冷冻干燥的时间。以下,通过实施例更详细地说明本发明。然而,本发明并不受限于下述实施例。[实施例]以下实施例中使用的两亲性嵌段共聚物和羧基末端结合有碱金属离子的聚乳酸盐或其衍生物是根据国际公开专利第03/033592号中公开的方法来制备,其全部内容在本发明中作为参考而并入。实施例1、实施例2及比较例2:高分子纳米粒子冷冻干燥块状物的制备作为两亲性嵌段共聚物,合成了数均分子量为2000~1766道尔顿的单甲氧基聚乙二醇-聚丙交酯。此外,合成了数均分子量为1800道尔顿的d,l-pla-coona。以下表1所示的使用量,在聚乳酸盐中添加3.0ml的二氯甲烷,并在40℃下搅拌至溶液变成透明的溶液。使用连接有真空泵的旋转式减压蒸馏器,通过减压蒸馏约3小时来去除二氯甲烷,从而生成白色泡沫状固体。另外,将60℃的水添加到两亲性嵌段共聚物中,搅拌至高分子块状物完全溶解,然后冷却至室温。将室温的两亲性嵌段共聚物溶液添加到所述白色泡沫状固体中,维持约35℃的温度的同时胶束化至变成蓝色透明溶液。其中,添加氯化钙形成高分子纳米粒子。在所述高分子纳米粒子溶液中添加作为冷冻干燥化剂的d-甘露醇并完全溶解后,使用孔隙大小为200nm的过滤器进行过滤,然后,根据下述冷冻干燥条件来进行冷冻干燥,从而制备高分子纳米粒子的冷冻干燥块状物。[表1][表2][表3]<冷冻条件>区分温度(℃)时间(分钟)真空度(毫托)温度设定步骤1530大气压维持步骤2-4090大气压降温步骤3-40120大气压维持步骤4-15100大气压升温步骤5-15120大气压维持步骤6-4080大气压降温步骤7-40120大气压维持<第一次干燥条件(primarydrying)><第二次干燥条件(secondarydrying)>区分温度(℃)时间(分钟)真空度(毫托)温度设定步骤1510050升温步骤2520050维持步骤32540050升温步骤42574050维持比较例1:无退火工序的高分子纳米粒子冷冻干燥块状物的制备以与实施例1相同的方法实施,但将冷冻条件进行变更,并且没有进行退货工序和第二次冷冻工序。即,使用了下述表4的冷冻条件。[表4]<冷冻条件>区分温度(℃)时间(分钟)真空度(毫托)温度设定步骤1530大气压维持步骤2-4090大气压降温步骤3-40120大气压维持实验例1:冷冻条件对高分子纳米粒子块状物重建时间的影响按照下述方法,将分别在实施例1和比较例1中制备的高分子纳米粒子的冷冻干燥块状物进行重建,并测量了重建时间。重建方法将36ml的约20℃的注射用蒸馏水添加到装有4788mg的冷冻干燥块状物的小瓶中,并用手剧烈摇晃小瓶一分钟,然后用手轻轻摇晃至小瓶中的固体成分全部溶解,并确认重建时间。测量结果示于图1中。从图1的重建时间测量结果可知,在冷冻条件中,进行第一次冷冻后在熔点以下的温度范围内进行升温,并经过维持一定时间的退过工序(annealingprocess),再次进行第二次冷冻时(实施例1:3.7分钟)的重建时间显著短于直接降低温度并只进行冷冻时(比较例1:5.9分钟)的重建时间。实验例2:冷冻干燥用原液的浓度对高分子纳米粒子块状物重建时间的影响以与实验例1相同的方法,将分别在实施例1、实施例2及比较例2中制备的高分子纳米粒子的冷冻干燥块状物进行重建,并测量重建时间。测量结果示于图2中。从图2的重建时间测量结果可知,冷冻干燥中使用的原液的浓度越高,显示出重建时间越长的倾向。尤其超过1.2mg/ml(以高分子浓度表示约为120mg/ml)时,显示出重建时间急剧增加的倾向。实验例3:重建时小瓶中的真空度对高分子纳米粒子块状物重建时间的影响以与实验例1相同的方法,将实施例1中制备的高分子纳米粒子的冷冻干燥块状物进行重建,但重建时变更小瓶内部的真空度(真空状态:大气压),并测量重建时间。测量结果示于图3中。从图3的重建时间测量结果可知,重建时将小瓶内部维持真空状态的情况下添加水时,重建时间显著增加,并且小瓶之间的重建时间的偏差也非常大。实验例4:冷冻条件对高分子纳米粒子的冷冻干燥原液的崩溃(collapse)温度的影响以如下述表5的冻结条件,将实施例1的组成的高分子纳米粒子的冷冻干燥用原液进行冷冻后,用冷冻干燥电子显微镜(freezedryingmicroscope)测量获得的冷冻体的崩溃温度。[表5]<冷冻条件和崩溃温度>1):以-20℃/分钟的速度降温至-45℃(第一次冷冻);然后以2℃/分钟的速度升温至-15℃后,在-15℃的温度下维持10分钟(退火);然后以-20℃/分钟的速度降温至-45℃(第二次冷冻)na:不适用从表5的结果可知,将实施例1组成的高分子纳米粒子冷冻干燥用原液通过包括退火的冷冻工序进行冷冻时的崩溃温度高于通过不包括退火的单纯冷冻工序进行冷冻时的崩溃温度。因此,可以确认,冷冻时进行退火的情况下,可以进行更有效率的冷冻干燥。实施例3:含有多西紫杉醇的高分子纳米粒子冷冻干燥块的制备除了将3.0ml的二氯甲烷添加到如下表6所示的使用量的多西紫杉醇和聚乳酸盐中,并在40℃下搅拌至变成透明溶液之外,以与实施例1相同的工序实施。[表6]将36ml的约20℃的注射用蒸馏水添加到装有4828mg的所述制备的含有多西紫杉醇的高分子纳米粒子冷冻干燥块状物的小瓶中,用手剧烈摇晃1分钟,然后用手轻轻摇晃至小瓶中的所有固体成分全部溶解。小瓶中的所有固体成分全部溶解所用的重建时间为4.2分钟。另外,制备的含有多西紫杉醇的高分子纳米粒子冷冻干燥物(多西紫杉醇-pnp)的孔隙率为90.0%(以冷冻干燥原液中的多西紫杉醇浓度表示为1.0mg/ml)用电子显微镜放大50倍来观察实施例3的冷冻干燥物的结果示于图4中。如图4所示,可知本发明的冷冻干燥物具有无定形的大孔隙。为了比较,将用电子显微镜放大50倍观察比较例1中得到的冷冻干燥物的结果示于图5中。从图4、图5及表7可知,可以确认本发明中获得的冷冻干燥物与通过常规方法获得的冷冻干燥物相比具有更大的孔隙。[表7]实施例4:含有紫杉醇的高分子纳米粒子冷冻干燥块状物的制备除了将3.0ml的二氯甲烷添加到如下表8所示的使用量的紫杉醇和聚乳酸盐中,并在45℃的温度下搅拌至变成透明溶液之外,以与实施例1相同的工序实施。[表8]将26.4ml的约25℃的生理盐水添加到装有3574.5mg的所述制备的含有紫杉醇的高分子纳米粒子冷冻干燥块状物的小瓶中,用手剧烈摇晃1分钟,然后用手轻轻摇晃至小瓶中的所有固体成分全部溶解。小瓶中所有的固体成分全部溶解所用的重建时间为1.6分钟。实施例5:含有伏立康唑的高分子纳米粒子冷冻干燥块状物的制备除了将3.0ml的二氯甲烷添加到如下表9所示的使用量的伏立康唑和聚乳酸盐中,并在40℃下搅拌至变成透明溶液之外,以与实施例1相同的工序实施。[表9]将36.0ml的约25℃的生理盐水添加到装有3410mg的所述制备的含有伏立康唑的高分子纳米粒子冷冻干燥块状物的小瓶中,用手剧烈摇晃1分钟,然后用手轻轻摇晃至小瓶中的所有固体成分全部溶解。小瓶中所有固体成分全部溶解所用的重建时间为2.9分钟。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1