一种复方丹参有效成分组合物及其制备方法和应用与流程
本发明属于中药制备技术领域。具体涉及一种复方丹参有效成分组合物及其制备方法和应用。
二、
背景技术:
早老性痴呆(Alzheimer’s Disease,AD)是伴随老龄化社会出现的高发病,是一种常见的神经系统退行性疾病,主要以神经元纤维缠结(NFT)、β-淀粉样斑块的积累、神经元损失和炎症为病理标记,以记忆力减退、认知障碍等神经功能障碍为主要表现。目前,我国的老年痴呆患者有600万左右,而且患病率逐年增加,已成为仅次于心脏病、癌症和脑卒中的第四位导致患者死亡的疾病。2050年,估计全球老年痴呆患者将超过一亿。AD患者的生活不能完全自理,伴有精神和行为障碍,需要长期监护,无疑给全球医疗、经济、社会尤其是患者家属带来巨大的负担。目前,美国每年用于老年痴呆患者的治疗费用已经达到57000美元/人。现在,获准用于治疗AD的药物全球市场销售额也在逐年增加,这潜在的市场对企业也存在巨大的吸引力。
近年来,AD药物研究进展非常迅速,主要涉及改善认知功能的药物和防止或延缓病程的药物两大类,前者包括胆碱能激动剂、促智药、钙拮抗剂、神经生长因子等,后者主要有抗炎药、抗氧化剂、抗β淀粉样蛋白(amyloid-β,Aβ)聚集药物等。而用于临床的AD药物主要包括胆碱脂酶抑制剂(如石杉碱甲、多奈哌齐等)和NMDA(N-甲基-D-天冬氨酸)受体拮抗剂(如盐酸美金刚等);减少氧化应激和胞内钙超载的药物如维生素E、司来吉兰以及艾地苯醌,在临床上均有一定效果;干扰Aβ形成和沉积的药物,如β-环糊精、利福霉素、层粘连蛋白、蒽环类抗生素、褪黑激素等均可抑制Aβ的纤维形成;Aβ免疫疗法可望成为AD的一种新的治疗方法。
目前市场上虽然有多种药物,但治疗效果却不明显,因此寻找能修复大脑学习和记忆功能的药物,对于改善AD患者的病情具有十分重要的临床意义。已有研究表明,复方丹参在对AD的治疗中表现出巨大潜力,作为改善冠状动脉和脑部循环的经典中药处方,复方丹参能够提高心脑血管功能、保护神经系统、改善机体微循环,且对脑局部慢性缺血具有代偿性的修复功能。
中国药典2005年版记载,复方丹参片由丹参450g、三七141g和冰片8g组成。其功效为活血化瘀,理气止痛。用于气滞血瘀所致的胸痹,症见胸闷、心前区刺痛;临床用于胸中憋闷、冠心病、心绞痛等。
阐明复方配伍的化学物质成分以及多靶点效应机制,是解决中药与国际医药发展趋势接轨问题的必经之路。现代研究中药方剂配伍组方的方法,主要是在组分层次上研究中药有效组分的配伍组方,能够实现药物配伍组方的定量分析,有助于明确中药有效组分的作用靶点,探讨中药方剂的可能作用机制,为中药现代化研究奠定基础,为中药拓展国际市场提供依据。
目前,海外中药市场上,中国拥有专利权的中药仅为0.3%;全球中药市场销售额一年约800亿美元,中国仅占10%。日本汉药企业借组中医药占领了国际中成药市场的80%,赚取高额利润。将西药的标准用于对中药的研究开发,将药效和化学成分予以标准化呈现,这令全球各国更易接受日本生产的中成药,即“汉药”,这也是日本“汉药”走向世界的根本。
因此,继承和发展传统中药,并与现代医药技术相结合,是中药步入国际市场的关键所在。
三、
技术实现要素:
本发明需要解决的问题是:提供一种复方丹参有效成分组合物及其制备方法和应用。
本发明的技术方案:
1.复方丹参有效成分组合物的组成
本发明所述复方丹参有效成分组合物由丹参酮IIA(Tanshinone IIA,Tan IIA,C19H18O3)、三七皂苷R1(Notoginsenoside R1,NG-R1,C47H80O18)和龙脑(borneol,C10H18O),三者按照不同的比例给出范围进行组合,产生复方丹参有效成分组合物。
丹参的主要有效成分为丹参酮IIA(Tanshinone IIA,C19H18O3),具有改善冠状动脉血循环、血管内皮细胞修复、抗动脉粥样硬化(AS)形成、抗心肌肥厚等作用;主要用于冠心病、心绞痛、心肌梗死的医治,也可用于室性早搏。三七的主要有效成分为三七皂苷R1(Notoginsenoside R1,C47H80O18),具有散瘀止血、消肿定痛的功能。冰片的主要有效成分为龙脑(borneol,C10H18O),具有发 汗、兴奋、镇痉、驱虫和腐蚀等功效。
本发明所述复方丹参有效成分组合物由2mg-4mg丹参酮IIA,10mg-20mg三七皂苷R1,10mg-20mg龙脑混和均匀组成,混和溶液中各有效组分的终浓度分别为丹参酮IIA 0.2-0.4mg/ml,三七皂苷R1 1.0-2.0mg/ml,龙脑1.0-2.0mg/ml。
2.本发明所述复方丹参有效成分组合物的制备方法:
分别称取丹参酮IIA(2mg-4mg)、三七皂苷R1(10mg-20mg)和龙脑(10mg-20mg),混合均匀,加入200μl 95%乙醇置于超声(功率250W,频率33kHz)处理30min促进药物溶解,然后加入2%Tween-20的生理盐水至10ml,置于超声(功率250W,频率33kHz)处理30min,配制成丹参酮IIA、三七皂苷R1和龙脑的混和溶液,混和溶液中各有效组分的终浓度分别为丹参酮IIA0.2-0.4mg/ml,三七皂苷R1 1.0-2.0mg/ml,龙脑1.0-2.0mg/ml。
本发明的有益效果是:
本发明基于临床使用的中药复方进行改造,将其有效成分进行合理组合,产生全新的组合药物,即复方丹参有效成分组合物。该组合物既保留了复方丹参的有效成分,又明确了药物的组成,确保质量的可控性。由于复方丹参片、复方丹参滴丸等为临床使用药物,因此,该组合物又具有可靠的安全性。该组合物具备了创新药物所具有的特征,可制备成治疗老年性痴呆、冠心病、心绞痛、心肌梗死的药物,也可以制备成治疗月经不调、经闭痛经、关节疼痛、疮疡肿痛的药物,还可在制备治疗镇静催眠、慢性肝炎、慢性胆囊炎药物或辅助药物中应用。本发明将中药与现代科学技术相结合,将西药的标准用于中药的研究开发,将药效和化学成分予以标准化呈现,并研究开发出安全、稳定、质量可控的现代中药。该组合物具备了药品的安全性、有效性和质量可控性三大要素。这有利于解决中药与国际医药发展趋势接轨问题,有助于实现中药的现代化和国际化。继承和发展传统中药,并与现代医药技术相结合,是中药步入国际市场的关键所在。
四附图说明
图1、模型小鼠的水迷宫训练期测试结果。在时长为60s的训练期中,实验小鼠的逃离潜伏期(秒),模型组小鼠到达平台所用时间显著增加,经石杉碱甲和复方丹参组合物处理后,相比于模型组小鼠,到达平台所用时间显著下降。数据以均值±SD显示,**p<0.01, compared with control;#p<0.05,##p<0.01,compared with model。
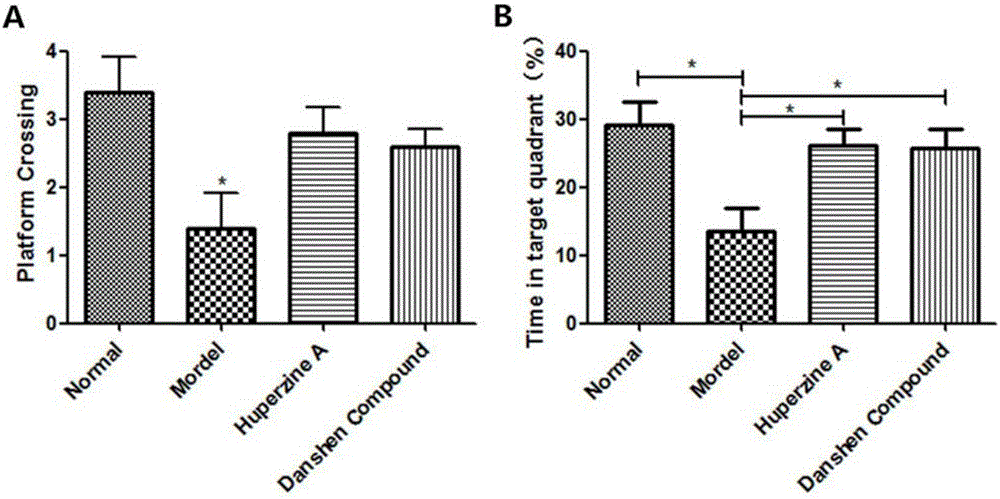
图2模型小鼠在水迷宫空间搜索实验中的检测结果。A:目标平台撤走后,小鼠穿越目标平台位置的次数,模型组小鼠穿越次数明显减少,经石杉碱甲或复方丹参组合物处理后,小鼠穿越平台的次数有所增加;B:小鼠在目标象限所用时间占总测试时间的比例,模型小鼠在目标象限停留时间占比显著减少,而经石杉碱甲或复方丹参组合物处理后,目标象限停留时间占比显著升高。数据以均值±SD显示,*p<0.05。
图3、实验小鼠血清中INF-γ和IL4的ELISA检测结果。A:相比于正常组,模型组小鼠血清中的INF-γ水平显著升高,经石杉碱甲或复方丹参组合物处理后,小鼠血清中的INF-γ水平显著下降;B:各组小鼠血清中IL4含量均没有显著的变化。数据以均值±SD显示,*p<0.05,**p<0.01,ns p>0.05。
图4、复方丹参组合物对D-gal和AlCl3引起的AD小鼠神经细胞的影响。A:经D-gal和AlCl3诱导后,小鼠脑部皮层区的神经细胞着色浅、边缘模糊、形态萎缩,接受石杉碱甲或复方丹参组合物处理后,这一情况得到明显改善;B:模型小鼠海马CA1区的椎体细胞边缘模糊、结构松散,经石杉碱甲或复方丹参组合物处理后,细胞的边缘清晰、排列紧密。
图5、MIF诱导SH-SY5Y细胞的MTT检测结果。为了观察MIF对SH-SY5Y细胞的作用,加入梯度剂量的MIF诱导36h,呈剂量依赖性使细胞活力下降。数据以均值±SD显示,***p<0.001,compared with control。
图6、复方丹参组合物及其组分孵育SH-SY5Y的MTT检测结果。为了观察复方丹参组合物及其组分对细胞活力是否有影响,分别以梯度剂量的丹参酮IIA(Tan IIA)、三七皂苷R1(NG-R1)、龙脑(Borneol)以及复方丹参有效组分复合物(Danshen Compound)诱导36h,A-D:分别为Tan IIA,NG-R1,Borneol及Danshen Compound孵育SH-SY5Y细胞的MTT检测结果,显示细胞的活力均没有显著的影响。数据以均值±SD显示。
图7、复方丹参有效组分及其组合物对MIF诱导SH-SY5Y细胞损伤的MTT检测。预先分别使用4μg/ml Tan IIA、20μg/ml NG-R1、20μg/ml Borneol以及Danshen Compound孵育SH-SY5Y细胞1h,然后加入50ng/ml的MIF进行诱导,Tan IIA以及Danshen Compound能够显著地减缓MIF抑制细胞活力的效果。数据以均值±SD显示,*p<0.05,**p<0.01,***p<0.001。
图8、MIF诱导SH-SY5Y细胞凋亡的流式细胞术检测结果。50ng/ml MIF诱导SH-SY5Y细胞24h,细胞向右偏移,细胞膜通透性增加,Annexin V进入胞质,意味着细胞处于前期凋亡期,呈现出与4μM Aβ1-42相似的促细胞凋亡作用;MIF与Aβ共孵育,向右偏移更加严重,表现出更强的促细胞凋亡作用
图9复方丹参组合物及其组分与MIF共同孵育SH-SY5Y细胞的凋亡实验结果。分别加入4μg/ml丹参酮IIA(Tan IIA)、20μg/ml三七皂苷R1(NG-R1)、20μg/ml龙脑(Borneol)以及复方丹参有效组分复合物(Danshen Compound)预孵育SH-SY5Y细胞1h,然后加入50ng/ml MIF诱导24h,丹参酮IIA、三七皂苷R1以及组合物可显著的减缓MIF促进细胞向右偏移,抑制MIF的促凋亡作用。
图10、MIF诱导SH-SY5Y细胞Bad的蛋白量上调。加入梯度剂量的MIF 诱导SH-SY5Y细胞6h,MIF呈现出剂量依赖性促进Bad含量的上调。数据以均值±SD显示,**p<0.01,***p<0.001,compared with control。
图11、复方丹参组合物及其组分抑制MIF诱导SH-SY5Y的Bad上调作用。分别加入4μg/ml丹参酮IIA(Tan IIA)、20μg/ml三七皂苷R1(NG-R1)、20μg/ml龙脑(Borneol)以及复方丹参有效组分复合物(Danshen Compound)预培养SH-SY5Y细胞30min,然后加入50ng/ml MIF诱导细胞6h,Tan IIA、NG-R1以及Danshen Compound呈现出显著抑制MIF促进Bad水平上调的作用。数据以均值±SD显示,*p<0.05,***p<0.001。
五、具体实施方式
1.药理实验
(1)复方丹参有效成分组合物对AlCl3和D-半乳糖诱导的AD小鼠的空间学习及记忆能力研究
所有研究均获得实验动物伦理委员会许可,并遵循实验动物伦理学指南相关要求。使用AlCl3和D-半乳糖腹腔注射10mg/kg AlCl3和60mg/kg D-半乳糖,持续90天,构建Alzheimer小鼠模型。
在此基础上,分别对模型组、石杉碱甲阳性药物组、复方丹参有效成分组合物给药组的实验小鼠,灌胃给药持续两周。
32只三周龄的雄性BALB/c小鼠(购于南京大学模式动物研究所),体重16±2g,随机分成4组,分别标记为A、B、C和D四组,每组8只。A为正常组,腹腔注射生理盐水,B-D为AlCl3和D-半乳糖干预组,腹腔注射10mg/kg AlCl3和60mg/kg D-半乳糖,持续90天。造模结束后,A、B组灌胃注射生理盐水,C组灌胃给药0.05mg/kg石杉碱甲(Hupeizine A),D组灌胃给药复方丹参有效成分组合物,每只小鼠每天给药一次,每次0.2ml,实际给药量为4mg/kg丹参酮IIA、20mg/kg三七皂苷R1和20mg/kg龙脑。造模和治疗期间,正常供给水和食物,定期称量体重;给药结束后,进行行为学以及生化指标的检测。
小鼠给药结束后,通过水迷宫实验进行行为学检测,观察小鼠的学习、记忆和信息整理情况。测试开始前5天,每天通过4次训练和引导,帮助实验鼠记忆水池中平台的位置,并记录他们的行经和到达平台所需的时间;第6天测试学习和记忆能力,移除平台,观察和记录模型鼠在目标想象的停留时间和经过次数,以及记录原平台位置的穿越次数。通过分析穿越平台数、目标象限停留时间和路程,判断模型鼠的学习和记忆能力是否受损。
(2)复方丹参有效成分组合物对AlCl3和D-半乳糖诱导的AD小鼠血清中IL-4和IFN-γ含量的影响
使用乙醚麻醉小鼠,采用小鼠摘眼球方法取血,取血前先将小鼠胡须剪去以免溶血发生。血液室温静置2h,然后在12000rpm,4℃条件下离心15min,取离心后得到的上层血清进行ELISA检测。
实验采用双抗体夹心ELISA,使用ELISA检测盒(Mouse IL-4ELISA Kit 96T,Mouse IFN-gamma ELISA Kit,联科生物技术有限公司),分别检测血清中IL4和INF-γ的含量并进行统计分析。用待测因子的高特异性单克隆抗体,提前包被在高亲和力的酶标版上,加入适度稀释的样本和标准品,其中的因子会与其单抗结合,洗去游离成分;加入生物素化的抗小鼠单克隆抗体,其余结合在单抗上的因子形成免疫复合物,洗去未结合的成分;加入辣根过氧化物酶标记的亲和素,生物素与亲和素特异性结合,洗去未游离的酶结合物;然后加入显色液,若反应孔中有待测因子,辣根过氧化酶会致无色的显色液呈蓝色;加终止液后变黄。在Safire酶标仪上检测在波长450nm下的OD值(OD 450)。待测因子浓度与OD值呈正比。通过绘制标准曲线,计算出样本中待测因子浓度。
(3)复方丹参有效成分组合物对AlCl3和D-半乳糖诱导的AD小鼠大脑皮层和海马区的中枢神经细胞形态的影响
小鼠断颈处死后,采用尼氏染色法观察小鼠大脑皮层和海马区的中枢神经细胞的形态,了解小鼠脑部的健康状况。小鼠处死后灌注4%多聚甲醛并取整脑浸泡24h固定。将脑组织用石蜡包埋,用冰冻切片机冠状切片,片厚4-6μm。二甲苯脱蜡,分别用无水乙醇、90%乙醇和70%乙醇浸泡。清洗后置于尼氏体染色液中浸泡5min,接着分别浸泡于95%乙醇和70%乙醇,脱水晾干,中性树胶封片。在普通光学显微镜下拍照并观察神经细胞的形态变化。
(4)复方丹参有效成分及其组合物对MIF诱导的人神经瘤母细胞SH-SY5Y损伤的保护作用
通过外源加入MIF诱导人神经瘤母细胞SH-SY5Y,使用MTT细胞活力检测方法、流式细胞技术及Western blot技术检测MIF对神经细胞凋亡作用及其机制。同时,加入复方丹参有效成分及其组合物,检测其是否具有保护作用。
人神经瘤母细胞SH-SY5Y获赠于张辰宇实验室(南京大学生命科学学院)。 细胞培养液使用DMEM/F12细胞培养液、胎牛血清、双抗(青霉素、链霉素)按89:10:1的比例配制而成。细胞在37℃、含5%CO2的培养箱中培养至汇合度80%时,用胰酶消化细胞1min,加入细胞培养液终止消化,在1000rpm条件下离心5min,弃上清。
加入细胞培养液重悬细胞并混匀,分至6孔(Western blot实验)或96孔细胞板(MTT实验和细胞凋亡实验)中,待细胞贴壁后,弃掉细胞培养液。分别加入1ml(6孔板)或100μl(96孔板)预先配制的、工作浓度为4μg/ml丹参酮IIA、20μg/ml三七皂苷R1、20μg/ml龙脑以及复方丹参有效成分组合物溶液(含4μg/ml丹参酮IIA、20μg/ml三七皂苷R1、20μg/ml龙脑),处理1h(MTT实验和细胞凋亡实验)或30min(Western blot实验),然后每孔加入5μl(6孔板)或0.5μl(96孔板)10μg/ml MIF(实际工作浓度为50ng/ml)诱导6h(Western blot实验)、24h(细胞凋亡实验)以及36h(MTT实验)。接下来,进一步进行MTT检测、细胞凋亡检测和Western blot检测。
(A)MTT检测
采用MTT方法,使用Safire酶标仪测定光吸收值OD 570值,间接反映活细胞的数量。
在上述细胞培养液中,再加入10μl浓度为5mg/ml的MTT溶液(用无菌PBS配制,135mM NaCl,2.7mM KCl,1.5mM KH2PO4,8mM K2HPO4,pH 7.4),继续培养4h。终止培养,小心吸弃孔内培养上清液。每孔加入150μl DMSO低速震荡混匀10min,使结晶充分溶解。选择570nm波长,在Safire酶标仪上检测各孔光吸收值OD 570,记录结果,以时间为横坐标,吸光值为纵坐标绘制细胞生长曲线。
(B)细胞凋亡检测
采用Annexin V/PI双染色法,使用BD Accuri C6流式细胞仪检测细胞凋亡。Annexin V是一种Ca2+依赖性的磷脂结合蛋白,与磷脂酰丝氨酸(PS)有高度亲和力,通过与凋亡早期细胞的外侧暴露的PS结合。对Annexin V进行荧光素(FITC)标记,利用流式细胞仪可检测细胞早期凋亡的发生。碘化丙啶(Propidium Iodide,PI)是一种核酸染料,不能透过完整的细胞膜,却可透过凋亡中晚期的细胞和死细胞,而将细胞核染色。将Annexin V与PI合用,可区分处于不同凋亡 时期的细胞。
在上述细胞培养液中,用无EDTA胰酶消化贴壁细胞1min,加入培养液终止消化,轻轻吹打至细胞脱落。在300g,4℃条件下离心5min,弃上清,收集细胞。然后用预冷的PBS(135mM NaCl,2.7mM KCl,1.5mM KH2PO4,8mM K2HPO4,pH 7.4)洗涤细胞两次,每次在300g,4℃条件下离心5min,收集细胞。根据AnnexinV-FITC/PI细胞凋亡试剂盒(Vazyme Biotech Co.,Ltd)的操作步骤,加入100μl Binding buffer重悬细胞,然后加入5μl AnnexinV-FITC和5μl PI Staining Solution,轻轻混匀;避光,室温反应10min。补加400μl Binding buffer混匀,样品在1小时内用BD Accuri C6流式细胞仪检测。
激发波长为488nm,Annexin V-FITC在FL1通道检测,PI在FL3通道检测。运用BD Accuri C6流式细胞仪自带的CFlow软件进行分析,绘制单色散点图,FL1为横坐标,FL3为纵坐标。
(C)Western Blot检测
在上述细胞培养液中,将培养液吸出,用预冷的PBS(135mM NaCl,2.7mM KCl,1.5mM KH2PO4,8mM K2HPO4,pH 7.4)洗一遍,每孔加入500μl胰酶消化1min,加入培液终止消化,将细胞收集到1.5ml EP管中,1000rpm离心5min;弃上清,再加入1ml预冷的PBS重悬,同条件离心5min;弃上清,加入80-100μl含蛋白酶抑制剂的细胞裂解液混匀,置于冰上裂解30min,离心取蛋白上清。
通过BCA法进行蛋白定量,选择562nm波长,在Safire酶标仪上检测各孔光吸收值OD562,将数据制作成标准曲线,计算出每个样品的总蛋白量。
全蛋白经过SDS-PAGE电泳分离后,采用半干法转至PVDF膜。之后,将PVDF膜置于1×TBS缓冲液中洗5min,加入含5%脱脂奶粉的1×TBS室温封闭1h。裁剪含目标蛋白和内参蛋白的PVDF膜,用1×TBST缓冲液漂洗5×3min。将一抗用含5%BSA的1×TBST稀释,孵育一抗,4℃缓慢摇动过夜,用1×TBST洗膜5×3min。用含5%BSA的1×TBST稀释二抗,加入二抗,室温孵育1h,用1×TBST洗膜5×3min。使用ECL显影液,在Tanon5200全自动化学发光成像分析系统显示蛋白条带;用Image J v4.7软件分析并获得蛋白灰度值。
(5)数据统计分析
利用GraphPad Prism 5.0软件进行统计分析。实验数据用均值±标准差(SD) 表示。水迷宫的组间逃离潜伏期数据使用two-way ANOVA分析,其他数据多组间差异使用one-way ANOVA分析,两两间差异使用T检验。结果p值小于0.05表示比较差异具有统计学意义。
(6)实验结果
(A)复方丹参有效成分组合物对D-gal和AlCl3诱致小鼠学习记忆障碍的改善作用
水迷宫实验结果如图1和2所示。研究结果表明,模型组小鼠的逃避潜伏期并没有明显的趋势变化,说明学习和记忆能力受到损害;经过石杉碱甲和复方丹参有效成分组合物治疗后,小鼠找到目标平台的所使用的时间均比模型组短,表明复方丹参有效成分组合物可以修复小鼠受损的空间学习能力(p<0.01)(图1)。
实验小鼠经过5天的学习记忆训练后,进行空间摸索实验。撤出目标平台后,图2A显示AD鼠穿越目标平台的次数比正常组显著减少,接受石杉碱甲和复方丹参有效成分组合物治疗后,穿越平台位置的次数较模型组增多。图2B显示石杉碱甲和复方丹参有效成分组合物组较AD组,在目标象限的时间显著增长,说明复方丹参有效成分组合物可修复小鼠因长期摄入AlCl3及D-Gal而受损的学习及记忆能力(p<0.01)。
(B)复方丹参有效成分组合物对D-gal和AlCl3诱导小鼠INF-γ相关炎症的缓解作用
炎症反应伴随着AD的发生和发展。ELISA检测结果显示,AD模型小鼠血浆里的INF-γ水平显著升高(图3A),而IL4含量无明显变化(图3B),说明AlCl3及D-Gal的慢性诱导会引起小鼠体内INF-γ相关的炎症反应,而对IL4相关的炎症作用并无显著影响。石杉碱甲和复方丹参有效成分组合物能够显著降低AD小鼠血清中IFN-γ的含量(p<0.05)(图3A)。这说明复方丹参组合物可缓解AD小鼠体内与INF-γ相关的炎症反应。
(C)复方丹参有效成分组合物对D-gal和AlCl3致小鼠神经损伤的修复作用
神经元丢失是AD发生和发展的病因之一,通过观察尼氏体可以了解模型动物脑部的神经元形态。
尼氏染色结果显示,正常小鼠大脑皮层的尼氏体着色深、神经元形态清晰,表示神经细胞的蛋白质合成作用旺盛;模型组的尼氏体着色浅、形态萎缩。石杉 碱甲和复方丹参有效成分组合物组的AD小鼠大脑皮层的尼氏体着色深,神经元形态清晰、分布均匀,神经细胞数量较模型组显著增多,形态更充盈(图4A);而且,AD小鼠脑部海马CA1区的神经元结构比模型组更紧凑,边缘更清晰,染色较深,细胞的形态得到明显的改善(图4B)。
(D)复方丹参有效组分及其组合物对MIF诱导SH-SY5Y细胞损伤的影响
(a)复方丹参有效组分及其组合物对MIF诱导SH-SY5Y细胞损伤的作用
首先,使用不同浓度的MIF处理SH-SY5Y细胞,孵育36h。之后,采用MTT方法检测MIF对SH-SY5Y细胞生长的影响。图5显示,MIF显著地呈剂量依赖性抑制SH-SY5Y细胞的生长。而且,MIF浓度为50ng/ml时,能够显著抑制SH-SY5Y细胞的生长。
其次,使用不同浓度的复方丹参有效组分及其组合物,处理SH-SY5Y细胞,孵育36h之后,采用MTT方法,检测复方丹参有效组分及其组合物对SH-SY5Y细胞生长的影响。图6显示,在一定浓度范围内,复方丹参有效组分及其组合物对细胞几乎没有毒性。而且,丹参酮IIA、三七皂苷R1和龙脑的浓度分别为4μg/ml、20μg/ml和20μg/ml时可能有效较小。
最后,进一步使用终浓度为4μg/ml丹参酮IIA、20μg/ml三七皂苷R1、20μg/ml龙脑以及复方丹参有效组分复合物(含4μg/ml丹参酮IIA、20μg/ml三七皂苷R1和20μg/ml龙脑),分别孵育SH-SY5Y细胞1h,再加入50ng/ml MIF诱导细胞36h,MTT检测复方丹参有效组分及其组合物对MIF诱导SH-SY5Y细胞损伤的作用。结果如图7所示,丹参酮IIA与组合物组对MIF诱导SH-SY5Y细胞损伤具有显著的保护作用。
(b)复方丹参有效组分及其组合物对MIF诱导SH-SY5Y细胞凋亡的影响
MIF是一种炎症介导因子,有研究显示,AD患者的脑部MIF含量比正常人高。为了研究MIF对神经元的影响,采用流式细胞技术检测MIF对细胞的凋亡作用。寡聚化的Aβ1-42对神经细胞有显著的毒性作用,可作为神经细胞凋亡实验的阳性指标。图8显示,分别用4μM寡聚化的Aβ1-42和50ng/ml MIF孵育以及共孵育细胞24h,采用Annexin V-FITC/PI双染方法进行检测,发现Aβ1-42和MIF能够分别促进SH-SY5Y细胞发生早期凋亡,共孵育可诱导细胞发生大部分早期凋亡以及少部分晚期凋亡。可见,终浓度为50ng/ml的MIF能够诱导SH-SY5Y 细胞凋亡。
类似地,采用Annexin V-FITC/PI双染方法检测复方丹参有效组分及其组合物对MIF诱导SH-SY5Y细胞凋亡的作用。分别加入终浓度为4μg/ml丹参酮IIA、20μg/ml三七皂苷R1、20μg/ml龙脑以及复方丹参有效成分组合物(含4μg/ml丹参酮IIA、20μg/ml三七皂苷R1和20μg/ml龙脑),孵育SH-SY5Y细胞1h,然后加入50ng/ml MIF诱导刺激细胞24h。图9显示,丹参酮IIA、三七皂苷R1以及组合物可以改善MIF对细胞的损伤作用,能够有效地保护细胞。以及组合物可显著的减缓MIF促进细胞向右偏移,抑制MIF的促凋亡作用。
(c)复方丹参有效组分及其组合物抑制SH-SY5Y细胞凋亡的分子机制
首先,采用Western Blot方法,检测MIF诱导SH-SY5Y细胞中Bad的表达。使用浓度梯度的MIF孵育SH-SY5Y细胞,6h后收样,通过Western Blot检测细胞的Bad蛋白量。图10显示,MIF呈剂量浓度依赖性促进细胞Bad蛋白量上调。而且,MIF浓度为50ng/ml时,能够显著地诱导SH-SY5Y细胞中Bad表达上升。
其次,采用Western Blot方法,检测复方丹参有效成分及其组合物对MIF诱导SH-SY5Y细胞Bad表达上调的作用。分别加入终浓度为4μg/ml丹参酮IIA、20μg/ml三七皂苷R1、20μg/ml龙脑以及复方丹参有效成分组合物(含4μg/ml丹参酮IIA、20μg/ml三七皂苷R1和20μg/ml龙脑),预培养SH-SY5Y细胞30min,再加入终浓度为50ng/ml的MIF诱导6h。如图11所示,丹参酮IIA、三七皂苷R1和组合物均能够显著地抑制MIF致SH-SY5Y细胞中Bad表达量的上升。
复方丹参组合物治疗,可显著缓解AlCl3和D-gal诱致小鼠的神经毒性作用、降低炎症反应、修复小鼠智力。而且,复方丹参组合物能够使MIF诱导人神经瘤母细胞SH-SY5Y的Bad表达量下降,干预MIF诱导的细胞凋亡。结果显示,复方丹参组合物具有一定的神经保护作用。
2动物实验(体内实验)
所有研究均获得实验动物伦理委员会许可,并遵循实验动物伦理学指南相关要求。
BALB/c纯系小鼠(购自南京大学模式动物中心),清洁级,体重16±2g,雄性。适应性喂养。
32只三周龄的雄性balb/c小鼠(购于南京大学模式动物研究所),体重16±2g, 随机分成4组,分别标记为A、B、C和D四组,每组8只。
A组为正常组,腹腔注射生理盐水,持续90天;B、C和D三组为AlCl3和D-半乳糖(D-Galactose,D-Gal)干预组(AD小鼠模型组),持续90天。
BALB/c小鼠(A组,正常组)
BALB/c纯系小鼠(购自南京大学模式动物中心),清洁级,体重16±2g,雄性。腹腔注射生理盐水,持续90天。
AlCl3和D-半乳糖致Alzheimer’s disease小鼠模型的构建(AD小鼠模型组)
分别称取10mg AlCl3和60mg D-Gal,共溶于10ml生理盐水中,配制成AlCl3和D-半乳糖混和溶液(含1mg/ml AlCl3和6mg/ml D-gal)。
实验前一天,剔去小鼠腹部的毛。次日,腹腔注射已经配制的AlCl3和D-半乳糖混和溶液。每只小鼠每次腹腔注射0.2ml,实际上,小鼠体内的终浓度为10mg/kg AlCl3和60mg/kg D-Gal。持续90天。
造模结束后,A组灌胃注射生理盐水0.2ml(即正常组),B组灌胃注射生理盐水0.2ml(即AD模型组),C组灌胃给药0.2ml石杉碱甲(即阳性药组),D组灌胃给药0.2ml复方丹参有效成分组合物(即实验用药组),持续两周。
石杉碱甲(Hupeizine A)阳性药物实验(阳性药物组)
精密称取5mg石杉碱甲,加入1ml 95%乙醇置于超声(功率250W,频率33kHz)处理30min促进药物溶解。然后加入2%Tween-20的生理盐水至10ml,置于超声(功率250W,频率33kHz)处理30min,制成100×的石杉碱甲溶液0.5mg/ml,使用时用含2%Tween-20的生理盐水稀释至0.005mg/ml。
取AD小鼠8只,每只小鼠每天灌胃给药一次,每次0.2ml,实际给药浓度为10mg/kg。持续两周。
复方丹参有效成分组合物的制备与给药(简称组合物给药组)
根据中国药典2015年版第一部规定,每片复方丹参片规格要求如下:丹参以丹参酮IIA计,含量不得少于0.6mg;三七以人参皂苷Rg1、人参皂苷Rb1、三七皂苷R1以及人参皂苷Re总量计不得少于6.0mg;冰片无规定标准。每天推 荐服用9片,按人体重60kg计算,小鼠的药物摄入量应为:丹参酮IIA=0.6mg/60kg×9×12.33=1.1097mg/kg;三七皂苷R1=6mg/kg×9×12.33=11.097mg/kg。
同时,参考文献数据,进而确定复方丹参有效成分组合物的最终给药浓度为4mg/kg丹参酮IIA、20mg/kg三七皂苷R1和20mg/kg龙脑。
实际上,分别称取4mg丹参酮IIA、20mg三七皂苷R1和20mg龙脑,混合,加入200μl 95%乙醇置于超声(功率250W,频率33kHz)处理30min,促进药物溶解,然后加入2%Tween-20的生理盐水至10ml,置于超声(功率250W,频率33kHz)处理30min,配制成丹参酮IIA、三七皂苷R1和龙脑的混和溶液,混和溶液中各有效组分的终浓度分别为丹参酮IIA0.4mg/ml,三七皂苷R1 2.0mg/ml,龙脑2.0mg/ml。
取AD小鼠8只,每只每次灌胃给药0.2ml药液,每日给药一次。实际给药剂量丹参酮IIA为4mg/kg、三七皂苷R1为20mg/kg和龙脑为20mg/kg。持续两周。
造模和治疗期间,各组小鼠在相同环境下正常饲养,喂食SPF维持型鼠粮和双蒸水,定期称量体重。
3细胞实验(体外实验)
(1)TBS缓冲液的制备
用天平称取6g三羟甲基氨基甲烷(Tris)和9g NaCl。先将6g Tris倒入广口瓶,加蒸馏水约800-900ml,搅动,使Tris充分溶解后,用注射器抽取约5ml 37%浓盐酸,注入约3.8ml,搅动,用pH计测pH值。根据pH值再滴加盐酸,边滴边搅,直至pH值为7.6。再加入9g NaCl搅拌,待完全溶解后加蒸馏水至1000ml。得到由Tris配制的缓冲生理盐水(即TBS缓冲液)。
(2)PBS缓冲液的配制
称7.9g NaCl、0.2g KCl、0.24g KH2PO4和1.8g K2HPO4,溶于800ml蒸馏水中,用HCl调节溶液的pH值至7.4,最后加蒸馏水定容至1L,得到PBS(135mM NaCl,2.7mM KCl,1.5mM KH2PO4,8mM K2HPO4,pH 7.4)缓冲液。保存于4℃冰箱中即可。
(3)MTT溶液的配制
称取MTT 0.5克,溶于100ml的磷酸缓冲液(PBS)中,用0.22μm滤膜过滤以除去溶液里的细菌,得到浓度为5mg/ml的MTT溶液。4℃避光保存待用。
(4)细胞培养液的配制
使用DMEM/F12细胞培养基、胎牛血清和双抗(青霉素、链霉素)按89:10:1的比例配制而成。
(5)诱导剂配制
将0.1mg Aβ1-42干粉溶于DMSO配制为浓度4mM的母液,于-20℃储存;使用前取5μl母液加入35μl 1×PBS稀释成浓度为500μM,并于37℃静置3天,使其寡聚化;使用时取8μl浓度为500μM的Aβ1-42与1ml细胞培养液混匀,制成4μM寡聚化的Aβ1-42溶液。
将2μg MIF溶于0.2ml含有0.1%BSA的无菌1×PBS中,混匀制成浓度为10μg/ml的母液,于-20℃储存,使用时取5μl浓度10μg/ml的MIF溶液与1ml细胞培养液混匀制成50ng/ml的MIF溶液。
(6)药物配制
称取2mg丹参酮IIA、10mg NG-R1和10mg龙脑,分别加入2ml 95%乙醇溶解,超声(功率250W,频率33kHz)处理30min以促溶,配制成浓度为1mg/ml丹参酮IIA溶液、5mg/ml三七皂苷R1溶液和5mg/ml龙脑溶液,储存待用。使用时,取4μl丹参酮IIA、4μl三七皂苷R1、4μl龙脑溶液,分别与1ml细胞培养液混匀,制成4μg/ml丹参酮IIA工作液、20μg/ml三七皂苷R1工作液和20μg/ml龙脑工作液。
称取2mg丹参酮IIA、10mg三七皂苷R1和10mg龙脑,混合均匀,加入2ml95%乙醇溶解,采用超声处理(功率250W,频率33kHz)30min以促溶,制备出复方丹参有效成分组合物溶液(含1mg/ml丹参酮IIA、5mg/ml三七皂苷R1、5mg/ml龙脑)。取4μl复方丹参有效成分组合物溶液与1ml细胞培养液混匀,制成复方丹参有效成分组合物工作液(含4μg/ml丹参酮IIA、20μg/ml三七皂苷R1、20μg/ml龙脑)。
(7)人神经瘤母细胞SH-SY5Y
人神经瘤母细胞SH-SY5Y获赠于张辰宇实验室(南京大学生命科学学院)。细胞培养液使用DMEM/F12细胞培养液、胎牛血清、双抗(青霉素、链霉素)按89:10:1的比例配制而成。细胞在37℃、含5%CO2的培养箱中培养至汇合度80%时,用胰酶消化细胞1min,加入细胞培养液终止消化,在1000rpm条件下离心5min,弃上清。
加入细胞培养液重悬细胞并混匀,分至6孔(Western blot实验)或96孔细胞板(MTT实验和细胞凋亡实验)中,待细胞贴壁后,弃掉细胞培养液。分别加入1ml(6孔板)或100μl(96孔板)预先配制的、工作浓度为4μg/ml丹参酮IIA、20μg/ml三七皂苷R1、20μg/ml龙脑以及复方丹参有效成分组合物溶液(含4μg/ml丹参酮IIA、20μg/ml三七皂苷R1、20μg/ml龙脑),处理1h(MTT实验和细胞凋亡实验)或30min(Western blot实验),然后每孔加入5μl(6孔板)或0.5μl(96孔板)10μg/ml MIF(实际工作浓度为50ng/ml)诱导6h(Western blot实验)、24h(细胞凋亡实验)以及36h(MTT实验)。接下来,进一步进行MTT检测、细胞凋亡检测和Western blot检测。
(8).实验检测
(A)空间学习及记忆能力检测
小鼠给药治疗结束后,将其安置在已经设定好的水迷宫实验室内24h,熟悉环境;小鼠虽然天生就会游泳,但其厌恶处于水中的状态,将其放入水中,会本能找到平台休息。通过水迷宫的检测,来观察模型鼠的学习、记忆和信息整理情况。测试开始前5天,每天通过4次不同方位的训练和引导,每次训练时间为60s,在平台逗留时间为15s,帮助实验鼠记忆水池中平台的位置,并记录他们的行经和到达平台所需的时间;第6天测试学习和记忆能力,移除平台,观察和记录模型鼠在目标想象的停留时间和经过次数,以及记录原平台位置的穿越次数。通过分析穿越平台数、目标象限停留时间和路程,判断模型鼠的学习和记忆能力是否受损。
(B)血清中INF-γ及IL4的含量检测
采用小鼠摘眼球方法取血,取血前先将小鼠胡须剪去以免溶血发生。取血前,使用乙醚麻醉小鼠,然后用左手抓住小鼠身体,并用拇指和食指抓紧头部使眼球充血突出,然后用小镊子夹住眼球迅速取出,使血液流入EP管并轻按小鼠心脏部位,以获取更多血液,取血完毕后进行断颈处死小鼠。血液室温静置2h,然后在12000rpm,4℃条件下离心15min,小心吸取上清进行ELISA实验。
实验采用双抗体夹心ELISA,使用ELISA检测盒(Mouse IL-4ELISA Kit96T,Mouse IFN-gamma ELISA Kit,联科生物技术有限公司),测定IL4及INF-γ的表达量。
试剂准备
提前20分钟从冰箱中取出试剂盒,平衡至室温;
洗涤液的配制:取2.5ml浓缩洗涤液,加入47.5ml ddH2O,配制成ddH2O洗涤液,涡旋混匀待用;
标准曲线:取0.5ml标准品/标本稀释液(1b)加入冻干标准品(1a)中,制成浓度2000pg/ml,涡旋、待彻底溶解后静置15min。然后进行梯度稀释至标准曲线下的浓度:2000、1000、500、250、125、62.5、31.25、0pg/ml;
生物素化抗体工作液:用生物素化抗体稀释液(2b)稀释浓缩生物素化抗体(2a),稀释比例1:100,待用;
酶结合物工作液:以酶结合物稀释液(3b)稀释浓缩酶结合物(3a),比例为1:100,待用。
实验操作
从平衡至室温的密封袋中,取出所需96孔板;
除空白孔外,分别取血清和不同浓度的标准品100μl加入孔中,用封板胶纸封住反应孔,在37℃孵箱中反应90min;
手动洗板4次:将板中液体倒掉,在卫生纸上拍去孔内残留的液体,每孔加入350μl洗涤液,30s后倒掉,在卫生纸上拍去残留洗液,重复4次;
除空白对照孔外,加入100μl/生物素化抗体工作液,用封板胶纸封住反应孔, 在37℃孵箱中孵育60min;
重复手动洗板4次;
除空白孔外,加入100μl酶结合物工作液。用封板胶纸封住反应孔,在37℃条件下孵育30min;
重复手动洗板4次;
每孔加入100μl显色剂,板子外部包上一层锡箔纸,避光37℃孵箱孵育10-20min。每孔加入100μl终止液,混匀后5min内即刻在Safire酶标仪上测量OD 450值。
(C)脑组织尼氏染色
小鼠断颈处死后,灌注4%多聚甲醛并取整脑浸泡24h固定。将脑组织用石蜡包埋,用冰冻切片机冠状切片,片厚4-6μm。二甲苯脱蜡,分别用无水乙醇、90%乙醇和70%乙醇浸泡。清洗后置于尼氏体染色液尼氏染色液(货号C0117,碧云天生物技术有限公司)中浸泡5min,接着分别浸泡于95%乙醇和70%乙醇,脱水晾干,中性树胶封片。在普通光学显微镜下拍照并观察神经细胞的形态变化。
(D)MTT检测
加入细胞培养液重悬细胞并混匀,分至96孔细胞板中,,每孔约3000个细胞。培养至细胞贴壁后,弃掉培养液,然后分别加入100μl预先配制好的、工作浓度为4μg/ml丹参酮IIA、20μg/ml三七皂苷R1、20μg/ml龙脑和复方丹参有效成分组合物溶液(含4μg/ml丹参酮IIA、20μg/ml三七皂苷R1、20μg/ml龙脑),处理1h,然后加入0.5μl浓度为10μg/ml的MIF到细胞中至工作浓度为50ng/ml诱导36h。
再加入10μl浓度为5mg/ml的MTT溶液(用无菌PBS配制,pH=7.4),继续培养4h。终止培养,小心吸弃孔内培养上清液。每孔加入150μl DMSO低速震荡混匀10min,使结晶充分溶解。选择570nm波长,在Safire酶标仪上检测各孔光吸收值OD570,记录结果,以时间为横坐标,吸光值为纵坐标绘制细胞生长曲线。
(E)细胞凋亡检测
加入细胞培养液重悬细胞并混匀,分至96孔细胞板中,每孔约3000个细胞。培养至细胞贴壁后,弃掉培养液,然后分别加入100μl预先配制好的、工作浓度为4μg/ml丹参酮IIA、20μg/ml三七皂苷R1、20μg/ml龙脑和复方丹参有效成分组合物溶液(含4μg/ml丹参酮IIA、20μg/ml三七皂苷R1、20μg/ml龙脑),处理1h,然后加入0.5μl浓度为10μg/ml的MIF到细胞中至工作浓度为50ng/ml诱导24h。
用无EDTA胰酶消化贴壁细胞1min,加入细胞培养液终止消化,轻轻吹打至细胞脱落。在300g,4℃条件下离心5min,弃上清,收集细胞。然后用预冷的PBS洗涤细胞两次,每次在300g,4℃条件下离心5min,收集细胞。根据AnnexinV-FITC/PI细胞凋亡试剂盒(Vazyme Biotech Co.,Ltd)的操作步骤,加入100μl Binding buffer重悬细胞,然后加入5μl AnnexinV-FITC和5μl PI Staining Solution,轻轻混匀;避光,室温反应10min。补加400μl Binding buffer混匀,样品在1小时内用BD Accuri C6流式细胞仪检测。
激发波长为488nm,Annexin V-FITC在FL1通道检测,PI在FL3通道检测。运用BD Accuri C6流式细胞仪自带的CFlow软件进行分析,绘制单色散点图,FL1为横坐标,FL3为纵坐标。
2.6Western blotting检测
蛋白提取
加入细胞培养液重悬细胞并混匀,分至6孔中,每孔约106个细胞。培养至细胞贴壁后,弃掉培养液,然后分别加入1ml预先配制好的、工作浓度为4μg/ml丹参酮IIA、20μg/ml三七皂苷R1、20μg/ml龙脑和复方丹参有效成分组合物溶液(含4μg/ml丹参酮IIA、20μg/ml三七皂苷R1、20μg/ml龙脑),处理30min,然后加入5μl浓度为10μg/ml的MIF到细胞中至工作浓度为50ng/ml诱导6h。
然后,将培养液吸出,用预冷的PBS(135mM NaCl,2.7mM KCl,1.5mM KH2PO4,8mM K2HPO4,pH 7.4)洗一遍,每孔加入500μl胰酶消化1min,加入培液终止消化,将细胞收集到1.5ml EP管中,1000rpm离心5min;弃上清,再加入1ml预冷的PBS重悬,同条件离心5min;弃上清,加入80-100μl含蛋白酶抑制剂的细胞裂解液混匀,置于冰上裂解30min,离心取蛋白上清。
蛋白定量
从BCA试剂盒中取A、B液根据50:1的比例,配制3ml BCA工作液,并混匀待用,200μl分装,按表1加入标准品和样品;
取8μl浓度为5mg/ml的蛋白质标准品(BSA Standard)与72μl PBS(135mM NaCl,2.7mM KCl,1.5mM KH2PO4,8mM K2HPO4,pH 7.4)配制成浓度为0.5mg/ml混匀待用;
在96孔板上,按表1方案加入样品;
表1 BCA蛋白质定量加样方案
置于摇床上,37℃摇30min,充分反应;
然后在562nm波长下,放入酶标仪测OD值,将数据制作成标准曲线,计算出每个样品的总蛋白量。
目标蛋白检测
按表2的配方制作SDS-PAGE,待胶凝结后,将蛋白样品加至上样孔中,加入电泳液,在浓缩胶90V、分离胶120V的条件下,分离目的蛋白。电泳结束后,使用PVDF膜湿转,加入含15%甲醇的预冷转膜液,置于冰盒中,在300mA恒流条件下转膜90min。转膜结束后,将PVDF膜置于TBS中洗5min,而后加入含5%脱脂奶粉的1X TBS室温封闭1h,根据目标蛋白和内参蛋白的大小,裁剪PVDF膜,然后用1X TBST漂洗3次,每次5min。将目标蛋白的一抗(1:1000for Bad)或内参抗体(1:3000forβ-Actin)按产品说明书中的比例用含5%的BSA的1X TBST稀释,4℃过夜,回收一抗,用1X TBST洗涤蛋白膜3次,每次5min;按1:5000的比例用含5%BSA的1X TBST稀释二抗,室温孵育1h,回收二抗,用1X TBST洗涤蛋白膜3次,每次5min。使用ECL显影液,使用Tanon5200全自动化学发光成像分析系统检测蛋白的丰度。用Image J v4.7软件分析蛋白灰度值。
表2分离胶及浓缩胶配方
10%Separation Gel
(F)统计学处理
利用GraphPad Prism 5.0软件进行统计分析。实验数据用均值±标准差(SD)表示。水迷宫的组间逃离潜伏期数据使用two-way ANOVA分析,其他数据多组间差异使用one-way ANOVA分析,两两间差异使用T检验。结果p值小于0.05表示比较差异具有统计学意义。
- 还没有人留言评论。精彩留言会获得点赞!