一种制备高分子多层水凝胶药物缓释材料的方法与流程
本发明涉及一种高分子聚电解质药物缓释材料的制备方法,更具体的说是涉及一种溶液共挤出制备结构形态可定构、性能可设计、可连续化生产、药物释放行为灵活可控的多层水凝胶药物缓释材料的方法,属于功能复合材料技术领域。
背景技术:
智能水凝胶是一类能够对外界刺激产生响应的水凝胶,即在外界温度、pH、光、磁场、离子浓度、电场、压力、生物分子等因素变化时,其形态结构或性质亦随之发生改变。这一响应特性使智能水凝胶在环境响应型药物缓释材料的制备中发挥重要作用,受到学者们的广泛关注。
例如,基于聚N-异丙基丙烯酰胺(PNIPAM)制备的温敏型水凝胶,能通过改变温度实现凝胶网络的收缩和舒展,实现对所载药物的温度响应释放;基于丙烯酸酯类制备的pH敏感型水凝胶,能根据周围环境pH的改变实现凝胶网络的收缩和舒展,进而实现对所载药物的pH响应释放。然而,传统智能水凝胶药物缓释体系存在很多不足:由于其一般为亲水均相体系,所负载药物的释放行为大多为非线性,药物释放初期可能存在药物突释的现象,而释放后期药物浓度往往较低,无法达到治疗效果;制剂形态较为单一,用药剂量及给药方案难以灵活有效调控,无法满足复杂药物释放需求。探讨新型复配给药技术具有重要的理论意义和实际应用价值,正越来越受到学者们的重视。
研究表明,把药物缓释材料设计成多层结构,能有效调控药物的释放行为:(1)药物缓释材料的层状结构有利于实现所载药物的智能控制释放;(2)多层结构的载药体系能在不同层负载不同药物,通过层结构实现对多种药物的协同控制释放;(3)将载药体系设计成层结构,利用层状并联的等效叠加作用有望实现载药材料力学性能的改善。现有多层结构的水凝胶药物缓释材料一般通过层层自组装(layer-by-layer self-assembly,LBL)技术[1-3]制备。Hammond P.T.等利用PEO-PCL形成的微束负载疏水性药物二氯苯氧氯酚,利用氢键在载药微束层表面包覆一层聚丙烯酸(PAA),然后再在PAA层表面通过氢键包覆一层PEO-PCL载药微束层,如此进行PAA和载药微束层的层层组装获得多层载药体系,并实现二氯苯氧氯酚在特定pH下的准匀速释放[4]。2009年,日本的Fujie T.教授等以壳聚糖和海藻酸钠为原材料,通过层层自组装技术合成了用于修复组织损伤的薄膜状“组织创可贴”。研究结果表明,厚度仅为35nm的壳聚糖/海藻酸钠膜弹性模量高达1.1Gpa,并具有良好的柔韧性;将该膜贴附于狗的内脏损伤伤口处7天后,组织损伤完全修复[5]。Serpe M.J.等人以PAA修饰的PNIPAM制备的微凝胶与PAH构筑微凝胶多层膜,将小分子药物盐酸阿霉素负载到微凝胶膜中。与传统PNIPAM凝胶相比,这种多层膜凝胶能实现对所载药物较为稳定的释放,并且温度越高,其释药速率越快[6]。
以上研究虽能克服传统均相水凝胶载药材料给药方案单一的问题,但其制备方式过于繁琐,需要逐层构筑载药材料的层结构,在每层结构构筑时一般要进行该层的干燥或固化交联等过程,工艺复杂,耗时较长,无法满足工业大规模生产的需求;且由于其制备工艺的限制,材料单层厚度和层结构无法灵活调控,难以满足不同药效药物的复配释放需求。为解决这一问题,以期在一次简单加工过程中实现多层水凝胶药物缓释材料层结构的构筑和层状形态的调控,进而实现药物的灵活有效释放和良好复配,迫切需要开发一种新的多层水凝胶药物缓释材料制备技术。如何简便、高效地构建结构形态可定构、性能可设计、可连续化生产、药物释放行为灵活可控的高分子多层水凝胶药物缓释材料,是当今药物载体领域一个亟待解决的问题。
参考文献
[1]Iler R K. Multilayers of colloidal particles. Journal of colloid and interface science, 1966, 21(6): 569-594.
[2] Decher G, Hong J D. Buildup of ultrathin multilayer films by a self-assembly process, consecutive adsorption of anionic and cationic bipolar amphiphiles on charged surfaces. Macromolecular Symposia. 1991, 46(1): 321-327.
[3] Caruso F, Caruso R A, Möhwald H. Nanoengineering of inorganic and hybrid hollow spheres by colloidal templating. Science, 1998, 282(5391): 1111-1114.
[4] Kim B S, Park S W, Hammond P T. Hydrogen-bonding layer-by-layer-assembled biodegradable polymeric micelles as drug delivery vehicles from surfaces. ACS Nano, 2008, 2(2): 386-392.
[5] Fujie T, Matsutani N, Kinoshita M, et al. Adhesive, Flexible, and Robust Polysaccharide Nanosheets Integrated for Tissue-Defect Repair. Advanced Functional Materials, 2009, 19(16): 2560-2568.
[6] Serpe M J, Yarmey K A, Nolan C M, et al. Doxorubicin uptake and release from microgel thin films. Biomacromolecules, 2005, 6(1): 408-413。
技术实现要素:
针对传统方法制备均相水凝胶药物缓释材料的缺点和现有逐层叠加法制备高分子多层水凝胶药物缓释材料方法的不足,本发明的目的旨在提出一种溶液多层共挤出制备结构形态可定构、性能可设计、可连续化生产、药物释放行为灵活可控的高分子多层水凝胶药物缓释材料的方法。该方法能实现高分子水凝胶药物缓释材料的一次连续挤出制备,通过结构设计和调控药物分布使材料具备合理的初始释放浓度和所需的长期释放速率,达到既速效又长效的目的;通过对药物在不同层的浓度梯度和层结构的设计能有效调控药物释放行为,增加给药方案的灵活可调性,满足对药物释放的不同需要;可在聚阴离子高分子共混层A和聚阳离子高分子共混层B中分别加入不同药效的药物,实现不同药物的良好复配释放,满足对药物释放的复配需要;并可实现药物释放性能和力学性能同时提高。该方法同时有生产连续性强、质量稳定、适宜大规模工业化生产的优点。本发明的基本原理是,首先利用挤出机的强剪切搅拌作用,选择合适的聚电解质高分子(即聚阴离子高分子和聚阳离子高分子)溶液浓度和交联剂实现聚电解质高分子溶液的一次连续挤出;利用聚电解质高分子与药物的相互作用设计药物在聚阴离子高分子共混溶液A和聚阳离子高分子共混溶液B中的释放行为,并通过溶液多层共挤出的方式使聚阴离子高分子共混溶液A和聚阳离子高分子共混溶液B交替有序排布形成高分子多层水凝胶药物缓释材料;通过交替层形态结构设计,灵活调控聚阴离子高分子共混层A和聚阳离子高分子共混层B的形态结构,优化药物分散状态,改善药物扩散及释放通道,使得到的高分子多层水凝胶药物缓释材料具备合理的初始释放浓度和所需的长期释放速率,达到既速效又长效的目的。并可在聚阴离子高分子共混溶液A和聚阳离子高分子共混溶液B中分别加入不同药效的药物,实现不同药物的良好复配释放,满足对药物释放的不同需要。本发明从这点出发,在加工方法上致力于简便、高效的实现不同释药行为的聚阴离子高分子共混层A和聚阳离子高分子共混层B的良好交替复配,并通过对材料单层结构和整体层结构的形态调控改变药物释放周期,由此调控药物在高分子多层水凝胶药物缓释材料中的释放行为。具体来讲,本发明是通过组分选择及配比设计药物分别在聚阴离子高分子共混层A和聚阳离子高分子共混层B中的初始释放行为,采用溶液共挤出工艺在分层叠加力场的剪切、拉伸作用调节药物的分散状态,并通过调节聚阴离子高分子共混层A和聚阳离子高分子共混层B的单层结构、层数和相对厚度调控药物的溶出路径和释放周期,使交联后得到的高分子多层水凝胶药物缓释材料的释药行为灵活可调,力学性能也得到同步提高。
本发明基于上述原理,实现上述发明目的所采用的技术方案是:将混合均匀的聚阴离子高分子共混溶液A和聚阳离子高分子共混溶液B在2~80℃下分别经挤出机搅拌挤出,并在汇流器出口处叠合在一起形成初始结构为两层的高分子溶液复合结构,再经过与所述汇流器连接的若干层倍增器的多次层状叠合作用,形成具有聚阴离子高分子共混溶液A和聚阳离子高分子共混溶液B交替排布的多层结构,并密封放置4~96小时完成交联形成高分子多层水凝胶药物缓释材料:
(1)所述聚阴离子高分子共混溶液A为聚阴离子高分子、水、交联剂和药物的共混物,其中聚阴离子高分子指可在水中溶解解离形成带负电荷的高分子聚电解质,为海藻酸钠、硫酸软骨素、聚谷氨酸、羧甲基纤维素钠、果胶酸、肝素、透明质酸、聚丙烯酸中的一种;
(2)所述聚阳离子高分子共混溶液B为聚阳离子高分子、水、交联剂和药物的共混物,其中聚阳离子高分子指可在水中溶解解离形成带正电荷的高分子聚电解质,为壳聚糖、聚赖氨酸、氨基环糊精、明胶、聚乙烯亚胺、阳离子多肽中的一种。
随着层数增加,层界面增多,聚阴离子高分子共混层A和聚阳离子高分子共混层B的层间接触增多,可产生静电相互作用使层间界面结合紧密,提高材料释药行为的可调控性、尺寸稳定性和力学强度。
在上述经过与所述汇流器连接的若干层倍增器的多次层状叠合作用的过程中,制备方法采用本申请人申请的中国专利CN101439576A所公开的由挤出机(A、B)、分配器(C)、层倍增器(D)和出口模(E)构成的微层共挤出装置,其特点是先制备聚阴离子高分子共混溶液A和聚阳离子高分子共混溶液B,然后将聚阴离子高分子共混溶液A和聚阳离子高分子共混溶液B在2~80℃下分别投入微层共挤出装置的两台挤出机(A、B)中,使两股溶液在分配器(C)中叠合,经n个层倍增器(D)的切割和叠加后,从出口模(E)流出,再经过牵引机的牵引,形成交替层状结构的挤出物,将所得挤出物密封放置4~96小时完成交联,即可得到2(n+1)层由聚阴离子高分子共混层A和聚阳离子高分子共混层B连续交替分布的高分子多层水凝胶药物缓释材料。正是依靠多层共挤出机层倍增器的层状叠合作用,实现了高分子多层水凝胶药物缓释材料的层结构调控;聚阴离子高分子共混层A和聚阳离子高分子共混层B的层间静电引力作用,提供了层与层之间的相互作用力,使所制备高分子多层水凝胶药物缓释材料在释药行为灵活可控的同时具有良好的力学性能。
在上述制备高分子多层水凝胶药物缓释材料的方案中,加工温度2~80℃是由于温度低于2℃时溶液易结冰,而温度高于80℃时会使聚阴离子高分子共混溶液A和聚阳离子高分子共混溶液B中的水易于蒸发,部分温敏性药物也容易失效。综合加工过程可行性和药物稳定性考察,其优先选择的加工温度为2~80℃。
在上述制备高分子多层水凝胶药物缓释材料的方案中,将挤出得到的材料密封放置4~96小时是为了使聚阴离子高分子共混溶液A和聚阳离子高分子共混溶液B充分交联。针对本发明所选择的交联剂而言,不同交联剂的交联速率也不相同。大量实验证明,4~96小时为较佳的交联完成时间。交联时间小于4小时会由于材料交联不充分而使其力学性能下降;对于不同交联剂而言,密封放置96小时交联均已完成,交联时间大于96小时易使材料发生失水而变脆。综合材料药物释放行为和力学性能考察,其优先选择的交联时间为4~96小时,也可以根据药物释放和材料性能的需要适当缩短或延长。
在上述制备高分子多层水凝胶药物缓释材料的方案中,所制备的高分子多层水凝胶药物缓释材料实际为片材型药物缓释复合材料,可再根据释药和应用需求裁剪成不同形状和尺寸的药物缓释复合材料,从而满足不同的释药需求。
在上述制备高分子多层水凝胶药物缓释材料的方案中,所述的聚阴离子高分子共混溶液A为将聚阴离子高分子和水按重量百分比1~60%:40~99%,交联剂按聚阴离子高分子重量0.1~30%,药物按聚阴离子高分子和水总重量0.1~40%混合配料,并经真空脱泡搅拌机脱泡搅拌均匀得到。聚阴离子高分子浓度过高或过低,都不利于聚阴离子高分子共混溶液的挤出成型。当聚阴离子高分子浓度低于1%时,共混溶液粘度太低,不能实现其挤出成型;当聚阴离子高分子浓度高于60%时,挤出成型后的共混溶液不能形成均匀凝胶,其力学性能明显下降。交联剂含量选择与聚阴离子高分子种类和交联机理有关,大量实验证明一般交联剂的添加量占聚阴离子高分子重量0.1~30%为宜。药物占聚阴离子高分子和水总重量0.1~40%为较优选择。当药物重量比低于0.1%时,存在释药浓度过低,达不到释药需求的缺点;当药物重量比高于40%时,可能使释药浓度过大,容易引起毒副作用。
在上述制备高分子多层水凝胶药物缓释材料的方案中,所述的聚阳离子高分子共混溶液B为将聚阳离子高分子和水按重量百分比1~60%:40~99%,交联剂按聚阳离子高分子重量0.1~30%,药物按聚阳离子高分子和水总重量0.1~40%混合配料,并经真空脱泡搅拌机脱泡搅拌均匀得到。聚阳离子高分子浓度过高或过低,都不利于聚阳离子高分子共混溶液的挤出成型。当聚阳离子高分子浓度低于1%时,共混溶液粘度太低,不能实现其挤出成型;当聚阳离子高分子浓度高于60%时,挤出成型后的共混溶液不能形成均匀凝胶,其力学性能明显下降。交联剂含量选择与聚阳离子高分子种类和交联机理有关,大量实验证明一般交联剂的添加量占聚阳离子高分子重量0.1~30%为宜。药物占聚阳离子高分子和水总重量0.1~40%为较优选择。当药物重量比低于0.1%时,存在释药浓度过低,达不到释药需求的缺点;当药物重量比高于40%时,可能使释药浓度过大,容易引起毒副作用。
在上述制备高分子多层水凝胶药物缓释材料的方案中,所述的聚阴离子高分子共混溶液A和聚阳离子高分子共混溶液B中的交联剂为可与相应聚阴离子高分子或聚阳离子高分子发生缓慢交联的交联剂,交联从加入相应聚阴离子高分子溶液或聚阳离子高分子溶液起开始,完成时长为4~96小时,分别为碳酸钙—葡萄糖内酯体系、碳酸氢钙、硫酸钙、环氧氯丙烷、京尼平、戊二醛中的一种;其中碳酸钙—葡萄糖内酯体系、碳酸氢钙和硫酸钙为海藻酸钠的交联剂,环氧氯丙烷为壳聚糖和羧甲基纤维素钠的交联剂,京尼平为壳聚糖、聚赖氨酸、氨基环糊精、明胶、聚乙烯亚胺、阳离子多肽的交联剂,戊二醛为上述全部聚阴离子高分子和聚阳离子高分子的交联剂。实验测试表明,所选交联剂的缓慢交联特性使挤出的共混溶液在挤出成型过程中仅产生微交联,有利于提高共混溶液的强度,使其保持良好的可挤出性。
在上述制备高分子多层水凝胶药物缓释材料的方案中,所述的聚阴离子高分子共混溶液A和聚阳离子高分子共混溶液B中的药物分别为布洛芬、头孢氨苄、万古霉素、茶碱、氢氯噻嗪、双氯芬酸钠、硝硫氰胺、对乙酰氨基酚、亚甲基蓝中的一种;其中聚阴离子高分子共混溶液A和聚阳离子高分子共混溶液B中的药物可为同一药物,也可为不同药物。当聚阴离子高分子共混溶液A和聚阳离子高分子共混溶液B中的药物为同一种药物时,多层水凝胶载药体系能通过层结构的改变实现对所载药物释放速率的调控;当为不同药物时,多层水凝胶载药体系能通过对不同层的结构调控实现对所载不同药物释放速率的改变,从而实现对不同药效药物的可控复配释放。在上述制备高分子多层水凝胶药物缓释材料的方案中,所述的高分子多层水凝胶药物缓释材料的性能可通过高分子多层水凝胶药物缓释材料总厚度、内部的总层数、聚阴离子高分子共混溶液A和聚阳离子高分子共混溶液B的厚度比进行调控,从而实现对所载药物灵活有效的控制释放,其中:挤出物的总厚度为0.01-10mm;挤出物的总宽度为10-1000mm;挤出物内部的总层数数目为2-32768;所述聚阴离子高分子共混溶液A和聚阳离子高分子共混溶液B的厚度比为1:99-99:1。挤出物的总厚度可通过出口模厚度进行调控;挤出物内部的总层数可通过叠加单元数目进行调控;聚阴离子高分子共混溶液A和聚阳离子高分子共混溶液B的厚度比可通过两者粘度比以及各自所在挤出机挤出速率比进行调控。
本发明与现有逐层叠加法制备高分子多层水凝胶药物缓释材料的方法相比,概括起来具有以下突出的优点:
1、通过层倍增器的叠加作用可简便实现聚阴离子高分子共混溶液A和聚阳离子高分子共混溶液B的交替层状叠合,从而一次成型连续制备高分子多层水凝胶药物缓释材料。
2、选用不同数量的层倍增器和加工参数,通过调控挤出机转速比设计层结构形态及聚阴离子高分子共混层A和聚阳离子高分子共混层B的厚度比,可灵活调控高分子多层水凝胶药物缓释材料的层数、单层层厚和层数比等参数,进而定构高分子多层水凝胶药物缓释材料的层结构和所需的释放周期,制备性能可控的高分子多层水凝胶药物缓释材料,从而满足不同的释药需求。
3、能精确计算和控制药物负载量,同时溶液挤出的加工方式使药物加入量和加入方式灵活可调,可在聚阴离子高分子共混溶液A和聚阳离子高分子共混溶液B中分别负载两种不同药效和溶解性的药物,实现不同药物的一次加工和智能复配,从而获得不同药效药物的复配可控释放行为。
4、挤出机的强剪切搅拌作用和随后层倍增器的分层叠加力场作用使本发明中聚电解质高分子溶液(即聚阴离子共混溶液A和聚阳离子共混溶液B)的浓度和药物负载量较传统逐层叠加法有更大的选择范围,更高聚电解质高分子溶液浓度(高达60%)可赋予高分子多层水凝胶药物缓释材料更好的力学强度,而更高的药物负载量(高达40%)可赋予高分子多层水凝胶药物缓释材料更高的载药效率。
5、在交替层状叠合过程中层界面处的聚阴离子高分子共混层A和聚阳离子高分子共混层B由于静电吸引而相互扩散并使层间作用力增强,使所制备材料力学性能与均相水凝胶药物缓释材料以及传统层状水凝胶药物缓释材料相比有显著改善,达到材料药物释放性能和力学性能同时提升的目的。
6、该方法是一种连续生产过程,有利于生产效率的提高;工艺简单,不同批次之间的产品质量指标稳定,可大规模工业化生产,应用范围广,具有广阔的工业化和市场前景;实现了聚合物产品高性能化和功能化同一,提高了聚合物产品的附加价值,拓宽了聚合物产品的应用范围,在聚合物复合材料理论研究和应用开发等方面具有重要意义。
附图说明
下面结合附图进一步说明本发明。
图1为本发明所涉及的微层共挤出装置的结构示意图:A,B为挤出机;C为分配器;D为层倍增器;E为出口模。
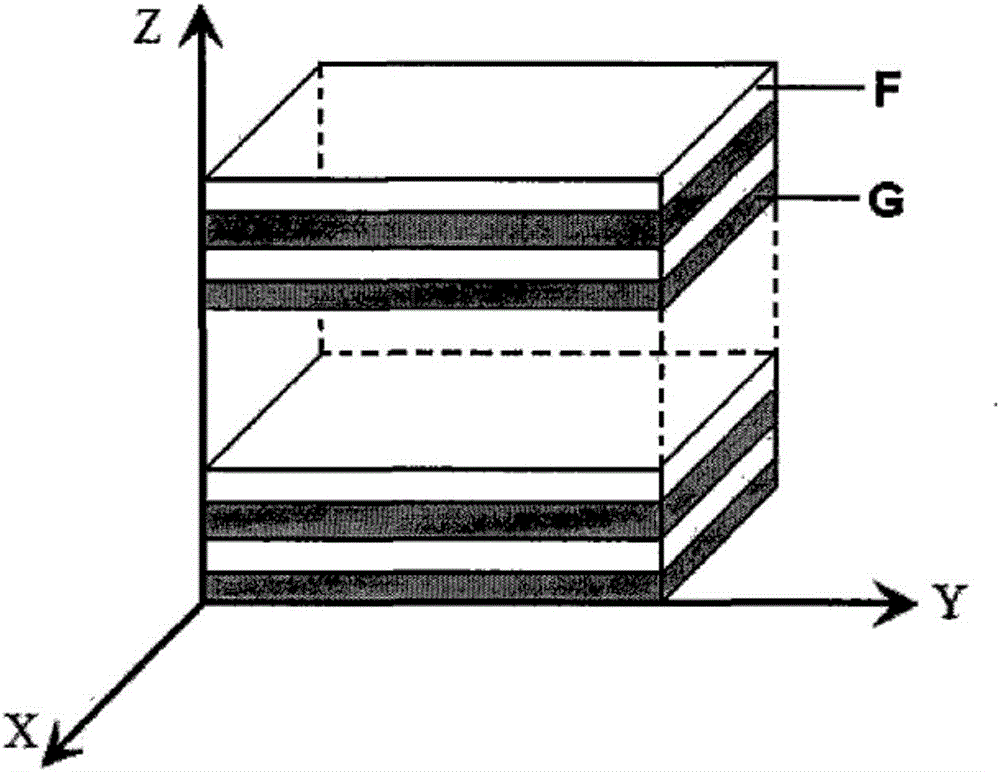
图2为本发明制备的高分子多层水凝胶药物缓释材料的结构放大示意图。在图中,F:聚阳离子高分子溶液,G:聚阴离子高分子溶液。
具体实施方法:
以下通过实施例对本发明进行进一步的具体描述。在以下各实施例中,各组分的用量均为质量用量。有必要在此指出,下面实施例只是对本发明的进一步说明,不能理解为对本发明保护范围的限制,该领域的技术人员可以根据上述本发明内容对本发明进行一些非本质的改进和调整。
实施例1
第一步,将海藻酸钠和水按重量百分比10%:90%,碳酸钙—葡萄糖内酯体系(为海藻酸钠交联剂,其中碳酸钙和葡萄糖内酯的摩尔比为1:2)按海藻酸钠重量的20%,药物亚甲基蓝按海藻酸钠和水总重量4%进行配料,并经真空脱泡搅拌机脱泡搅拌均匀得到聚阴离子高分子共混液A。
将壳聚糖和水按重量百分比10%:90%,京尼平(为壳聚糖交联剂)按壳聚糖质量的10%,药物亚甲基蓝按壳聚糖和水总重量1%进行配料,并经真空脱泡搅拌机脱泡搅拌均匀得到聚阳离子高分子共混液B。
第二步,将上述混合均匀的海藻酸钠共混溶液(聚阴离子高分子共混溶液A)和壳聚糖共混溶液(聚阳离子高分子共混溶液B)在25℃下分别经挤出机搅拌挤出,并在汇流器出口处叠合在一起形成初始结构为两层的高分子溶液复合结构,再经过与所述汇流器连接的4个层倍增器的多次层状叠合作用,形成具有海藻酸钠共混溶液和壳聚糖共混溶液交替排布的32层结构。在此,先说明一下多次层状叠合作用的过程,其制备方法采用本申请人申请的中国专利CN101439576A所公开的由挤出机(A、B)、分配器(C)、层倍增器(D)和出口模(E)构成的微层共挤出装置(图1),其特点是上述混合均匀的海藻酸钠共混溶液和壳聚糖共混溶液分别投入微层共挤出装置的两台挤出机(A、B)中,使两股溶液在分配器(C)中叠合,经4个层倍增器(D)的切割和叠加后,从出口模(E)流出,再经过牵引机的牵引,得到32层由海藻酸钠共混溶液和壳聚糖共混溶液连续交替分布的层状结构。截取长度20mm的挤出物在室温密封放置24小时进行交联形成具有32层交替层结构的高分子多层水凝胶药物缓释材料(图2)。在层倍增器的多次层状叠合作用中海藻酸钠共混溶液和壳聚糖共混溶液形成31个层界面,海藻酸钠和壳聚糖间的静电相互作用使层间界面结合紧密,力学性能良好。所得高分子多层水凝胶药物缓释材料的总层厚为2mm,总宽度为20mm,海藻酸钠共混溶液和壳聚糖共混溶液的层厚比为1:1。
将上述相同组分比的海藻酸钠共混溶液和壳聚糖共混溶液加入真空脱泡搅拌机进行共混脱泡,搅拌均匀后经过不采用微层共挤出装置的普通挤出机进行挤出,再经过牵引机的牵引,得到厚度为2mm、宽度为20mm的海藻酸钠/壳聚糖均相共混挤出物,其挤出温度为25℃。截取长度20mm的挤出物在室温密封放置24小时进行交联,所得到的均相共混高分子水凝胶药物释放材料具有和上述高分子多层水凝胶药物缓释材料相同的物料配比,但其非交替层状结构,而是均相共混结构。选取与高分子多层水凝胶药物缓释材料相同长度的均相共混高分子水凝胶药物释放材料在磷酸盐缓冲液(PBS)中浸泡10小时即释放达60%的药物,表现出明显的突释行为。
而由于本实施例采用了4个层倍增器,其得到的负载药物亚甲基蓝的32层高分子多层水凝胶药物缓释材料24小时释放30%的药物,7天释放90%,显示出更为平缓的可控释放行为和优良的长效释放性能。同时其压缩强度也由均相共混高分子水凝胶药物释放材料的180 kPa提高到400 kPa。说明高分子多层水凝胶药物缓释材料的药物释放行为和压缩强度均得到明显改善,同时实现了药物缓释功能改进和力学性能的提升,使负载药物亚甲基蓝的高分子多层水凝胶药物缓释材料功能化和高性能化得到统一。高分子多层水凝胶药物缓释材料具有更为可控的药物释放行为主要是由于在pH=7.4的PBS缓冲液中,聚阴离子高分子海藻酸钠层与药物亚甲基蓝产生静电吸引使药物在该层释放变缓,而聚阳离子高分子壳聚糖层与亚甲基蓝产生静电排斥使药物在该层释放加快。故而,在PBS缓冲液中浸泡时,材料表面的壳聚糖层会快速释放药物,使材料具有合适的初始释放速率,同时聚阴离子高分子海藻酸钠层的存在避免了突释的发生,显示出良好的初始释放行为;随后内层海藻酸钠和壳聚糖层的药物扩散到高分子多层水凝胶药物缓释材料表面发生释放,在此过程中海藻酸钠层的缓释作用及层状结构的扩散作用使药物在层厚度方向上的扩散和释放趋缓(由于材料厚度远小于长度和宽度尺寸,药物释放速率的决定因素是厚度方向药物的释放行为),释放周期延长,显示出良好的长效释放行为。而且,由于层倍增器的多次层状叠合作用,交替多层共混物中有连续界面存在,由于聚阴离子高分子和聚阳离子高分子的静电引力作用使层界面相容性好,粘接性强,界面作用力大,故而在受外界压缩作用力时,根据层状并联的等效叠加作用可知,界面作用的存在赋予了高分子多层水凝胶药物缓释材料更加优异的压缩性能。故而材料在获得良好释放行为的同时,其强度也得到提升。
可根据实际需要调整实施例1的配方、层厚比和层数,进而获得不同组分比的高分子多层水凝胶药物缓释材料。
实施例2
第一步,将海藻酸钠和水按重量百分比10%:90%,硫酸钙(为海藻酸钠交联剂)按海藻酸钠重量的20%,药物亚甲基蓝按海藻酸钠和水总重量10%进行配料,并经真空脱泡搅拌机脱泡搅拌均匀得到聚阴离子高分子共混液A。
将壳聚糖和水按重量百分比10%:90%,京尼平(为壳聚糖交联剂)按壳聚糖质量的10%,药物亚甲基蓝按壳聚糖和水总重量1%进行配料,并经真空脱泡搅拌机脱泡搅拌均匀得到聚阳离子高分子共混液B。
第二步,将上述混合均匀的海藻酸钠共混溶液(聚阴离子高分子共混溶液A)和壳聚糖共混溶液(聚阳离子高分子共混溶液B)在35℃下分别经挤出机搅拌挤出,并在汇流器出口处叠合在一起形成初始结构为两层的高分子溶液复合结构,再经过与所述汇流器连接的6个层倍增器的多次层状叠合作用,形成具有海藻酸钠共混溶液和壳聚糖共混溶液交替排布的128层结构。在此,先说明一下多次层状叠合作用的过程,其制备方法采用本申请人申请的中国专利CN101439576A所公开的由挤出机(A、B)、分配器(C)、层倍增器(D)和出口模(E)构成的微层共挤出装置(图1),其特点是上述混合均匀的海藻酸钠共混溶液和壳聚糖共混溶液分别投入微层共挤出装置的两台挤出机(A、B)中,使两股溶液在分配器(C)中叠合,经6个层倍增器(D)的切割和叠加后,从出口模(E)流出,再经过牵引机的牵引,得到128层由海藻酸钠共混溶液和壳聚糖共混溶液连续交替分布的层状结构。截取长度20mm的挤出物在室温密封放置24小时进行交联形成具有128层交替层结构的高分子多层水凝胶药物缓释材料(图2)。在层倍增器的多次层状叠合作用中海藻酸钠共混溶液和壳聚糖共混溶液形成127个层界面,海藻酸钠和壳聚糖间的静电相互作用使层间界面结合紧密,力学性能良好。所得高分子多层水凝胶药物缓释材料的总层厚为2mm,总宽度为20mm,控制海藻酸钠共混液层和壳聚糖共混液层挤出速率比为5:1,所得海藻酸钠共混溶液和壳聚糖共混溶液的层厚比为5:1。
将上述相同组分比的海藻酸钠共混溶液和壳聚糖共混溶液按质量分数5:1配料,加入真空脱泡搅拌机进行共混脱泡,搅拌均匀后经过不采用微层共挤出装置的普通挤出机进行挤出,再经过牵引机的牵引,得到厚度为2mm、宽度为20mm的海藻酸钠/壳聚糖均相共混挤出物,其挤出温度为35℃。截取长度20mm的挤出物在室温密封放置24小时进行交联,所得到的均相共混高分子水凝胶药物释放材料具有和上述高分子多层水凝胶药物缓释材料相同的物料配比,但其非交替层状结构,而是均相共混结构。所得到的均相共混高分子水凝胶药物释放材料在磷酸盐缓冲液(PBS)中浸泡24小时即释放达60%的药物,48小时释放93%的药物,表现出明显的突释行为。
而由于本实施例采用了6个层倍增器,其得到的负载药物亚甲基蓝的128层高分子多层水凝胶药物缓释材料24小时释放15%的药物,10天释放92%,显示出更为平缓的可控释放行为和优良的长效释放性能。同时其压缩强度也由均相共混高分子水凝胶药物释放材料的210kPa提高到490 kPa。说明高分子多层水凝胶药物缓释材料的药物释放行为和压缩强度均得到明显改善,同时实现了药物缓释功能改进和力学性能的提升,使负载药物亚甲基蓝的高分子多层水凝胶药物缓释材料功能化和高性能化得到统一。高分子多层水凝胶药物缓释材料具有更为可控的药物释放行为主要是由于在pH=7.4的PBS缓冲液中,聚阴离子高分子海藻酸钠层与药物亚甲基蓝产生静电吸引使药物在该层释放变缓,而聚阳离子高分子壳聚糖层是亚甲基蓝产生静电排斥使药物在该层释放加快。故而,在浸泡到PBS缓冲液时,材料表面的壳聚糖层会快速释放药物,使材料具有合适的初始释放速率,同时聚阴离子高分子海藻酸钠层的存在避免了突释的发生,显示出良好的初始释放行为;随后内层海藻酸钠和壳聚糖层的药物扩散到高分子多层水凝胶药物缓释材料表面发生释放,在此过程中海藻酸钠层的缓释作用及层状结构的扩散作用使药物在层厚度方向上的扩散和释放趋缓(由于材料厚度远小于长度和宽度尺寸,药物释放速率的决定因素是厚度方向药物的释放行为),释放周期延长,显示出良好的长效释放行为。而且,由于层倍增器的多次层状叠合作用,交替多层共混物中有连续界面存在,由于聚阴离子高分子和聚阳离子高分子的静电引力作用使层界面相容性好,粘接性强,界面作用力大,故而在受外界压缩作用力时,根据层状并联的等效叠加作用可知,界面作用的存在赋予了高分子多层水凝胶药物缓释材料更加优异的压缩性能。使得材料在获得良好释放行为的同时,其强度也得到提升。
可根据实际需要调整实施例2的配方、层厚比和层数,进而获得不同组分比的高分子多层水凝胶药物缓释材料。
实施例3
第一步,将透明质酸和水按重量百分比30%:70%,戊二醛(为透明质酸交联剂)按透明质酸重量的5%,药物布洛芬按透明质酸和水总重量30%进行配料,并经真空脱泡搅拌机脱泡搅拌均匀得到聚阴离子高分子共混液A。
将明胶和水按重量百分比20%:80%,戊二醛(为明胶交联剂)按明胶质量的2%,药物布洛芬按明胶和水总重量10%进行配料,并经真空脱泡搅拌机脱泡搅拌均匀得到聚阳离子高分子共混液B。
第二步,将上述混合均匀的透明质酸共混溶液(聚阴离子高分子共混溶液A)和明胶共混溶液(聚阳离子高分子共混溶液B)在25℃下分别经挤出机搅拌挤出,并在汇流器出口处叠合在一起形成初始结构为两层的高分子溶液复合结构,再经过与所述汇流器连接的5个层倍增器的多次层状叠合作用,形成具有透明质酸共混溶液和明胶共混溶液交替排布的64层结构。在此,先说明一下多次层状叠合作用的过程,其制备方法采用本申请人申请的中国专利CN101439576A所公开的由挤出机(A、B)、分配器(C)、层倍增器(D)和出口模(E)构成的微层共挤出装置(图1),其特点是上述混合均匀的透明质酸共混溶液和明胶共混溶液分别投入微层共挤出装置的两台挤出机(A、B)中,使两股溶液在分配器(C)中叠合,经5个层倍增器(D)的切割和叠加后,从出口模(E)流出,再经过牵引机的牵引,得到64层由透明质酸共混溶液和明胶共混溶液连续交替分布的层状结构。截取长度40mm的挤出物在室温密封放置24小时进行交联形成具有64层交替层结构的高分子多层水凝胶药物缓释材料(图2)。在层倍增器的多次层状叠合作用中透明质酸共混溶液和明胶共混溶液形成63个层界面,透明质酸和明胶间的静电相互作用使层间界面结合紧密,力学性能良好。所得高分子多层水凝胶药物缓释材料的总层厚为4mm,总宽度为40mm,控制透明质酸共混液层和明胶共混液层挤出速率比为1:4,所得透明质酸共混溶液和明胶共混溶液的层厚比为1:4。
将上述相同组分比的透明质酸共混溶液和明胶共混溶液按质量分数1:4配料,加入真空脱泡搅拌机进行共混脱泡,搅拌均匀后经过不采用微层共挤出装置的普通挤出机进行挤出,再经过牵引机的牵引,得到厚度为4mm、宽度为40mm的透明质酸/明胶均相共混挤出物,其挤出温度为25℃。截取长度40mm的挤出物在室温密封放置24小时进行交联,所得到的均相共混高分子水凝胶药物释放材料具有和上述高分子多层水凝胶药物缓释材料相同的物料配比,但其非交替层状结构,而是均相共混结构。所得到的均相共混高分子水凝胶药物释放材料在磷酸盐缓冲液(PBS)中浸泡24小时即释放达63%的药物,表现出明显的突释行为。
而由于本实施例采用了5个层倍增器,其得到的负载药物布洛芬的64层高分子多层水凝胶药物缓释材料24小时释放23%的药物,9天释放97%,显示出更为平缓的可控释放行为和优良的长效释放性能。同时其压缩强度也由均相共混高分子水凝胶药物释放材料的230kPa提高到350kPa。说明高分子多层水凝胶药物缓释材料的药物释放行为和压缩强度均得到明显改善,同时实现了药物缓释功能改进和力学性能的提升,使负载药物布洛芬的高分子多层水凝胶药物缓释材料功能化和高性能化得到统一。高分子多层水凝胶药物缓释材料具有更为可控的药物释放行为主要是由于在pH=7.4的PBS缓冲液中,聚阴离子高分子透明质酸层与药物布洛芬产生静电吸引使药物在该层释放变缓,而聚阳离子高分子明胶层与布洛芬产生静电排斥使药物在该层释放加快。故而,在浸泡到PBS缓冲液时,材料表面的明胶层会快速释放药物,使材料具有合适的初始释放速率,同时聚阴离子高分子透明质酸层的存在避免了突释的发生,显示出良好的初始释放行为;随后内层透明质酸和明胶层的药物扩散到高分子多层水凝胶药物缓释材料表面发生释放,在此过程中透明质酸层的缓释作用及层状结构的扩散作用使药物在层厚度方向上的扩散和释放趋缓(由于材料厚度远小于长度和宽度尺寸,药物释放速率的决定因素是厚度方向药物的释放行为),释放周期延长,显示出良好的长效释放行为。而且,由于层倍增器的多次层状叠合作用,交替多层共混物中有连续界面存在,由于聚阴离子高分子和聚阳离子高分子的静电引力作用使层界面相容性好,粘接性强,界面作用力大,故而在受外界压缩作用力时,根据层状并联的等效叠加作用可知,界面作用的存在赋予了高分子多层水凝胶药物缓释材料更加优异的压缩性能。使得材料在获得良好释放行为的同时,其强度也得到提升。
可根据实际需要调整实施例3的配方、层厚比和层数,进而获得不同组分比的高分子多层水凝胶药物缓释材料。
实施例4
第一步,将聚谷氨酸和水按重量百分比20%:80%,戊二醛(为聚谷氨酸交联剂)按聚谷氨酸重量的2%,药物茶碱按聚谷氨酸和水总重量10%进行配料,并经真空脱泡搅拌机脱泡搅拌均匀得到聚阴离子高分子共混液A。
将聚赖氨酸和水按重量百分比15%:85%,京尼平(为聚赖氨酸交联剂)按聚赖氨酸质量的10%,药物布洛芬按聚赖氨酸和水总重量10%进行配料,并经真空脱泡搅拌机脱泡搅拌均匀得到聚阳离子高分子共混液B。
第二步,将上述混合均匀的聚谷氨酸共混溶液(聚阴离子高分子共混溶液A)和聚赖氨酸共混溶液(聚阳离子高分子共混溶液B)在40℃下分别经挤出机搅拌挤出,并在汇流器出口处叠合在一起形成初始结构为两层的高分子溶液复合结构,再经过与所述汇流器连接的5个层倍增器的多次层状叠合作用,形成具有聚谷氨酸共混溶液和聚赖氨酸共混溶液交替排布的64层结构。在此,先说明一下多次层状叠合作用的过程,其制备方法采用本申请人申请的中国专利CN101439576A所公开的由挤出机(A、B)、分配器(C)、层倍增器(D)和出口模(E)构成的微层共挤出装置(图1),其特点是上述混合均匀的聚谷氨酸共混溶液和聚赖氨酸共混溶液分别投入微层共挤出装置的两台挤出机(A、B)中,使两股溶液在分配器(C)中叠合,经5个层倍增器(D)的切割和叠加后,从出口模(E)流出,再经过牵引机的牵引,得到64层由聚谷氨酸共混溶液和聚赖氨酸共混溶液连续交替分布的层状结构。截取长度40mm的挤出物在室温密封放置12小时进行交联形成具有64层交替层结构的高分子多层水凝胶药物缓释材料(图2)。在层倍增器的多次层状叠合作用中聚谷氨酸共混溶液和聚赖氨酸共混溶液形成63个层界面,聚谷氨酸和聚赖氨酸间的静电相互作用使层间界面结合紧密,力学性能良好。所得高分子多层水凝胶药物缓释材料的总层厚为1mm,总宽度为20mm,控制聚谷氨酸共混溶液层和聚赖氨酸共混溶液层挤出速率比为1:1,两层的层厚比为1:1。
将上述相同组分比的聚谷氨酸共混溶液和聚赖氨酸共混溶液按质量分数1:1配料,加入真空脱泡搅拌机进行共混脱泡,搅拌均匀后经过不采用微层共挤出装置的普通挤出机进行挤出,再经过牵引机的牵引,得到厚度为1mm、宽度为20mm的聚谷氨酸/聚赖氨酸均相共混挤出物,其挤出温度为40℃。截取长度40mm的挤出物在室温密封放置12小时进行交联,所得到的均相共混高分子水凝胶药物释放材料具有和上述高分子多层水凝胶药物缓释材料相同的物料配比,但其非交替层状结构,而是均相共混结构。所得到的均相共混高分子水凝胶药物释放材料在磷酸盐缓冲液(PBS)中浸泡24小时即释放50%的布洛芬、81%的茶碱,表现出明显的突释行为。
而由于本实施例采用了5个层倍增器,其得到的负载两种药物的64层高分子多层水凝胶药物缓释材料24小时即释放21%的布洛芬、29%的茶碱,8天释放95%的布洛芬、84%的茶碱,显示出更为平缓的可控释放行为和优良的长效释放性能。同时其压缩强度也由均相共混高分子水凝胶药物释放材料的150 kPa提高到250 kPa。说明高分子多层水凝胶药物缓释材料的药物释放行为和压缩强度均得到明显改善,达到了药物缓释功能改进和力学性能的提升,并实现了两种药物的复配释放,使高分子多层水凝胶药物缓释材料功能化和高性能化得到统一。高分子多层水凝胶药物缓释材料具有更为可控的药物释放行为主要是由于在pH=7.4的PBS缓冲液中,聚阴离子高分子聚谷氨酸层与药物茶碱、聚阳离子高分子聚赖氨酸层与药物布洛芬产生静电吸引使药物在该层释放变缓,并通过层状结构使两种药物在层厚度方向上的扩散路径增长(由于材料厚度远小于长度和宽度尺寸,药物释放速率的决定因素是厚度方向药物的释放行为),使其释放周期延长,故而材料同时具有两种药物的合适的初始释放速率和良好的长效释放行为。而且,由于层倍增器的多次层状叠合作用,交替多层共混物中有连续界面存在,聚阴离子高分子和聚阳离子高分子的静电引力作用使层界面相容性好,粘接性强,界面作用力大,故而在受外界压缩作用力时,根据层状并联的等效叠加作用可知,界面作用的存在赋予了高分子多层水凝胶药物缓释材料更加优异的压缩性能。使得材料在获得良好释放行为的同时,其强度也得到提升。
可根据实际需要调整实施例4的配方、层厚比和层数,进而获得不同组分比的高分子多层水凝胶药物缓释材料。
实施例5
第一步,将羧甲基纤维素和水按重量百分比15%:85%,环氧氯丙烷(为羧甲基纤维素交联剂)按羧甲基纤维素重量的5%,药物万古霉素按羧甲基纤维素和水总重量20%进行配料,并经真空脱泡搅拌机脱泡搅拌均匀得到聚阴离子高分子共混液A。
将明胶和水按重量百分比30%:70%,京尼平(为明胶交联剂)按明胶质量的5%,药物对乙酰氨基酚按明胶和水总重量5%进行配料,并经真空脱泡搅拌机脱泡搅拌均匀得到聚阳离子高分子共混液B。
第二步,将上述混合均匀的羧甲基纤维素共混溶液(聚阴离子高分子共混溶液A)和明胶共混溶液(聚阳离子高分子共混溶液B)在45℃下分别经挤出机搅拌挤出,并在汇流器出口处叠合在一起形成初始结构为两层的高分子溶液复合结构,再经过与所述汇流器连接的6个层倍增器的多次层状叠合作用,形成具有羧甲基纤维素共混溶液和明胶共混溶液交替排布的128层结构。在此,先说明一下多次层状叠合作用的过程,其制备方法采用本申请人申请的中国专利CN101439576A所公开的由挤出机(A、B)、分配器(C)、层倍增器(D)和出口模(E)构成的微层共挤出装置(图1),其特点是上述混合均匀的羧甲基纤维素共混溶液和明胶共混溶液分别投入微层共挤出装置的两台挤出机(A、B)中,使两股溶液在分配器(C)中叠合,经6个层倍增器(D)的切割和叠加后,从出口模(E)流出,再经过牵引机的牵引,得到128层由羧甲基纤维素共混溶液和明胶共混溶液连续交替分布的层状结构。截取长度40mm的挤出物在室温密封放置24小时进行交联形成具有128层交替层结构的高分子多层水凝胶药物缓释材料(图2)。在层倍增器的多次层状叠合作用中羧甲基纤维素共混溶液和明胶共混溶液形成127个层界面,羧甲基纤维素和明胶的静电相互作用使层间界面结合紧密,力学性能良好。所得高分子多层水凝胶药物缓释材料的总层厚为1mm,总宽度为40mm,控制羧甲基纤维素共混溶液层和明胶共混溶液层挤出速率比为2:3,两层的层厚比为2:3。
将上述相同组分比的羧甲基纤维素共混溶液和明胶共混溶液按质量分数2:3配料,加入真空脱泡搅拌机进行共混脱泡,搅拌均匀后经过不采用微层共挤出装置的普通挤出机进行挤出,再经过牵引机的牵引,得到厚度为1mm、宽度为40mm的羧甲基纤维素/明胶均相共混挤出物,其挤出温度为45℃。截取长度40mm的挤出物在室温密封放置24小时进行交联,所得到的均相共混高分子水凝胶药物释放材料具有和上述高分子多层水凝胶药物缓释材料相同的物料配比,但其非交替层状结构,而是均相共混结构。所得到的均相共混高分子水凝胶药物释放材料在磷酸盐缓冲液(PBS)中浸泡24小时即释放41%的万古霉素、80%的对乙酰氨基酚,表现出明显的突释行为。
而由于本实施例采用了6个层倍增器,其得到的负载两种药物的128层高分子多层水凝胶药物缓释材料24小时即释放11%的万古霉素、23%的对乙酰氨基酚,14天释放72%的万古霉素、89%的对乙酰氨基酚,显示出更为平缓的可控释放行为和优良的长效释放性能。同时其压缩强度也由均相共混高分子水凝胶药物释放材料的120 kPa提高到280 kPa。说明高分子多层水凝胶药物缓释材料的药物释放行为和压缩强度均得到明显改善,达到了药物缓释功能改进和力学性能的提升,并实现了两种药物的复配释放,使高分子多层水凝胶药物缓释材料功能化和高性能化得到统一。高分子多层水凝胶药物缓释材料具有更为可控的药物释放行为主要是由于在pH=7.4的PBS缓冲液中,聚阴离子高分子羧甲基纤维素层与药物万古霉素产生静电吸引使万古霉素在该层释放变缓,聚阳离子高分子明胶层与药物对乙酰氨基酚之间的氢键作用使对乙酰氨基酚在该层释放变缓,并通过层状结构使两种药物在层厚度方向上的扩散路径增长(由于材料厚度远小于长度和宽度尺寸,药物释放速率的决定因素是厚度方向药物的释放行为),使其释放周期延长,故而材料同时具有两种药物的合适的初始释放速率和良好的长效释放行为。而且,由于层倍增器的多次层状叠合作用,交替多层共混物中有连续界面存在,聚阴离子高分子和聚阳离子高分子的静电引力作用使层界面相容性好,粘接性强,界面作用力大,故而在受外界压缩作用力时,根据层状并联的等效叠加作用可知,界面作用的存在赋予了高分子多层水凝胶药物缓释材料更加优异的压缩性能。使得材料在获得良好释放行为的同时,其强度也得到提升。
可根据实际需要调整实施例5的配方、层厚比和层数,进而获得不同组分比的高分子多层水凝胶药物缓释材料。
实施例6
第一步,将海藻酸钠和水按重量百分比20%:80%,碳酸氢钙(为海藻酸钠交联剂)按海藻酸钠重量的10%,药物头孢氨苄按海藻酸钠和水总重量10%进行配料,并经真空脱泡搅拌机脱泡搅拌均匀得到聚阴离子高分子共混液A。
将明胶和水按重量百分比30%:70%,京尼平(为明胶交联剂)按明胶质量的5%,药物布洛芬按明胶和水总重量2%进行配料,并经真空脱泡搅拌机脱泡搅拌均匀得到聚阳离子高分子共混液B。
第二步,将上述混合均匀的海藻酸钠共混溶液(聚阴离子高分子共混溶液A)和明胶共混溶液(聚阳离子高分子共混溶液B)在40℃下分别经挤出机搅拌挤出,并在汇流器出口处叠合在一起形成初始结构为两层的高分子溶液复合结构,再经过与所述汇流器连接的4个层倍增器的多次层状叠合作用,形成具有海藻酸钠共混溶液和明胶共混溶液交替排布的32层结构。在此,先说明一下多次层状叠合作用的过程,其制备方法采用本申请人申请的中国专利CN101439576A所公开的由挤出机(A、B)、分配器(C)、层倍增器(D)和出口模(E)构成的微层共挤出装置(图1),其特点是上述混合均匀的海藻酸钠共混溶液和明胶共混溶液分别投入微层共挤出装置的两台挤出机(A、B)中,使两股溶液在分配器(C)中叠合,经4个层倍增器(D)的切割和叠加后,从出口模(E)流出,再经过牵引机的牵引,得到32层由海藻酸钠共混溶液和明胶共混溶液连续交替分布的层状结构。截取长度40mm的挤出物在室温密封放置48小时进行交联形成具有32层交替层结构的高分子多层水凝胶药物缓释材料(图2)。在层倍增器的多次层状叠合作用中海藻酸钠共混溶液和明胶共混溶液形成31个层界面,海藻酸钠和明胶的静电相互作用使层间界面结合紧密,力学性能良好。所得高分子多层水凝胶药物缓释材料的总层厚为2mm,总宽度为20mm,控制海藻酸钠共混溶液层和明胶共混溶液层挤出速率比为6:1,两层的层厚比为6:1。
将上述相同组分比的海藻酸钠共混溶液和明胶共混溶液按质量分数6:1配料,加入真空脱泡搅拌机进行共混脱泡,搅拌均匀后经过不采用微层共挤出装置的普通挤出机进行挤出,再经过牵引机的牵引,得到厚度为2mm、宽度为20mm的海藻酸钠/明胶均相共混挤出物,其挤出温度为40℃。截取长度40mm的挤出物在室温密封放置48小时进行交联,所得到的均相共混高分子水凝胶药物释放材料具有和上述高分子多层水凝胶药物缓释材料相同的物料配比,但其非交替层状结构,而是均相共混结构。所得到的均相共混高分子水凝胶药物释放材料在磷酸盐缓冲液(PBS)中浸泡24小时即释放58%的头孢氨苄、51%的布洛芬,表现出明显的突释行为。
而由于本实施例采用了4个层倍增器,其得到的负载两种药物的32层高分子多层水凝胶药物缓释材料24小时即释放20%的头孢氨苄、15%的布洛芬,8天释放93%的头孢氨苄、71%的布洛芬,显示出更为平缓的可控释放行为和优良的长效释放性能。同时其压缩强度也由均相共混高分子水凝胶药物释放材料的163kPa提高到240 kPa。说明高分子多层水凝胶药物缓释材料的药物释放行为和压缩强度均得到明显改善,达到了药物缓释功能改进和力学性能的提升,并实现了两种药物的复配释放,使高分子多层水凝胶药物缓释材料功能化和高性能化得到统一。高分子多层水凝胶药物缓释材料具有更为可控的药物释放行为主要是由于在pH=7.4的PBS缓冲液中,聚阴离子高分子海藻酸钠层与药物头孢氨苄、聚阳离子高分子明胶层与药物布洛芬产生静电吸引使药物在该层释放变缓,并通过层状结构使两种药物在层厚度方向上的扩散路径增长(由于材料厚度远小于长度和宽度尺寸,药物释放速率的决定因素是厚度方向药物的释放行为),使其释放周期延长,故而材料同时具有两种药物的合适的初始释放速率和良好的长效释放行为。而且,由于层倍增器的多次层状叠合作用,交替多层共混物中有连续界面存在,聚阴离子高分子和聚阳离子高分子的静电引力作用使层界面相容性好,粘接性强,界面作用力大,故而在受外界压缩作用力时,根据层状并联的等效叠加作用可知,界面作用的存在赋予了高分子多层水凝胶药物缓释材料更加优异的压缩性能。使得材料在获得良好释放行为的同时,其强度也得到提升。
可根据实际需要调整实施例6的配方、层厚比和层数,进而获得不同组分比的高分子多层水凝胶药物缓释材料。
- 还没有人留言评论。精彩留言会获得点赞!