可经皮输送的心脏瓣膜及相关制备方法与流程
本申请是中国发明专利申请(申请日:2011年3月1日;申请号:201180022155.x(国际申请号:pct/us2011/026763);发明名称:可经皮输送的心脏瓣膜及相关制备方法)的分案申请。
本发明涉及医疗器械领域,更具体地,涉及一种可经皮输送的心脏瓣膜和制备可经皮输送的心脏瓣膜的方法。
背景技术:
心脏瓣膜疾病是一种常见的衰退状态,其会损害生理功能,引起限制症状并危及生活在世界各地的数百万患者的生命。有各种不同的根本原因,但心脏瓣膜故障时终极原因,表现为由于解剖学的通路变窄(狭窄)而使得通过瓣膜平面的血液传导不足,或由于关闭机能不全而使血液通过瓣膜再次返回,从而减少了血液通过瓣膜的(不全或返流)有效正向传导。这些血流动力学状态导致,1)心输出量缺乏症;和2)心脏泵送室的不利的负载,这两个均导致患者功能损害并往往过早的死亡,除非得到有效纠正。
决定性的心脏瓣膜疾病的矫正治疗是常规的开胸手术技术,其中直观地调整,修理,或使用人工瓣膜更换心脏瓣膜。尽管每年世界各地进行成千上万的心脏瓣膜手术,但还是承受高的成本,发病率和死亡率,特别是在易感患者,其可能是老人或其他由并发症而生理受到损害的患者。此外,外科器械企业的成本和资源需求限制世界各地更多的患者进行心脏瓣膜置换术。
寻求心脏瓣膜手术的替代技术,在过去的十年里,大量的发展计划带来了经皮、导管植入的人工心脏瓣膜,其在欧盟(eu)进入商业应用,和在美国进入关键的临床测试。欧盟的初步临床经验目标是主动脉瓣狭窄的患者,但其被认为具有不可接受开放式心脏瓣膜置换术的高风险。在几千个这种情况中,利用球囊扩张和自我扩张的两个不同的方案设计,经皮心脏瓣膜置换(phvr)被证明是可行的,与选定患者的手术效果竞争,其12-18个月死亡率约25%。grubee.,etal.,progressandcurrentstatusofpercutaneousaorticvalvereplacement:resultsofthreedevicegenerationsofthecorevalverevalvingsystem,circ.cardiovascintervent.2008;1:167-175.
迄今为止的应用phvr要挑战的技术困难是植入次序,尤其是在主动脉瓣位置。采用可用装置的技术受限于这些设备和它们的输送导管的大尺寸;通常,如果在一些小动脉可以完全做到,插入18-24弗伦奇(6-8毫米直径)系统需要股骨动脉的开放式外科曝光和管理,并且在中央动脉内他们的庞大的尺寸可对输送次序(deliverysequence)的安全造成威胁。此外,进入位置出血并发症等形成所述程序的不良事件的重要部分。
通常情况下,目前的phv设计包括生物膜,其形成瓣膜的操作瓣叶,附着在金属框架内,然后将其折起到一个输送导管或球囊,然后约束在外护套内。在患病瓣膜初始扩大(initialdilation)具有大气囊之后,这个组件前进到瓣膜平面并经过自膨胀或球囊扩张而展开。
瓣膜输送系统的有效尺寸由每个同轴地安装的组件的总体积确定。phv本身体积由框架的直径和厚度,刚度,以及形成瓣膜操作瓣叶的内部膜的特别安排确定。目前phv膜的特征厚度是phv的最终输送(deliveryprofile)的限制因素。反过来,这样的膜的特征厚度是在它的加工方法以及最终输送方法的结果。通常情况下,采用戊二醛固定(蛋白质交联)动物组织以制造合适的供载入的生物膜。强度和耐用性的要求已经确定了组织厚度和交联最有用的范围虽然通常抵消刚度和脆性。随后在合适的溶液中水合以提高这些性质,但采用这种方式的水合膜也增加厚度。
phv设计的明显的要求之一是该瓣膜在高的直接展开能力(competenceimmediatelyondeployment)下起效,由于患者的血流动力学存活依赖于它。为此,部分,类似手术的瓣膜假体,目前phv设计为在一罐溶液中于水合状态下完成,运输,并输送使用。在使用中,市售的手术以及经皮植入的生物心脏瓣膜在使用前以“湿”的状态清洗并制备。更具体地,市售的人工心脏瓣膜在导管插入术实验室(catheterizationlab)中漂洗,卷曲,并安装。因此,目前市售的人工心脏瓣膜的问题包括时间,成本和与必要的在导管插入术实验室中冲洗,卷曲,并安装相关的变异性(variability)。也就是说,当前在导管插入术实验室中安装人工心脏瓣膜会有一个或多个延迟,成本,技术负担和可能出现的错误的问题。避免这些问题中的一个或多个将是有利的。此外,现行的“湿”瓣膜设计在折起瓣膜上施加额外轮廓(profile)。水合膜,虽然具有期望且必要的灵活性,以便可靠地进行直接展开操作,但该组装的和安装的瓣膜也有很大一部分的危及其输送能力的的厚度。
扩大针对一些上述问题,使用目前的在导管插入术实验室中的phvs需要一些预备行为,其是潜在的麻烦,并会在程序的关键阶段延长输送序列。由于phvs以“湿”态在防腐剂溶液中输送使用,它们必须在插入之前进行一系列的清洁和水合方案。一旦完成这一操作,phvs必须安装在输送导管上。例如,在球囊扩张的edwardssapien瓣膜情况下,需要特别的卷曲和安装工具。因此,存在解决上面讨论的缺点的需求。
发明简介
应该理解,本发明包括了各种不同版本或实施方案,发明简介并不意味着要限制或包括所有。本发明简介提供了部分实施方案的一些一般性描述,但也可包括其他实施例中的一些更具体的描述。
在至少一个实施方案中,提供基本上“干”膜phv系统,其中组织材料在干燥状态下制备和折叠以形成组织瓣叶组件(tissueleafletassembly)。此后,组织瓣叶组件被连接到框架,以形成可植入的人工心脏瓣膜,随后被预先安装在集成的导管输送系统。包括人工心脏瓣膜的导管输送系统然后在组织瓣叶组件基本上保持干燥的状态下进行包装和运输。人工心脏瓣膜可拆封后直接使用。因此,它可以插入身体而无需水合,卷曲或安装工具,或其他预备行为。即,形成人工心脏瓣膜的组织瓣叶组件的组织可以经过处理和干燥,然后,同时保持干燥,折叠进入组织瓣叶组件。此后,组织瓣叶组件是至少部分地再水合,然后附着在框架内,如支架,以形成可植入的人工心脏瓣膜。然后,人工心脏瓣膜的组织瓣叶组件允许干燥。此后,在人工心脏瓣膜的组织瓣叶组件保持干燥的条件下,人工心脏瓣膜可以接着进行包装,输送和运输。而后人工心脏瓣膜可植入患者。因此,phv系统简化动脉插入,并且,由于在干燥条件下,也赋予较低的体积和轮廓,即便不能消除,程序的操作和相关的并发症也可以减少。此外,本发明的一个或多个实施方案拓宽了小动脉需要phv过程的患者的选择范围。作为一个附加的好处,本发明的至少一个实施例允许在最关键的阶段缩短植入时间(undershortenelapsedtimes)。
在至少一个实施方案中,提供膜phv系统,其中在干燥状态下制备和折叠组织材料以形成组织瓣叶组件,并且进一步的,其中所述组织瓣叶组件随后至少部分水合并连接到框架,随后被预先安装在集成的导管输送系统。
在至少一个实施方案中,提供膜phv系统,其中在干燥状态下制备和折叠组织材料以形成组织瓣叶组件,并且进一步的,其中所述组织瓣叶组件至少部分水合并连接到框架以形成人工心脏瓣膜。此后,干燥人工心脏瓣膜,并接着预先安装在集成的导管输送系统,之后使人工心脏瓣膜的组织瓣叶组件保持干燥,系统然后在组织瓣叶组件保持干燥的状态下包装以运输。
在至少一个实施方案中,提供膜phv系统,其中在干燥状态下制备和折叠组织材料以形成组织瓣叶组件,并且进一步的,其中所述组织瓣叶组件至少部分水合并连接到框架以形成人工心脏瓣膜。此后,干燥人工心脏瓣膜,并接着预先安装在集成的导管输送系统,之后人工心脏瓣膜的组织瓣叶组件至少部分地水合并包装以运输。
在至少一个实施方案中,提供适于经导管(trans-catheter)输送到患者体内的器件,其包括:人工心脏瓣膜,其进一步包括连接到框架的已处理组织,其中所述已处理的组织包含的水分含量小于约50%时,基于已处理的组织的切片的重量,所述已处理的组织包括约50至500微米的厚度和大于约15兆帕的极限抗张强度抗张强度。应当指出,这里所描述的已处理组织的抗张强度高于其它已知制备的组织的抗张强度,无论在水合的或干的状态。在至少一个实施方案中,已处理组织的水含量小于约40%,基于已处理组织的重量。在至少一个实施方案中,最终的抗张强度大于约20兆帕。在至少一个实施方案中,已处理组织不包括已暴露在聚合物渗透物的基体。在至少一个实施方案中,已处理组织包括已处理的心包组织。
在至少一个实施方案中,所述方法进一步包括使组织切片(section)暴露在光能量中持续曝光一段时间,曝光持续时间持续到组织切片的暴露面不再有可见的脂滴(lipiddroplets)分离。在至少一个实施方案中,光能量至少相当于使组织切片暴露于25-100瓦的光源,更优选的是,暴露于50瓦的白炽灯光源15分钟,其中暴露表面距离平面辐射面约10厘米。在至少一个实施方案中,所述方法进一步包括:(d),在后固定期,用蒸馏水和异丙醇漂洗组织切片不少于约7天;其中步骤(d)步骤在步骤(c)之后发生。
在至少一个实施方案中,提供适于在患者体内植入的器件,其中包括:人工心脏瓣膜,其进一步包括连接到框架的已处理组织,其中,已处理组织的水含量小于约60%,基于已处理组织的重量。在至少一个实施方案中,已处理组织包括心包组织切片,其具有大于约12兆帕的极限抗张强度。在至少一个实施方案中,已处理组织的切片包括约50至300微米之间的厚度。在至少一个实施方案中,已处理组织中的水含量小于约40%,基于已处理组织的重量。
本文中,术语“干的”(或“基本上干燥”),当其指构成经皮心脏瓣膜的心脏瓣膜的组织状态时,意味着水分含量小于当组织在患者体内完全再水合时组织的水分含量。通常,根据本文的一个或多个实施方案处理的心包组织在充分水合时,含有约70重量%的水。干燥到小于40重量%的水有效地改变折叠和缝合组织时的操作性。本领域中技术人员将理解,干燥时组织的水分含量可能会发生变化。例如,折叠和干燥时组织的水分含量可能不同于在导管输送系统中预安装状态下干燥和运输时组织中的水分含量。
优选地,一项或多项本发明的至少一个实施方案涉及人工心脏瓣膜,其被安装到瓣膜输送系统且存储在无菌包中。因此,在至少一个实施方案中,提供一种组件,其中包括:
人工心脏瓣膜,其包括:
框架;
组织瓣叶组件,其连接到该框架;
可经皮插入瓣膜的输送机构,其中,人工心脏瓣膜可拆卸地安装到所述可经皮插入瓣膜输送机构;以及
无菌包装,其含有可拆卸地安装到所述可经皮插入瓣膜的输送机构的人工心脏瓣膜。
在至少一个实施方案中,可经皮插入瓣膜的输送机构包括气囊导管。在至少一个实施方案中,所述气囊导管是12至14弗伦奇的导管。在至少一个实施方案中,气囊导管是小于约12弗伦奇。在至少一个实施方案中,气囊导管在约5至12弗伦奇之间。在至少一个实施方案中,可经皮插入瓣膜的输送机构包括轴柄(mandrel)。在至少一个实施方案中,形成无菌包装内的组织瓣叶组件的组织是水合的和非基本上干燥中的至少一种。在至少一个实施方案中,形成无菌包装内的组织瓣叶组件的组织是基本上干燥的。在至少一个实施方案中,所述框架包括支架。在至少一个实施方案中,形成组织瓣叶组件的组织包括已处理的心包组织。
一项或多项本发明的至少一个实施方案包括一种用于植入在患者体内的人工心脏瓣膜。因此,提供备好(readyfor)的植入患者体内的预先包装的可经皮、经导管输送的人工心脏瓣膜,其中包括:
框架;以及
组织瓣叶组件,其连接到该框架,所述组织瓣叶组件包括基本上干燥的组织。
在至少一个实施方案中,基本上干燥的组织包括已处理的心包组织。在至少一个实施方案中,框架以及附着到框架的组织瓣叶组件与12至14弗伦奇的气囊导管可操作地关联。在至少一个实施方案中,框架以及附着到框架的组织瓣叶组件与小于约12弗伦奇的尺寸的气囊导管可操作地关联。在至少一个实施方案中,框架以及附着到框架的组织瓣叶组件与约5至12弗伦奇的尺寸的气囊导管可操作地关联。在至少一个实施方案中,所述基本上干燥的组织包含小于约40%的水分含量,基于基本上干燥的组织的重量。
在至少另一个实施方案中,提供用于患者的组件,其中包括:
密封的无菌包装,其包括输送系统,用于在患者体内经皮地展开心脏瓣膜,所述心脏瓣膜包括:
框架,其在密封的无菌包装内可拆卸地安装在所述输送系统;
组织瓣叶组件,其安装到框架。
在至少一个实施方案中,组织瓣叶组件包括心包组织。
在至少一个实施方案中,提供方法,其包括:
部分压缩并安装人工心脏瓣膜到输送导管,所述人工心脏瓣膜包括组织;
允许所述组织至少部分地干燥;
进一步压缩和安装人工心脏瓣膜至输送导管;并且
灭菌和包装人工心脏瓣膜和输送导管。
在至少一个实施方案中,所述方法进一步包括运输所述灭菌和包装的人工心脏瓣膜以及输送导管。在至少一个实施方案中,所述组织包括已处理的心包组织。在至少一个实施方案中,在部分压缩和安装人工心脏瓣膜到输送导管之前,所述组织至少是(a)非基本上干燥的和(b)至少部分水合中的至少一种。
对于这里所描述的各种实施方案中,包括组织瓣叶组件的人工心脏瓣膜包括除心包组织以外的膜组织。
在至少一个实施方案中,提供方法,其中包括:
附着心包组织到框架;
部分压缩和安装附着组织后的框架至输送导管;以及
允许组织至少部分地干燥;
进一步压缩和安装附着组织后的框架至输送导管;
灭菌和包装所述框架和输送导管,其具有附着在其上的组织。
在至少一个实施方案中,在部分压缩并安装框架之前,所述组织是(a)非基本上干燥的,和(b)至少部分水合中的至少一种。在至少一个实施方案中,所述方法进一步包括运输所述灭菌和包装的框架到外科手术或医疗设施,所述框架具有所附着的组织,安装在输送导管上。在至少一个实施方案中,在组织附着到框架之前,折叠组织以形成组织瓣叶组件。在至少一个实施方案中,组织瓣叶组件包括至少一个袖口状瓣(cuff)和至少一个褶(pleat)。
在至少一个实施方案中,提供可经皮、经导管人工心脏瓣膜的制备方法,该方法包括:
提供来自有机体的膜组织;
用至少一种化学物质处理所述膜组织以产生已处理的膜组织;
干燥已处理的膜组织直到形成基本上干燥的组织;
附着基本上干燥的组织到框架上;
再水合附着在框架内的基本上干燥的组织,以形成再水合的组织;
折起附着有再水合的组织的框架;以及
干燥折起的框架内的再水合的组织直到它是基本上干燥的组织。
在至少一个实施方案中,所述方法进一步包括压缩和安装框架到输送导管,所述框架上附着有基本上干燥的组织。在至少一个实施方案中,所述方法进一步包括灭菌和包装框架,所述框架上附着有基本上干燥的组织,并安装在输送导管上。在至少一个实施方案中,所述处理包括将附着有基本上干燥的组织的框架暴露于环氧乙烷、质子束和γ射线辐射中的至少一个以灭菌。在至少一个实施方案中,所述方法进一步包括运输所述已灭菌的和已包装的框架到手术或医疗设施,所述框架上附着有基本上干燥的组织,并安装在输送导管上。在至少一个实施方案中,在附着步骤之前,不折叠所述干燥的组织以提供一种袖口状瓣(cuff)和/或褶(pleat)。在至少一个实施方案中,在附着步骤之前,折叠所述干燥的组织以形成组织瓣叶组件。在至少一个实施方案中,组织瓣叶组件包括至少一个袖口状瓣(cuff)和至少一个褶(pleat)。
在至少一个实施方案中,所述可经皮、经导管人工心脏瓣膜的制备方法进一步包括在患者体内植入附着基本上干燥组织的框架。在至少一个实施方案中,该框架包括支架。在至少一个实施方案中,所述方法进一步包括将所述框架和其上附着的组织瓣叶组件安装至12至14弗伦奇的气囊导管。在至少一个实施方案中,所述方法进一步包括将所述框架和其上附着的组织瓣叶组件安装至尺寸小于约12弗伦奇的气囊导管。在至少一个实施方案中,所述方法进一步包括将所述框架和其上附着的组织瓣叶组件安装至尺寸在约5至12弗伦奇之间的气囊导管。在至少一个实施方案中,所述方法进一步包括将所述框架和其上附着的组织瓣叶组件安装在轴柄上。在至少一个实施方案中,所述可经皮、经导管人工心脏瓣膜的制备方法进一步包括将膜组织浸入缓冲或无缓冲1-37.5%福尔马林中约3天~3周。在至少一个实施方案中,所述可经皮、经导管人工心脏瓣膜的制备方法进一步包括将膜组织浸入缓冲或无缓冲1-37.5%福尔马林中约3天~5周。在至少一个实施方案中,所述处理包括将膜组织浸入100%的甘油中超过3周。在至少一个实施方案中,所述处理包括将膜组织浸入0.1-25%戊二醛中约3天~3周。在至少一个实施方案中,所述处理包括将膜组织浸入0.1-25%戊二醛中约3天~5周。在至少一个实施方案中,所述处理包括将膜组织浸入低聚过滤的0.1-25%戊二醛中约3天~3周。在至少一个实施方案中,所述处理包括将膜组织浸入低聚过滤的0.1-25%戊二醛中约3天~5周。在至少一个实施方案中,所述处理包括将膜组织浸入上述的福尔马林,戊二醛,或低聚过滤(oligomericfiltered)的戊二醛溶液,其中添加游离氨基酸赖氨酸和/或组氨酸。在至少一个实施方案中,所述处理不包括接触和/或暴露于聚合物中以渗透和/或封装(encapsulate)组织的组织纤维。
在至少一个实施方案中,提供可经皮、经导管人工心脏瓣膜的制备方法,该方法包括:
提供来自哺乳动物生物体的组织切片(asectionoftissue);以及
通过用蒸馏水进行多次清洗所述组织切片以引起该组织切片渗压休克。在至少一个实施方案中,所述方法进一步包括:在多个时间间隔期间,用蒸馏水水合所述组织切片。在至少一个实施方案中,组织切片包括心包组织。在至少一个实施方案中,所述方法进一步包括不使用盐水(saline)以引起所述组织渗压休克和水合中至少一种。在至少一个实施方案中,所述方法进一步包括在与异丙醇,戊二醛和福尔马林中的一种或多种接触之前,使用甘油预处理所述组织切片。在至少一个实施方案中,所述方法进一步包括使用甘油预处理后,使所述组织切片接触含有福尔马林的溶液。在至少一个实施方案中,所述方法进一步包括使用甘油预处理后,使所述组织切片接触含有戊二醛的溶液。在至少一个实施方案中,所述方法进一步包括在与无论是戊二醛还是福尔马林接触之前,用异丙醇预处理所述组织切片。在至少一个实施方案中,所述方法进一步包括使用异丙醇预处理后,使所述组织切片与含有福尔马林的溶液接触。在至少一个实施方案中,所述方法进一步包括使用异丙醇预处理后,使所述组织切片与含有戊二醛的溶液接触。在至少一个实施方案中,所述方法进一步包括暴露所述组织切片于光能量中一段时间,直到所述组织切片的暴露面(exposedsurface)不再有可见的脂滴分离。在至少一个实施方案中,光能量是至少相当于使组织切片暴露于50瓦的白炽灯光源约15分钟,其中暴露面距离平面辐射面(flatradiantface)约10厘米。
关于输送特性,这里所述的使用相对薄的组织成分的可植入人工心脏瓣膜的另一个显著优点是,相对于市售的人工心脏瓣膜,该可植入的人工心脏瓣膜提供了相对小的填充体积(packingvolume)。其结果是,所述可植入的人工心脏瓣膜提供相对小的导管输送轮廓,从而能够植入有相对小直径的血管系统的患者。
根据一个或多个实施方案,干燥的组织膜基本上比湿膜的质量小。例如,由本发明的实施方案中的一个或多个制备的基本上干燥的心包组织为湿的心包组织质量的约30%,并且轮廓和填充体积显著减少,从而实现了相对小的轮廓,并使其适用于植入大量的,尤其是那些具有小直径血管系统的患者。此外,干燥的人工心脏瓣膜不需要在防腐剂中存储和运输。干的人工心脏瓣膜可以在其产地安装到输送导管,其允许预包装集成的输送系统。与相对小的轮廓(profile)一起,由于所述可植入的人造心脏瓣膜被预先安装到输送导管并形成预先包装包装的输送系统的一部分,实施方案中的可植入的人工心脏瓣膜从而提供可靠性和便利性。此外,干燥的人工心脏瓣膜不需要在导管插入术实验室中漂洗,再水合,或安装到输送导管。因此,干燥的人工心脏瓣膜,可以在过程的关键时刻由包装直接插入人体中。有利的是,这样就避免了过程时间(proceduretime),操作以及安装,压接(crimping)和定向导管和鞘(sheaths)时会发生的错误。一旦在手术设施/现场,干燥的人工心脏瓣膜插入并以标准方式在患病瓣膜平面通过气囊导管膨胀输送,干燥的人工心脏瓣膜立即开始发挥作用,即使是在干燥状态的或不完全再水合状态(因为一些再水合发生在导管冲洗时,其中该导管具有安置在其中的人工心脏瓣膜),使组织膜在体内自然地完成再水合。
各种组件在本文中被称为“可操作地关联”。本文所用的“可操作地关联”是指处于可操作的方式连接在一起的组件,并包括组件直接连接的实施方案,在两个相连的组件之间设置额外组件的实施方案。
如本文所用,“至少一个”,“一个或多个”和“和/或”是开放式的表述,其在操作即是连接性的也是分离性的。例如,表达式“a,b和c中的至少一个”,“a,b,或c的至少一个”,“一个或多个a,b,和c”,“一个或多个a,b或c“和”a,b,和/或c“是指单独的a,单独的b,单独的c,a和b,a和c,b和c,或a,b和c。
如本文所用,“一段时间”是指在某些模糊的或不确定的时间点。因此,例如,如这里所使用的,“之后的一段时间”是指跟随,不论紧随或在先前的动作之后在某些模糊的或不确定的时间点。
本发明的各种实施方案在附图中以本文所提供的发明详述中阐明,并由权利要求书体现。然而,应当理解,本发明简介并不包含一个或多个本发明的所有方面和实施方案,并不意味着要限制或以任何方式的限制,并且,应当理解,本文中所公开的发明,包括那些本领域普通技术人员对其明显的改进和修改。
从下面的讨论中,在本发明的另外的优点将变得显而易见的,尤其是当与附图一起。
附图说明
为了进一步澄清的一个或多个本发明的上述以及其它的优点和特性,通过参照在附图中示出的特定实施方案,呈现一个或多个本发明更具体的描述。可以理解,这些附图仅示出一个或多个本发明的典型实施方案,并不因此被认为是限制其范围。所述一个或多个本发明,通过使用附图以额外的特性和细节进行描述和解释,其中:
图1是本发明的至少一个实施方案相关联的方法的流程图;
图2a-2b是表示组织制备基本原理(elements)的流程图;
图3是表示干燥和调整尺寸的基本原理的流程图;
图4是表示在框架上附着组织膜瓣叶的瓣膜构造基本原理的流程图;
图5是表示安装瓣膜到输送系统的基本原理的流程图;
图6是表示入鞘(ensheathing),灭菌和包装基本原理的流程图;
图7是表示输送瓣膜到患者的基本原理的流程图;
图8a是折叠之前的单件组织切片的视图;
图8b是折叠后(详见下文)两(三)个分离的组织片视图;
图8c是两片图8b所示的组织在折叠后(详见下文)形成的褶处缝合在一起的视图;
图8d是使用虚线指示主折叠线的组织坯料(blank)视图;
图8e是沿着主折叠线折叠的组织坯料(blank)的透视图;
图8f是2部分的视图,示出了褶的折叠线和折叠后的褶;
图8g是示于图8f的单一的褶的详细透视图;
图8h是折叠和缝接的组织瓣叶组件的立体示意图;
图8i是框架的立体示意图;
图8j是其上附着有图8h的组织瓣叶组件的图8i的框架的立体示意图;
图8k是图8j中所示的装置的侧视图;
图8l是框架以及附着到其上的组织瓣叶组件的端部示意图;
图9是示出了根据至少一个实施方案制备的五个组织样本的实际应力-应变测试(stress-straintest)结果的曲线图;
图10是在其上安装了可经皮输送心脏瓣膜的导管一部分的示意图;
图11a是可植入的人工心脏瓣膜的照片,该瓣膜包括附着在框架内的组织瓣叶组件,其中组织位于部分开放的方向;
图11b是可植入的人工心脏瓣膜图,该瓣膜包括附着在框架内的组织瓣叶组件,其中组织位于闭合的方向;
图11c是可植入的人工心脏瓣膜一侧的剖视图,该瓣膜包括附着在框架内的组织瓣叶组件,其中组织位于闭合的方向;
图11d是可植入的人工心脏瓣膜另一侧的剖视图,该瓣膜包括附着在框架内的组织瓣叶组件,其中组织位于闭合的方向;
图12是在通过30,000,000次泵送循环测试之后的瓣膜组织照片,其模拟人类心脏条件,照片显示了平滑均匀的表面;
图13是外科医生拿着预先安装的可经皮输送心脏瓣膜的图,其中该心脏瓣膜和导管相关联以及位于无菌包装内;
图14是简化的人的心脏的剖视图,包括心脏瓣膜,其根据目标接收可植入的人工心脏瓣膜;
图15是人主动脉的示意图,该主动脉接收其上安装有可植入的人工心脏瓣膜的导管;以及
图16是人主动脉的示意图,其中该主动脉具有在原始患病的主动脉瓣膜位置植入的可植入人工心脏瓣膜。
这些附图不必按比例绘制。
发明详述
本文描述的一个或多个本发明的实施方案包括一个或多个设备,组件和/或与人工心脏瓣膜相关的方法。根据本发明的至少一个实施方案中的人工心脏瓣膜可以通过外科手术植入,例如可经皮、经导管输送,植入患者体内的植入位点。本文所述的人工心脏瓣膜的一个或多个实施方案应用于至少主动脉和肺动脉瓣的位置,包括用于结构缺陷和患病瓣膜。
在至少一个实施方案中,生物相容性材料附着在框架内以形成可植入的人工心脏瓣膜,然后在稍后的时间,所述可植入的人工心脏瓣膜被植入到患者体内,例如通过可经皮、经导管输送机构。一旦植入,人工心脏瓣膜用于调节患者的心脏血流,允许前向血流,基本上防止了倒流或瓣膜关闭不全(valvularregurgitation)。
现在参照图1,其是一个流程图,示出了至少一个实施方案的人工心脏瓣膜制备和输送方法100。所述人工心脏瓣膜制备和输送方法100一般包括多个过程,包括组织制备200,干燥300,组织瓣叶组件构造和附着到框架400以形成可植入人工心脏瓣膜,安装人工心脏瓣膜(即,具有组织瓣叶组件的框架)到输送系统500,入鞘(ensheathing),灭菌和包装包括人工心脏瓣膜的输送系统600,并最终,输送人工心脏瓣膜到患者体内700。下面详细描述人工心脏瓣膜制备和输送方法100。
本文描述的至少一个或多个实施方案包括相对薄的组织组件。通过示例而非限制的方式,在至少一个实施方案中,所述组织的厚度为约50-150微米,并进一步具有柔韧性和耐植入后钙化(resistancetocalcificationafterimplantation)的特性。用于可植入的人工心脏瓣膜的所述组织的相对薄的性质助其具有生物相容性。此外,相对薄的组织组件从而具有相对小的质量。其结果是,使用该组织的可植入人工心脏瓣膜具有符合要求的功能,其可以使每分钟的心率加速到相对高的数值。
适用于本文描述的一个或多个人工心脏瓣膜和/或一个或多个组件的组织是比较薄的,并且通常是一种膜。本领域技术人员理解,天然的和合成的两种类型的材料都可用于形成人工心脏瓣膜的瓣叶组件。因此,应当理解,虽然已处理的心包组织被描述为适用于本文中描述的一个或多个实施方案中的人工心脏瓣膜的瓣叶组件的材料,可以使用异种移植组织膜之外的其它材料,并且确实,可以使用心包组织以外的异种移植组织膜。更具体地,合成材料可以包括,但不限于,ptfe、pet、涤纶和尼龙。此外,心包组织以外,异种移植组织膜可包括,但不限于,取自肠,肺和大脑的膜材料。合适的材料还可以包括同种异体移植体的材料,即,来自人的来源的材料。列举可能的材料是为了示范的目的,不得被视为限制。
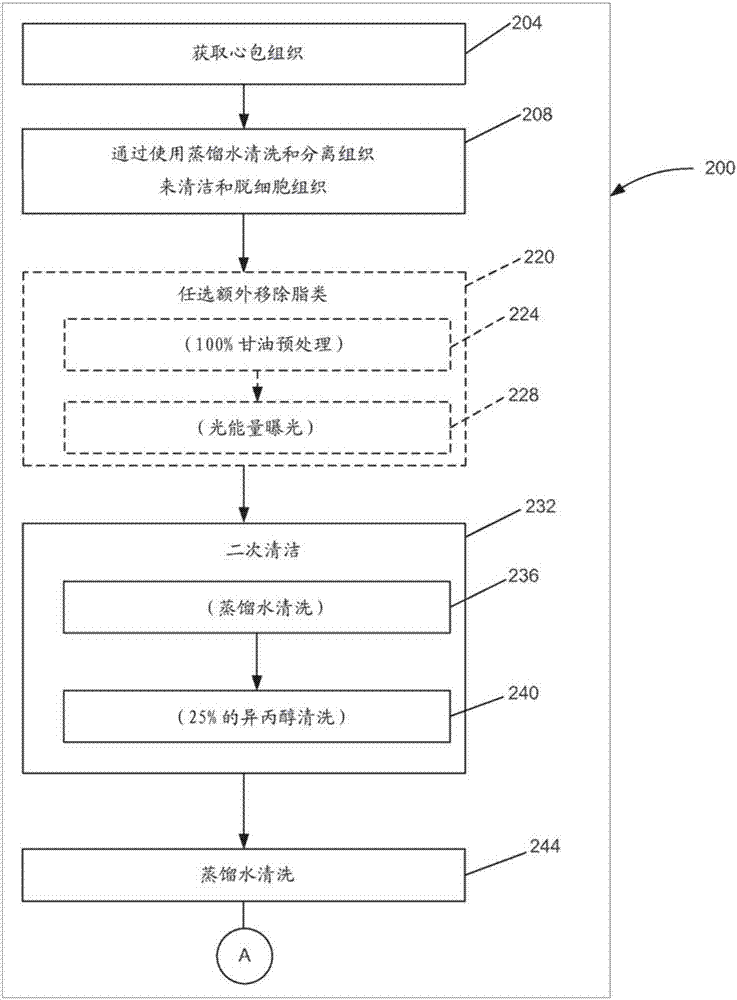
现参考图2,描述了和制备与上面提到的特性相一致的生物相容性组织的方法相关的过程。在至少一个实施方案中,采集心包组织204,如猪或牛的心包组织,然后加工成用于和框架相关联的生物相容性组织,如通过附着在框架内。因此,在采集204后,心包组织被清洁和脱细胞208。更具体地,在至少一个实施方案中,所述组织最初采用柔和摩擦和流体压力用蒸馏水清洁208以去除粘附的非心包和非胶原组织。在至少一个实施方案中,通过使用相对较弱的液体流喷洒所述组织来提供流体压力208,以去除至少一些与组织相关联的非胶原材料。所述清洗208通过渗压休克实现对心包组织有效脱细胞。典型的,在清洁的条件下,组织的厚度变化从约50至500微米,这取决于原料组织的来源。优选地,清洁持续直到没有可见的粘附的非心包或非胶原组织。
继续参考图2a,在组织被清洁和脱细胞208后,所述组织然后可选地额外地去除脂类220,以进一步处理组织以防止免疫反应和钙化。更具体地,所述组织首先在放置在平坦表面(例如,丙烯酸类板)上时任选地经历100%的甘油预处理224,在这之后的组织变得几乎透明。
任选地,所述组织经历“(热光化)thermophotonic”过程228。在至少一个实施方案中,任选地将该组织暴露光能中以额外地除去脂类和初始胶原交联。通过示例的方式,而不是限制,在至少一个实施方案中,采用25-100瓦的白炽灯的光源,并且更优选的是,采用具有距离组织表面约10厘米的平面辐射面的50瓦的白炽灯光源,在进一步可见的脂滴从组织分离停止之前,通常需要15分钟的曝光(exposure)。
仍然参照图2a,所述组织然后在二次清洁232时被再次清洁。更具体地,组织再次用蒸馏水清洗236。此后,所述组织用25%的异丙醇清洗几个小时到数天至数周240,这取决于所需的组织的柔韧性和抗张强度。通过示例而非限制的方式,经过7天的25%异丙醇清洗成功地制备了组织,以及本文所描述的进一步的处理步骤后,提供的极限抗张强度大于25兆帕。这里,寻求组织的柔韧性和抗张强度的组合,以生产具有适合身体(physically)操控的性能的材料,以形成组织瓣叶组件或其他适于附着到框架的结构,而同时提供一旦植入能够正常操作的组织材料。这些技术的目的是保护和保存胶原纤维,最小化组织损伤,改善组织的性能。相对之前常规的技术,该制备和固定技术可以生产组织膜材料,其可以更小的厚度提供和使用。更薄的膜会更柔软,但使用常规的制备技术会牺牲组织的抗张强度。有利的是,相对现有技术的商用产品,本文所述的制备技术产生的膜的抗张强度高达三倍。所实现的这种强度,使得提供具有适当的耐久性的组织瓣叶组件,其具有小的轮廓,即使在基本上干燥的状态下。更具体地,所述组织具有相对高的抗张强度。通过示例而非限制的方式,测试表明,根据本文所述制备的组织的实施方案提供的组织具有相对现有的心包瓣膜组织约为3倍的抗张强度,例如约25兆帕,从而提供的瓣膜组织的生理负荷强度(physiologicloadstrength)为约2000倍。此外,采用根据本文所述而制备的组织制成的可植入人工心脏瓣膜的实施方案在大于约250mmhg的静荷载(staticload)下测试,显示小于约14%的泄漏,其中,这样的结果通常被认为优于外科组织瓣膜假体(prostheses)。
在至少一个实施方案中,异丙醇为清洗剂,乙醇可作为替代物,尽管得到的组织的特性可能会发生变化。
参照图9,示出了根据一个实施方案制备的5个不同的组织样本的应力-应变曲线(stress-straincurve)结果。对于所示的测试结果,安装固定在线性力测试仪中的端部的组织带,并以0.3毫米/秒增加长度,记录所得的力(张力),直到材料破坏或彻底分离,得到屈服应力或极限抗拉强度;然后将这些测量用于计算图9所示的应力-应变曲线。如图所示,不同组织样品的屈服应力或极限抗张强度的变化范围从约30到约50兆帕。更具体地,对于每条图9所示的曲线,测试过程是相同的。即,所示的每条曲线分别属于经历同样的测试的单独的组织片段(pieceoftissue)。结果显示出最小的极限抗张强度为30兆帕,其范围可达50兆帕。因此,示出的测试结果表明针对该组织处理过程的极限抗张强度的结果具有一致性。
返回参考图2a,该组织用蒸馏水清洗244,作为最后的清洁步骤并再水合。
现在参照图2b,在用蒸馏水清洗244后,继续处理组织。更具体地,固定以使胶原质交联248,其通过执行以下操作中的至少一个来实现:
a.在约4至37℃,将组织浸渍在1-37.5%的福尔马林,理想的缓冲溶液,约3天~5周,以及更优选的是,约3天~4周,并且更优选的是,约3周~4周,和更优选的是,在20℃温度时,10%的福尔马林中6天,248a;或
b.在4至37℃之间,将组织浸入100%的甘油中多达6周,并且更优选地,在20℃,将组织浸渍在100%的甘油中约3周,248b;或
c.在0至37℃,将组织浸渍在0.1-25%的戊二醛中约3天~5周,和更优选的是,约3天至4周,更优选的是,约3周~4周,并且更优选地,在4℃,将组织浸在0.25%的戊二醛中7天,248c;或
d.在0至37℃,将组织浸渍在0.1-25%戊二醛(过滤以限制低聚物含量)中约3天~5周,和更优选的是,约3天至4周,更优选的是,约3周~4周,并且更优选地,在4℃,将组织浸在0.25%的戊二醛中7天,248d;或
e.将组织浸渍在加入氨基酸、赖氨酸和/或组氨酸的上述福尔马林,戊二醛,或低聚过滤的戊二醛溶液中,其中所述的氨基酸的浓度,l-赖氨酸或组氨酸,其用作固定剂的添加剂,是约100-1000毫摩尔的范围,优选值是约684mm,248e。
除了上述情况,可以采用以上所列过程的组合,包括:步骤a之后跟着步骤b;步骤a之后跟着步骤c;以及步骤a之后跟着步骤d。
正如本领域技术人员将理解的,对组织样本进行热收缩测试以测试蛋白质交联的有效性。这里,一个或多个组织样本的热收缩测试结果表明,该组织的收缩温度(shrinktemperature)为90℃,所述组织样本根据至少一个实施方案使用福尔马林制备。这有利地和使用戊二醛制备的样品进行比较,其收缩温度为80℃。因此,福尔马林是合适的固定的变量(variantoffixation)。值得指出的是,在本领域,福尔马林通常被抛弃,主要是由于材料的性能是不利的,因为不充足的或不稳定的蛋白质交联。通过本文所述的预处理已克服了这些问题,允许以较薄的膜生产具有强度,柔韧性和耐用性的组织。在用于可经皮输送心脏瓣膜(本文中也称为“人工心脏瓣膜”)时,由该组织制备过程赋予的组织特性有利于形成具有相对小的轮廓的构造,这也从而促进了人工心脏瓣膜的干燥的包装。相同的优点,也能够在使用戊二醛过程进行预处理时实现。
仍参照图2b,固定胶原质交联248后,优选地进行醇后固定处理252,其通过在蒸馏水中清洗组织256,然后,在约0至37℃,在25%异丙醇清洗组织约30分钟到14天或以上260,更优选地,在20℃清洗至少约7天。所述组织经蒸馏水清洗264。
根据至少一个实施方案中,组织的处理,包括从收集时到植入或移植(grafting)时,不包括接触和/或暴露于聚合物中的渗透和/或封装组织的组织纤维。
现在参看图1和图3,所述干燥过程300在组织制备200之后进行。因此,根据至少一个实施方案,在载荷(load)下干燥组织。更具体地,对于干燥组织304,该组织以最小延伸平面(minimallystretchedflat)(即,拉伸只是足以消除可见的皱和气泡)被放置在平坦表面(例如,聚合物或丙烯酸系片材)上308,并在其边缘处进行固定312。可选的,结合的组织和下面的薄板然后设置轻微的弯曲。在干燥时,该张力使组织保持基本上平坦的结构,从而减轻或防止过度的收缩,起皱,和/或边缘处的卷曲,并且也因为板和所述组织之间的表面张力使组织的整个表面干燥更均匀。可替代地,组织压缩在丙烯酸板之间被干燥。干燥该组织时,将温度保持在约4至37℃之间,更优选的是,约20至37℃(即,约室温至人体正常体温)之间,并且更优选的是,在约20℃。所述干燥过程在基本上黑暗的条件下(即,基本上没有可见光)进行约6小时至5天,并且更优选的是,约72小时314。通过示例,组织是在温度约20℃在黑暗条件下干燥约6小时至5天之间,并且更优选的是,约72小时。本领域中的技术人员理解,当组织压缩在板之间时,组织的干燥需要一段较长的时间。
在至少一个实施方案中,干燥后,检查组织堆(lot)316,例如通过立体显微镜,以识别和丢弃那些有缺陷的或纤维基体不连续的组织。此外,每一片段的优选的纤维方向被识别,以确定将形成瓣膜瓣叶的片段的自由边缘的所需取向。根据制备的组织的尺寸(即,面积),以及给定的瓣膜所需的组织尺寸,该组织可被修整或以任选的尺寸调整尺寸320,如通过切割组织形成适当大小和形状的瓣膜。优选地,组织膜的切割进行取向,使得所得的瓣叶的自由边缘平行于组织膜的优选纤维方向。任选地,所述的瓣叶的自由边缘也可能被切割成抛物线或其他的曲线轮廓,以补偿从合缝瓣叶(commissuralleaflet)的附着点到中央的接合点(centralcoaptationpoint)的下降角(downwardangle),以及增加接合瓣叶(coaptingleaflet)之间的总接触表面。这种方法可以减少在瓣叶组件的经营利润方面受关注的弱点,以及有利的分配沿胶原纤维长轴方向操纵瓣膜的主要负载力(thisapproachminimizesfocalweaknessesintheoperatingmarginsoftheleafletassemblyandadvantageouslydistributestheprincipalloadingforcesoftheoperatingvalvealongthelongaxisofthecollagenfibers)。其结果是,该组织是耐表面断裂和磨损的。如图3所示,在干燥304和检查316后可选地调整尺寸(sizing)320。
现在参考图4,进一步说明了和形成组织瓣叶组件并附着到框架上以形成人工心脏瓣膜400相关的实施方案。应当理解的是,本文描述的一个或多个组织制备过程制备的组织可用于各种设备或用途,并且在人工心脏瓣膜中利用该组织,仅仅是一个可能的应用。例如,该组织可用于分流器(shunt),或作为移植材料以修复或修正一个或更多的人体器官,包括心脏及其血管。通过进一步的实施例,该组织可用作心包膜的补丁(patch)修复先天性心脏缺陷。该组织也用作腱和韧带置换的假体组织,及用于伤口管理的组织产品。此外,用于人工心脏瓣膜时,组织可能以各种不同的方式配置,并以各种不同的方式附着到框架。通过示例的方式,而不是限制,在至少一个实施方案中,通过折叠组织408,所制备的组织形成为组织瓣叶组件404,优选的,所述组织在干燥状态下,以形成至少部分组织瓣叶组件。在这里,本领域技术人员将会理解,完整的组织瓣叶组件可以由单个的组织片段800形成,如在图8a中所示的,或者,如图8b和8c所示,它可以由多个可操作地关联的组织片段802形成,例如通过沿着接缝(seam)804一起胶合或缝制组织片段。如图8c所示,接缝804优选的位于多个组织片段802的褶832的重叠部分。
本领域中的技术人员进一步理解,可以使用单个的组织片段800或多个的组织片段802,以形成人工心脏瓣膜,其中所述组织瓣叶组件是不折叠的构造。通过示例的方式,而不是限制,多个独立的组织片段均可以附着到框架(例如通过缝合(suturing)),以形成人工心脏瓣膜。此后,无论人工心脏瓣膜由折叠的组织瓣叶组件或附着到框架的多个独立的组织片段制成,所得到的人工心脏瓣膜随后均可进一步操作以干燥的人工心脏瓣膜进行输送。
在一个备选实施方案中,本文所描述的一个或多个组织制备过程生成的组织可用来形成人工心脏瓣膜,其包括框架,并且可由“经心尖(trans-apical)”的方法植入,其中人工心脏瓣膜如外科手术般的通过胸壁和心尖插入。
在又一替代实施方案中,本文所描述的一个或多个组织制备过程生成的组织可用来形成人工心脏瓣膜,其不包括框架,且不是通过导管输送,而是,通过患者的胸部开口手术植入。在这样的情况下,人工心脏瓣膜可作为干的人工心脏瓣膜包装输送。
在又一替代的实施方案中,本文所描述的一个或多个组织制备过程生成的组织可用来形成人工心脏瓣膜,其包括框架,但不是经由导管输送,而是,通过患者的胸部开口手术植入。在这样的情况下,人工心脏瓣膜可作为干的人工心脏瓣膜包装输送。
如本文所描述的另一替代形式的实施方案,组织可以“湿”或水合状态植入。例如,利用根据本文所述制备的组织的人工心脏瓣膜可能会作为水合人工心脏瓣膜包装输送。因此,组织制备过程的一部分,可以包括干燥该组织,以便它可以更容易地被操控,组织可以在植入之前的一较后的时间点时水合以及该组织可以保持在水合条件下包装、输送并直到植入患者体内。与使用折叠的组织瓣叶组件相关联的优点包括,折叠结构允许使用相对薄的膜,通过避免加载的,动态的有效表面的缝合(suture)。因此,非缝合的瓣叶组件保持长期的完整性。然而,可以理解的是,本文描述的一个或多个实施方案包括人工心脏瓣,其不包含折叠的组织瓣叶组件。
现在参考图8d-8l,并根据至少一个实施方案,对于包括由折叠的组织膜形成的组织瓣叶组件的人工心脏瓣膜,示出组织的折叠顺序以配置组织成完整的组织瓣叶组件。更具体地,组织坯料808示于图8d,其中,所述组织坯料808是单个的组织片段800。根据给定的组织瓣叶组件的尺寸要求,主折叠线或折叠线812(以虚线示出)可见于组织坯料808。如图8d所示,通过沿折叠线812将组织坯料808的底部边缘816朝着顶部边缘820折叠而实现主折叠814,但沿着组织坯料808的上部828留下袖口状瓣(cuff)部分824。这里,应当指出,顶部和底部的方向上彼此相对,并用于方便地说明折叠次序,其中这样的方向对应于附图页面的方向。有利的是,图8d-8l的折叠几何形成袖口状瓣824,其是瓣叶的连续部分,从而减少了主动脉瓣关闭不全或泄漏的风险。
现在参考图8f。沿折叠线812折叠所述组织坯料808形成主折叠814后,通过沿其长度方向折叠以形成褶。对于图8f中所示的实施方案,示出了832a,832b,832c三个褶。图8g示出详图,其是代表褶832a-c中其中一个的单个的褶832。在图8g中,以瓣窦(valvesinus)840和合缝褶皱(commissurefolds)844的形式示出了内瓣叶层自由边缘836。
再次参照图4以及图8h,折叠的组织被缝合以形成折叠的组织瓣叶组件412。更具体地,图8h示出了组织瓣叶组件848的示意性立体图,其中,示于图8f的下半部分褶式组织构造(pleatedtissueconstruct)被缝合,如沿着接缝850,以形成基本上为管状的结构。在组织瓣叶组件附着到框架之前,折叠的组织瓣叶组件848保持干燥或使其部分水合416。组织瓣叶组件848然后附着到框架内420,如在图8i所示的框架852。如示意性透视图8j,侧视图8k以及图11a中的照片和图11b所示,附着到框架852内的组织瓣叶组件848形成可植入人工心脏瓣膜860。图8k示出了可能的缝合点(suturepoint)864,组织瓣叶组件848可以缝合到框架852。也就是说,组织瓣叶组件848可附着在框架852内,如通过缝合组织瓣叶组件848的外层到框架。在前述句子中,如本文中所使用的,应当注意,虽然在人工心脏瓣膜860操作期间,内瓣叶层自由边缘836能够容易地移动,术语“附着”意味着组织瓣叶组件848固定到框架852上。
现在参照图11c,其示出了人工心脏瓣膜860的剖面侧视图,该人工心脏瓣膜包括框架852,其中组织瓣叶组件848附着到其中。组织膜瓣叶组件848同轴地设置在框架852内。如图中11c中所示,瓣膜860在闭合位置,瓣叶自由边缘836至少部分地彼此接触。瓣叶自由边缘836(剖视图的平面外)的弧1112与组织瓣叶组件848的径向边缘的褶832是连续的,并且可以在备选视图8l中可见。再次的如图8l所示,组织膜瓣叶组件848沿轴向取向膜褶832附着到框架852上。伸出的袖口状瓣层沿圆周附着到框架852的远侧边缘1104。通过示例的方式,而不是限制,可以使用连续缝合附着1108使伸出的袖口状瓣层附着到远侧边缘1104。
现在参照图11d中,示出一个实施方案,其中,所述的袖口状瓣层没有向远侧延伸到框架852的远侧边缘1104。如图11d中所示,袖口状瓣层的远侧边缘沿圆周附着到框架852的内面,例如沿图8k所示的那些可能的缝合点864。其结果是,框架852的远侧部分1116不包括组织瓣叶组件848的任何部分,比如袖口状瓣层。然而,在闭合位置的瓣膜860瓣叶自由边缘836还至少部分地彼此接触。
现在参考图8l,所示为人工心脏瓣膜的端视图。如图8l所示,褶832作为组织瓣叶组件848的部分以附着到框架852。如图8l中可见,外部袖口状瓣层附着到框架852的框架部件。当人工心脏瓣膜860被关闭时,内瓣叶层所形成的尖点(cusps)868一般位于图8l所示的位置。图12是经过30,000,000次循环测试以模拟人类心脏条件之后的人工心脏瓣膜的组织瓣叶的照片。在测试中,人工心脏瓣膜860演示其自然开放梯度(naturalopeninggradient)约5mmhg。
本领域中技术人员将理解,本文描述和所示的组织瓣叶组件848的一个可能的构造是形成流控制机制,其可以附着到框架以在展开后调节患者的血管系统的血液流动。也就是说,所示的组织瓣叶组件848是通过示例的方式,而不是限制,且绝不应被解释为限制可用于调节流体流动的膜瓣叶组件的几何形状。因此,权利要求包含其他瓣叶配置和结构,其指向或包括预安装的可经皮输送瓣膜。
本领域中的技术人员将理解,框架852可以是支架或类似支架的结构。框架852基本上用作组织瓣叶组件848的支撑机构,然后可以经皮插入到患者体内,其中,所述的框架852作为锚固折叠的组织瓣叶组件848至患者的血管部分(例如,在原位动脉组织)的途径。因此,组织瓣叶组件848被插入到框架852中424。更具体地,框架852可以包括气囊-可膨胀的框架424a,或者,可以使用自膨胀的框架424b。组织瓣叶组件被插入到框架中后,折叠组织瓣叶组件848附着到框架852上428,如图8l中所示的,例如通过缝合组织瓣叶组件848到框架852形成可植入人工心脏瓣膜860。在至少一个实施方案中,在组织瓣叶组件848附着到框架852内和连接组织瓣叶组件848到框架852以形成可植入的人工心脏瓣膜860后,人工心脏瓣膜860进行完全水合432以检查和测试。此后,完全构造的可植入的人工心脏瓣膜860可以在基本上干的条件下干燥并保持。因此,本领域中的技术人员理解,本发明描述的一个或多个实施方案中提供适合植入人体的组织800,其中,所述可植入的组织允许在植入之前干燥,或者可以在植入前水合。此外,组织800是适合用于形成人工心脏瓣膜用的组织瓣叶组件848,其包括可植入人工心脏瓣膜860,该瓣膜可在干燥状态下与其组织瓣叶组件一起植入,或与它的组织瓣叶组件一起在部分或完全水合状态下植入。
本文所描述的一个或多个实施方案的组织瓣叶组件可以使用球囊-可膨胀的框架或自膨胀框架被植入到患者体内。可膨胀的框架通常是输送到气囊导管(ballooncatheter)上的目标瓣膜的部位。为了插入,可膨胀的框架以压缩的结构沿输送装置定位,例如卷曲到气囊导管的气囊上,其是输送装置的一部分,拟用于在导丝(guidewire)上同轴安装。在可膨胀的框架定位在瓣膜平面上后(aftertheexpandableframeispositionedacrosstheplaneofthevalve),可膨胀的框架由输送装置膨胀。对于自膨胀的框架,通常鞘缩回,以允许自膨胀框架膨胀。
在至少一个实施方案中,该框架包括金属合金框架,其具有高应变设计公差,其可压缩至相对小的直径。通过提供具有小轮廓的设备,可植入的人工心脏瓣膜860,无手术切开或全身麻醉的情况下,允许经股动脉插入进行标准逆行主动脉输送(standardretrogradearterialaorticdelivery)。这是通过提供附有组织瓣叶组件或基本上干燥状态下的组织膜构造的预先安装的输送系统上的人工心脏瓣膜来实现的。
根据一个或多个实施方案中,比起湿膜,干燥的组织膜具有基本上较小的质量。通过示例的方式,本发明中一个或多个实施方案制备的基本上干燥的心包组织的质量约为湿的心包组织的质量的30%,并具有显著减少的轮廓以及填充体积,从而实现了相对小的轮廓,并使其适用于植入大量的患者,尤其是那些具有小直径血管系统的患者。此外,干燥的人工心脏瓣膜不需要在防腐剂中存储和运输。干的人工心脏瓣膜可以在生产场地安装在输送导管上,这使得可以形成预包装的集成输送系统。在上文中,应当注意的是,术语“安装”意味着人工心脏瓣膜860暂时与输送导管相关联。连同其相对小的轮廓,实施方案的人工心脏瓣膜,因此提供可靠性和便利性,因为可植入的人工心脏瓣膜860预先安装到它的输送导管上并形成预先包装的输送系统的一部分。此外,干燥的人工心脏瓣膜不需清洗,再水合,或在导管插入术实验室中(catheterizationlab)安装。因此,干燥的人工心脏瓣膜可以在过程的关键时刻由包装直接插入到患者的体内。有利的是,这样就避免了过程时间,操作以及安装,压接和定向导管和鞘时会发生的错误。一旦在手术设施/现场,干燥的人工心脏瓣膜通过气囊导管膨胀以标准方式在目标瓣膜的平面插入并输送,即使没有使心脏瓣膜的组织膜部分从干燥状态再水合的具体的步骤,干的人工心脏瓣膜也立即开始运作,其组织膜的水合随后迅速且自然地在体内发生。更具体地,组织膜部分的水合迅速发生,并从简单地用盐水预冲洗导管开始。此后,水合随着设备插入和停留到中央血管时继续,并在患者体内展开后自然地完成。
可植入的人工瓣膜的小的轮廓对具有相对小的直径的血管系统的患者是特别有利的。表1提供了主动脉瓣和肺动脉瓣假体尺寸。
表1:主动脉瓣和肺动脉瓣假体尺寸
对于大多数人类患者,股动脉具有的直径为约5-8毫米之间。因此,很明显,本文所描述的实施方案中折起的可植入的人工心脏瓣膜860提供了小的轮廓,使更大群体的患者能够接受可植入的人工心脏瓣膜860。作为本文所描述的一个或多个实施方案的可植入人工心脏瓣膜860具有的尺寸优势的结果,几乎没有候选患者被排除使用基于股动脉血管口径(accesscaliber)不足、不开心手术、不全身麻醉的可植入的人工心脏瓣膜860进行治疗。此外,本文所描述的一个或多个实施方案的可植入人工心脏瓣膜860设有可伸缩的构造,其中,所述可植入的人工心脏瓣膜860可制造成适应目标瓣膜直径,其介于6-35毫米,且其中,通过使用基础的单一设计,所述可植入的人工心脏瓣膜860提供一致的功能。
现在参照图5,进一步描述了安装可植入人工心脏瓣膜860到输送系统中500。更具体地,可植入的人工心脏瓣膜860(这里也称为可经皮输送心脏瓣膜)已折起504。可经皮输送心脏瓣膜折起的的初始阶段是组织膜以水合状态进行的。也就是说,由于可经皮输送心脏瓣膜860包括框架852,其中所述组织瓣叶组件848附着到框架852内,可经皮输送的心脏瓣膜860已折起为整体单元。如果使用气囊-可膨胀的框架,然后可以利用轴向牵拉折起可经皮输送的心脏瓣膜860的框架852,而不直接向框架852的侧面施加力。此过程具有保持框架852的单元结构(cellstructure)的优点,同时由于可经皮输送的心脏瓣膜860被压缩,还保持组织瓣叶组件848的瓣叶的取向。所述瓣叶的合适方向和安排(disposition)通过瓣叶的水合状态促进。这有助于防止组织800或802通过框架852脱垂或膨出。此外,这种技术减少了金属框架852(例如,支架)的再压缩应变,其倾向于损害框架852的疲劳寿命。这种技术也倾向于促进框架852中的单元的周向均一的折起,从而减轻组织聚束,所述组织构成可经皮输送的心脏瓣膜860的组织瓣叶组件848。对于自膨胀的框架,通过提供径向压缩力施加到框架上,侧面受力,并且在轴向牵引力的协助下折叠。
进一步参照图5,可经皮输送心脏瓣膜860(即,具有附着在其上的组织瓣叶组件848的框架852)在最初的水合状态折起。输送轴柄或气囊插入输送鞘508,然后安装段延伸出鞘的端部。此后,鞘和框架同轴地安装512,然后组织瓣叶组件848仍然在水合状态条件下,随初始卷曲压缩到安装段上。然后可经皮输送心脏瓣膜860的组织瓣叶组件848干燥516,这进一步降低了组织膜瓣叶的体积和轮廓(profile),允许通过径向力进一步压缩。因此,在最终的压缩步骤中,可经皮输送心脏瓣膜860进一步用圆周卷曲工具卷曲520,以至最后安装压缩的瓣膜/框架到输送轴柄或气囊导管。
现在参照图6,描述了入鞘,灭菌和包装600。更具体地,如上所述且示于图5,一旦可经皮输送心脏瓣膜860同轴地安装并卷曲到输送轴柄或球囊导管上,该组件然后插入604到输送鞘的远端,例如通过“回载(backloading)”该组件进入位置,该位置是所述可经皮输送心脏瓣膜860的远端在输送鞘内靠近鞘的端部的位置。参考图10,示意性地表示导管1000,可植入人工心脏瓣膜860安装到其上。
进一步的参照图6,对经皮输送的心脏瓣膜860和输送导管进行灭菌608,例如,通过使用环氧乙烷、质子束或γ辐射的一个或多个。该组件然后任选在无菌包中包装612。附加元件任选地随组件运载,其中,通过示例的方式,这样的元件可包括任何所需的输送工具和文档。在至少一个实施方中,所述包装任选的含有在包装的密封体积内控制水蒸汽含量的设备。图13描述了外科医生,拿着灭菌包装1300,其中包含预先安装的可经皮植入的人工心脏瓣膜。
现在参照图7,提供流程图,其表示和植入可经皮输送心脏瓣膜860相关的一般过程。更具体地,对患者的股动脉开导管接入口,通过接收植入物的患病瓣膜的平面放置导丝704。图14是人的心脏的简化的剖视图,包括心脏瓣膜,其可以是实施方案的可植入人工心脏瓣膜的接收目标。图15示出具有通过患病主动脉瓣放置的导丝的主动脉。以预先包装装配好的干燥的人工心脏瓣膜的形式的可经皮输送心脏瓣膜860从无菌包装中移出708。包括腔(lumens)的干燥的人工心脏瓣膜组件优选地经过冲洗,并以用于不包含生物相容性组织的标准的气囊和导管的通常方式进行制备。有利的是,植入干燥的人工心脏瓣膜组件不需经皮输送心脏瓣膜860组织瓣叶组件848的具体的再水合操作而进行。组织瓣叶的再水合可能会由于准备和其他导管一起使用时常规地冲洗导管腔而发生。此外,植入干燥的人工心脏瓣膜组件可以不进行额外的清洁步骤,如通过不得不用的醇或水清洗溶液。此外,进一步安装干燥的组织瓣叶组件848是没有必要的,所述组织瓣叶组件848位于可经皮输送的心脏瓣膜860的框架852,从而避免了另一个安装步骤的需求。因此,可经皮输送心脏瓣膜860基本上可以在干燥状态经皮植入。然后,并先于导丝,载流导管(carriercatheter)或气囊导管同轴地安装712,例如在透视(fluoroscopicvision)下最初的大血管水平,在那里其可以在透视下检查。确认标称位置和配置后,输送系统在透视下通过患病瓣膜平面前进716,和撤回覆盖鞘,无论是在这一点上,或在它之前的前进,从而暴露合适安装的可植入的人工心脏瓣膜860。在球囊可膨胀的框架的情况下,并假设输送手段包含预安装可经皮输送心脏瓣膜860到膨胀球囊上,球囊然后膨胀720,在瓣膜的平面展开该可经皮输送心脏瓣膜860。可经皮输送心脏瓣膜860的瓣叶立即运行724。展开的人工心脏瓣膜860示于图16中,其中,所述的组织瓣叶组件848用于适当地控制血液流动。
总之,本发明涉及以下方面:
1.组件,其包括:
人工心脏瓣膜,其包括:框架;以及附着到该框架的组织瓣叶组件;
可经皮插入的瓣膜输送机构,其中,所述人工心脏瓣膜可拆卸地安装到所述可经皮插入的瓣膜输送机构;和
无菌包装,含有可拆卸地安装到所述可经皮插入的瓣膜输送机构的所述人工心脏瓣膜。
2.如项1所述的组件,其中所述可经皮插入的瓣膜输送机构包括气囊导管。
3.如项2的组件,其中所述气囊导管是12至14弗伦奇的气囊导管。
4.如项2的组件,其中所述气囊导管小于约12弗伦奇。
5.如项2的组件,其中所述气囊导管在约5至12弗伦奇之间。
6.如项1的组件,其中所述可经皮插入的瓣膜输送机构包括轴柄。
7.如项1的组件,其中形成所述无菌包装内的组织瓣叶组件的组织,是水合的和非基本上干燥中的至少一个。
8.如项1的组件,其中形成所述无菌包装内的组织瓣叶组件的组织,是基本上干燥的。
9.如项1的组件,其中所述框架包括支架。
10.如项1的组件,其中形成组织瓣叶组件的组织包括已处理的心包组织。
11.备好的植入患者的预包装的可经皮、经导管输送人工心脏瓣膜,包括:
框架;以及
组织瓣叶组件,其附着到该框架,所述组织瓣叶组件包括基本上干燥的组织。
12.如项11所述的预包装的可经皮、经导管输送人工心脏瓣膜,其中所述基本上干燥的组织包括已处理的心包组织。
13.如项11所述的预包装的可经皮、经导管输送人工心脏瓣膜,其中所述基本上干燥的组织包括的水分含量小于约40%,基于基本上干燥组织的重量。
14.如项11所述的预包装的可经皮、经导管输送人工心脏瓣膜,其中所述框架和附着到其上的组织瓣叶组件与12至14弗伦奇的气囊导管可操作地相关联。
15.如项11所述的预包装的可经皮、经导管输送人工心脏瓣膜,其中所述框架和附着到其上的组织瓣叶组件与尺寸小于约12弗伦奇的气囊导管可操作地相关联。
16.如项11所述的预包装的可经皮、经导管输送人工心脏瓣膜,其中所述框架和附着到其上的组织瓣叶组件与尺寸在约5至12弗伦奇之间的气囊导管可操作地相关联。
17.供患者使用的组件,其包括:
密封的无菌包装,其包含用于在患者体内经皮展开的心脏瓣膜的输送系统,所述心脏瓣膜包括:
框架,其可拆卸地安装在密封的无菌包装内的输送系统;和
附着到该框架的组织瓣叶组件。
18.如项17的组件,其中所述组织瓣叶组件包括已处理的心包组织。
19.如项17的组件,其中所述输送系统包括可经皮插入的气囊导管。
20.如项19的组件,其中所述气囊导管是12至14弗伦奇的气囊导管。
21.如项19的组件,其中所述气囊导管小于约12弗伦奇。
22.如项19的组件,其中所述气囊导管在约5至12弗伦奇之间。
23.如项17的组件,其中所述输送系统包括可经皮插入的轴柄。
24.如项17的组件,其中所述密封的无菌包装内的组织瓣叶组件是部分水合的和非基本上干燥中的至少一种。
25.如项17的组件,其中所述密封的无菌包装内的组织瓣叶组件是基本上干燥的。
26.如项17的组件,其中所述框架包括支架。
27.适于植入患者体内的制品,其包括:
人工心脏瓣膜,其进一步包括附着到框架的已处理的组织,其中所述已处理的组织包括的水分含量小于约60%,基于所述已处理的组织的重量。
28.如项27的制品,其中所述已处理的组织包括已处理的心包组织切片,其具有大于约12兆帕的极限抗张强度。
29.如项28的制品,其中所述心包组织切片包括约50至300微米之间的厚度。
30.如项27的制品,其中所述已处理的组织中的水分含量小于约40%,基于已处理的组织的重量。
31.适于经导管输送到患者体内的制品,其包括:
人工心脏瓣膜,所述人工心脏瓣膜还包括附着到框架的已处理的组织,其中所述已处理的组织包含的基于已处理的组织重量的水分含量小于约50%时,包括约50至500微米的厚度和大于约15兆帕的极限抗张强度。
32.如项31的制品,其中所述已处理的组织包括已处理的心包组织。
33.如项31的制品,其中所述已处理的组织中的水分含量小于约40%,基于已处理的组织的重量。
34.如项31的制品,其中所述的极限抗张强度大于约20兆帕。
35.如项31的制品,其中所述已处理的组织不包括已暴露在聚合物渗透物的基体。
36.一种方法,其包括:
部分压缩和安装人工心脏瓣膜到输送导管,所述人工心脏瓣膜包括组织;
允许所述组织至少部分地干燥;
进一步压缩和安装所述人工心脏瓣膜到输送导管;且
灭菌和包装所述人工心脏瓣膜和输送导管。
37.根据项36的方法,其中还包括:运输已灭菌和包装的人工心脏瓣膜和输送导管。
38.根据项36的方法,其中所述组织包括已处理的心包组织。
39.根据项36的方法,其中在部分压缩和安装所述人工心脏瓣膜到输送导管之前,所述组织是(a)非基本上干燥和(b)至少部分水合中的至少一种。
40。一种方法,其包括:
附着组织到框架;
部分压缩和安装附着组织后的所述框架到输送导管;
允许组织至少部分地干燥;
进一步压缩和安装附着组织后的所述框架到输送导管;和
灭菌和包装所述框架和输送导管,其具有附着到其上的组织。
41.如项40的方法,其中在部分压缩并安装所述框架之前,所述组织是(a)非基本上干燥的和(b)至少部分水合中的至少一种。
42.如项40的方法,其中还包括运输所述已灭菌和包装的框架到外科手术或医疗设施,所述框架具有附着到其上的组织,以及已安装到输送导管。
43.如项40的方法,其中在所述组织附着到所述框架之前,折叠所述组织以形成组织瓣叶组件。
44.如项43的方法,其中所述组织瓣叶组件包括至少一个袖口状瓣和至少一个褶。
45.如项40的方法,其中所述组织包括已处理的心包组织。
46.制备可经皮、经导管的人工心脏瓣膜的方法,其包括:
提供取自有机体的膜组织;
使用至少一种化学物质处理所述膜组织以产生已处理的膜组织;
干燥所述已处理的膜组织,直到它是基本上干燥的组织;
附着所述基本上干燥的组织到框架;
再水合附着到所述框架的所述基本上干燥的组织以形成再水合的组织;
折起其上附着有再水合组织的所述框架;以及
干燥所述再水合的组织,其附着到已折起的框架,直到它是基本上干燥的组织。
47.如项46的制备可经皮、经导管的人工心脏瓣膜的方法,其还包括:压缩和安装其上附着有组织的所述框架到输送导管。
48.如项47的制备可经皮、经导管的人工心脏瓣膜的方法,其还包括:灭菌和包装其上附着有基本上干燥的组织的所述框架,其已安装到所述输送导管。
49.如项48的制备可经皮、经导管的人工心脏瓣膜的方法,其还包括以下的至少一种:运输和/或载运所述已灭菌和包装的框架到外科或医疗设施,所述框架上附着有基本上干燥的组织以及已安装到输送导管。
50.如项49的制备可经皮、经导管的人工心脏瓣膜的方法,其中还包括:在患者体内植入其上附着有基本上干燥的组织的框架。
51.如项46的制备可经皮、经导管的人工心脏瓣膜的方法,其中所述框架包括支架。
52.如项46的制备可经皮、经导管的人工心脏瓣膜的方法,其中在所述附着步骤之前,所述干燥的组织不折叠有袖口状瓣和褶。
53.如项46的制备可经皮、经导管的人工心脏瓣膜的方法,其中在所述附着步骤之前,折叠所述干燥的组织以形成组织瓣叶组件。
54.如项53的制备可经皮、经导管的人工心脏瓣膜的方法,其中所述组织瓣叶组件包括至少一个袖口状瓣和至少一个褶。
55.如项53的制备可经皮、经导管的人工心脏瓣膜的方法,其中还包括:安装所述框架和其上附着的组织瓣叶组件到12到14弗伦奇的气囊导管。
56.如项53的制备可经皮、经导管的人工心脏瓣膜的方法,其中还包括:安装所述框架和其上附着的组织瓣叶组件到尺寸小于约12弗伦奇的气囊导管。
57.如项53的制备可经皮、经导管的人工心脏瓣膜的方法,其中还包括:安装所述框架和其上附着的组织瓣叶组件到尺寸在约5至12弗伦奇之间的气囊导管。
58.如项53的制备可经皮、经导管的人工心脏瓣膜的方法,其中还包括:安装所述框架和其上附着的组织瓣叶组件到轴柄上。
59.如项46的制备可经皮、经导管的人工心脏瓣膜的方法,其中还包括灭菌其上附着有基本上干燥的组织的所述框架,通过使其暴露于环氧乙烷、质子束和γ射线辐射中的至少一个进行灭菌。
60.如项46的制备可经皮、经导管的人工心脏瓣膜的方法,其中所述处理包括浸渍所述膜组织在缓冲或无缓冲1-37.5%的福尔马林溶液中约3天~3周。
61.如项46的制备可经皮、经导管的人工心脏瓣膜的方法,其中所述处理包括浸渍所述膜组织在缓冲或无缓冲1-37.5%的福尔马林溶液中约3天~5周。
62.如项46的制备可经皮、经导管的人工心脏瓣膜的方法,其中所述处理包括浸渍所述膜组织在缓冲或无缓冲1-37.5%的福尔马林溶液中约3天~3周,所述福尔马林溶液含有下述游离氨基酸中的至少一种:(a)赖氨酸和(b)组氨酸。
63.如项46的制备可经皮、经导管的人工心脏瓣膜的方法,其中所述处理包括浸渍所述膜组织在缓冲或无缓冲1-37.5%的福尔马林溶液中约3天~5周,所述福尔马林溶液含有下述游离氨基酸中的至少一种:(a)赖氨酸和(b)组氨酸。
64.如项46的制备可经皮、经导管的人工心脏瓣膜的方法,其中所述处理包括浸渍所述膜组织在100%的甘油中超过约3周。
65.如项46的制备可经皮、经导管的人工心脏瓣膜的方法,其中所述处理包括浸渍所述膜组织在0.1-25%戊二醛溶液中约3天~3周。
66.如项46的制备可经皮、经导管的人工心脏瓣膜的方法,其中所述处理包括浸渍所述膜组织在0.1-25%戊二醛溶液中约3天~5周。
67.如项46的制备可经皮、经导管的人工心脏瓣膜的方法,其中所述处理包括浸渍所述膜组织在0.1-25%戊二醛溶液中约3天~3周,其中戊二醛溶液含有下述游离氨基酸的至少一种:(a)赖氨酸和(b)组氨酸。
68.如项46的制备可经皮、经导管的人工心脏瓣膜的方法,其中所述处理包括浸渍所述膜组织在0.1-25%戊二醛溶液中约3天~5周,其中戊二醛溶液含有下述游离氨基酸的至少一种:(a)赖氨酸和(b)组氨酸。
69.如项46的制备可经皮、经导管的人工心脏瓣膜的方法,其中所述处理包括浸渍所述膜组织在低聚过滤的0.1-25%戊二醛溶液中约3天~3周。
70.如项46的制备可经皮、经导管的人工心脏瓣膜的方法,其中所述处理包括浸渍所述膜组织在低聚过滤的0.1-25%戊二醛溶液中约3天~5周。
71.如项46的制备可经皮、经导管的人工心脏瓣膜的方法,其中所述处理包括浸渍所述膜组织在低聚过滤的0.1-25%戊二醛溶液中约3天~3周,其中戊二醛溶液含有下述游离氨基酸的至少一种:(a)赖氨酸和(b)组氨酸。
72.如项46的制备可经皮、经导管的人工心脏瓣膜的方法,其中所述处理包括浸渍所述膜组织在低聚过滤的0.1-25%戊二醛溶液中约3天~5周,其中戊二醛溶液含有下述游离氨基酸的至少一种:(a)赖氨酸和(b)组氨酸。
73.如项46的制备可经皮、经导管的人工心脏瓣膜的方法,其中所述膜组织包括已处理的心包组织。
本发明可以体现其它特定形式,而不脱离其精神或基本特征。所描述的实施方案被认为在所有方面仅是说明性的,而不是限制性的。因此,本发明的范围由所附权利要求,而不是由前面的描述表明。权利要求的等同的含义和范围内的所有变化都被包含在其范围内。
所述一个或多个本发明的、在各种实施方案中、包括组件,方法,过程,系统和/或装置,基本上如本文所描绘和描述的,包括各种实施方案,次组合(subcombinations),和其子集。本技术领域的技术人员理解本公开之后将明白如何制造和使用本发明。
在各种实施方案中,本发明包括提供设备和方法中的未画出和/或描述的项目,或者在各种的实施方案,包括缺少可能已经在先前的设备或方法中使用的这样的项目的情况(例如,用于提高性能,实现轻松和/或减少实施成本)。
本发明的前述讨论以说明和描述为目的。前述内容并不意在限制本发明到本文所公开的形式。例如在前述的发明详述中,本发明的各种特征的组合在一个或多个实施方案是精简公开的目的。本公开的方法不应被解释为反映一种意图,即所要求保护的发明需要比权利要求中明确记载的更多的特征。相反,如以下权利要求所反映的,创造性方面在于比单一的上述公开的实施方案的所有特征少。因此,下面的权利要求被并入到该发明详述中,每个权利要求自身作为本发明的一个单独的优选实施方案。
此外,虽然本发明的描述包括一个或多个实施方案以及一定的变化和修改,其他的变化和修改也在本发明的范围内的(例如,在理解本公开后,可以是那些在本领域技能和知识内)。它的目的是获得允许的范围内的权利,包括替换,互换和/或等同的结构,功能,范围或所声称的行为,不论这种替换,互换和/或等同的结构,功能,范围,或行为是否被本文所披露,并没有打算向公众奉献任何专利标的。
- 还没有人留言评论。精彩留言会获得点赞!