一种羟乙基淀粉修饰的抗肿瘤药物偶联物及其组装纳米系统的制备与应用的制作方法
本发明属于纳米药物制剂技术领域,更具体地,涉及一种羟乙基淀粉修饰的还原响应型抗肿瘤药物偶联物及其组装纳米系统的制备方法与应用。
背景技术:
难溶性抗肿瘤药物的纳米载药系统一直是药剂学研究领域的热点,为了增溶难溶性药物,研究者通常采用大量的增溶载体或辅料,比如为了增溶紫杉醇药物,泰素(英文商品名:)中加入了大量的聚氧乙烯蓖麻油,而该辅料将引起明显的不良反应,如急性超敏反应、外周神经毒性以及细胞毒性等。其中急性超敏反应是聚氧乙烯蓖麻油引起的最广泛且严重的不良反应,其发生与否是无法预知的。目前,临床上的应对措施主要为输液前使用皮质激素与组胺拮抗剂药物组合进行预防。因此,使用泰素进行抗肿瘤治疗不仅存在较高的不良反应发生率,并且,使用前的过敏预防增加了整个抗肿瘤治疗程序的复杂性。
针对难溶抗肿瘤药物自身的特性和现有剂型的缺陷,许多研究者试图通过将水溶性分子与抗肿瘤药物偶联的方法来改善难溶抗肿瘤药物在水中的溶解行为。其中,水溶性高分子是近年来肿瘤化疗药物研究领域热门的一类载体材料。高分子前药进入血液循环后,由于肿瘤组织血管的高通透性,淋巴管路回流的缺失等特点,使得高分子前药可以在肿瘤部位蓄积,及增强滞留效应(Enhanced Permeability and Retention effect,EPR效应)。同时,水溶性高分子聚合物与紫杉醇通过共价键结合后,可以控制药物缓慢释放,降低代谢速度,提高药物的稳定性,减少毒副作用。常用于偶联化疗药物的水溶性高分子聚合物包括聚乙二醇、羟丙基甲基酰胺等。这些高分子聚合物能有效增加难溶药物的水溶性,但同时也存在一些缺陷,例如,聚乙二醇在体内会产生抗聚乙二醇抗体,从而加快体内清除速率,并引起免疫反应;聚乙二醇在体内不可降解,只能通过肾脏排出体外等(K.Knop,R.Hoogenboom,D.Fischer,U.S.Schubert,Poly(ethylene glycol)in drug delivery:pros and cons as well as potential alternatives,Angewandte Chemie,49(2010)6288-6308.)。这些缺陷限制了该类高分子聚合物在偶联化疗药物中的应用。
在现有的应用于偶联抗肿瘤药物的水溶性高分子材料中,羟乙基淀粉(hydroxyethyl starch,HES)是一类新型的具有较多优良特性的高分子。羟乙基淀粉是以糯玉米淀粉中的支链淀粉为原料,经轻度酸水解和糊化,并在碱性条件下经环氧乙烷或2-氯乙醇羟乙基化而制成的高分子聚合物,其基本结构如图所示:
羟乙基淀粉基本结构
淀粉经羟乙基化后,水溶性、溶液稳定性增加,粘度降低,同时由于羟乙基增加的位阻,内源性的α-淀粉酶对羟乙基化的淀粉降解速度变慢,从而增加了其在血液中的循环时间。由于其良好的水溶解性、长循环特性及生物相容性,在20世纪70年代,羟乙基淀粉就开始在临床上作为血浆扩容剂使用。(J.Treib,J.F.Baron,M.T.Grauer,R.G.Strauss,An international view of hydroxyethyl starches,Intensive Care Med,25(1999)258-268.)。
通过偶联水溶性高分子,抗肿瘤药物的溶解性能得到改善,在此基础上,利用智能响应的连接臂来偶联水溶性高分子和抗肿瘤药物的智能响应型载药系统在增强抗肿瘤效果上具有更大的意义。载药系统根据外界因素的变化如温度、pH和场效应等,自发做出响应,从而达到人们预期可控的药物释放。其中,还原响应性载药系统是一类响应敏感度较高的载药系统。还原型谷胱甘肽(GSH)是动物细胞内含量最丰富的含有巯基的生物小分子,还原性谷胱甘肽(GSH)和氧化型谷胱甘肽(GSSG)是体内最主要的氧化还原对。在细胞内外不同的环境中GSH/GSSG的含量存在显著的差异。由于谷胱甘肽还原酶的作用,细胞内GSH浓度是细胞外环境的100-1000倍,从而使细胞内环境保持较强的还原性。此外,研究发现,肿瘤组织中GSH浓度比正常组织至少高4倍,因此,比正常组织有更高的还原性(X.X.Chuan,Q.Song,J.L.Lin,X.H.Chen,H.Zhang,W.B.Dai,B.He,X.Q.Wang,Q.Zhang,Novel Free-Paclitaxel-Loaded Redox-Responsive Nanoparticles Based on a Disulfide-Linked Poly(ethylene glycol)-Drug Conjugate for Intracellular Drug Delivery:Synthesis,Characterization,and Antitumor Activity in Vitro and in Vivo,Mol Pharmaceut,11(2014)3656-3670.)。
尽管目前现有难溶抗肿瘤药物的剂型能在一定程度上改善药物本身的水溶解性,但药物本身以及制剂成分造成的毒副作用为临床应用带来了难度。此外,传统剂型没有靶向肿瘤和在肿瘤部位靶向释放药物的特性,从而导致药物抗肿瘤效果不佳。
技术实现要素:
针对现有技术的以上缺陷或改进需求,本发明提供了一种羟乙基淀粉修饰的还原响应型抗肿瘤药物偶联物及其组装纳米系统的制备方法与应用,其目的在于通过羟乙基淀粉与紫杉烷类抗肿瘤药物通过二硫键偶联,此偶联物在无其他药物载体的情况下通过超声乳化加高压均质法组装成纳米载药系统,得到尺寸更小的纳米载药系统,由此解决现有技术的传统抗肿瘤药物剂型的毒副作用、没有靶向肿瘤、在肿瘤部位靶向释放药物的特性以及肿瘤治疗效率不佳的技术问题。
为实现上述目的,按照本发明的一个方面,提供了一种羟乙基淀粉修饰的抗肿瘤药物偶联物,所述偶联物为羟乙基淀粉与抗肿瘤药物通过二硫键偶联形成的化合物,所述羟乙基淀粉平均分子量为70~200kDa,羟乙基的摩尔取代度为0.4~0.5。
优选地,所述羟乙基淀粉为HES 130/0.4,平均分子量为130kDa,羟乙基的摩尔取代度为0.4。
优选地,所述抗肿瘤药物为紫杉烷类抗肿瘤药物,优选为紫杉醇抗肿瘤药物。
按照本发明的另一个方面,提供了一种羟乙基淀粉修饰的抗肿瘤药物偶联物的制备方法,包括如下步骤:
(1)3-(2-吡啶二硫)-丙酸(PDP)的合成:将2,2′-二吡啶二硫溶解在无水乙醇和冰乙酸混合溶液中,另取3-巯基丙酸溶解在无水乙醇中,再逐滴加入至所述2,2′-二吡啶二硫的无水乙醇和冰乙酸混合溶液中,继续搅拌反应,反应完成后减压蒸出溶剂,硅胶柱层析分离纯化产物,以正己烷、乙酸乙酯和冰乙酸的混合溶剂为洗脱剂,收集含有产物的洗脱剂,减压蒸出溶剂,再真空干燥,得到产物3-(2-吡啶二硫)-丙酸,所述2,2′-二吡啶二硫和3-巯基丙酸的投料摩尔比为1~4:1;
(2)3-(2-吡啶二硫)-丙酸-紫杉醇的合成:将紫杉醇溶解在二氯甲烷中,加入步骤(1)获得的3-(2-吡啶二硫)-丙酸和N,N′-二环己基碳二亚胺,20~50℃下,反应4~24小时,抽滤除去生成的N,N′-二环己基脲,将滤液减压蒸出溶剂,硅胶柱层析分离纯化产物,以二氯甲烷和丙酮的混合溶剂为洗脱剂,收集含样品的洗脱剂,减压蒸出溶剂,再真空干燥,得到产物3-(2-吡啶二硫)-丙酸-紫杉醇,所述紫杉醇、3-(2-吡啶二硫)-丙酸和N,N′-二环己基碳二亚胺投料摩尔比为1:1~2:1~10;
(3)3-巯基丙酸-紫杉醇的合成:将步骤(2)获得的3-(2-吡啶二硫)-丙酸-紫杉醇和二硫苏糖醇溶解在溶剂中,惰性气体保护下搅拌反应4~24小时,用超纯水萃取1~10次,收集有机相并浓缩得到产物3-巯基丙酸-紫杉醇,所述3-(2-吡啶二硫)-丙酸-紫杉醇和二硫苏糖醇投料摩尔比为1:8~20;
(4)3-(2-吡啶二硫)-丙酸-羟乙基淀粉的合成:将预先干燥的羟乙基淀粉溶解在二甲基亚砜中,再依次加入3-(2-吡啶二硫)-丙酸、N,N′-二环己基碳二亚胺和4-二甲氨基吡啶,20~50℃下,反应4~24小时,抽滤除去生成的N,N′-二环己基脲,滤液加入至异丙醇/乙醚混合溶剂中,抽滤,固体再用异丙醇/乙醚混合溶剂洗涤,超纯水透析,冻干得到3-(2-吡啶二硫)-丙酸-羟乙基淀粉,所述羟乙基淀粉中的糖环、3-(2-吡啶二硫)-丙酸、N,N′-二环己基碳二亚胺和4-二甲氨基吡啶投料摩尔比为1.5~3:1:1:0.5;
(5)羟乙基淀粉修饰的紫杉醇偶联物的合成:将步骤(4)获得的3-(2-吡啶二硫)-丙酸-羟乙基淀粉溶解在二甲亚砜中,向其中加入步骤(3)获得的3-巯基丙酸-紫杉醇的二甲亚砜溶液,惰性气体保护下搅拌反应,反应液加入至乙醇/乙醚混合溶剂中,固液分离,固体再用乙醇/乙醚混合溶剂洗涤,超纯水透析,冻干得到羟乙基淀粉修饰的紫杉醇偶联物,所述3-(2-吡啶二硫)-丙酸-羟乙基淀粉中的二硫键和3-巯基丙酸-紫杉醇的投料摩尔比为1:1~2:1。
优选地,步骤(1)所述2,2′-二吡啶二硫和3-巯基丙酸的投料摩尔比为2:1;
优选地,步骤(2)所述反应温度为25℃;
优选地,步骤(2)所述紫杉醇、3-(2-吡啶二硫)-丙酸和N,N′-二环己基碳二亚胺投料摩尔比为1:1.5:6;
优选地,步骤(3)所述3-(2-吡啶二硫)-丙酸-紫杉醇和二硫苏糖醇投料摩尔比为1:10;
优选地,步骤(4)反应温度为25℃;
优选地,步骤(4)所述羟乙基淀粉中的糖环、3-(2-吡啶二硫)-丙酸、N,N′-二环己基碳二亚胺和4-二甲氨基吡啶投料摩尔比为3:1:1:0.5;
优选地,步骤(5)所述3-(2-吡啶二硫)-丙酸-羟乙基淀粉中的二硫键和3-巯基丙酸-紫杉醇的投料摩尔比为2:1。
按照本发明的另一个方面,提供了一种基于所述的羟乙基淀粉修饰的抗肿瘤药物偶联物的纳米载药系统,所述纳米载药系统包括所述的羟乙基淀粉修饰的抗肿瘤药物偶联物。
优选地,所述纳米载药系统中羟乙基淀粉修饰的抗肿瘤药物偶联物纳米粒的粒径为100~500nm,优选为100~180nm,载药量为3%~10%,优选为5%,Zeta电位为2~10mV,优选为5mV。
进一步优选地,所述纳米载药系统中羟乙基淀粉修饰的抗肿瘤药物偶联物纳米粒的粒径为100~180nm,载药量为5%,Zeta电位为5mV。
按照本发明的另一个方面,提供了一种所述的羟乙基淀粉修饰的抗肿瘤药物偶联物的纳米载药系统的制备方法,包括如下步骤:
(1)将权利要求1~3所述的羟乙基淀粉修饰的抗肿瘤药物偶联物溶解于含水溶液中,得到羟乙基淀粉修饰的抗肿瘤药物偶联物的水溶液;
(2)向步骤(1)获得的羟乙基淀粉修饰的抗肿瘤药物偶联物的水溶液中逐滴加入脂溶性有机溶剂,并在滴加的过程中超声分散,制备得到初乳;
(3)利用高压均质机将步骤(2)得到的初乳进行进一步分散,减压真空除去有机溶剂,得到羟乙基淀粉修饰的抗肿瘤药物偶联物的组装纳米载药系统。
优选地,步骤(2)所述偶联物的水溶液与有机溶剂的体积比为1:1~100:1,优选为10:1~20:1。
优选地,步骤(3)所述高压均质机的高压均质压力为500~1000bar,高压均值次数为1~10次,优选1~5次,高压均质温度为0~50℃,优选4~15℃。
按照本发明的另一个方面,提供了一种所述的羟乙基淀粉修饰的抗肿瘤药物偶联物的纳米载药系统的应用,所述组装纳米载药系统应用于制备抗肿瘤药物。
总体而言,通过本发明所构思的以上技术方案与现有技术相比,能够取得下列有益效果。
(1)本发明提供了一种羟乙基淀粉修饰的具有还原响应性抗肿瘤药偶联物。所述的羟乙基淀粉-抗肿瘤药偶联物具有还原响应性指的是分子中含有的二硫键可在还原剂的作用下断裂,而在肿瘤细胞内部,存在有大量的还原性谷胱甘肽(GSH),所以当羟乙基淀粉-抗肿瘤药物偶联物进入肿瘤组织后,在还原性谷胱甘肽的作用下二硫键断裂,释放出抗肿瘤药物,从而能显著提高其生物利用度和治疗效率。
(2)本发明提供了基于羟乙基淀粉修饰的抗肿瘤药物偶联物构建的纳米载药系统,赋予难以组装形成纳米粒的抗肿瘤药物组装成纳米载药系统的能力。
(3)本发明提供的基于羟乙基淀粉修饰的抗肿瘤药物偶联物在无其他药物载体的情况下可通过超声乳化加高压均质法组装成纳米载药系统,此方法无需再添加额外的表面活性剂或交联剂,即可组装成水溶液中稳定存在的纳米粒。同两亲性分子在水溶液中自组装的方法相比,超声乳化加高压均质法能够得到尺寸更小的纳米载药系统,有利于肿瘤的被动靶向和深部穿透。经此方法制备的纳米载药系统不仅能够保证药物本身的药理活性,还能够使得药物具有纳米载药系统的优势。
(4)本发明提供的羟乙基淀粉修饰的抗肿瘤药物纳米载药系统,相比于传统的游离抗肿瘤药物制剂,有效改善了抗肿瘤药物的水溶性,不仅能够保证药物本身的药理活性,且具有被动靶向能力,可提高生物利用度,延长体内循环时间,改善药代动力学行为,减少化疗过程中的毒副作用。
附图说明
图1为本发明实施例1制备的还原响应型羟乙基淀粉修饰的紫杉醇偶联物的合成路线;
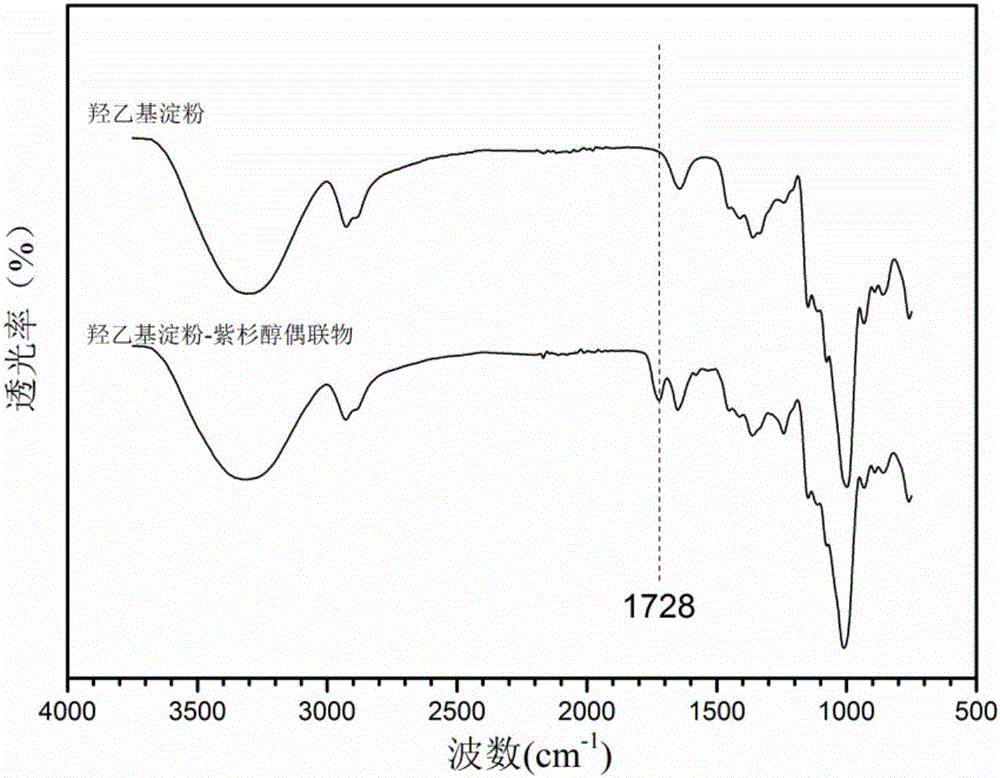
图2为本发明实施例1制备的还原响应型羟乙基淀粉修饰的紫杉醇偶联物的红外光谱图;
图3为本实施例1制备的还原响应型羟乙基淀粉修饰的紫杉醇偶联物的核磁共振谱图(氢谱);
图4为本实施例2制备的还原响应型羟乙基淀粉-紫杉醇纳米粒的透射电镜图;
图5为本发明实施例2制备的还原响应型羟乙基淀粉-紫杉醇纳米粒在不同还原条件下释放的曲线图;
图6为发明实施例2制备的还原响应型羟乙基淀粉-紫杉醇纳米粒在不同还原条件下及不同药物浓度对肿瘤细胞的杀伤作用;
图7为本发明实施例2制备的还原响应型羟乙基淀粉-紫杉醇纳米粒和游离紫杉醇的血药浓度-时间曲线;
图8为本发明实施例2制备的还原响应型羟乙基淀粉-紫杉醇纳米粒和游离紫杉醇的肿瘤体积-时间曲线(A)和肿瘤照片(B)。
具体实施方式
为了使本发明的目的、技术方案及优点更加清楚明白,以下结合附图及实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。此外,下面所描述的本发明各个实施方式中所涉及到的技术特征只要彼此之间未构成冲突就可以相互组合。
本发明提供的一种羟乙基淀粉修饰的抗肿瘤药物偶联物,为羟乙基淀粉与抗肿瘤药物通过二硫键偶联形成的化合物,所述的羟乙基淀粉包括但不限于以下几种:HES 70/0.5,平均分子量为70kDa,羟乙基的摩尔取代度为0.5;HES 130/0.4,平均分子量为130kDa,羟乙基的摩尔取代度为0.4;HES 200/0.5,平均分子量为200kDa,羟乙基的摩尔取代度为0.5。优选HES 130/0.4。
所述抗肿瘤药物为紫杉烷类抗肿瘤药物,优选为紫杉醇抗肿瘤药物。
本发明提供的羟乙基淀粉修饰的抗肿瘤药物偶联物的制备方法,包括如下步骤:
(1)3-(2-吡啶二硫)-丙酸(PDP)的合成:将2,2′-二吡啶二硫溶解在无水乙醇和冰乙酸混合溶液中,另取3-巯基丙酸溶解在无水乙醇中,再逐滴加入至所述2,2′-二吡啶二硫的无水乙醇和冰乙酸混合溶液中,继续搅拌反应,反应完成后减压蒸出溶剂,硅胶柱层析分离纯化产物,以正己烷、乙酸乙酯和冰乙酸的混合溶剂为洗脱剂,收集含有产物的洗脱剂,减压蒸出溶剂,再真空干燥,得到产物3-(2-吡啶二硫)-丙酸,所述2,2′-二吡啶二硫和3-巯基丙酸的投料摩尔比为1~4:1,优选2:1;
(2)3-(2-吡啶二硫)-丙酸-紫杉醇的合成:将紫杉醇溶解在二氯甲烷中,加入步骤(1)获得的3-(2-吡啶二硫)-丙酸和N,N′-二环己基碳二亚胺,20~50℃下,优选25℃下反应4~24小时,抽滤除去生成的N,N′-二环己基脲,将滤液减压蒸出溶剂,硅胶柱层析分离纯化产物,以二氯甲烷和丙酮的混合溶剂为洗脱剂,收集含样品的洗脱剂,减压蒸出溶剂,再真空干燥,得到产物3-(2-吡啶二硫)-丙酸-紫杉醇,所述紫杉醇、3-(2-吡啶二硫)-丙酸和N,N′-二环己基碳二亚胺投料摩尔比为1:1~2:1~10,优选1:1.5:6;
(3)3-巯基丙酸-紫杉醇的合成:将步骤(2)获得的3-(2-吡啶二硫)-丙酸-紫杉醇和二硫苏糖醇溶解在溶剂中,惰性气体保护下搅拌反应4~24小时,用超纯水萃取1~10次,收集有机相并浓缩得到产物3-巯基丙酸-紫杉醇,所述3-(2-吡啶二硫)-丙酸-紫杉醇和二硫苏糖醇投料摩尔比为1:8~20,优选1:10;
(4)3-(2-吡啶二硫)-丙酸-羟乙基淀粉的合成:将预先干燥的羟乙基淀粉溶解在二甲基亚砜中,再依次加入3-(2-吡啶二硫)-丙酸、N,N′-二环己基碳二亚胺和4-二甲氨基吡啶,20~50℃下,优选25℃下反应4~24小时,抽滤除去生成的N,N′-二环己基脲,滤液加入至异丙醇/乙醚混合溶剂中,抽滤,固体再用异丙醇/乙醚混合溶剂洗涤,超纯水透析,冻干得到3-(2-吡啶二硫)-丙酸-羟乙基淀粉,所述羟乙基淀粉中的糖环、3-(2-吡啶二硫)-丙酸、N,N′-二环己基碳二亚胺和4-二甲氨基吡啶投料摩尔比为1.5~3:1:1:0.5,优选3:1:1:0.5;
(5)羟乙基淀粉修饰的紫杉醇偶联物的合成:将步骤(4)获得的3-(2-吡啶二硫)-丙酸-羟乙基淀粉溶解在二甲亚砜中,向其中加入步骤(3)获得的3-巯基丙酸-紫杉醇的二甲亚砜溶液,惰性气体保护下搅拌反应,反应液加入至乙醇/乙醚混合溶剂中,固液分离,固体再用乙醇/乙醚混合溶剂洗涤,超纯水透析,冻干得到羟乙基淀粉修饰的紫杉醇偶联物,所述3-(2-吡啶二硫)-丙酸-羟乙基淀粉中的二硫键和3-巯基丙酸-紫杉醇的投料摩尔比为1:1~2:1,优选2:1。
本发明提供了一种基于所述的羟乙基淀粉修饰的抗肿瘤药物偶联物的纳米载药系统,包括所述的羟乙基淀粉修饰的抗肿瘤药物偶联物。所述纳米载药系统中羟乙基淀粉修饰的抗肿瘤药物偶联物纳米粒的粒径为100~500nm,优选为100~180nm,载药量为3%~10%,优选为5%,Zeta电位为2~10mV,优选为5mV。
所述的羟乙基淀粉修饰的抗肿瘤药物偶联物的纳米载药系统的制备方法,包括如下步骤:
(1)将所述的羟乙基淀粉修饰的抗肿瘤药物偶联物溶解于含水溶液中,得到羟乙基淀粉修饰的抗肿瘤药物偶联物的水溶液;含水溶液可选纯水、体积百分数为5%葡萄糖溶液、生理盐水和磷酸盐缓冲液等,优选纯水;溶解时搅拌速度可选50~1500转/分,优选500~700转/分。
(2)向步骤(1)获得的羟乙基淀粉修饰的抗肿瘤药物偶联物的水溶液中逐滴加入脂溶性有机溶剂,并在滴加的过程中超声分散,制备得到初乳;有机溶剂可选二氯甲烷、三氯甲烷等脂溶性有机溶剂,优选三氯甲烷;所述偶联物的水溶液与有机溶剂的体积比为1:1~100:1,优选为10:1~20:1;超声功率为500~700W;超声温度为0~50℃,优选4~15℃。
(3)利用高压均质机将步骤(2)得到的初乳进行进一步分散,减压真空除去有机溶剂,得到羟乙基淀粉修饰的抗肿瘤药物偶联物的纳米载药系统。高压均值次数为1~10次,优选1~5次;高压均质温度为0~50℃,优选4~15℃;减压真空温度为10~60℃,优选25~37℃。
本发明制备得到的羟乙基淀粉修饰的抗肿瘤药物偶联物纳米粒的粒径为100~500nm,进一步优选为100~180nm。载药量为3%~10%,进一步优选为5%。Zeta电位为2~10mV,优选为5mV。本发明所述的羟乙基淀粉修饰的抗肿瘤药物偶联物的纳米载药系统的应用,可应用于制备抗肿瘤药物。
实施例中所用试剂或仪器未注明生产厂商者,均为可通过正规渠道购买得到的常规产品。
本发明的实施例中,所述抗肿瘤药物为紫杉醇。
除非特别指明,以下实施例中所用水溶液的溶剂均为无菌超纯水溶液。
除非特别指明,以下实施例中所用的试剂均为分析纯试剂。
除非特别指明,以下实施例中所用的乳腺癌细胞系4T1购自中国科学院细胞库。
除非特别指明,以下实施例中所用的动物购自湖北省医学实验动物中心。
以下为实施例:
实施例1:
一种还原响应型羟乙基淀粉修饰的抗肿瘤药物偶联物,其制备方法包括如下步骤:
(1)3-(2-吡啶二硫)-丙酸的合成:
称取2,2’-二吡啶二硫(5.0017mg,0.02mmol)于150mL三口圆底烧瓶中,加入75mL无水乙醇和2mL冰乙酸,机械搅拌溶解。另称取3-巯基丙酸(1.2889mg,0.01mmol)完全溶解于25mL无水乙醇中,通过恒压滴液漏斗逐滴加入到2,2’-二吡啶二硫的无水乙醇溶液中,25℃下反应,薄层色谱检测反应的完全程度,展开剂:正己烷/乙酸乙酯/冰乙酸=40:20:1。待原料3-巯基丙酸反应完全后,将溶剂旋干,进行硅胶柱层析,洗脱剂:正己烷/乙酸乙酯/冰乙酸=40:20:1,收集产品并旋干,得产物3-巯基丙酸,产率97%。
(2)3-(2-吡啶二硫)-丙酸-紫杉醇的合成:
称取紫杉醇(88.45mg,0.1mmol)于10mL单口圆底烧瓶中,加入5mL二氯甲烷,搅拌溶解。另取3-(2-吡啶二硫)-丙酸(32.69mg,0.15mmol)和N,N’-二环己基碳二亚胺(114.53mg,0.60mmol)加入烧瓶中,25℃下反应,薄层色谱检测反应的完全程度,展开剂:二氯甲烷/丙酮=4:1,收集产物并旋干,得产物3-(2-吡啶二硫)-丙酸-紫杉醇,产率76.02%。
(3)3-巯基丙酸-紫杉醇的合成:
称取3-(2-吡啶二硫)-丙酸-紫杉醇(46.34mg,0.05mmol)和二硫苏糖醇(77.13mg,0.5mmol)于50mL三口圆底烧瓶中,加入5mL二氯甲烷,搅拌溶解,氮气保护下反应。薄层色谱检测反应的完全程度,展开剂:二氯甲烷/丙酮=4:1,反应完全后用10mL超纯水萃取5次,收集有机相并旋干,得产物3-巯基丙酸-紫杉醇,产率85%。
(4)3-(2-吡啶二硫)-丙酸-羟乙基淀粉的合成:
称取预先干燥的羟乙基淀粉(HES 130/0.4,300mg,1.67mmol糖单元)于25mL单口圆底烧瓶中,加入4mL二甲基亚砜,搅拌溶解。然后依次向体系中加入3-(2-吡啶二硫)-丙酸(11.63mg,0.54mmol)、N,N’-二环己基碳二亚胺(111.45mg,0.54mmol)和4-二甲氨基吡啶(33.00mg,0.27mmol),25℃下反应24小时。待反应完全后,抽滤出去生成的N,N’-二环己基脲,滤液加入40mL 1:1异丙醇/乙醚混合溶剂,有固体生成,抽滤,固体再用30mL 1:1异丙醇/乙醚混合溶剂洗涤,超纯水透析,冻干。即得到产物3-(2-吡啶二硫)-丙酸-羟乙基淀粉。
(5)羟乙基淀粉-紫杉醇偶联物的合成:
称取36mg 3-(2-吡啶二硫)-丙酸-羟乙基淀粉(0.2mmol糖单元)于50mL三口圆底烧瓶中,加入4mL二甲基亚砜,搅拌溶解。然后将3-巯基丙酸-紫杉醇(94.2mg,0.1mmol)溶解于1mL二甲基亚砜中,并加入体系中,在氮气保护下,搅拌反应48h。反应结束后,反应液加入至乙醇/乙醚混合溶剂中,有固体生成,离心,固体再用乙醇/乙醚混合溶剂洗涤,超纯水透析,冻干。即得到产物羟乙基淀粉-紫杉醇偶联物。
图1为实施例1制备得到的的还原响应型羟乙基淀粉修饰的紫杉醇偶联物的合成路线;图2为实施例1制备的还原响应型羟乙基淀粉修饰的紫杉醇偶联物的红外光谱图;图3为本实施例1制备的还原响应型羟乙基淀粉修饰的紫杉醇偶联物的核磁共振谱图(氢谱);图2和图3的结果证实本实施例制备合成的产物为羟乙基淀粉-紫杉醇偶联物。
实施例2
基于羟乙基淀粉-紫杉醇偶联物的纳米载药系统的制备:
取10mg实施例1制备得到的羟乙基淀粉-紫杉醇偶联物溶解于40mL纯水中,搅拌使其充分溶解,搅拌速度为700转/分,搅拌温度为37℃。另取2mL三氯甲烷,逐滴滴入羟乙基淀粉-抗肿瘤药偶联物水溶液中,在滴加的过程中超声以制备初乳,超声功率为400W,温度为10℃,超声5分钟,再利用高压均质机将超声后得到的初乳进行进一步分散,高压均质温度为10℃,压力为500bar,循环2次。37℃下减压真空除去有机溶剂,即得到羟乙基淀粉修饰的抗肿瘤药物偶联物纳米粒分散液,其载药量为5%,Zeta电位为5mV。
实施例3
基于羟乙基淀粉-紫杉醇偶联物的纳米载药系统的制备:
取20mg实施例1制备得到的羟乙基淀粉-紫杉醇偶联物溶解于10mL纯水中,搅拌使其充分溶解,搅拌速度为500转/分,搅拌温度为20℃。另取1mL三氯甲烷,逐滴滴入羟乙基淀粉-抗肿瘤药偶联物水溶液中,在滴加的过程中超声以制备初乳,超声功率为300W,温度为4℃,超声3分钟,再利用高压均质机将超声后得到的初乳进行进一步分散,高压均质温度为4℃,压力为1000bar,1次。25℃下减压真空除去有机溶剂,即得到羟乙基淀粉修饰的抗肿瘤药物偶联物纳米粒分散液。图4为本实施例制备得到的还原响应型羟乙基淀粉-紫杉醇纳米粒的透射电镜图,从图中可以看出该纳米粒粒径分布均一,颗粒直径在100nm左右。
实施例4
基于羟乙基淀粉-紫杉醇偶联物的纳米载药系统的制备:
取50mg实施例1制备得到的羟乙基淀粉-紫杉醇偶联物溶解于15mL生理盐水中,搅拌使其充分溶解,搅拌速度为600转/分,搅拌温度为30℃。另取1mL三氯甲烷,逐滴滴入羟乙基淀粉-抗肿瘤药偶联物水溶液中,在滴加的过程中超声以制备初乳,超声功率为350W,温度为15℃,超声7分钟,再利用高压均质机将超声后得到的初乳进行进一步分散,高压均质温度为15℃,压力为800bar,循环5次。30℃下减压真空除去有机溶剂,即得到羟乙基淀粉修饰的抗肿瘤药物偶联物纳米粒分散液。
实施例5
羟乙基淀粉-紫杉醇纳米粒中紫杉醇体外还原响应释放的测定:
将实施例2中制备的羟乙基淀粉-紫杉醇纳米粒装入截留分子量为14000的透析袋中,将透析袋分别转入以下两种条件的释放介质中:(1)磷酸缓冲液,pH=7.4,含0.05%吐温-80;(2)磷酸缓冲液,pH=7.4,含0.05%吐温-80和10mM二硫苏糖醇。然后置于摇床上进行释放实验,转速为100转/分,在第2,4,6,12,24小时从释放液中取样,每次取样1mL,每次取样后向体系中补充相应体积的释放介质。每次取出的样品使用如下方法进行萃取:向每次取出的样品中加入1mL甲基叔丁基醚,涡旋1分钟,静置3分钟后5000转/分条件下离心5分钟,萃取2次,收集有机相,氮气吹干,用100微升色谱级乙腈复溶,10000转/分条件下离心5分钟,取上清用高效液相色谱检测紫杉醇的含量。高效液相色谱柱为反相C18硅胶柱(Hypersil ODS,4.6×250mm,5μm),流动相为乙腈/水=60:40(v/v),流速为1.0mL/分,进样量为20微升,紫外检测波长为227nm,柱温为25℃。根据各个时间点的紫杉醇含量绘制释放曲线。图5为还原响应型羟乙基淀粉-紫杉醇纳米粒在不同还原条件下释放的曲线图,从图中可以看到在还原剂二硫苏糖醇的作用下,羟乙基淀粉-紫杉醇纳米粒具有较快的释放药物速度,而在不含二硫苏糖醇的磷酸盐缓冲液中,几乎没有游离的药物释放出来。从而说明了羟乙基淀粉-紫杉醇纳米粒的还原响应性。羟乙基淀粉-紫杉醇纳米粒水溶液在两种磷酸盐缓冲液中的累积释放量结果见表1。
表1羟乙基淀粉-紫杉醇纳米粒溶液在两种磷酸盐缓冲液中的累积释放率
实施例6:
羟乙基淀粉-紫杉醇纳米粒体外还原响应细胞毒性的测定:
按照实施例2的方法制备羟乙基淀粉-紫杉醇纳米粒。将乳腺癌4T1细胞接种于96孔板中,接种密度为8×103个细胞/孔,培养基体积为100μL,置于37℃,5%CO2培养箱中孵育24小时。弃去培养基,加入100μL含还原性谷胱甘肽-乙酯(GSH-OEt,10mM)的磷酸盐缓冲液,同时对照孔中加入100μL不含GSH-OEt的磷酸盐缓冲液。孵育1小时后,弃去孔内溶液,加入含有不同浓度羟乙基淀粉-紫杉醇纳米粒的培养基,孵育24小时或48小时后,加入20μL 3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT),孵育4小时后,弃去孔内溶液,加入150μL二甲基亚砜溶解紫色结晶,利用酶标仪在492nm波长下测定各孔吸光值,计算细胞存活率。图6显示的是还原响应型羟乙基淀粉-紫杉醇纳米粒在不同还原条件下及不同药物浓度对肿瘤细胞的杀伤作用。从图中可以看出,羟乙基淀粉-紫杉醇纳米粒对肿瘤细胞的杀伤能力具有浓度依赖性,并且使用还原性谷胱甘肽-乙酯提高了细胞内还原性谷胱甘肽的浓度后,纳米粒对细胞的杀伤能力有明显提高,进一步证明了羟乙基淀粉-紫杉醇纳米粒的还原响应性。
实施例7:
大鼠模型考察羟乙基淀粉-紫杉醇纳米粒的体内药代动力学性质:
对照药物(游离紫杉醇制剂)的配制:将紫杉醇先溶解于无水乙醇中,再加入与无水乙醇等体积的聚氧乙烯蓖麻油,涡旋混匀,再用生理盐水稀释至2.5mg/mL。按照实施例2的方法制备羟乙基淀粉-紫杉醇纳米粒。随机将大鼠分为2组,每组3只。将游离紫杉醇制剂和羟乙基淀粉-紫杉醇纳米粒以紫杉醇10mg/kg的剂量,通过尾静脉给药。在给药后第5、15、30分钟,以及第1、2、4、8、12、24、48小时,经大鼠眼眶静脉丛取血0.4mL收集至肝素抗凝管中,3500转/分离心10分钟,取血浆0.2mL。按照实施例7中的方法进行萃取,用高效液相色谱检测紫杉醇的含量。高效液相色谱柱为反相C18硅胶柱(Hypersil ODS,4.6×250mm,5μm),流动相为乙腈/水=60:40(v/v),流速为1.0mL/分,进样量为20微升,紫外检测波长为227nm,柱温为25℃。根据各个时间点的紫杉醇含量绘制血药浓度-时间曲线。使用药代动力学软件DAS 2.0进行拟合,分别计算游离紫杉醇制剂和羟乙基淀粉-紫杉醇纳米粒的药代动力学参数。图7是还原响应型羟乙基淀粉-紫杉醇纳米粒和游离紫杉醇的血药浓度-时间曲线,从图中可以看出游离紫杉醇的药物消除速率很快,而羟乙基淀粉-紫杉醇纳米粒的消除速率明显低于游离紫杉醇,大鼠血药浓度也高于游离紫杉醇给药组。从而表明羟乙基淀粉-紫杉醇纳米粒具有体内长循环的特性。不同时间点大鼠血浆中紫杉醇的浓度结果见表2。
表2不同时间点大鼠血浆中紫杉醇的浓度
实施例8
小鼠乳腺癌模型考察羟乙基淀粉-紫杉醇纳米粒的体内抗肿瘤效应:
在雌性BALB/c小鼠右后肢近腋下皮下接种小鼠乳腺癌4T1细胞悬液4×105个细胞/100μL,建立小鼠乳腺癌4T1皮下移植瘤小鼠模型。当皮下瘤体积为50~120mm3时,将小鼠随机分为3组,各组6只,分别经尾静脉注射给予生理盐水、游离紫杉醇制剂和羟乙基淀粉-紫杉醇纳米粒治疗,其中后两组中紫杉醇剂量为10mg/kg,记第一天给药时间为第0天,再分别于第3、6、9天按上述剂量给药。自第0天起,每隔一天用游标卡尺测量小鼠皮下瘤的长边(a)和短边(b),计算肿瘤体积,计算公式为:肿瘤体积V=a×b2/2。绘制瘤体积-时间曲线。在第12天处死小鼠,剥离皮下瘤并称重拍照。图8为还原响应型羟乙基淀粉-紫杉醇纳米粒和游离紫杉醇的肿瘤体积-时间曲线(A)和肿瘤照片(B)。从图(A)中可以看出,游离紫杉醇组和羟乙基淀粉-紫杉醇纳米粒组的肿瘤体积增长速率明显低于生理盐水组,此外,羟乙基淀粉-紫杉醇纳米粒组肿瘤体积增长速率显著低于游离紫杉醇组,从而说明游离紫杉醇和羟乙基淀粉-紫杉醇纳米粒均有抑制肿瘤生长的效应,而羟乙基淀粉-紫杉醇纳米粒的抑瘤效果更优于游离紫杉醇,图(B)显示的抑瘤实验终点剥出的小鼠肿瘤的图片也证明了这一结论。实验组和空白对照组肿瘤体积结果见表3。
表3不同时间点实验组和空白对照组平均肿瘤体积测量结果
本领域的技术人员容易理解,以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!