一种组合物及其应用的制作方法
本发明涉及细胞技术领域,特别涉及一种组合物及其应用。
背景技术:
肝脏疾病是临床常见病、多发病,严重危害人类健康。大量肝病患者因缺乏理想、有效的治疗手段而死亡。目前采用肝移植等方法,延缓病情;肝脏的配型低,来源少;复发率高,病人的长期存活率低。
骨髓间充质干细胞是一类具有自我增殖和分化潜能的多能干细胞,因其具有可塑性、取材方便、低免疫原性以及易于外源基因的转染和表达等优点而被广泛用于肝脏疾病的研究。近年研究表明,在适宜的微环境下,骨髓问充质干细胞具有向肝细胞分化的潜能,使其在肝细胞治疗的临床应用中越来越受到人们的重视。当前,骨髓充质干细胞移植被认为有可能替代原位肝移植,为肝衰竭的有效治疗带来新的希望。
但是异基因细胞在输注后在体内的增殖、分化、寿命以及以此带来的免疫调节功能的变化的认识尚不很明确,临床应用所产生的问题陷入瓶颈期。
外泌体(exosomes)是一种由真核细胞的多泡内涵体(multivesicular bodies,MVBs)与细胞膜融合后释放到细胞外环境中的纳米量级的膜性小囊泡,可由多种类型细胞分泌,其内含有不同种类的蛋白质、脂质、mRNAs、microRNAs、信号分子等具有生物学活性的物质,较易与邻近细胞的细胞膜发生融合,将生物学活性物质选择性地递送至受体细胞,在不同细胞间进行信息传递,调节细胞间的信号传导,发挥多种生物学功能。并且,外泌体的应用较之MSC直接应用更为安全,可以开启非细胞治疗的方法。
因此,提供一种改善急性肝衰竭的制剂具有重要的现实意义。
技术实现要素:
有鉴于此,本发明提供一种组合物及其应用。该组合物采用脐带干细胞外泌体联合肝样细胞联合进行组织局部注射,其可避免血液流动而造成外泌体的损失。外泌体可直接修复损伤组织,增强未损伤组织的抵抗能力,大大的缩短组织修复时间。外泌体制剂不具有免疫原性,可适用任何个体。肝样细胞可缩短组织适应性,在微环境下直接行使功能,缩短治愈周期。外泌体的应用较之直接应用更为安全,可以开启非细胞治疗的方法。外泌体在提取后可长期保存,在应用时制剂制备更为方便。避免了细胞治疗方案需重新培养细胞等操作。使用肝样细胞,可避免干细胞分化不确定性的缺点。能够用于制备改善和/或治疗肝损伤或急性肝衰竭的药物。
为了实现上述发明目的,本发明提供以下技术方案:
本发明提供了一种组合物,包括脐带干细胞外泌体、肝样细胞。
在本发明的一些具体实施方案中,所述的组合物中所述脐带干细胞外泌体的制备方法包括如下步骤:
步骤1:获得脐带干细胞,培养;
步骤2:收集P2~P5代脐带干细胞(UC-MSCs)培养上清,提取获得外泌体。
在本发明的一些具体实施方案中,所述的组合物中所述脐带干细胞外泌体的制备方法步骤2中所述提取具体为:将所述培养上清转至高速离心管中,4℃,离心,2000g/30min,去除细胞碎片;取上清,转移至新的高速离心管中,以细胞上清液:试剂=2:1的比例加入试剂,用祸旋器充分混匀后,置于冰箱中4℃过夜孵育;在4℃坏境中10000g离心60min,弃去上清,用100μL 4℃的PBS溶液缓冲液重悬即为外泌体悬液,置于-20℃保存。
在本发明的一些具体实施方案中,所述的组合物包括如下组分:
脐带干细胞外泌体 5×106~5×107cells所提取出来的外泌体总量
肝样细胞 1×106~1×107cells。
在本发明的一些具体实施方案中,所述的组合物包括如下组分:
脐带干细胞外泌体 5×106~5×107cells所提取出来的外泌体总量
肝样细胞 2×106~1×107cells。
在本发明的一些具体实施方案中,所述的组合物包括如下组分:
脐带干细胞外泌体 1×107cells所提取出来的外泌体总量
肝样细胞 5×106cells。
在本发明的一些具体实施方案中,所述的组合物还包括生理盐水。
在本发明的一些具体实施方案中,所述的组合物所述生理盐水的添加量为至终体积为5mL。
本发明还提供了所述的组合物在制备改善和/或治疗肝损伤的药物中的应用。
本发明还提供了组合物在制备改善和/或治疗急性肝衰竭的药物中的应用。
本发明提供了一种组合物,包括脐带干细胞外泌体、肝样细胞,能够用于制备改善和/或治疗肝损伤或急性肝衰竭的药物。该组合物的有益效果如下:
1.采用脐带干细胞外泌体联合肝样细胞联合进行组织局部注射,其可避免血液流动而造成外泌体的损失。
2.外泌体可直接修复损伤组织,增强未损伤组织的抵抗能力,大大的缩短组织修复时间。
3.外泌体制剂不具有免疫原性,可适用任何个体。
4.肝样细胞可缩短组织适应性,在微环境下直接行使功能,缩短治愈周期。
5.外泌体的应用较之直接应用更为安全,可以开启非细胞治疗的方法。
6.外泌体在提取后可长期保存,在应用时制剂制备更为方便。避免了细胞治疗方案需重新培养细胞等操作。
7.使用肝样细胞,可避免干细胞分化不确定性的缺点。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍。
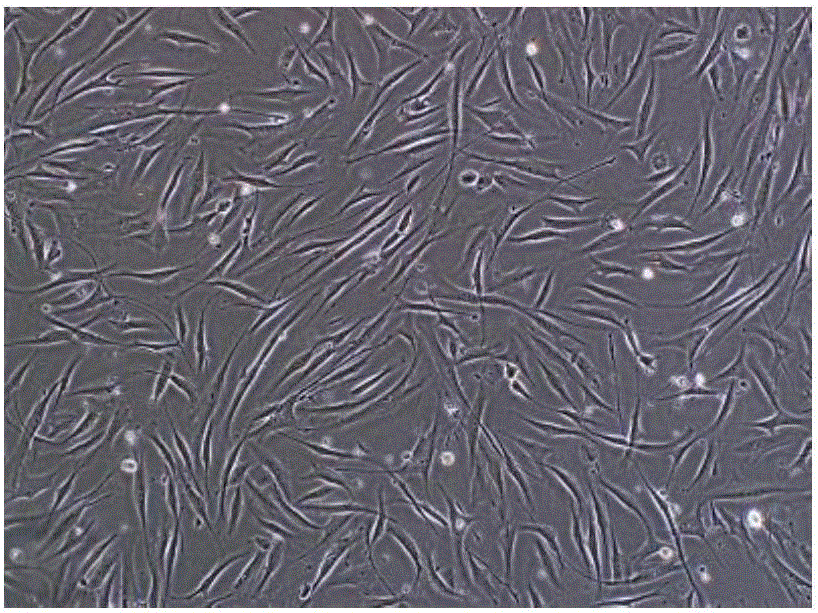
图1示脐带干细胞形态(UC-MSC P2 40倍);
图2示脐带干细胞形态(UC-MSC P2 100倍);
图3示外泌体形态(10000倍,外泌体直径约为60nm-100nm);
图4示骨髓干细胞的形态(BMSC P2 40倍);
图5示骨髓干细胞的形态(BMSC P2 100倍)。
具体实施方式
本发明公开了一种组合物及其应用,本领域技术人员可以借鉴本文内容,适当改进工艺参数实现。特别需要指出的是,所有类似的替换和改动对本领域技术人员来说是显而易见的,它们都被视为包括在本发明。本发明的方法及应用已经通过较佳实施例进行了描述,相关人员明显能在不脱离本发明内容、精神和范围内对本文所述的方法和应用进行改动或适当变更与组合,来实现和应用本发明技术。
本发明的技术方案如下:
1)脐带干细胞原代培养
取健康足月剖腹产婴儿的脐带,于超净台中进行无菌清洗,剥离脐带羊膜和动静脉,取出沃顿胶,用手术剪进行剪碎,用DMEM+10%FBS完全培养基重悬后接种至15cm平皿中,转移至5%CO2,37摄氏度的环境中培养。
于5天后补液,直至细胞爬出,弃去组织块,补充新的完全培养基继续培养,待细胞形成较大的克隆,即可传代
2)脐带干细胞传代培养
①取可传代的P0代细胞,弃掉皿内原培养液,加入10mLPBS缓冲液轻轻冲洗细胞生长面,弃去洗液。
②加入2mL0.25%胰蛋白酶,左右摇晃平皿使胰酶均匀覆盖于皿底;显微镜下观察可见细胞间隙增大,胞质回缩;当长梭形细胞变圆变亮时,立即加入10倍体积的完全培养基终止消化。
③反复吹打,直至细胞全部脱落成单细胞悬液,将悬液转移至离心管中,室温离心l5OOrpm/5min。
④弃上清,加入DMEM+10%FBS完全培养基重悬细胞,按密度为1×105cells传代培养。将培养瓶置于37℃、5%二氧化碳、饱和湿度的细胞培养箱中培养。
⑤待细胞生长至融合时,重复操作⑤进行细胞扩增培养。如无说明,本研究中所用人脐带干细胞均为P2至P5代。
3)外泌体的分离
收集P2-P5代UC-MSCs培养上清,按照invitrogen试剂盒说明书提取外泌体。
具体步骤为:将培养上清转至高速离心管中,4℃,离心,2000g/30min,去除细胞碎片。取上清,转移至新的高速离心管中,以细胞上清液:试剂=2:1的比例加入试剂,用祸旋器充分混匀后,置于冰箱中4℃过夜孵育。在4℃坏境中10000g离心60min,弃去上清,用100μL 4℃的PBS溶液缓冲液重悬即为外泌体悬液,置于-20℃保存。
4)外泌体鉴定
取分离纯化外泌体10uL,按体积比=1:1,加入4℃的PBS溶液稀释后滴加于2mm的载样铜网上,于室温静置1min后用滤纸将多余液体轻轻吸去,用3%(w/v)磷钨酸钠溶液(PH6.8)室温负染5分钟,用双蒸水轻轻洗一遍后室温晾干,于透射电镜观察并照相。随机选取20个外泌体测量其直径。
5)骨髓间充质干细胞诱导分化形成肝样细胞
参见——熊剑勇.骨髓间充质干细胞分化为肝样细胞的实验研究,硕士学位论文,2010年。
6)制备:
①从-20℃取出外泌体,4℃环境中溶解后,按组成:外泌体+生理盐水混匀。充分混匀后置于4℃环境中保存备用。外泌体的含量为5×106~5×107cells所提取出来的外泌体总量,其中优选用量为1×107cells所提取出来的外泌体总量。
②用外泌体的制剂重悬肝样细胞,充分混匀后置于4℃环境中保存备用。肝样细胞含量为1×106~1×107cells所提取出来的外泌体总量,其中优选用量为5×106cells。
配制具体步骤:
①往生理盐水中添加体积为100uL 1×107cells所提取出来的外泌体总量。
②用外泌体悬液重悬5×106cells的肝样细胞。
本发明提供了一种组合物,包括脐带干细胞外泌体、肝样细胞。该组合物的有益效果如下:
1.采用脐带干细胞外泌体联合肝样细胞联合进行组织局部注射,其可避免血液流动而造成外泌体的损失。
2.外泌体可直接修复损伤组织,增强未损伤组织的抵抗能力,大大的缩短组织修复时间。
3.外泌体制剂不具有免疫原性,可适用任何个体。
4.肝样细胞可缩短组织适应性,在微环境下直接行使功能,缩短治愈周期。
5.外泌体的应用较之直接应用更为安全,可以开启非细胞治疗的方法。
6.外泌体在提取后可长期保存,在应用时制剂制备更为方便。避免了细胞治疗方案需重新培养细胞等操作。
7.使用肝样细胞,可避免干细胞分化不确定性的缺点。
本发明提供的组合物及其应用中所用原料及试剂均可由市场购得。
下面结合实施例,进一步阐述本发明:
实施例1
脐带干细胞原代培养(或由市场购得):
取健康足月剖腹产婴儿的脐带,于超净台中进行无菌清洗,剥离脐带羊膜和动静脉,取出沃顿胶,用手术剪进行剪碎,用DMEM+10%FBS完全培养基重悬后接种至15cm平皿中,转移至5%CO2,37摄氏度的环境中培养。
于5天后补液,直至细胞爬出,弃去组织块,补充新的完全培养基继续培养,待细胞形成较大的克隆,即可传代
脐带干细胞传代培养:
①取可传代的P0代细胞,弃掉皿内原培养液,加入10mLPBS缓冲液轻轻冲洗细胞生长面,弃去洗液。
②加入2mL0.25%胰蛋白酶,左右摇晃平皿使胰酶均匀覆盖于皿底;显微镜下观察可见细胞间隙增大,胞质回缩;当长梭形细胞变圆变亮时,立即加入10倍体积的完全培养基终止消化。
③反复吹打,直至细胞全部脱落成单细胞悬液,将悬液转移至离心管中,室温离心l5OOrpm/5min。
④弃上清,加入DMEM+10%FBS完全培养基重悬细胞,按密度为1×105cells传代培养。将培养瓶置于37℃、5%二氧化碳、饱和湿度的细胞培养箱中培养。
⑤待细胞生长至融合时,重复操作⑤进行细胞扩增培养。如无说明,本研究中所用人脐带干细胞均为P2至P5代。
外泌体的分离:
收集P2-P5代UC-MSCs培养上清,按照invitrogen试剂盒说明书提取外泌体。
具体步骤为:将培养上清转至高速离心管中,4℃,离心,2000g/30min,去除细胞碎片。取上清,转移至新的高速离心管中,以细胞上清液:试剂=2:1的比例加入试剂,用祸旋器充分混匀后,置于冰箱中4℃过夜孵育。在4℃坏境中10000g离心60min,弃去上清,用100μL 4℃的PBS溶液缓冲液重悬即为外泌体悬液,置于-20℃保存。
外泌体鉴定:
取分离纯化外泌体10uL,按体积比=1:1,加入4℃的PBS溶液稀释后滴加于2mm的载样铜网上,于室温静置1min后用滤纸将多余液体轻轻吸去,用3%(w/v)磷钨酸钠溶液(PH6.8)室温负染5分钟,用双蒸水轻轻洗一遍后室温晾干,于透射电镜观察并照相。随机选取20个外泌体测量其直径。
骨髓间充质干细胞诱导分化形成肝样细胞:
方法参见——熊剑勇.骨髓间充质干细胞分化为肝样细胞的实验研究,硕士学位论文,2010年。
实施例2组合物的制备:
①从-20℃取出外泌体,4℃环境中溶解后,按组成:外泌体+生理盐水混匀。充分混匀后置于4℃环境中保存备用。外泌体的含量为5×107cells所提取出来的外泌体总量。
②用外泌体的制剂重悬肝样细胞,充分混匀后置于4℃环境中保存备用。肝样细胞含量为1×106cells。
配制具体步骤:
①往生理盐水中添加体积为100μL 5×107cells所提取出来的外泌体总量。
②用外泌体悬液重悬1×106cells的肝样细胞。
③添加生理盐水至终体积为5mL。
实施例3
①从-20℃取出外泌体,4℃环境中溶解后,按组成:外泌体+生理盐水混匀。充分混匀后置于4℃环境中保存备用。外泌体的含量为1×107cells所提取出来的外泌体总量。
②用外泌体的制剂重悬肝样细胞,充分混匀后置于4℃环境中保存备用。肝样细胞含量为5×106cells。
配制具体步骤:
①往生理盐水中添加体积为100μL 1×107cells所提取出来的外泌体总量。
②用外泌体悬液重悬5×106cells的肝样细胞。
③添加生理盐水至终体积为5mL。
实施例4
①从-20℃取出外泌体,4℃环境中溶解后,按组成:外泌体+生理盐水混匀。充分混匀后置于4℃环境中保存备用。外泌体的含量为5×106cells所提取出来的外泌体总量。
②用外泌体的制剂重悬肝样细胞,充分混匀后置于4℃环境中保存备用。肝样细胞含量为1×107cells。
配制具体步骤:
①往生理盐水中添加体积为100μL 5×106cells所提取出来的外泌体总量。
②用外泌体悬液重悬1×107cells的肝样细胞。
③添加生理盐水至终体积为5mL。
实施例5
取清洁级昆明小鼠,按每10g体质量0.15mL 40%CCl4灌胃,建立稳定的昆明小鼠ALF动物模型。取ALF动物模型96只,雌雄兼用,体质量(25±2)g,随机分成4组,按表1分组进行肝脏局部注射:
表1分组情况
①血清生化指标检测:分别于术后0、1、2、3及7d随机挑选各组小鼠各6只,摘眼球采血,3500r·min离心10min,取血清0.1mL。在全自动生化分析检测仪上检测丙酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)及总胆红素(TBIL)。
②肝脏白蛋白(ALB)表达检测:处死以上时间点采血后的小鼠,用兔抗鼠白蛋白抗体及SP试剂盒进行免疫组织化学染色,以检测肝组织中ALB的表达,阳性细胞胞浆被染成棕黄色。
表2各时间检测点的ALT检测结果(n=6)
*表示与对照组相比,P<0.01,具有极显著性差异。
#表示三组实施例组内相比,P<0.05,具有显著性差异。
从表2可知,对照组1、对照组2和实验组在1d、2d、3d、7d的ALT值,与空白对照组相比,具有极显著差异(P<0.01),说明了三组显著的改善了肝衰竭的情况,具有良好的肝保护作用。
而实验组各时间检测点的ALT值与对照组1、对照组2和相比,具有显著性差异(P<0.05),说明了实验组的效果优于对照组1、对照组2。
表3各时间检测点的AST检测结果(n=6)
*表示与对照组相比,P<0.01,具有极显著性差异。
#表示三组实施例组内相比,P<0.05,具有显著性差异。
从表3可知,对照组1、对照组2和实验组在1d、2d、3d、7d的AST值,与空白对照组相比,具有极显著差异(P<0.01),说明了三组显著的改善了肝衰竭的情况,具有良好的肝保护作用。
而实验组各时间检测点的AST值与对照组1、对照组2相比,具有显著性差异(P<0.05),说明了实验组的效果优于对照组1、对照组2。
表4各时间检测点的TBIL检测结果(n=6)
*表示与对照组相比,P<0.01,具有极显著性差异。
#表示三组实施例组内相比,P<0.05,具有显著性差异。
从表4可知,对照组1、对照组2和实验组在1d、2d、3d、7d的TBIL值,与空白对照组相比,具有极显著差异(P<0.01),说明了三组显著的改善了肝衰竭的情况,具有良好的肝保护作用。
而实验组各时间检测点的TBIL值与对照组1、对照组2相比,具有显著性差异(P<0.05),说明了实验组的效果优于对照组1、对照组2。
取实施例2、实施例4制备的组合物进行上述试验,试验结果与实施例3制备的组合物的实验结果相近,实施例2、实施例4制备的组合物与实施例3制备的组合物的实验结果无显著差异(P>0.05)。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!