一种PEGMa修饰MoOx与温敏PNIPAM微凝胶的组装体系及其制备方法与流程
本发明涉及一种微凝胶的组装体系及其制备方法。
背景技术:
根据世界癌症报道,癌症始终是主要致死疾病之一,平均每年约有1000万新增病例,而经过常规的手术切除,放疗和化疗等手段治疗后,平均生存期也仅为6-24个月。且常规治疗有很多的弊端,如杀死正常组织细胞,增加肿瘤细胞的代谢率和破坏机体免疫功能等。近些年,越来越多的人开始注意使用微创性的光热疗法来治疗肿瘤,即用一定波长的近红外光照射光热剂将光能转换为热能局部加温杀死肿瘤细胞。光热治疗可以避免常规疗法的不足,还会使治疗过程简便易操作,治疗后并发症较少,住院时间缩短。
光热治疗技术的实际应用中主要是借助对人体没有伤害的近红外光辐照光热剂从而将光能转化为热能杀死癌细胞。因此,光热治疗技术的关键在于光热剂,也就是光热转换材料。目前人们已经开发出一系列在近红外光范围有强吸收的纳米材料,如含贵重金属的纳米粒子(Au、Ag)、有机聚合物纳米材料、半导体光热材料以及碳基纳米材料。为了进一步提高光热治疗效果,人们采用光热化学联合治疗技术开发出多种用于联合治疗试剂包括聚苯胺/聚异丙基丙烯酰;金纳米粒/聚异丙基丙烯酰胺-丙烯酸;石墨烯/二氧化硅/聚异丙基丙烯酰胺-丙烯酸等;然而这些联合治疗试剂对载入的药物难以实现精确可控的靶向释放,且会在人体内积累形成潜在毒性。
技术实现要素:
本发明目的是为了解决了现有光热转换材料对载入的药物难以实现精确可控的靶向释放,且存在毒副作用的问题,而提供一种PEGMa(甲基丙烯酸酯)修饰MoOx(氧化钼)与温敏PNIPAM(聚异丙基丙烯酰胺)微凝胶的组装体系及其制备方法。
一种PEGMa修饰MoOx与温敏PNIPAM微凝胶的组装体系,其化学式为PEGMa-MoOx/P(NIPAM-co-MAA)。
上述PEGMa修饰MoOx与温敏PNIPAM微凝胶的组装体系的制备方法,按照以下步骤进行的:
一、将0.08~0.09g的钼酸铵在搅拌的条件下溶解在15~25ml的去离子水中;
二、将0.4~0.6g甲基丙烯酸酯溶解于10~15ml无水乙醇溶液;
三、将步骤一和步骤二中所得溶液混匀,然后用水热法在160℃恒温条件下反应10~14h,对沉淀物进行离心分离,经洗涤、干燥后得到改性氧化钼PEGMa-MoOx;
四、将上述PEGMa-MoOx溶解在盛有100ml去离子水的烧杯中,搅拌30min后转移到250ml圆底烧瓶中,然后加入1.5~2.0g的N-异丙基丙烯酰胺(NIPAM)、82~328μL甲基丙烯酸(MAA)、0.05~0.07g N,N-亚甲基双丙烯酰胺(MBA)和0.05~0.06g十二烷基硫酸钠(SDS)并混匀,在通氮气的条件下以1~5℃/min的升温速度加热到70℃,然后加入0.2~0.3g过硫酸铵(APS),使反应在70℃下聚合6h,于8000r/min条件下离心10min,经洗涤、透析、干燥后获得PEGMa-MoOx/P(NIPAM-co-MAA),即完成PEGMa修饰MoOx与温敏PNIPAM微凝胶的组装体系的制备。
本发明的优点是:
1、本发明制备方法具有简单可行,成本低廉,反应条件温和,易操作,光热转换纳米粒子粒径可控且分布均匀等特点。通过该方法制备得到PEGMa-MoOx/P(NIPAM-co-MAA),它是具有光热化学联合治疗效果的近红外光刺激可控响应性光热转换微凝胶组装体系,在808nm激光器照射下,微凝胶中改性氧化钼纳米粒子可将光能转换为热能,负载抗癌药物后在病灶处烧蚀细胞的同时还可以使具有靶向作用的微凝胶发生可控受热收缩,可将内部包覆的药物可控释放于病灶处,杀死肿瘤细胞,达到光热化学联合治疗的效果。
2、本发明采用甲基丙烯酸酯修饰改性氧化钼,使氧化钼被部分还原能以多种价态存在,从而实现光热转换的性能。同时使改性后的氧化钼带有双键可以与温敏单体进行复合。通过水热法制备得到的改性氧化钼粒径分布较均匀且光热转换效果较佳。
3、本发明采用钼酸铵和甲基丙烯酸酯为主要反应物制备改性氧化钼,使氧化钼得以应用于生物医药领域的同时,可进一步与具有双键的功能性聚合物反应,实现各种兼具光热治疗效果的其他多功能治疗的作用。
4、本发明将改性后的氧化钼与温敏单体(NIPAM),亲水性单体(MAA)复合的制备方案,可使复合微凝胶实现靶向定位的作用。由于肿瘤细胞的微环境偏酸温度也相对较高,因此通过复合MAA后可以使复合凝胶稳定存在于肿瘤细胞中,同时,在808nm激光器照射后复合微凝胶除了烧蚀细胞外还能体积收缩,实现靶向释药。通过调节激光强度和照射时间能精确控制药物的释放量及释放速率。优于单一的光热治疗或化疗的效果,无副作用。
5、本发明中改性氧化钼能在PH为7-8的人体正常生理环境中自动降解,而在PH为5-6的偏酸性条件下稳定存在,因此在实现光热化学治疗的效果后,改性氧化钼能在24h内自动降解,排除体外,避免纳米粒子在体内积累,产生毒副作用。
6、本发明所选用的温敏单体及亲水性单体制备的微凝胶生物相容性良好,且复合改性氧化钼后复合微凝胶的光热转换效率也较高,制备方法简单,成本低廉,毒副作用小,具有极高的实用性。
附图说明
图1为实施例中PEGMa-MoOx的SEM图;
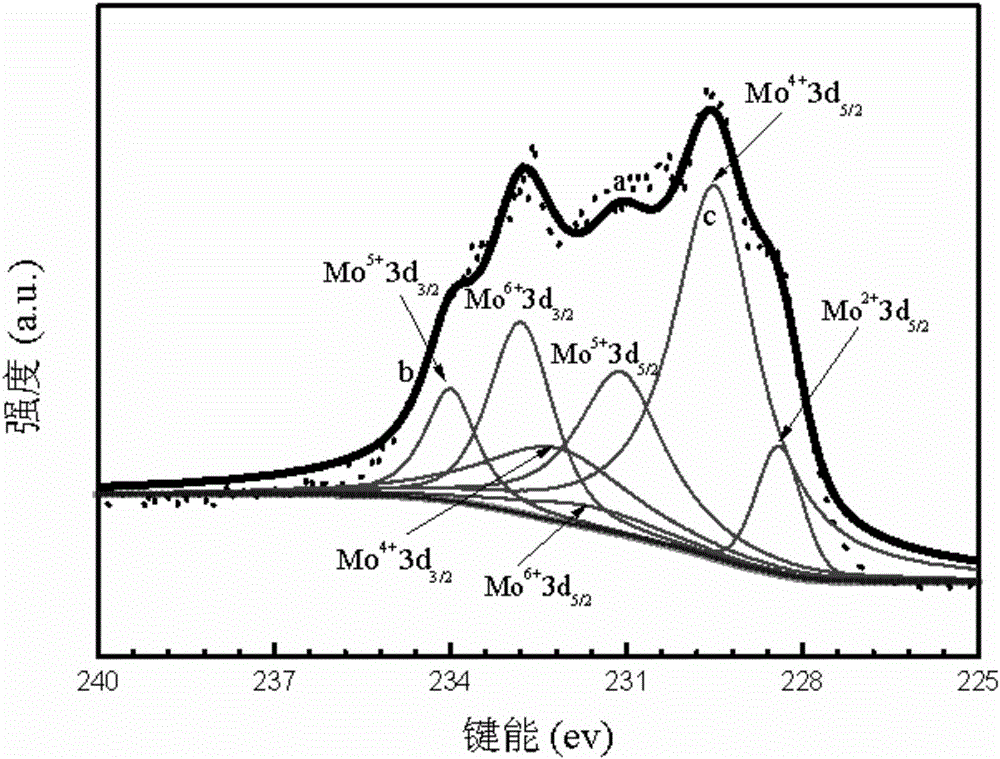
图2为实施例中PEGMa-MoOx的XPS图,其中a曲线表示原始数据,b曲线表示拟合曲线,c曲线表示背景线;
图3为实施例中PEGMa-MoOx的温度-辐照时间曲线图,其中■表示PEGMa-MoOx,●表示水;
图4为实施例中MAA的用量为82μL时,PEGMa-MoOx/P(NIPAM-co-MAA)的SEM图;
图5为实施例中实施例中MAA的用量为164μL时,PEGMa-MoOx/P(NIPAM-co-MAA)的SEM图;
图6为实施例中实施例中MAA的用量为328μL时,PEGMa-MoOx/P(NIPAM-co-MAA)的SEM图;
图7为实施例中PEGMa-MoOx/P(NIPAM-co-MAA)的红外谱图,其中a曲线表示MAA的用量为82μL,b曲线表示MAA的用量为164μL,c曲线表示MAA的用量为328μL;
图8为实施例中PEGMa-MoOx/P(NIPAM-co-MAA)的温度-辐照时间曲线图▲表示MAA的用量为82μL,●表示MAA的用量为164μL,■表示MAA的用量为328μL。
具体实施方式
本发明技术方案不局限于以下所列举的具体实施方式,还包括各具体实施方式之间的任意组合。
具体实施方式一:本实施方式一种PEGMa修饰MoOx与温敏PNIPAM微凝胶的组装体系,其化学式为PEGMa-MoOx/P(NIPAM-co-MAA)。
具体实施方式二:本实施方式一种PEGMa修饰MoOx与温敏PNIPAM微凝胶的组装体系的制备方法,按照以下步骤进行的:
一、将0.08~0.09g的钼酸铵在搅拌的条件下溶解在15~25ml的去离子水中;
二、将0.4~0.6g甲基丙烯酸酯溶解于10~15ml无水乙醇溶液;
三、将步骤一和步骤二中所得溶液混匀,然后用水热法在160℃恒温条件下反应10~14h,对沉淀物进行离心分离,经洗涤、干燥后得到改性氧化钼PEGMa-MoOx;
四、将上述PEGMa-MoOx溶解在盛有100ml去离子水的烧杯中,搅拌30min后转移到250ml圆底烧瓶中,然后加入1.5~2.0g的N-异丙基丙烯酰胺、82~328μL甲基丙烯酸、0.05~0.07g N,N-亚甲基双丙烯酰胺和0.05~0.06g十二烷基硫酸钠并混匀,在通氮气的条件下以1~5℃/min的升温速度加热到70℃,然后加入0.2~0.3g过硫酸铵,使反应在70℃下聚合6h,于8000r/min条件下离心10min,经洗涤、透析、干燥后获得PEGMa-MoOx/P(NIPAM-co-MAA),即完成PEGMa修饰MoOx与温敏PNIPAM微凝胶的组装体系的制备。
本实施方式步骤三中在160℃恒温条件下反应12h,沉淀物为黑蓝色沉淀。
本实施方式步骤四中氮气的目的是除去游离的氧气。
本实施方式步骤四中N,N-亚甲基双丙烯酰胺作为交联剂使用;十二烷基硫酸钠作为表面活性剂使用;过硫酸铵作为引发剂使用。
具体实施方式三:本实施方式与具体实施方式二不同的是:步骤一中将0.0865g的钼酸铵在搅拌的条件下溶解在20ml的去离子水中。其它步骤及参数与具体实施方式二相同。
具体实施方式四:本实施方式与具体实施方式二或三不同的是:步骤二中将0.5g甲基丙烯酸酯溶解于10ml无水乙醇溶液。其它步骤及参数与具体实施方式二或三相同。
具体实施方式五:本实施方式与具体实施方式二至四之一不同的是:步骤三在160℃恒温条件下反应12h。其它步骤及参数与具体实施方式二至四之一相同。
具体实施方式六:本实施方式与具体实施方式二至五之一不同的是:步骤三中洗涤是采用去离子水洗涤。其它步骤及参数与具体实施方式二至五之一相同。
具体实施方式七:本实施方式与具体实施方式二至六之一不同的是:步骤三干燥的温度为50℃。其它步骤及参数与具体实施方式二至六之一相同。
具体实施方式八:本实施方式与具体实施方式二至七之一不同的是:步骤四中加入1.8729g的N-异丙基丙烯酰胺、164μL甲基丙烯酸、0.0618g N,N-亚甲基双丙烯酰胺和0.055g十二烷基硫酸钠并混匀。其它步骤及参数与具体实施方式二至七之一相同。
具体实施方式九:本实施方式与具体实施方式二至八之一不同的是:步骤四中在通氮气的条件下以2℃/min的升温速度加热到70℃,然后加入0.288g过硫酸铵。其它步骤及参数与具体实施方式二至八之一相同。
具体实施方式十:本实施方式与具体实施方式二至九之一不同的是:步骤四中洗涤是采用去离子水洗涤。其它步骤及参数与具体实施方式二至九之一相同。
具体实施方式十一:本实施方式与具体实施方式二至十之一不同的是:步骤四中透析是采用截留分子量为8000-14000Da的透析袋透析4天,每天换四次水。其它步骤及参数与具体实施方式二至十之一相同。
具体实施方式十二:本实施方式与具体实施方式二至十一之一不同的是:步骤四中干燥的温度为50℃。其它步骤及参数与具体实施方式二至十一之一相同。
采用以下实施例验证本发明的有益效果:
实施例:
一种PEGMa修饰MoOx与温敏PNIPAM微凝胶的组装体系的制备方法,按照以下步骤进行的:
一、将0.0865g的钼酸铵在搅拌的条件下溶解在15~25ml的去离子水中;
二、将0.5g甲基丙烯酸酯溶解于10ml无水乙醇溶液;
三、将步骤一和步骤二中所得溶液混匀,然后用水热法在160℃恒温条件下反应12h,对沉淀物进行离心分离,经洗涤、干燥后得到改性氧化钼PEGMa-MoOx;
四、将上述PEGMa-MoOx溶解在盛有100ml去离子水的烧杯中,搅拌30min后转移到250ml圆底烧瓶中,然后加入1.8729g的N-异丙基丙烯酰胺(NIPAM)、82μL或者164μl或者328μl甲基丙烯酸(MAA)、0.0618g N,N-亚甲基双丙烯酰胺(MBA)和0.055g十二烷基硫酸钠(SDS)并混匀,在通氮气的条件下以2℃/min的升温速度加热到70℃,然后加入0.288g过硫酸铵(APS),使反应在70℃下聚合6h,于8000r/min条件下离心10min,经洗涤、透析、干燥后获得PEGMa-MoOx/P(NIPAM-co-MAA),即完成PEGMa修饰MoOx与温敏PNIPAM微凝胶的组装体系的制备。
本实施例步骤三中在160℃恒温条件下反应12h,沉淀物为黑蓝色沉淀。
本实施例步骤四中氮气的目的是除去游离的氧气。
本实施例步骤四中甲基丙烯酸(MAA)的用量82μL或者164μl或者328μl,对应着的MAA摩尔比为变量分别为5,10,20。
本实施例步骤三中改性氧化钼PEGMa-MoOx从图1可见,PEGMa改性后的氧化钼纳米粒子分布较均匀,粒径在140-160nm,且表面粗糙。说明该改性氧化钼纳米粒子具有负载生物大分子的潜能,由于PEGMa的改性,大大提高了其生物相容性,增加了其在生物医药方面应用的功能。从图2可见,232.8,235.5ev所在的峰为Mo6+3d3/2,Mo6+3d3/2;231.1,234.0ev所在的峰为Mo5+3d3/2,Mo5+3d3/2;229.5,232.2ev所在的峰为Mo4+3d3/2,Mo4+3d5/2;228.4,231.6ev所在的峰为Mo2+3d3/2,Mo2+3d3/2;确认各个峰后,发现通过PEGMa改性氧化钼后,钼以多中价态存在,对3d峰进行分峰处理的时候就发现加入了+2价态的键能位置的数据后拟合较好,峰形基本符合。说明改性氧化钼中钼元素以+6,+5,+4价态存在,同时可能有少量的+2价态的钼存在。正是钼元素多种价态的存在,使改性氧化钼能够吸收近红外光,将光能转换为热能。同时由于多种价态的存在,氧化钼也具有被还原或是氧化的可能,使其能够在生物体内降解,并排出体外。
本实施例步骤三中改性氧化钼PEGMa-MoOx在808nm激光器(1W/cm2)照射下温度随时间的变化曲线,见图3。a曲线表示0.55mg/ml的改性氧化钼在7min内温度从31℃升高到50℃左右。温度升高了21度左右,b曲线表示水在同样的条件下温度只升高了4度。说明PEGMa改性氧化钼较成功,改性氧化钼能够将近红外光的光能转换为热能。从温度升高情况来看,将改性氧化钼注射到生物体内通过近红外光照射可以将肿瘤细胞加热到50℃,从而将癌细胞杀死,实现无副作用的光热治疗肿瘤的效果。
本实施例步骤三中改性氧化钼PEGMa-MoOx能在PH为7-8的人体正常生理环境中自动降解,而在PH为5-6的偏酸性条件下稳定存在,因此在实现光热化学治疗的效果后,改性氧化钼能在24h内自动降解,排除体外,避免纳米粒子在体内积累,产生毒副作用。
本实施例步骤四中所得PEGMa-MoOx/P(NIPAM-co-MAA),在扫描电子显微镜下观察得到的形貌图见图4、图5和图6,分别为组装体系中MAA投入量的摩尔比分别为5,10,20时的形貌图,图中复合凝胶的粒径为300-400nm,近似球形。由于MAA的加入可以使组装体系更加稳定,而从形貌观察也发现该复合体系仍然是微凝胶。说明该组装体系组装较成功,为后续载药和光热化学治疗提供了必要条件,同时MAA的加入可以防止该组装体系在靶向到达肿瘤细胞之前被降解或者失去光热活性,保证了光热治疗的最佳效果。
本实施例步骤四中所得PEGMa-MoOx/P(NIPAM-co-MAA),其红外谱图见图7,曲线a,b,c分别为组装体系中MAA投入量的摩尔比分别为5,10,20时的红外谱图。图中3270-1处为-OH键的吸收峰,740cm-1处是Mo-O-Mo键的伸缩振动峰,970cm-1为C-O-C键的伸缩振动峰,1642,1404cm-1处为碳氧双键和碳碳双键的振动峰,1204cm-1为N-H键的伸缩振动吸收峰。从红外谱图的分析来看,改性氧化钼与温敏PNIPAM微凝胶的组装已经实现,该组装体系具有更高的生物相容性,并且能够负载药物,随着温度的变化可以靶向到达肿瘤细胞的位置,经近红外光照射后杀死肿瘤细胞。
本实施例步骤四中所得PEGMa-MoOx/P(NIPAM-co-MAA),在808nm激光器(1W/cm2)照射下温度随时间的变化曲线,见图8,曲线a,b,c表示组装体系中MAA投入量的摩尔比分别为5,10,20时的变化曲线。从图中可以发现三条曲线在7min内温度都从18℃升高到了34℃左右,温度升高了16℃左右,但是由于该复合为凝胶的浓度只有0.005mg/ml,比现有其他光热材料在0.5mg/ml时温度升高20度左右要高很多,说明该复合体系能够实现光热化学联合治疗肿瘤的目标。由于改性氧化钼能够在正常的生物体环境中降解排出体外,因此该复合体系在达到光热治疗癌细胞的效果的同时还能避免正常细胞受损。最后还能以较少含量的微凝胶达到较好的光热治疗的目的。
本实施例步骤四中所得PEGMa-MoOx/P(NIPAM-co-MAA),记作NCm。将24mg NCm分散于10mL超纯水中,得到的复合微凝胶水溶液放入透析袋(截留分子量为8000-14000)中,并将透析袋置于50.0mL含有抗癌药物DOX的水溶液(1.0mg/mL)中,于室温下静置24h,得到MoOx/P(NIPAM-co-MAA)-DOX载药微凝胶,它为可控响应性光热转换微凝胶组装体系,可应用于近红外光热治,药物靶向可控释放,肿瘤的热化疗;MoOx/P(NIPAM-co-MAA)-DOX载药微凝胶在808nm激光器(1W/cm2)照射下温度可从18℃升高到34℃,微凝胶中改性氧化钼纳米粒子可将光能转换为热能,在病灶处烧蚀细胞的同时还可以使具有靶向作用的微凝胶发生可控受热收缩,可将内部包覆的药物可控释放于病灶处,杀死肿瘤细胞,达到光热化学联合治疗的效果。
- 还没有人留言评论。精彩留言会获得点赞!