一种磁性纳米动力棒‑tPA系统及其构建与应用的制作方法
本发明涉及磁性纳米材料技术领域,尤其是一种作为药物载体应用于微小血管溶栓治疗的磁性纳米动力棒-tPA系统及其构建。
背景技术:
近些年来,纳米技术在医学领域得到前所未有的运用,例如磁共振造影剂、药物靶向运输和医学诊断等。
磁性纳米颗粒(magneticnanoparticle, MNP)因为形状、表面特性和电性等方面的有利特征,在药物载体方面具有广泛运用价值。磁性纳米材料合成的药物载体一般以超磁性的氧化铁作为核,以亲水性聚合物作为表层外壳。外壳的电性具有可以结合蛋白、抑制聚集和增加药物的稳定性的作用。最新的研究发现,磁性纳米材料共价结合的tPA(MNP-tPA)可以促进血栓的溶解。在体外实验中,有研究学者证实在磁场引导下MNP-tPA组溶栓时间比单纯tPA 组减少 40%,比无磁场引导组减少34%,而且依靠磁性介导的机械力能进一步促进 MNP-tPA 渗透入血栓。有研究表明,脂质体包被的tPA 半衰期延长16-21倍。在体内实验中,通过大鼠髂动脉血栓模型证实制备的四氧化三铁纳米材料体内注射后经磁场的定向引导可到达特定的血栓部位。浓聚的纳米材料为MNP-tPA定向运载提高溶栓效力提供可能。在另一组实验中,相当于0.2mg/kg tPA量的MNP-tPA在75min内能恢复大鼠髂动脉82%的血流,提示20%的tPA用量即可达到同样的溶栓效果,大大减少tPA的用量。 但这些实验均用于大血管——髂动脉的溶栓, 而且所用纳米材料均为纳米磁珠,在旋转磁场中产生的机械力渗透力有限。但是缺血性脑卒中多数在基底节区,属于中动脉及分支,特别是基底节区脑梗塞属于微小血管栓塞。由于MNP的研究数据均来源于大血管实验,并未涉及微小血管的研究。因此,我们希望进一步研究改进磁性纳米材料结构,使其可以作为药物载体而能够特别应用于缺血性脑卒中后的梗塞动脉血管再通和血流重建。
技术实现要素:
目的一:为了克服现有技术的不足,本发明提供了一种磁性纳米动力棒-tPA系统。
目的二:本发明提供了一种构建磁性纳米动力棒-tPA系统的制备方法。
目的三:本发明提供了一种tPA-磁性纳米动力棒作为药物载体的应用方法。
为了实现上述目的一,本发明采用的技术方案是:一种磁性纳米动力棒-tPA系统,其特征在于:包括磁性结构和骨架结构,磁性结构包括由Fe3O4成型的杆状铁臂,该杆状铁臂的头端链接有聚苯乙烯微珠,该聚苯乙烯微珠表面涂覆有硅层,所述骨架结构包括由二氧化硅或二氧化钛成型的二氧化硅臂或二氧化钛臂,骨架结构间隔排列在杆状铁臂之间形成螺旋状结构,该螺旋状结构耦合连接有生物相容性聚合物APTES形成APTES氨基化的磁性纳米动力棒,该APTES氨基化的磁性纳米动力棒以戊二醛为交联剂,将tPA分子共价结合到APTES氨基化的纳米动力棒表面,构建磁性纳米动力棒-tPA运载体。
上述杆状铁臂长度范围为300nm~400nm,上述聚苯乙烯微珠直径为100纳米,杆状铁臂以固定的84°沉积角沉积在苯乙烯微珠上,四氧化三铁具有良好的生物相容性和无毒性,四氧化三铁的纳米杆状结构可以直接由纳米级杆状的铁氧化而来,也可以直接经掠射角沉积(GLAD)的方法沉积得到,上述骨架结构的二氧化硅臂或二氧化钛臂通过掠射角沉积的方法使其间隔排列在四氧化三铁纳米杆状结构上,该结构的杆状纳米动力棒具有高度的均一性,其可以经磁性系统控制在微通道中运动。重组组织型纤溶酶原激活剂(rtPA)通过EDC/NHSS交联剂固化到PVP-磁性纳米动力棒上,使得磁性纳米动力棒与rtPA通过化合价结合,促使PVP-磁性纳米动力棒上的活化羧基基团和rtPA的氨基连接形成酰胺,该PVP-磁性纳米动力棒-rtPA仍然具有绝大部分rtPA的活性,且rtPA与底物之间具有有效的亲和力。
作为本发明的进一步设置,还包括驱动磁场装置,该驱动磁场装置的驱动条件满足要求:电磁转矩Tm>旋转所需的扭矩Tf,
其中,Tm =mHsinα,Tf=D+EL,m是磁性纳米动力棒的磁矩,H是磁场的强度,α为m和H 之间的角度,D是磁性纳米动力棒的旋转阻尼系数,E是每单位长度磁性纳米动力棒抵抗血流的效率,而L是磁性纳米动力棒的总长度。
上述驱动磁场装置包括电机,电机的输出轴联动连接有铁芯组件,铁芯组件绕设有射频线圈。
为了完成发明目的二:本发明采用的技术方案是:用于构建磁性纳米动力棒-tPA系统的制备方法,其特征在于,包括以下步骤:①磁性纳米动力棒的制备,②磁性纳米动力棒结合tPA的制备,
所述步骤①中包括以下步骤:a.将直径为540nm的二氧化硅小球单层膜铺在硅基片上作为沉积模板,将该沉积模板进行真空电子束沉积,沉积材料采用氧化铁,沉积角为86°,沉积速率为0.1nm/s,并采用石英晶体微天平读数为2μm时停止沉积,获得长度为1μm的纳米动力棒,b. 将纳米动力棒取出置于350℃环境下,并加入氮气,酒精,60 min后可将无磁性的氧化铁还原为磁性四氧化三铁,
所述步骤②中包括以下步骤:c. 将磁性纳米动力棒悬浮在体积比为4:1的乙醇/水混合物中,加入APTES和二甲基甲酰胺,直至APTES和二甲基甲酰胺的最终体积浓度均为5%,室温下振荡2小时,使纳米动力棒表面氨基化,d. 用磁铁将氨基化纳米动力棒与溶液分离,用3X PBS溶液洗涤,洗涤后,将纳米动力棒重悬于PBS溶液中,与0.5%的戊二醛混合,30℃下振荡30分钟,然后用PBS洗涤3次,e. 将戊二醛修饰的纳米动力棒同浓度为500μg/ml的tPA溶液混合,4℃下孵育12小时,获得tPA固化的纳米动力棒,即纳米动力棒-tPA运载体。
为了完成发明目的三:本发明采用的技术方案是:将磁性纳米动力棒-tPA作为用于治疗微小血管溶栓药物的运载体的应用。
采用上述方案,本发明的磁性纳米动力棒-rtPA作为药物载体可以应用于微小血管,在旋转磁场的作用下,能在外部磁场的作用下在液体环境中进行旋转和前向运动。当该纳米动力棒在血管中与血栓相遇,可通过机械性快速旋转穿过血栓(通过凝集的红细胞或血小板),或像搅拌机一样绞碎血块,使交联的纤维蛋白网(血栓的骨架)断裂。 另外,tPA 能共价结合到磁性纳米动力棒上,并能保持其酶活性。随后在外部磁场的引导下以纳米动力棒-tPA的形式进行靶向运动,并能高效地定位于脑血栓部位,在局部形成高浓度tPA环境,促进溶栓。这种特性可以降低 tPA的使用剂量,减少脑出血等并发症,进而延长了tPA 的治疗时间窗。再者,纳米动力棒本身在旋转磁场下产生的机械力,可以破坏血栓中交织的纤维蛋白骨架,促使 tPA到达新的结合位点,从而提高血栓溶解的敏感性,加速溶栓并缩短血管再通时间。此外,纳米动力棒-tPA 还能在磁场引导下被传送到脑部微小动脉中,提高靶向性从而能在绝大多数脑卒中得以应用。可产生机械力降解血栓纤维网结构,快速并准确地到达血栓位置释放药物,缩短溶栓时间,提高溶栓效果。
下面结合附图对本发明作进一步描述。
附图说明
附图1为磁性纳米棒的物理参数(a)扫描电镜下Fe2O3磁性纳米棒的形态,(b)低温退火后Fe3O4纳米棒扫描电镜图,纳米粒子密度,(c)Fe3O4纳米棒透射电镜图,(d)Fe3O4纳米棒X射线衍射图,(e)Fe3O4纳米棒磁化曲线;
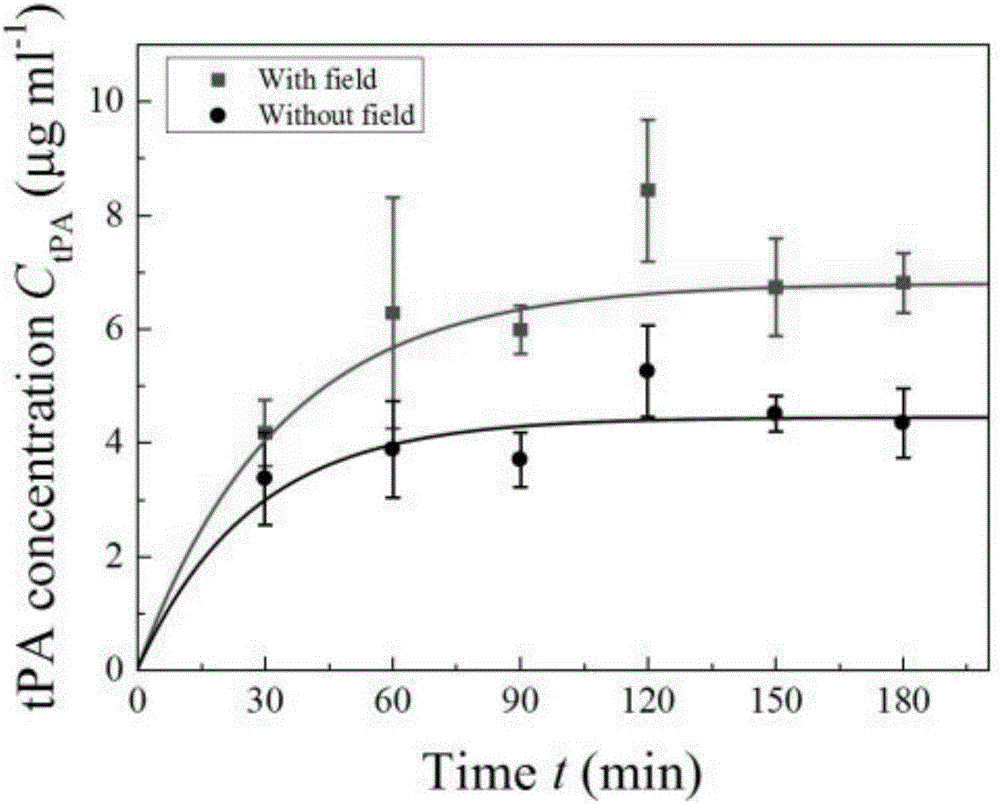
附图2为Nanorod-tPA溶液在室温下、磁场作用下, tPA释放的浓度和作用时间的关系;
附图3为Nanorods-tPA溶液静置于载玻片上的情况,(A)超声前Nanorods-tPA溶液,(B)超声处理4小时后Nanorods-tPA溶液;
附图4为PE50 管内血栓溶解过程;
附图5为不同浓度Nanorods下PE50管内溶栓时间;
附图6为不同组别体外血栓模型溶栓效率 A. PE50管体外溶栓模型,生理盐水组;B. Nanorods溶液组;C. tPA溶液组;D. Nanorods-tPA溶液组;
附图7为不同组别在PE50管内溶栓时间;
附图8为 FeCl3 诱导的小鼠血栓性脑卒中模型:(A)小鼠大脑远端中动脉;(B)饱含FeCl3溶液的滤纸片放置于大脑中动脉后形成血栓;(C)脑卒中模型建立24h后行TTC染色;
附图9为小鼠左侧颈内动脉注射方式:(A)暴露颈总(CCA),颈内(ICA),颈外(ECA)动脉;(B)用手术线阻断颈外动脉远心端及颈内动脉侧支血流;(C)通过留置管注射药物;
附图10为磁铁及磁场的放置方式:(A)经颈内动脉注射药物时,五块条形磁铁垂直放置于小鼠手术骨窗的右侧;(B)药物注射后,将磁铁移至近血栓1cm处;(C)将小鼠头端(dMCA)放置于磁场中央外源1-1.5cm处;
附图11为小鼠大脑中动脉血栓模型中NaCl溶液组的溶栓效果:(A)小鼠大脑中动脉;(B)小鼠大脑中动脉血栓模型;(C)NaCl溶液治疗60min后血栓溶解情况;(D)NaCl溶液治疗90min后血栓溶解情况;
附图12为小鼠大脑中动脉血栓模型中Nanorods(1 mg/kg)组的溶栓效果:(A)小鼠大脑中动脉;(B)小鼠大脑中动脉血栓模型;(C)Nanorods注射5 min后靶向到达血栓图片;(D)Nanorods注射90 min后血栓溶解情况;
附图13为小鼠大脑中动脉血栓模型中tPA组的溶栓效果:(A)小鼠大脑中动脉;(B)小鼠大脑中动脉血栓模型;(C)tPA治疗60min后血栓溶解情况;(D)tPA治疗90min后血栓溶解情况;
附图14为小鼠大脑中动脉血栓模型中Nanorods-tPA(1 mg/kg)组的溶栓效果:(A)小鼠大脑中动脉;(B)小鼠大脑中动脉血栓模型;(C)Nanorods-tPA注射5 min后靶向到达血栓图片;(D)Nanorods-tPA注射20 min后血栓溶解情况;
附图15为不同条件下小鼠大脑中动脉血栓模型的溶栓时间检测:在旋转磁性作用下(20 Hz, 40 mT),tPA溶液组(10 mg/kg)及Nanorods-tPA溶液组(1 mg/kg)溶解血栓所需时间。
具体实施方式
本发明实施例只用于对本发明进行进一步说明,不能理解为对本发明保护范围的限定,该领域的技术工程师可根据上述发明的内容对本发明作出一些非本质的改进和调整。本发明具体实施例如下所示。
磁性纳米动力棒-tPA系统的制备包括磁性纳米动力棒的制备和磁性纳米动力棒-tPA运载系统的构建,其中第二步中是以戊二醛(GlutaraldehydeG)为交联剂,将外购的重组tPA分子(rtPA,Genentech公司)共价结合到APTES氨基化的纳米动力棒表面,构建新型磁性纳米动力棒(Nanorods)-tPA运载体。
一、磁性纳米动力棒(Nanorods)的制备
纳米动力棒包括由Fe3O4纳米杆状结构构成的磁性结构、以及由SiO2臂或TiO2臂构成的骨架结构,SiO2臂或TiO2臂间隔排列在Fe3O4杆状铁臂上。本实施例采用“掠射角沉积(GLAD)”的多功能纳米加工技术来制造经聚苯乙烯微珠连接有铁臂(Fe臂)的杆状纳米动力棒。
首先, 将一层直径为540 nm的二氧化硅小球单层膜通过使用空气-液面法,铺在硅基片上当做沉积模板,之后将这些模板悬挂在真空沉积室中进行电子束沉积。沉积材料为氧化铁(Fe2O3),并且沉积角为86度,一个垂直于入射蒸汽方向的石英晶体微天平(QCM)被用来监控沉积速率,沉积速率大约是0.1 nm/s。沉积在QCM读数为2 µm的时候停止,从而获得长度为1 µm的纳米动力棒。沉积完毕后,将纳米动力棒取出并置于350℃环境下,并加入氮气,酒精,60 min后可将无磁性的氧化铁还原为磁性四氧化三铁。扫描电镜(SEM)显像表明,杆状的Nanorods具有高度的均一性,磁性动力棒的运动可以经一个在微通道中特殊设计的磁性系统控制。因Fe3O4具有良好的生物相容性和无毒性,我们将专注于Fe3O4纳米杆状结构,并将其作为磁性纳米动力棒。在该合成步骤之后,通过应用SEM技术、透射电镜技术(TEM) 、动态激光散射技术(DLLS)和振动样品磁强计(VSM)对生物相容性纳米动力棒的粒度分布、形态学和磁学性质进行定性描述。
二、磁性纳米动力棒-tPA运载系统的构建(Nanorods-tPA)
以戊二醛(GlutaraldehydeG)为交联剂,将外购的重组tPA分子(rtPA,Genentech公司)共价结合到APTES氨基化的纳米动力棒表面,构建新型磁性纳米动力棒(Nanorods)-tPA运载体。
上述磁性纳米动力棒(Nanorods)-tPA运载体的制备过程为:将磁性纳米动力棒(Nanorods)悬浮在乙醇/水混合物中(体积比为4:1),加入3-氨基丙基三乙氧基硅烷(APTES)和二甲基甲酰胺,直至APTES和二甲基甲酰胺的最终体积浓度均为5%。APTES为纳米动力棒提供丰富的氨基,室温下振荡2小时,使纳米动力棒表面氨基化。用磁铁将氨基化纳米动力棒与溶液分离,用3X PBS溶液洗涤。洗涤后,将纳米动力棒重悬于PBS溶液中,与0.5%的戊二醛混合,30℃下振荡30分钟,然后用PBS洗涤3次。最后,将戊二醛修饰的纳米动力棒同浓度为500μg/ml的tPA溶液混合,4℃下孵育12小时,以获得tPA固化的纳米动力棒, 即Nanorods-tPA。我们将用初始速率法测定游离tPA和nanorods-tPA的米氏常数,从而对其动力学参数进行研究。通过rtPA与不同浓度的rtPA特异性显色底物S-2288TM进行反应,可以测定其Km和Vmax值。Vmax是饱和的rtPA与底物发生酶促反应时所能达到的最高反应速度,Km即米氏常数,指酶促反应达到实际最大反应速度一半时的底物浓度,代表着rtPA与底物之间的有效亲和力。
三、磁性纳米动力棒的性能检测
Fe3O4的纳米棒可通过斜角淀积法和后沉积退火方法制造。如图1(a)所示,扫描电子显微镜(SEM)下可见在单层二氧化硅小球上沉积Fe2O3纳米棒,这些排列整齐的纳米棒阵列与表面法线形成β= 41°倾斜角,长度l = 1.02±0.03 µm。扫描电镜图像示单个Fe3O4纳米棒呈圆柱形,其直径为d = 300纳米(图1(b))。当Fe3O4纳米棒除去二氧化硅珠后,透视电镜下可见其呈粒状结构,由大小为30纳米的Fe3O4晶体组成,并显示具有大的孔隙率,与X射线衍射图像(TEM)数据相符。退火的Fe3O4纳米棒具有优选的偏角,顶角2θ= 35.4°(图1(d)),根据Scherrer公式可得平均晶体大小约为30.3纳米,与TEM测量结果一致。另外,磁滞回线表明该纳米棒磁化率χ= 2.10,饱和磁化强度Ms = 41 emug-1,约为Fe3O4材料(92 - 100 emu g-1)的一半,这是因为小的晶体和孔隙率可同时降低磁化率和纳米棒的饱和磁化强度。
四、磁性nanorods-tPA的tPA释放率检测
1)将新鲜制备的Nanorods-tPA粉末储存于500 µg/ml tPA溶液中,以tPA + Nanorod-tPA的形式置于4℃环境中保存备用;
2)吸取均匀混合的tPA + Nanorod-tPA悬液于1.5 ml 的离心管中,EP管底端放置钕磁铁块,通过磁铁吸附纳米动力棒作用下分离出上清液,并通过吸管弃去上清液,随后用生理盐水快速洗涤2次,再用生理盐水将Nanorod-tPA配置为1 mg/ml的溶液,再次混合均匀备用;
3)取均匀混合的Nanorod-tPA悬液55 µl置于离心管中,根据待测的不同时间点(30,60,90,120,150,180 min)分为6管,在避光条件下,将所有离心管置于旋转磁场(f=20 Hz)中,并在相应的6个不同时间点吸取样本上清液,并保存于4℃冰箱中,待所有样本收集完毕后,对样本液进行tPA浓度测定;
4)tPA定量(使用Pierce 660 nm Protein Assay Reagent from Thermo Scientific™):
① 设定全波长酶标仪参数,温度25℃,波长为660 nm;
② 冰浴下,用生理盐水制备不同梯度BSA标准液(5,10,20,40,80 µg/ml);
③ 取50 µl生理盐水(作为空白对照)、不同浓度梯度BSA标准液及待测样本液(每个样本从复3次),依次加入96孔板中。最后,在所有待测孔内滴加50 µl Pierce 660nm蛋白显色液,避光静置于室温下15 min;
④ 待显色反应完成后,将96孔板(去盖)放入酶标仪进行读数,记录测定值;
⑤ 实验重复3次,取平均值,并进行统计分析。(图2)
tPA的装载率定义为装载的tPA的质量除以纳米棒的质量,在本实验中测得其装载率为6%。在室温下,tPA的释放过程与有无外部磁场(B ~ 3 mT)有关。实验结果可得在最初的2个小时,释放在溶液中的tPA浓度随时间逐渐增长,最终到达饱和,在有外加磁场的情况下,tPA饱和浓度为=4.4±0.2µg ml-1。在无外加磁场的情况下,tPA饱和浓度为 = 6.8 ± 0.4 µg ml-1。
五. 降低磁性Nanorods-tPA聚集的研究
为进一步降低磁性Nanorods-tPA的聚集现象,避免Nanorods-tPA在血液循环过程中发生聚集而形成新的微小血管栓塞,提高生物安全性,本发明将对Nanorods-tPA进行物理超声处理及(或)选用不同液体介质进行重悬。通过不同参数下的超声作用(包括超声频率、持续时间、处理次数),观察超声作用后的Nanorods-tPA在不同液体介质中(如生理盐水、自体血浆、不同浓度的PVP溶液或聚丙烯酸溶液)的悬浮情况。具体操作如下:
1)Nanorod-tPA储存于500 µg/ml 的tPA溶液中,长期保存于-20 ℃;
2)注射该药物前1小时,将其解冻并进行超声前期处理;
3)用移液器将Nanorod-tPA(1 mg/ml)溶液转移至1.5 ml离心管内,并将离心管置于冰内;
4)设置超声波细胞篇破碎仪参数,振幅50,作用时间20秒/次,间隔时间5秒/次,重复3次;
5)超声裂解后借助磁铁的作用下将原存储液的tPA(500 µg/ml)取出,加入新的tPA(10 mg/ml)溶液作为tpa+Nanorod-tPA组;
6)储存于冰上备用,注射前用移液枪混匀。
上述试验,将Nanorods-tPA储存于500 µg/ml 的tPA溶液中,由于Nanorods-tPA本身带有磁性,久置于溶液中Nanorods-tPA相互之间会发生聚集现象。通过超声处理后可发现,室温下静置4小时Nanorods-tPA仍可均匀分散于溶液中,未发现集合颗粒团块,无明显聚集现象(参考图3)。
六、磁性纳米动力棒-tPA作为药物载体的体外实验应用
1. 旋转磁场的制作
磁性纳米动力棒(Nanorods)可以经旋转磁场驱动。旋转磁场作用在磁性纳米动力棒(Nanorods)上的电磁转矩Tm由下式Tm =mHsinθ计算得到,其中m是磁性纳米动力棒(Nanorods)的磁矩,H是磁场的强度,以及为m和H 之间的角度。另一方面,旋转所需的扭矩和角速度由Tf=Dω+E.L/ω计算得到,其中D是磁性纳米动力棒(Nanorods)的旋转阻尼系数,E是每单位长度磁性纳米动力棒(Nanorods)抵抗血流的效率,而L是磁性纳米动力棒(Nanorods)的总长度。因此,驱动条件是Tm>Tf。为驱动磁性纳米动力棒(Nanorods),制作旋转磁场是必需的。在诱发脑卒中后0.5、3、6或8小时,经颈内动脉(ICA)途径注射磁性纳米动力棒(Nanorods)或tPA。我们将在注射后5min到2小时这段时间内施加磁场,测定最佳的作用时间点。
2. 体外血栓的制备
1)血液的准备:3月龄雄性Sprague-Dawley大鼠(280g-310g),将其麻醉后从心脏采取新鲜血液,注射入含EDTA的采血管内,储存在4 ℃;
2)用移液器从抗凝管内抽取100 µl的大鼠全血移至1.5 ml的离心管内,加入20µl的凝血酶溶液(50 U/ml),2µl的CaCl2溶液(1 M)并混合均匀;
3)血液混匀后,立马用注射器抽取该全血注入PE60管内;
4)放置于室温下15分钟在PE60管内形成血栓;
5)血栓形成后,用含有生理盐水的注射器将PE60管内的血栓冲出入盛有生理盐水的培养皿中,储存于4℃备用。
离体溶栓模型:将含凝血酶的全血注射到PE50导管中,放置在温控箱30min至血栓形成。将不同浓度的磁性纳米动力棒(Nanorods)-tPA加到血栓一侧,然后加入10μM 台盼蓝溶液,监测溶栓速率。在台盼蓝侧施以一定压力,然后用连有计算机的视频摄像机对导管进行监测,记录台盼蓝染料的渗透时间。终止时间设定为染料从血栓前端到达末端的时间。
PE50 管内血栓溶解过程
如图4(A)所示将生理盐水,5 mm血栓,tPA溶液,油剂及台盼蓝试剂依次注入PE50管内,随着血栓的溶解,台盼蓝逐渐移向血栓侧如图4(B),当血栓完全溶解的时候,台盼蓝可通过血栓到达另一端如图4(C)。
3. 不同浓度nanorod-tPA溶液的溶栓实验
1)在PE60管内制备血栓,在显微镜下将培养皿中的血栓切成5 mm长度的血栓;
2)通过注射器将5mm的血栓重新吸入PE50管内;
3) 在装有血栓(5mm)的PE50管内分别加入100 µg/ml,200 µg/ml,400 µg/ml,800 µg/ml的Nanorod-tPA溶液,体积10 µl;
4) 在PE50管末端连接PE10管以防止血栓漏出,将含有血栓的连接好的装置垂直放置于磁场的中心(f = 20 Hz, 磁场通量密度为40 mT),时间设定为60 min;
5)通过测量血栓处理前后的长度,计算相应的体积下降百分数,从而反映血栓融解效率;
6)重复该实验5次,并进行统计分析。
PE50 管内不同浓度Nanorods-tPA的溶栓分析
室温下,在含有血栓的不同PE50管内分别加入10 µl不同浓度的Nanorods-tPA溶液。随后垂直放置于磁场(20 Hz,40 mT)中央,得血栓完全溶解后,记录下血栓的溶解时间(Lysis Time)如图5所示。实验结果所得,在Nanorods-tPA浓度低于800 µg/ml情况下,血栓溶解所需的时间随tPA浓度的增加而减少;与200 µg/ml的tPA溶液相比,400 µg/ml的Nanorods-tPA溶液溶解血栓的时间显著减少(***P<0.001); 而400 µg/ml tPA溶液与800 µg/ml tPA溶液溶解5 mm血栓所需时间无明显差别。
PE50 管内不同组间的溶栓分析
在室温下,在含有血栓的不同PE50管内分别加入生理盐水,Nanorods溶液(400 µg/ml),tPA溶液(40 µg/ml),Nanorods-tPA溶液(400 µg/ml),体积为10 µl。垂直放置旋转磁性作用60 min后,测量并计算血栓溶解效率分数(Lysis Efficency)如图6所示。实验结果所得,磁场下旋转的Nanorods-tPA可获得70%的血栓溶解效率,相比单纯tPA溶液组(30%)具有较明显的优势(***P<0.001)。单纯Nanorods组也具有15%溶解率,表明Nanorods的机械旋转也可进行溶栓作用。
PE50 管内不同组间的溶栓分析
室温下,将含有血栓的不同PE50管内分别加入tPA溶液(40 µg/ml),Nanorods-tPA溶液(400 µg/ml)以及Nanorods-tPA溶液(400 µg/ml,40 µg/ml),体积为10 µl。垂直放置旋转磁性,记录下血栓完全溶解所需的时间,即血栓的溶解时间(Lysis Time)如图7所示。结果示Nanorods-tPA组(90 min)溶解血栓的时间明显短于单纯tPA组(150 min); 而Nanorods-tPA组与Nanorods-tPA+tPA组无明显差异。
七、磁性纳米动力棒-tPA作为药物载体的体内实验应用
1.10%氯化铁诱导的小鼠大脑中动脉远端血栓模型制备(参考图8)
采用2月龄雄性CD1小鼠(30g-45g)作为实验动物,由温州医科大学动物实验中心提供。实验开始前一周小鼠饲养于清洁笼中, 并进行行为学训练。大脑中动脉血栓模型制作具体方法:小鼠用2%异氟醚、70%N2O 和30%O2麻醉,并监测肛门温度使之保持37℃±0.1℃。麻醉后侧卧位固定,在眼外眦和外耳道连线中点做一弧形切口,长度约1cm,夹断颞肌并切除,暴露颞骨,去除颅骨,暴露大脑中动脉远端(位于嗅束及大脑下静脉之间)。将吸有10 % FeCl3溶液的小片定量滤纸敷在此段大脑中动脉上,1 min后取下滤纸,用生理盐水冲洗局部组织。确定建模成功后,将小鼠回笼饲养,室温控制在24℃左右。
2. 经颈内动脉药物注射方法
1)麻醉后仰卧位固定,用碘酒消毒颈部皮肤,剔除毛发备皮,在正中线做一垂直切口,长约3 cm,分离颈部肌肉,暴露左侧颈总动脉,并在下方放置6-0手术线备用;
2)钝性分离胸锁乳突肌,暴露颈内动脉及颈外动脉;
3)在颈外动脉远心端用8-0手术线置死结以离断血流,近心端则打一活结以备用,同样方法在颈内动脉出放置活结以备用;
4)临时阻断左侧颈总动脉,颈内动脉血流,用显微剪在颈外动脉放置活结的远心端剪一小口以备用;
5)通过注射器将药物吸入留置管内(远端最小直径为1 F),随后将留置管放置于颈外动脉,经过颈内、外动脉分叉处入颈内动脉;(图9)
6)固定颈外动脉处的活结并松开颈内动脉的活结,注射药物;
7)药物注射后,拔出留置管并阻断颈外动脉血流,松开颈总动脉活结恢复血流;
8)将颈部肌肉组织复位,缝合颈部皮肤并消毒。
3. 体内实验方法及分组
在血栓性脑缺血模型制作成功后,分别将1)生理盐水;2)tPA;3)Nanorods;4)Nanorods-tPA通过血栓同侧颈内动脉注射入血管,并在距离血栓0.5-1cm处应用单向磁铁对其进行靶向性引导,5 min后撤去单向磁铁,使磁性纳米动力棒靶向到达血栓部位。接着,将小鼠移至磁场,并将头端放于外加旋转磁场边缘1-1.5 cm处,并确保小鼠头端的水平面及垂直面位于磁场的正中央,调整控制器调至旋转速度为1000 r/min(f = 20 Hz, 磁场通量密度为40 mT),从而使nanorods-tPA 发生转动并作用于血栓。磁铁及磁场的放置方式参考图10。
体内实验具体为以下几个部分:
①检验磁性纳米动力棒能否使低剂量的tPA在血栓栓塞性脑卒中动物模型发挥溶栓作用。脑缺血诱发30 min后,分别注射生理盐水、高剂量tPA (10mg/kg) 、中等剂量tPA(5mg/kg)、低剂量tPA(2.5mg/kg)、磁性纳米动力棒或tPA-磁性纳米动力棒。MCAO形成后24h和72h对梗死灶大小和出血量进行定量检测。药物注射后2小时内对溶栓情况进行动态监测,每隔10 min显微镜下观察远端大脑中动脉血栓溶解情况。
②探究最佳Nanorods-tPA体内溶栓剂量:制备氯化铁诱导的小鼠远端大脑中动脉血栓模型(dMCAO),经同侧颈内动脉途径分别给予不同剂量组(10 mg/kg,5 mg/kg,2.5 mg/kg,1 mg/kg,0.5 mg/kg)Nanorods-tPA,施以外置磁场,注射后持续2小时显微镜下观察靶向至血栓部位的磁性粒子及血栓的溶解情况,24小时后取脑组织进行H-E染色,铁染色等组织学方法观察不同剂量组的磁性粒子在脑血管内分布情况。
③检验Nanorods-tPA能否在延长时间窗的情况下发挥溶栓作用。脑缺血诱发1、3、6 、12h后,分别注射生理盐水、tPA(10 mg/kg)或Nanorods-tPA,注射后2 小时内对脑血流进行动态监测。脑卒中诱发后24h进行组织学检测。
如图11所示是生理盐水组的溶栓情况,在小鼠大脑中动脉血栓模型中经颈内动脉注射生理盐水溶液(NaCl)作为对照组,90分钟后观察血栓溶解情况。
如图12所示是Nanorods组(1 mg/kg)的溶栓情况,小鼠大脑中动脉血栓模型中经颈内动脉注射Nanorods溶液,Nanorods剂量为1 mg/kg。手术显微镜下可发现在外加磁铁的引导下Nannorods可靶向到达大脑中动脉血栓部位。随后,在外加磁场的作用下,Nanorods在血管中与血栓相遇,通过机械性旋转可贴附于血栓表面。
如图13所示是 tPA组(10 mg/kg)的溶栓情况,在小鼠大脑中动脉血栓模型中经颈内动脉注射高剂量tPA(10 mg/kg)药物,血栓完全溶解时间为90±5 min。高剂量tPA溶栓存在血栓再通后脑出血的并发症。
附图14所示 Nanorods-tPA组(1 mg/kg)的溶栓情况,小鼠大脑中动脉血栓模型中经颈内动脉注射Nanorods-tPA溶液,Nanorods-tPA剂量为1 mg/kg。手术显微镜下可发现在外加磁铁的引导下Nannorods-tPA可靶向到达大脑中动脉血栓部位。随后,在外加磁场的作用下,Nanorods-tPA在血管中与血栓相遇,通过机械性旋转穿入血栓,并做前向运动,发挥溶栓作用,从而促进血流再通,作用时间大约为20 min。
如图15所示,Nanorods-tPA在小鼠大脑中动脉远端血栓模型中应用并在旋转磁场引导下,相比较tPA溶液组,在减少tPA剂量的同时,可显著缩短血栓溶解时间以及提高溶栓的效率及血流再通率。
- 还没有人留言评论。精彩留言会获得点赞!
- 具吡啶二硫功能基的磁性纳米粒子Fe3O4@SiO2@S-S-Py的制备及生物医药中的应用的制造方法与工艺
- 聚乙二醇化包裹聚多巴胺载药磁性纳米颗粒的制备方法与流程
- 一种PQQ‑DA印迹磁性纳米粒子的制备方法及其应用与制造工艺
- 一种可降解聚合物磁性纳米粒子及其制备方法与制造工艺
- 一种山梨酸-茶多酚复合纳米粒子及其应用的制造方法与工艺
- 一种实现纳米线生物传感器表面修饰的方法与制造工艺
- 磁性纳米粒子和产生自由基的酶的介孔催化剂及其使用方法与制造工艺
- 一种靶向性超顺磁性纳米探针的制备方法和应用方法与制造工艺
- 油酸包裹的超顺磁性纳米Fe3O4及其制备方法与制造工艺
- 一种贵金属纳米粒子间距可控的SERS衬底制备方法与制造工艺