一种牛血清白蛋白包覆紫杉醇脂质纳米粒制剂的制备方法与流程
本发明提出了一种新型的具有肿瘤细胞靶向的给药系统的制备方法即一种牛血清白蛋白包覆紫杉醇脂质纳米粒制剂的制备方法,属于医药技术领域。
背景技术:
白蛋白(Albumin,Alb)由肝实质细胞合成,在血浆中的半衰期约为15-19天,是血浆中含量最多的蛋白质,占血浆总蛋白的40%-60%。白蛋白的分子结构已于1975年阐明,为含585个氨基酸残基的单链多肽,分子量为66458,分子中含17个二硫键,不含有糖的组分。在体液pH7.4的环境中,白蛋白为负离子,每分子可以带有200个以上负电荷。它是血浆中很重要的载体,许多水溶性差的物质可以通过与白蛋白的结合而被运输,这些物质包括胆红素、长链脂肪酸(每分子可以结合4-6个分子)、胆汁酸盐、前列腺素、类固醇激素、金属离子(如Cu2+、Ni2+、Ca2+)、药物(如阿司匹林、青霉素等)。具有活性的激素或药物当与白蛋白结合时,可以不表现其活性,而视为其储存形式,由于这种结合的可逆性和处于动态平衡,因此在调节这些激素和药物的代谢上,具有重要意义。
目前作为载体材料使用的白蛋白包括人血清白蛋白(Human Serum Albumin,HSA)和牛血清白蛋白(Bovine Serum Albumin,BSA)。牛血清白蛋白(BSA),又称第Ⅴ组分,是牛血清中的一种球蛋白,包含583个氨基酸残基,分子量为66000,等电点为4.7。其中35个半胱氨酸组成17个二硫键,在肽键的34位是一个游离巯基。白蛋白在pH4-9范围内保持稳定,在60℃加热10h而没有变化,具有良好的稳定性。在BSA的三个结构域Ⅰ、Ⅱ和Ⅲ中,结构域Ⅱ和Ⅲ均有一个由疏水性及荷正电的基团所构成的袋装结构,其中能够容纳多种结构的化合物。由于BSA与HSA不仅结构相似,而且两者的氨基酸序列高度相似,且不同氨基酸均为保守性替换,而BSA更价廉易得,因此被广泛应用于医药研究领域中。
近年来越来越多事实表明,仅仅发展新药不足以保证药物治疗的进步,发展合适的药物载体系统可以克服目前存在的一些问题,还可能实现药物控释和定点释药。因此,微球、微乳、纳米粒、脂质体等亚微粒药物载体输送系统研究成为药物新剂型研究中非常活跃的领域,同时研究工作者在选择性吸收和靶向给药等方面取得了显著的成就。将药物包封于这些亚微粒中可以改变药物在体内的分布、调节释药速度、提高生物利用度、增加药物对生物膜的透过性、增加药物在靶器官的分布量,从而提高疗效,减轻毒副作用。在以上给药系统中,脂质体的研究较为广泛,脂质体在体内具有良好的靶向性和生物相容性等优点,但一般脂质体也存在体内外不稳定、药物易于渗漏等问题。含药微乳由于其物理稳定性、油相对药物的溶解度等问题限制了其进一步发展。聚合物纳米粒在制备过程中可能带来潜在毒性的物质,如残留单体、有机溶剂、聚合物引发剂等,所用的生物降解性高分子材料在细胞吞噬降解后也常产生细胞毒性。因此人们将目光逐渐转向由生物相容、体内降解的天然脂质材料作为载体的脂质纳米粒。
1990初开发的脂质纳米粒(LNP,lipid nanoparticles)是一种可替代乳剂、脂质体和聚合物纳米粒的新型给药系统。LNP系统既具备聚合物纳米粒物理稳定性高、药物泄漏慢的优势,又兼具了脂质体、乳剂的毒性低、能大规模生产的优点,是一种极有发展前景的新型给药系统。LNP是由具有生理相容性并可生物降解的,由拥有良好人体使用历史的脂质制备而成,具有下述优点:(1)纳米粒粒径小,平均粒径在纳米级,微米级颗粒含量极少,可用于注射给药(当颗粒径>5μm时,不宜用于注射给药);(2)生理可接受,载体无生物毒性,制备过程中不使用有毒聚合物、单体等有毒残留物;(3)对亲脂性药物有足够的载药能力,相对脂质体载药量提高,通过工艺调整,也可以包封亲水性药物;(4)药物释放可以达到缓释、控释目的;(5)其水分散系统可以进行高压灭菌或γ辐射灭菌,具有长期的物理化学稳定性,也可将之冻干或喷雾干燥制成固体粉末;(6)通过对其表面进行特征修饰可控制靶向特定组织(靶向给药);(7)有足以供应市场的大规模工业化生产方式;(8)价格相对较为低廉。因此,近期LNP吸引了人们越来越多的注意。
近年来越来越多事实表明,仅仅发展新药不足以保证药物治疗的进步,需要发展合适的药物靶向肿瘤载体系统可以克服目前存在的一些问题,实现药物肿瘤靶向释药。
技术实现要素:
本发明的目的在于提供一种牛血清白蛋白包覆紫杉醇脂质纳米粒制剂的制备方法,为药物靶向肿瘤载体系统提供了一种新的具有肿瘤细胞靶向的纳米给药系统,提高了抗肿瘤药物对肿瘤部位的靶向及肿瘤杀伤能力。
本发明采用以下技术方案:
一种牛血清白蛋白包覆紫杉醇纳米粒制剂的制备方法,它包括以下步骤:
(1)脂质核心(PTX-LNP)的制备:按比例精密称取紫杉醇、磷脂、十八胺置于茄形瓶中,加入氯仿8~12ml超声溶解,30-40℃减压蒸发成膜,加入水合介质PBS8~12ml,30-40℃水合15~30min,冰浴探头超声后即得到脂质核心溶液;所述紫杉醇与磷脂重量比为1:15~1:5;所述十八胺与紫杉醇重量比为1:6~1:3;
(2)牛血清白蛋白包覆载紫杉醇脂质纳米粒制剂(BSA-PTX-LNP)的制备:按照磷脂:BSA重量比为5:1~15:1的比例称取BSA,用PBS溶液溶解后,缓慢加入步骤(1)制备得到的脂质核心溶液中,于30-40℃缓慢搅拌孵育6~10h,使BSA物理包覆于脂质核心表面,微柱离心法分离未包覆的游离蛋白,即得牛血清白蛋白包覆的紫杉醇脂质纳米粒。
优选的,所述步骤(1)中紫杉醇与磷脂重量比为1:10。
优选的,所述步骤(1)中十八胺与紫杉醇重量比为1:5。
优选的,所述步骤(1)中超声的功率为200W,超声1s,间歇1s,总时间为3~6min。
优选的,所述超声总时间为5min。
优选的,所述步骤(2)中PBS溶液的pH为7.4。
优选的,所述步骤(2)中磷脂:BSA的重量比为10:1。
优选的,所述步骤(2)中搅拌孵育时间为8h,温度为37℃。
本发明的制备方法中对紫杉醇脂质核心的制备采用的是加入紫杉醇、磷脂和十八胺,其加入十八胺为了增加脂质核心的电荷带正电荷,目的是与带负电荷的牛血清白蛋白通过静电作用相结合。这种结合方式是通过正负电荷静电吸引结合在一起,这个方法与白蛋白包覆紫杉醇相比,能增加载药量及良好的生物相容性。
本发明的有益效果是:紫杉醇脂质纳米粒经BSA包覆后,肿瘤细胞对抗肿瘤药物紫杉醇的摄取大大增加,并且对肿瘤细胞的杀伤力也大大增加,其意义在于:(1)增加药物分子靶标部位的药物浓度,有利于减小药物在正常组织活细胞的分布,降低药物的毒副作用;(2)药物分子靶标部位的药物浓度增加,有利于提高该类抗肿瘤药物的疗效。
附图说明
图1为BSA-PTX-LNP的透射电镜下的形态图。
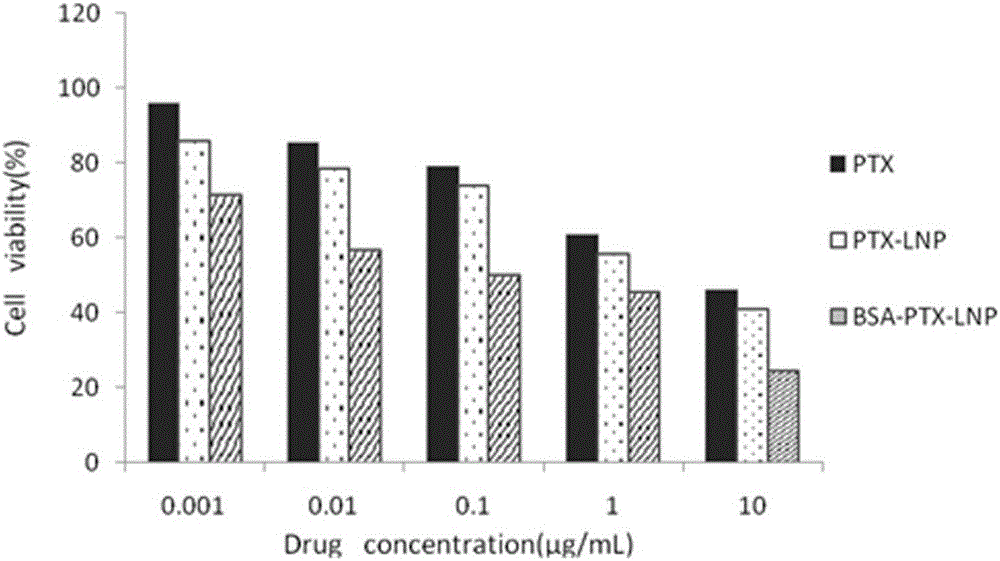
图2为MCF-7细胞在不同药物载体及浓度的培养液中的细胞存活率。
具体实施方式
下面结合具体实施例对本发明做进一步的详细说明
实施例1
一种白蛋白包覆载杉醇脂质纳米粒的制备
(1)脂质核心的制备:按比例精密称取紫杉醇10mg、磷脂50mg、十八胺1.7mg置于茄形瓶中,加入氯仿8~12ml超声溶解,30℃减压蒸发成膜,加入水合介质pH为7.4的PBS8~12ml,30℃水合30min,冰浴探头超声功率为200w,超声1s,间歇1s,总时间为3min,即得到脂质核心溶液;
(2)牛血清白蛋白包覆载紫杉醇脂质纳米粒制剂的制备:称取BSA 3.3mg,用PBS溶液溶解后,缓慢加入步骤(1)制备得到的脂质核心溶液中,于30℃缓慢搅拌孵育10h,使BSA物理包覆于脂质核心表面,微柱离心法分离未包覆的游离蛋白,即得牛血清白蛋白包覆的紫杉醇脂质纳米粒。
实施例2
一种白蛋白包覆载杉醇脂质纳米粒的制备
(1)脂质核心的制备:按比例精密称取紫杉醇10mg、磷脂100mg、十八胺2mg置于茄形瓶中,加入氯仿8~12ml超声溶解,35℃减压蒸发成膜,加入水合介质pH为7.4的PBS 8~12ml,30-40℃水合20min,冰浴探头超声,功率为200w,超声1s,间歇1s,总时间为5min,即得到脂质核心溶液;
(2)牛血清白蛋白包覆载紫杉醇脂质纳米粒制剂的制备:称取BSA 10mg,用PBS溶液溶解后,缓慢加入步骤(1)制备得到的脂质核心溶液中,于37℃缓慢搅拌孵育8h,使BSA物理包覆于脂质核心表面,微柱离心法分离未包覆的游离蛋白,即得牛血清白蛋白包覆的紫杉醇脂质纳米粒。
实施例3
一种白蛋白包覆载杉醇脂质纳米粒的制备
(1)脂质核心的制备:按比例精密称取紫杉醇10mg、磷脂150mg、十八胺3.3mg置于茄形瓶中,加入氯仿8~12ml超声溶解,40℃减压蒸发成膜,加入水合介质pH为7.4的PBS 8~12ml,40℃水合15min,冰浴探头超声,功率为200w,超声1s,间歇1s,总时间为6min,即得到脂质核心溶液;
(2)牛血清白蛋白包覆载紫杉醇脂质纳米粒制剂的制备:称取BSA 30mg,用PBS溶液溶解后,缓慢加入步骤(1)制备得到的脂质核心溶液中,于3℃缓慢搅拌孵育6h,使BSA物理包覆于脂质核心表面,微柱离心法分离未包覆的游离蛋白,即得牛血清白蛋白包覆的紫杉醇脂质纳米粒。
实施例4
紫杉醇脂质纳米粒的理化性质考察
取实施例2中制备的PTX-LNP及BSA-PTX-LNP对其理化性质进行考察,粒子的形态、粒径大小、荷电情况是表征纳米粒子的基本参数,很大程度上影响纳米粒子分散成胶体溶液的稳定性。本发明主要采用Nicomp-380型粒度测定仪测定PTX-LNP及BSA-PTX-LNP的粒径和Zeta电位,对纳米粒的一些表观性质进行研究。另外,并对PTX-LNP及BSA-PTX-LNP的包封率与载药量、包覆率进行了测定。
方法与结果
1.紫杉醇脂质纳米粒外观
新制备的PTX-LNP与BSA-PTX-LNP外观均为淡蓝色乳光明显的澄明溶液。透射电子显微镜(TEM)是以电子束透过样品经过聚焦和放大产生物像后,投射到光屏进行观察。由于电子的易散射和易被物体吸收,穿透力低,容易成像。BSA-PTX-LNP的电镜照片见图1。由图可见,牛血清白蛋白包覆载紫杉醇脂质纳米粒制剂(BSA-PTX-LNP)呈圆形或类圆形。
2.紫杉醇脂质纳米粒粒径及分布
取制备好的两种紫杉醇脂质纳米粒适量,加灭菌注射用水稀释,利用Nicomp-380激光粒度测定仪测定其粒径及分布。两种紫杉醇脂质纳米粒的粒径数据见表1。
表1 PTX-LNP和BSA-PTX-LNP的直径
The data are expressed as the mean±SD value for at least three different preparations
由上述表1中的实验数据可见紫杉醇脂质纳米粒在包覆了BSA后粒径有所增加。
3.紫杉醇脂质纳米粒Zeta电位测定
Zeta电位是微粒表面荷电性质和荷电大小的标志,常用来预测和控制微粒分散系统的物理稳定性。本研究采用Nicomp-380激光粒度测定仪测定了PTX-LNP和BSA-PTX-LNP的Zeta电位,将样品分别稀释至一定浓度,放入比色池中测定,测得PTX-LNP和BSA-PTX-LNP的Zeta电位分别为+17.5mV和+4.66mV。
4.紫杉醇脂质纳米粒包封率与载药量的测定
微孔滤膜法测定紫杉醇包封率。分别取过膜前后的脂质纳米载粒100μL,加适量甲醇破乳,离心取上清液,按上述HPLC法测定紫杉醇含量。分别计算紫杉醇的包封率(EE)和载药量(DL)。数据见表2。
表2 PTX-LNP和BSA-PTX-LNP中紫杉醇的包封率(EE)和载药量(DL)
5.紫杉醇脂质纳米粒包覆率的测定
凝胶色谱法分离包覆在纳米粒表面的BSA及游离BSA。取BSA-PTX-LNP 0.5mL置于琼脂糖CL-4B凝胶柱上方,以蒸馏水洗脱并收集BSA部分至10mL量瓶,并以蒸馏水定容,考马斯亮蓝法测定BSA含量,BSA包覆率(CE)=(1-Wf/Wt)×100%。其中,Wf为游离白蛋白的量,Wt为制剂中白蛋白的加入量。BSA在BSA-PTX-LNP上的包覆率为85%。
本发明采用薄膜分散法制备了BSA包覆的阳离子脂质纳米粒和未包覆的普通阳离子脂质纳米粒(BSA-PTX-LNP和PTX-LNP),并对包覆和未包覆牛血清白蛋白的紫杉醇脂质纳米粒的理化性质分别进行了表征。包括外观、形态学、粒度、Zeta电位、包封率和载药量、包覆率。结果显示:两种紫杉醇脂质纳米粒外观均为淡蓝色乳光明显的澄明溶液。PTX-LNP和BSA-PTX-LNP的粒径分别为104.1nm和119.0nm;Zeta电位分别为+17.5mV和4.66mV;包封率分别为93.51%和89.76%;载药量分别为6.86%和6.21%;BSA在BSA-PTX-LNP上的包覆率为85%。以上实验数据均表明了白蛋白在BSA-PTX-LNP上的有效包覆。
实施例5
白蛋白包覆载紫杉醇脂质纳米粒肿瘤细胞靶向实验
细胞:人乳腺癌细胞系MCF-7细胞,购自上海坤肯生物化工有限公司。
1.培养液配制及细胞培养
培养液配制
DMEM培养液:取DMEM干粉10.4g,用重蒸馏水溶解后,加入碳酸氢钠3.7g,HEPES 2.0g,溶解后用重蒸馏水定容至1000mL,用1mol·L-1HCl调pH至7.0,经0.2μm滤膜过滤器除菌,分装,-20℃贮存备用。用前加入胎牛血清至浓度为10%,青链霉素至终浓度为100单位/mL。
磷酸盐缓冲液(PBS):分别称取氯化钠8.0g、氯化钾0.2g,磷酸氢二钠1.44g、磷酸二氢钾0.24g,依次溶解于800mL蒸馏水中,混匀。用1mol·L-1HCl调pH至7.4,最后加蒸馏水定容至1000mL,配成浓度为0.01mol·L-1的磷酸盐缓冲液(pH7.4)。高压灭菌30min,4℃贮存备用。
消化液:取胰蛋白酶0.25g,EDTA0.02g,溶解于100mL PBS中,经0.22μm滤膜过滤除菌,4℃贮存备用。
细胞培养
细胞复苏与培养:从液氮中取出冻存的MCF-7细胞,迅速放入37℃水浴快速解冻,无菌条件下将细胞转移至10mL离心管,加细胞培养液补足至10mL,1000r·min-1,离心5min,弃去上清。加入含10%胎牛血清的DMEM培养液,重悬细胞,并接种于100mL培养瓶中,在5%CO2、37℃培养箱中培养,维持细胞处于对数生长期,备用。
细胞传代:培养瓶中细胞生长面积至培养瓶培养面的70%~80%时,弃去培养液,加入2mL PBS,清洗3次。向培养瓶中加入400μL胰酶消化液,使之充分润湿瓶壁后倒掉,用残余的胰酶消化。置于培养箱中2~5min,倒置显微镜下观察,当细胞变圆收缩、细胞间隙增大时,加入含10%胎牛血清的DMEM培养液,轻轻吹打瓶壁,至贴壁细胞全部进入培养液。将细胞悬液平均分为2~3瓶培养,补足培养液。
2紫杉醇脂质纳米粒体外细胞毒实验
MTT法原理
MTT法是一种检测细胞存活和生长的方法。MTT商品名:噻唑蓝,化学名为3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyl tetrazolium bromide,MTT),是一种能接受氢离子黄色染料。活细胞线粒体中的琥珀酸脱氢酶能使外源性的MTT还原为难溶性的蓝紫色结晶物(Formazan)并沉积在细胞中,而死细胞无此功能。二甲基亚砜(DMSO)能溶解细胞中的紫色结晶物,用酶联免疫检测仪在492nm波长处测定其吸光度值(OD值),可间接反映活细胞数量。
MTT溶液的配制
用pH 7.4的磷酸盐缓冲液(PBS)制成浓度为5mg·mL-1溶液,磁力搅拌30min,用0.22μm微孔滤膜过滤除菌,放2~8℃冰箱内避光保存备用。
MTT的测定
取对数生长期MCF-7的细胞株胰酶消化后,用加有10%胎牛血清的DMEM细胞培养液制成细胞悬液。计数后,以每孔6000个/100μL细胞浓度接种于96孔板,将细胞于5%CO2,37℃、饱和湿度条件下恒温CO2培养箱中培养24h。取出培养板后,小心吸走孔内培养液,再分别加入含PTX浓度为0.001,0.01,0.1,1,10μg·mL-1的PTX溶液,PTX-LNP和BSA-PTX-LNP,每孔加入100μL。作用48h后,分别取出培养板,每孔加入MTT(5μg·mL-1,25μL)继续置于培养箱培养4h后取出,小心吸出孔内液体,每孔再加入DMSO 100μL。在恒温摇床上,振摇10min,使沉淀充分溶解。在酶标仪波长(λ)=490nm处测定吸光度(A),记录结果,按公式计算细胞存活结果如图2所示。
细胞抑制率=[(A对照组-A给药组)/(A对照组-A空白组)]×100%
细胞存活率=(1-细胞抑制率)×100%
由图2中的实验数据可以看出,PTX浓度相同时,肿瘤细胞在三种溶液中的存活率依次为PTX>PTX-LNP>BSA-PTX-LNP,并且随着药物浓度逐渐增大,细胞存活率逐渐降低,说明白蛋白的包覆有利于提高紫杉醇脂质纳米制剂的药效。
3紫杉醇脂质纳米粒细胞摄取实验
样品的处理
将培养板中的细胞用4℃预冷的pH7.4的磷酸盐缓冲液(PBS)洗细胞三次,每次5ml,加入胰酶消化细胞,用重蒸水稀释,将细胞转移至10ml离心管中,1000r·min-1,离心5min,弃去上清。转移到5ml离心管中,冰浴下探头超声,(工作1s,间歇1s,功率为40w,超声5min)。10000r·min-1,离心5min,取上清液待测。
细胞摄取实验
将对数生长期MCF-7的细胞株胰酶消化,制成细胞悬液。计数后,以每孔6×104个/1mL细胞浓度接种于12孔板中,将细胞置于恒温CO2培养箱中,5%CO2,37℃,饱和湿度条件下培养24小时。取出培养板,吸走孔内培养液,再分别加含PTX、PTX-LNP、BSA-PTX-LNP的细胞培养液,置于恒温CO2培养箱中37℃分别孵育2小时后,按“2.3.1”方法操作后,HPLC法测定含量。结果如表3所示。
表3 不同制剂的细胞摄取实验
由表3中的实验数据可以看出,三种不同溶液的细胞摄取量为BSA-PTX-LNP>PTX-LNP>PTX,说明白蛋白的包覆有利于增加细胞对紫杉醇的摄取量。
通过上述细胞毒性实验以及细胞摄取实验初步探讨BSA对紫杉醇脂质纳米粒肿瘤细胞杀伤力以及在肿瘤细胞中摄取情况的影响。MTT法研究BSA-PTX-LNP和PTX-LNP对MCF-7细胞的体外细胞毒作用,实验结果表明,BSA的有效包覆有利于增加紫杉醇对肿瘤细胞的杀伤能力。细胞摄取实验结果表明BSA的有效包覆有利于增加肿瘤细胞对药物的摄取率。
综上所述,本发明制备的牛血清白蛋白包覆紫杉醇脂质纳米粒制剂为药物靶向肿瘤载体系统提供了一种新的具有肿瘤细胞靶向的纳米给药系统,提高了抗肿瘤药物对肿瘤部位的靶向及肿瘤杀伤能力。可增加药物分子靶标部位的药物浓度,有利于减小药物在正常组织活细胞的分布,降低药物的毒副作用;药物分子靶标部位的药物浓度增加,有利于提高该类抗肿瘤药物的疗效。
- 还没有人留言评论。精彩留言会获得点赞!