一种载药聚吡咯/海藻酸钠凝胶的制备方法与流程
本发明属于高分子技术领域以及药物缓释技术领域,具体涉及一种载药聚吡咯/海藻酸钠凝胶的制备方法。
背景技术:
药物缓释体系有利于提高药物疗效、降低毒副作用,可减轻病人多次用药的痛苦,对提高临床用药水平具有重要意义。水凝胶通常是由亲水单体和交联剂形成的聚合物水溶胀体,水凝胶中富含的水分可使溶于其中的物质以及低分子量物质从其间渗透扩散。同时,由于大量的水分充斥于聚合物网络中,较大程度地伸展被交联的大分子链,使整个材料具备了一种流体的性质,这与含有大量水性液体的人体组织极其相似,增加与组织的亲和性。大多数聚合物水凝胶具有环境响应性,即在外界刺激下,如温度、pH、光和电场等,可发生溶胀和消溶胀的响应。这种独特的性质使得聚合物水凝胶成为一种理想的药物载体材料。
目前,药物缓释水凝胶材料以聚乙烯醇、海藻酸钠、壳聚糖、丝素、聚酰胺等生物相容性好的高聚物为主,采用导电聚合物制备药物缓释水凝胶的报导较少。聚吡咯具有高电导率、制备容易、生物相容性好及无毒无害等优点,使其成为一种优异的药物缓释高分子材料。
技术实现要素:
本发明所要解决的技术问题在于提供一种载药聚吡咯/海藻酸钠凝胶的制备方法。
为解决上述技术问题,本发明采用的技术方案是:首先采用化学聚合法制备载药聚吡咯/海藻酸钠微球,然后将载药聚吡咯/海藻酸钠微球分散在氯化钙水溶液中固化而得。
上述一种载药聚吡咯/海藻酸钠凝胶的制备方法,具体步骤如下:
(1)将海藻酸钠溶于去离子水中,配制海藻酸钠溶液;
(2)将吡咯单体溶于1mol/L HCl溶液中,配制吡咯单体溶液;
(3)将药物溶于1mol/L HCl溶液中,配制药物溶液;
(4)磁力搅拌下,将步骤(3)配制的药物溶液滴入到步骤(2)所得的吡咯单体溶液中,滴加结束后,搅拌15-30min;
(5)磁力搅拌下,将步骤(4)所得的溶有药物的吡咯单体溶液逐滴滴加到步骤(1)制得的海藻酸钠溶液中,滴加结束后,超声分散15-25min;
(6)将30%H2O2溶于去离子水中,混合均匀后,冰浴条件下,将H2O2溶液缓慢滴加到步骤(5)所得的混合溶液中,滴加过程中,保持磁力搅拌,滴加结束后,冰浴条件下继续反应24-48h,反应过程中,保证体系温度不超过5℃,反应结束后,离心分离,固体产物用去离子水洗涤3-5次后,重新分散在去离子水中,即得聚吡咯/海藻酸钠微球分散液;
(7)配制20mL质量浓度1%-3%的CaCl2溶液,待CaCl2完全溶解后,将20mL步骤(6)所得的聚吡咯/海藻酸钠微球分散液滴加其中,磁力搅拌30-60min,离心分离,固体产物冷冻干燥,即得载药聚吡咯/海藻酸钠凝胶。
步骤(1)中所述的海藻酸钠溶液的质量-体积浓度为1.0-3.0g/L。
步骤(2)中所述吡咯单体溶液的质量-体积浓度为8-16g/L,海藻酸钠与吡咯单体质量之比为m海藻酸钠:m吡咯=1:16-3:16。
步骤(3)中所述的药物为乙酰水杨酸、甲氨蝶呤、地塞米松、5-三磷酸腺苷二钠盐中的一种,药物溶液质量-体积浓度为0.1-0.5g/L,药物质量占吡咯单体质量的1%-5%。
步骤(6)中所述的30%H2O2溶液的质量-体积浓度为20-40g/L,30%H2O2与吡咯单体质量之比为m30%H2O2:m吡咯=2:1-3:1。
步骤(6)中所述的聚吡咯/海藻酸钠微球分散液的质量-体积浓度为8-20g/L。
由上述技术方案可知:本发明以天然高聚物海藻酸钠为结构导向剂,首先利用海藻酸钠分子结构中的羧基与吡咯单体中氨基间的静电引力,形成单体复合物,通过原位氧化聚合制备聚吡咯/海藻酸钠微球,再利用海藻酸钠与钙离子间快速的离子交换反应,形成载药聚吡咯/海藻酸钠凝胶。
本发明的有益效果是:
(1)以海藻酸钠、吡咯为主要原料,制备载药聚吡咯/海藻酸钠凝胶,所得凝胶具有pH、电场双重响应。
(2)采用H2O2为氧化剂,避免了载药聚吡咯/海藻酸钠凝胶中残留有毒过硫酸铵、氯化铁等氧化剂的风险。
附图说明
图1实施例1-4不同pH值下,药物释放量(释放时间7days)
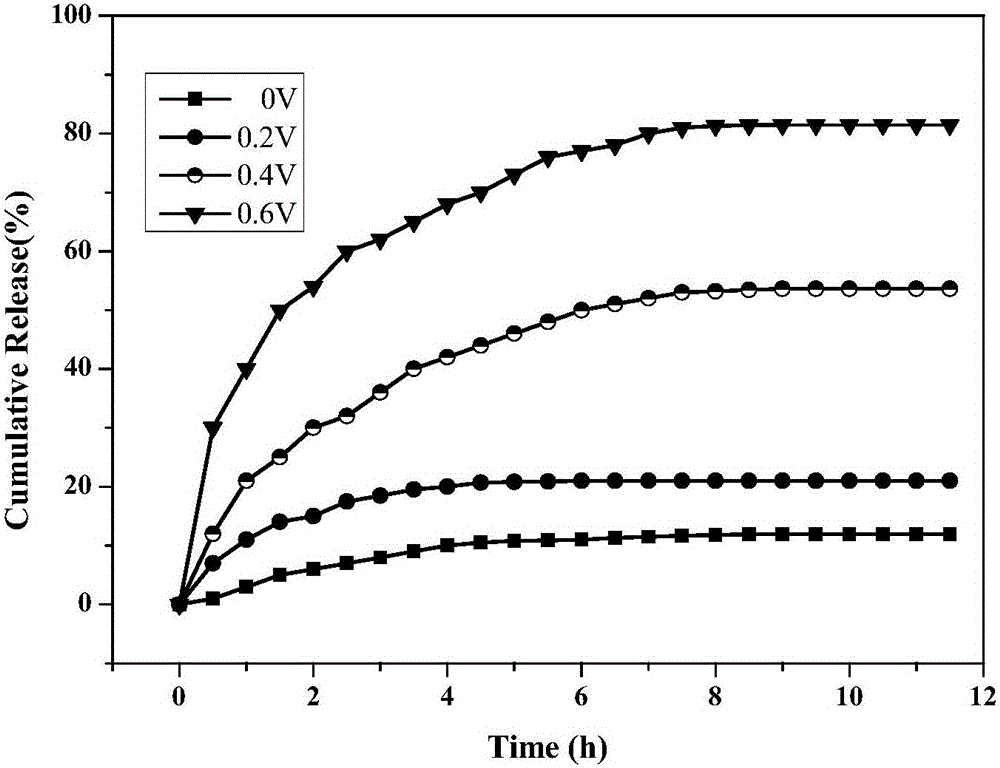
图2实施例1在不同电场强度下累积释放曲线
图3实施例1、比较例1-1、1-2在pH7.4值下累积释放曲线
具体实施方式
下面结合具体的实施例,进一步详细地描述本发明。应理解,这些实施例只是为了举例说明本发明,而非以任何方式限制本发明的范围。
实施例1
(1)将25mg海藻酸钠溶于25mL离子水中,配制海藻酸钠溶液;
(2)将0.4g吡咯单体溶于50mL 1mol/L HCl溶液中,配制吡咯单体溶液;
(3)将4mg乙酰水杨酸溶于40mL 1mol/L HCl溶液中,配制药物溶液;
(4)磁力搅拌下,将步骤(3)配制的药物溶液滴入到步骤(2)所得的吡咯单体溶液中,滴加结束后,搅拌15min;
(5)磁力搅拌下,将步骤(4)所得的溶有药物的吡咯单体溶液逐滴滴加到步骤(1)制得的海藻酸钠溶液中,滴加结束后,超声分散15min;
(6)将0.8g 30%H2O2溶于40mL去离子水中,混合均匀后;冰浴条件下,将H2O2溶液缓慢滴加到步骤(5)所得的混合溶液中,滴加过程中,保持磁力搅拌,滴加结束后,冰浴条件下继续反应24h,反应过程中,保证体系温度不超过5℃,反应结束后,离心分离,固体产物用去离子水洗涤3次后,取0.2g固体产物重新分散在25mL去离子水中,配制质量-体积浓度8g/L聚吡咯/海藻酸钠微球分散液;
(7)配制20mL质量浓度1%的CaCl2溶液,待CaCl2完全溶解后,将20mL步骤(6)所得的聚吡咯/海藻酸钠微球分散液滴加其中,磁力搅拌60min,离心分离,固体产物冷冻干燥,即得载药聚吡咯/海藻酸钠凝胶。
对比例1-1
(1)将25mg海藻酸钠溶于25mL离子水中,配制海藻酸钠溶液;
(2)将0.4g吡咯单体溶于50mL 1mol/L HCl溶液中,配制吡咯单体溶液;
(3)将4mg乙酰水杨酸溶于40mL 1mol/L HCl溶液中,配制药物溶液;
(4)磁力搅拌下,将步骤(3)配制的药物溶液滴入到步骤(2)所得的吡咯单体溶液中,滴加结束后,搅拌15min;
(5)磁力搅拌下,将步骤(4)所得的溶有药物的吡咯单体溶液逐滴滴加到步骤(1)制得的海藻酸钠溶液中,滴加结束后,超声分散15min;
(6)将0.8g 30%H2O2溶于40mL去离子水中,混合均匀后;冰浴条件下,将H2O2溶液缓慢滴加到步骤(5)所得的混合溶液中,滴加过程中,保持磁力搅拌,滴加结束后,冰浴条件下继续反应24h,反应过程中,保证体系温度不超过5℃,反应结束后,离心分离,固体产物用去离子水洗涤3次后,固体产物冷冻干燥,即得载药聚吡咯/海藻酸钠凝胶。
对比例1-2
(1)将25mg海藻酸钠溶于25mL离子水中,配制海藻酸钠溶液;
(2)将4mg乙酰水杨酸溶于40mL 1mol/L HCl溶液中,配制药物溶液;
(3)磁力搅拌下,将步骤(2)配制的药物溶液滴入到步骤(1)所得的海藻酸钠溶液中,滴加结束后,超声分散15min;
(4)配制20mL质量浓度1%的CaCl2溶液,待CaCl2完全溶解后,将步骤(3)所得的海藻酸钠溶液滴加其中,磁力搅拌60min,离心分离,固体产物冷冻干燥,即得载药海藻酸钠凝胶。
实施例2
(1)将75mg海藻酸钠溶于25mL离子水中,配制海藻酸钠溶液;
(2)将0.4g吡咯单体溶于25mL 1mol/L HCl溶液中,配制吡咯单体溶液;
(3)将20mg甲氨蝶呤溶于40mL 1mol/L HCl溶液中,配制药物溶液;
(4)磁力搅拌下,将步骤(3)配制的药物溶液滴入到步骤(2)所得的吡咯单体溶液中,滴加结束后,搅拌30min;
(5)磁力搅拌下,将步骤(4)所得的溶有药物的吡咯单体溶液逐滴滴加到步骤(1)制得的海藻酸钠溶液中,滴加结束后,超声分散25min;
(6)将1.2g 30%H2O2溶于30mL去离子水中,混合均匀后;冰浴条件下,将H2O2溶液缓慢滴加到步骤(5)所得的混合溶液中,滴加过程中,保持磁力搅拌,滴加结束后,冰浴条件下继续反应48h,反应过程中,保证体系温度不超过5℃,反应结束后,离心分离,固体产物用去离子水洗涤5次后,取0.5g固体产物重新分散在25mL去离子水中,配制质量-体积浓度20g/L聚吡咯/海藻酸钠微球分散液;
(7)配制20mL质量浓度3%的CaCl2溶液,待CaCl2完全溶解后,将20mL步骤(6)所得的聚吡咯/海藻酸钠微球分散液滴加其中,磁力搅拌30min,离心分离,固体产物冷冻干燥,即得载药聚吡咯/海藻酸钠凝胶。
实施例3
(1)将50mg海藻酸钠溶于25mL离子水中,配制海藻酸钠溶液;
(2)将0.4g吡咯单体溶于40mL 1mol/L HCl溶液中,配制吡咯单体溶液;
(3)将16mg地塞米松溶于40mL 1mol/L HCl溶液中,配制药物溶液;
(4)磁力搅拌下,将步骤(3)配制的药物溶液滴入到步骤(2)所得的吡咯单体溶液中,滴加结束后,搅拌20min;
(5)磁力搅拌下,将步骤(4)所得的溶有药物的吡咯单体溶液逐滴滴加到步骤(1)制得的海藻酸钠溶液中,滴加结束后,超声分散20min;
(6)将1.0g 30%H2O2溶于40mL去离子水中,混合均匀后;冰浴条件下,将H2O2溶液缓慢滴加到步骤(5)所得的混合溶液中,滴加过程中,保持磁力搅拌,滴加结束后,冰浴条件下继续反应36h,反应过程中,保证体系温度不超过5℃,反应结束后,离心分离,固体产物用去离子水洗涤4次后,取0.25g固体产物重新分散在25mL去离子水中,配制质量-体积浓度10g/L聚吡咯/海藻酸钠微球分散液;
(7)配制20mL质量浓度2%的CaCl2溶液,待CaCl2完全溶解后,将20mL步骤(6)所得的聚吡咯/海藻酸钠微球分散液滴加其中,磁力搅拌45min,离心分离,固体产物冷冻干燥,即得载药聚吡咯/海藻酸钠凝胶。
实施例4
(1)将62.5mg海藻酸钠溶于25mL离子水中,配制海藻酸钠溶液;
(2)将0.4g吡咯单体溶于40mL 1mol/L HCl溶液中,配制吡咯单体溶液;
(3)将12mg 5-三磷酸腺苷二钠盐溶于40mL 1mol/L HCl溶液中,配制药物溶液;
(4)磁力搅拌下,将步骤(3)配制的药物溶液滴入到步骤(2)所得的吡咯单体溶液中,滴加结束后,搅拌25min;
(5)磁力搅拌下,将步骤(4)所得的溶有药物的吡咯单体溶液逐滴滴加到步骤(1)制得的海藻酸钠溶液中,滴加结束后,超声分散18min;
(6)将1.2g 30%H2O2溶于40mL去离子水中,混合均匀后;冰浴条件下,将H2O2溶液缓慢滴加到步骤(5)所得的混合溶液中,滴加过程中,保持磁力搅拌,滴加结束后,冰浴条件下继续反应30h,反应过程中,保证体系温度不超过5℃,反应结束后,离心分离,固体产物用去离子水洗涤4次后,取0.4g固体产物重新分散在25mL去离子水中,配制质量-体积浓度16g/L聚吡咯/海藻酸钠微球分散液;
(7)配制20mL质量浓度2.5%的CaCl2溶液,待CaCl2完全溶解后,将20mL步骤(6)所得的聚吡咯/海藻酸钠微球分散液滴加其中,磁力搅拌45min,离心分离,固体产物冷冻干燥,即得载药聚吡咯/海藻酸钠凝胶。
- 还没有人留言评论。精彩留言会获得点赞!