利用MFG‑E8的用于预防或者治疗组织纤维化的组合物的制作方法
本发明涉及一种通过乳脂肪球表皮生长因子8蛋白(MFG-E8,Milk fatglobule-EGF factor 8)的纤维化减少效果来使用于预防或者治疗组织纤维化的MFG-E8的用途,所述乳脂肪球表皮生长因子8蛋白(MFG-E8)为从间充质干细胞中得到分泌的蛋白质。
背景技术:
在针对由间充质干细胞(Mesenchymal Stem Cell)向肝细胞分化的研究的情况下,虽然在早期报告了中胚层间充质干细胞超出胚层的发生学上的局限性并具有向内胚层肝细胞分化转化(transdifferentiation)的可能性,但是最近提出了如下可能性:根据积累的研究结果,其不是分化转化的结果,而是通过间充质干细胞被移植后分泌的活性因子来抑制宿主组织内的肝细胞的死亡,受损的宿主肝组织本身的再生可得到促进(paracrine effects)。
利用干细胞来进行细胞治疗的适应症中,导致肝功能损害的原因有包含C型肝炎(hepatitis C)的病毒性肝炎、脂肪肝、酒精性肝病、肝癌、急性/慢性肝硬化、遗传性代谢病(inherited metabolic diseases)以及胆管疾病(bile duct disease)或者遗传肝功能损伤等各种疾病。
最近,从干细胞分泌的蛋白质参与到各种组织的再生及免疫调节的证据正在被积累。目前蛋白质医药品市场在生命工程领域中迅速成为代表性的前景明朗的产业,与由通过消化器官的吸收来对全身产生影响的化学合成医药品相比,治疗效果高且副作用少,与现有化学合成医药品相比,在市场价值上具有如下优点:开发期间短,同时价格维持得高。由此,与细胞治疗剂一起,在挖掘从干细胞以及被分化的细胞分泌并对组织再生及重构起重要作用的分泌蛋白质的新功能的情况下,经过用于强化功能性及稳定性的蛋白质工程工艺,存在开发为高附加价值的蛋白质医药品的可能性。
针对在各种组织中间充质干细胞的旁分泌(paracrine)效果的报告正在进行。但是,针对被分泌的物质的详细的机理(mechanism)鲜为人知,并且针对从间充质干细胞分化的细胞的特性仍存在争议,因此将间充质干细胞或者被分化的细胞直接作为治疗剂使用会受制约。由此趋势为,与直接利用细胞的治疗剂相比,利用从其中分泌的物质的治疗剂挖掘更众所瞩目。
肝纤维化是由ECM(细胞外基质,extra cellular matrix)非正常地积累而产生的疾病,可发展为肝硬变或者肝癌。如果出现肝纤维化,则从受损的肝细胞或者血管细胞分泌的趋化因子(chemokine)使得巨噬细胞聚集,同时由于分泌的TGFβ,在肝组织内存在的肝星状细胞(hepatic stellate cell)成为肌纤维母细胞样细胞(myofibroblast-like cell),从而进行ECM生产,但是针对对此进行预防及治疗的物质或者方法尚未众所周知。
此外,肾脏纤维化指的是肾脏的组织以及/或者血管变硬的症状,肺纤维化或者肺纤维症作为以弥散性纤维在肺泡壁上的增值为特征、以干性咳嗽或在劳动时呼吸困难为主要症状的疾病而被众所周知。
干细胞或者从干细胞得到分化的细胞被移植后,用各种分泌因子对与细胞替代效应(repopulation by donor cells)一起被损伤的组织周围进行刺激,从而暗示将有助于宿主组织自身的再生及修复(regeneration of host tissue)的可能性,但是实情为与此相关的研究到目前为止还非常少。进一步,到目前为止还没有得知针对能够根本上治疗疾病本身的纤维化的治疗剂。
MFG-E8蛋白质是从哺乳动物中发现的蛋白质,不仅包括精氨酸(arginine)-甘氨酸(glycine)-天冬氨酸(aspartic acid)模序(motif),而且还包括磷脂酰丝氨酸(phosphatidylserine)结合结构域(domain),从而能够与整合素(integrin)相结合。MFG-E8已被众所周知为具有如下特征:通过与露出在细胞死亡细胞的表面的磷脂酰丝氨酸相结合而具有细胞死亡细胞的调理素作用,通过与处于吞噬细胞表面的整合素的结合而具有对死细胞的吞噬进行介导的功能,并且有助于去除被积累的胶原(collagen)。此外,针对抑制肠内上皮细胞的死亡且减少损伤的同时参与到新生血管的形成进行了研究。此外,有报告称在从人类胚胎干细胞中被诱导分化的肝细胞中提高高的表达率,促进肝细胞增殖及血管再生,从而可使用于肝再生及肝病改善(参照专利文献1)。但是实情为没有针对在肝组织内肝纤维化或者除此之外的其他组织内纤维化阶段中产生何种影响的报告。
技术实现要素:
本发明的目的在于,弄清对在间充质干细胞中得到诱导分化的肝细胞中被分泌的分泌蛋白质组(secretome)蛋白质的纤维化产生的效果,并且以所述分泌蛋白质组蛋白质中的其中一个的MFG-E8的纤维化抑制效果为基础提供一种用于预防或者治疗组织纤维化的药剂学上的用途。
本发明的另一个目的在于,提供一种所述MFG-E8和从间充质干细胞中得到诱导分化的肝细胞的作为用于治疗组织纤维化的细胞治疗剂的用途。
本发明的又另一个目的在于,提供一种通过所述MFG-E8的表达或者分泌水平的测量对用于预防或者治疗组织纤维化的医药进行筛选(screening)的方法。
本发明的又另一个目的在于,提供一种通过在间充质干细胞中MFG-E8得到增加的表达或者分泌水平的测量或决定对组织纤维化治疗效能得到改善的间充质干细胞进行筛选的方法。
为了实现所述目的,本发明提供一种包含乳脂肪球表皮生长因子8蛋白(MFG-E8,Milk fat globule-EGF factor 8)的用于预防或者治疗组织纤维化的组合物。
本发明还提供一种用于制造用于预防或者治疗组织纤维化的药剂学组合物的MFG-E8的用途。
本发明还提供一种包括将药学中有效剂量的MFG-E8投入于个体的步骤的组织纤维化的治疗方法。
本发明还提供一种包含从间充质干细胞中得到诱导分化的肝细胞的分泌蛋白质组(secretome)的用于预防或者治疗组织纤维化的组合物。
本发明还提供一种从用于制造用于预防或者治疗组织纤维化的药剂学组合物的间充质干细胞中得到诱导分化的肝细胞的分泌蛋白质组的用途。
本发明还提供一种包括将从间充质干细胞中得到诱导分化的肝细胞的分泌蛋白质组投入于个体的步骤的组织纤维化的治疗方法。
本发明还提供一种包括MFG-E8以及
肝细胞的用于治疗组织纤维化的细胞治疗剂。
本发明还提供一种用于预防或者治疗组织纤维化的医药的筛选方法,其包括如下步骤:使得从间充质干细胞得到诱导分化的肝细胞的分泌蛋白质组或者MFG-E8与候选药物接触;以及对所述候选药物是否使得MFG-E8的表达或者分泌水平增加进行测量,从而将所述候选药物判定为用于预防或者治疗组织纤维化的医药。
本发明还提供一种组织纤维化治疗效能得到改善的间充质干细胞的筛选方法,其包括如下步骤:与正常间充质干细胞进行对比,对任意的间充质干细胞的MFG-E8的表达或者分泌水平是否增加进行测量或者决定。
本发明减少通过TGFβ/Smad信号传递通路被诱导的胶原的表达,特别是,起到抑制肝星状细胞的活性而使得肝纤维化好转的作用,在肝纤维化疾病模型中使得肝纤维化程度减少,如果在体外培养的肝星状细胞上进行处理,则以使得活性化得到抑制的MFG-E8蛋白质的特性为基础,可使用于肝、肺、肾、脑、心脏或者横隔膜等的组织纤维化的预防或者治疗。
此外,从间充质干细胞得到诱导分化的肝细胞与所述MFG-E8一起可用作用于治疗组织纤维化的细胞治疗剂。
附图说明
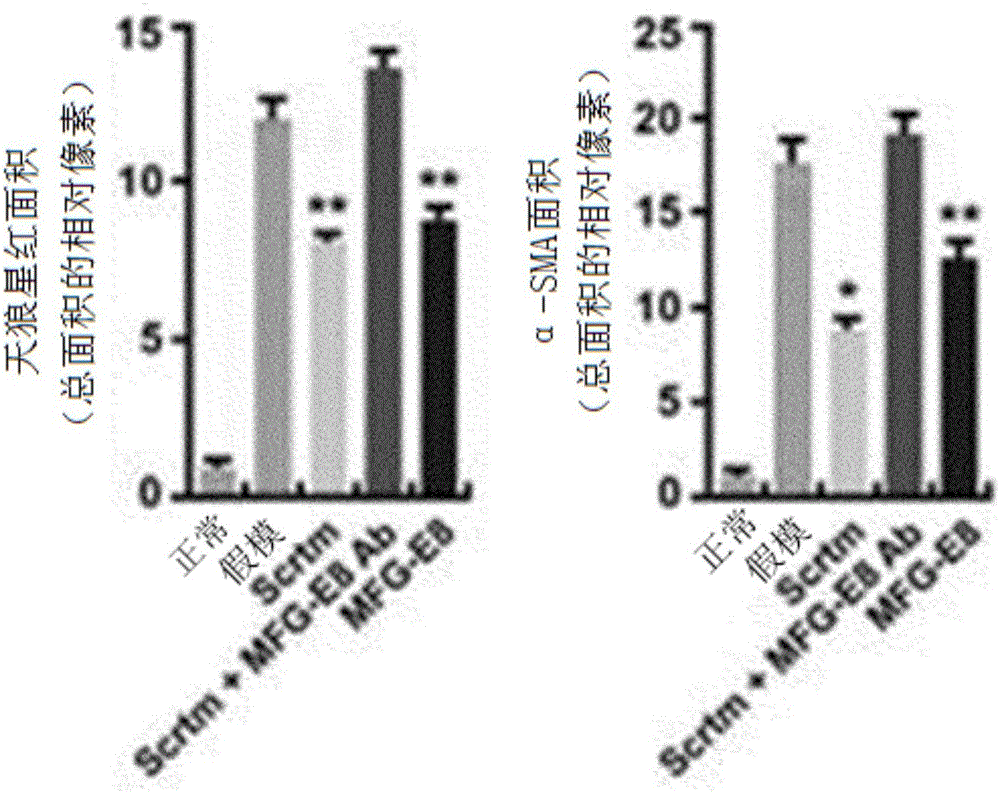
图1a是使用hpUCMSC分泌蛋白质组、用MFG-E8抗体对hpUCMSC分泌蛋白质组进行处理后的分泌蛋白质组以及MFG-E8合成蛋白质来分别对慢性肝病小鼠模型进行处理,从而通过H&E、天狼星红(Sirius Red)以及MT染色来对肝组织的结构以及纤维化程度进行比较的照片图,图1b是用图表来表示在所述图1a中确认的结果,图1c是在慢性肝病小鼠模型中用不同浓度的MFG-E8蛋白质进行处理,并且用天狼星红来对胶原积累进行确认的结果,图1d是在肝纤维化小鼠模型中进行如所述图1c一样的实验的结果,图1e是表示用光学显微镜对所述图1d的结果进行观察的照片图。
图2a是用TGFβ1(转化生长因子-β,transforming growth factor-β)使得作为肝星状细胞株的hTert-HSCs活性化后,用饰胶蛋白聚糖(decorin)、PEDF(色素上皮源性因子,pigment epithelium-derived factor)以及MFG-E8的3种合成蛋白质进行处理,从而表示α-SMA(α-平滑肌肌动蛋白,α-smooth muscle actin)的表达的照片图,图2b是用蛋白质印迹(Western blot)来表示所述图2a的结果的照片图,图2c是用3种蛋白质抗体对hpUCMSC分泌蛋白质组进行处理,从而使得蛋白质的活性降低后,对肝星状细胞(HSCs)的活性进行确认的结果,图2d是在人类初代培养的HSCs(人类原代肝星状细胞,Human primary HSCs)中用3种蛋白质进行处理,从而对α-SMA的表达进行确认的结果,图2e是用不同浓度的MFG-E8对hTert-HSCs进行处理的结果,图2f是用不同浓度的MFG-E8对人类初代培养的HSCs进行处理的结果,图2g是在各种间充质干细胞分泌蛋白质组中对MFG-E8蛋白质的表达进行确认的结果,图2h是表示通过ELISA对所述图2g的结果进行确认的结果。
具体实施方式
以下,对本发明的构成进行具体说明。
本发明涉及一种包含乳脂肪球表皮生长因子8蛋白(MFG-E8)的用于预防或者治疗组织纤维化的组合物。
此外,本发明提供一种用于制造用于预防或者治疗组织纤维化的药剂学组合物的MFG-E8的用途。
所述组织纤维化是由于在肺、肾、肝、脑、心脏或者横隔膜组织等中通过TGFβ/Smad信号传递通路而引起的细胞外基质(ECM)的积累而产生的,MFG-E8抑制通过TGFβ/Smad信号传递通路被诱导的胶原的表达,或者抑制肝星状细胞的活性化,从而使得肝纤维化减少。
更加具体地,根据本发明的一个具体例,将从间充质干细胞得到诱导分化的肝细胞的分泌蛋白质组投入于慢性肝病小鼠模型的结果为,作为肝组织标志物的α-SMA(平滑肌肌动蛋白,Smooth Muscle Actin)的表达变少,纤维化变少。为了确认所述肝细胞的分泌蛋白质组的肝纤维化抑制效果,用MFG-E8蛋白质的抗体对分泌蛋白质组进行处理后投入于慢性肝病小鼠模型的结果为,未产生α-SMA表达变少的效果。以此为基础,将MFG-E8合成蛋白质投入于慢性肝病小鼠模型的结果为,可确认到与肝细胞的分泌蛋白质组类似的α-SMA表达变少的效果。此外,MFG-E8蛋白质的投入使得胶原的积累减少,所述减少效果通过MFG-E8的浓度依赖性方式呈现。并且,MFG-E8蛋白质在肝纤维化小鼠模型中也呈现纤维化减少效果。
其次,用TGFβ1使得肝星状细胞株活性化后,用饰胶蛋白聚糖、PEDF(色素上皮源性因子,Pigment Epithelium-Derived Factor)以及MFG-E8蛋白质进行处理的结果为,α-SMA的表达变少,用MFG-E8蛋白质的抗体对从间充质干细胞得到诱导分化的肝细胞的分泌蛋白质组进行处理,从而使得蛋白质的活性减少后,对肝星状细胞(HSC)进行处理,并且对HSC的活性化进行确认的结果为,α-SMA的表达变高,在用MFG-E8蛋白质进行处理的情况下,在HSC中α-SMA的表达以浓度依赖性方式变少,据此可得知MFG-E8蛋白质抑制肝纤维化。
此外,MFG-E8在各种间充质干细胞,例如,脐带间充质干细胞(Umbilical Cord Mesenchymal Stem Cell;UCMSC)、乳牙牙髓干细胞(Stem cells from Human Exfoliated Deciduous teeth;SHED)、骨髓干细胞(Bone Marrow Stem Cell;BMSC)等的分泌蛋白质组或者从所述干细胞中得到诱导分化的肝细胞的分泌蛋白质组中得到表达,但是在人类胚胎干细胞中没有得到表达。
由此,MFG-E8可以通过纤维化抑制功能来用作预防或者治疗组织纤维化的用途。
所述MFG-E8包括天然型或者重组MFG-E8,或与它们实质上具有同等的生理活性的蛋白质。在实质上具有同等的生理活性的蛋白质中包括天然型/重组MFG-E8、功能等同物(functional equivalent)以及功能衍生物(functional derivative)。
所述“功能等同物”是指,作为在天然型蛋白质氨基酸中一部分或者全部被取代,或氨基酸的一部分缺失或者附加的氨基酸序列变形体,实质上与天然型MFG-E8具有同等的生理活性。
"功能衍生物"是指,作为为了使得所述MFG-E8蛋白质的物理化学性质增加或者减少而施加了变形的蛋白质,实质上与天然型MFG-E8具有同等的生理活性。
所述MFG-E8可以是来源于人类、小鼠、大鼠(rat)等的哺乳动物的蛋白质。
此外,所述MFG-E8可以在公知的序列,例如公开于基因库(GenBank)NM_005928的人类MFG-E8的序列的基础上通过从业者所公知的遗传工程方法来制造。
重组MFG-E8可以通过通常的柱色谱法(column chromatography)等来分离,蛋白质的精制程度可以通过十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-polyacrylamide gel electrophoresis(PAGE))等来确认。
本发明还涉及一种包含从间充质干细胞得到诱导分化的肝细胞的分泌蛋白质组的用于预防或者治疗组织纤维化的组合物。
此外,本发明提供一种用于制造用于预防或者治疗组织纤维化的药剂学组合物的从间充质干细胞得到诱导分化的肝细胞的分泌蛋白质组的用途。
根据本发明,从间充质干细胞得到诱导分化的肝细胞的分泌蛋白质组包含所述MFG-E8,从而从间充质干细胞得到诱导分化的肝细胞的分泌蛋白质组可使用于预防或者治疗组织纤维化。
所述"分化"是对使得结构和形态从干细胞变化为特定细胞的过程的统称,是指使得适于执行各个功能的结构和形态变化的过程。所述分化包括自发的分化以及诱导分化。从所述干细胞向特定细胞的诱导分化可使用公知于所属领域的各种方法或者应用所述方法来得到执行。
所述"分泌蛋白质组"通常意味着从细胞、组织、器官、生物体中分泌出来的有机以及无机要素的混合,更为具体地,指代分泌的蛋白质,本发明的从间充质干细胞得到诱导分化的肝细胞的分泌蛋白质组包含MFG-E8。
所述分泌蛋白质组可通过使得间充质干细胞在血清培养基中分化并培养一定时间后使得培养物浓缩来得到,但是并非限于此。
就利用所述MFG-E8蛋白质和肝细胞的用于治疗肝、肺或者肾的纤维化的细胞治疗剂而言,除了肝、肺或者肾的纤维化以外,在脑、心脏、横隔膜等产生的纤维化症也是因为通过TGF-β而得到活性化的星状细胞(myofibroblast,成肌纤维细胞)引起的,因此从从所述间充质干细胞得到诱导分化的肝细胞的分泌蛋白质组也可以使用于脑、心脏、横隔膜等纤维化治疗中。
由此,所述组织纤维化可以是在肺、肾、肝、脑、心脏或者横隔膜中任意一个组织中产生的纤维化。
本发明的用于预防或者治疗组织纤维化的组合物还可包括在药剂学上可允许的载体。
在所述药剂学上可允许的载体包括在医药领域中通常使用的载体以及媒介物(vehicle),具体包括离子交换树脂(ion exchange resin)、氧化铝(alumina)、硬脂酸铝(aluminum stearate)、卵磷脂(lecithin)、血清蛋白质(例如,人血清白蛋白(albumin))、缓冲物质(例如,各种磷酸盐(phosphate)、甘氨酸(glycine)、山梨酸(sorbic acid)、山梨酸钾(potassium sorbate)、饱和植物脂肪酸的部分甘油酯(glyceride)混合物)、水、盐或者电解质(例如,鱼精蛋白硫酸盐(protamine sulfate)、磷酸氢二钠(Disodium hydrogen phosphate)、磷酸氢二钾(acid potassium phosphate)、氯化钠(sodium chloride)以及锌盐(zinc salt))、胶体二氧化硅(silica)、硅酸镁(magnesium silicate)、聚乙烯吡咯烷酮(polyvinyl pyrrolidone)、纤维素(cellulose)基质、聚乙二醇(polyethylene glycol)、羧甲基纤维素钠(sodium carboxymethylcellulose)、聚芳酯(polyarylate)、蜡(wax)、聚乙二醇(polyethylene glycol)或者羊毛脂(wool grease)等,但并非限于此。
此外,本发明的组合物除了所述成分以外,可额外包括润滑剂、润湿剂、乳化剂、悬浮剂或者保存剂等。
作为一个样态,根据本发明的组合物可以通过用于肠胃外投药(parenteral administration)的水溶性溶液来制造,优选地,可以使用Hank's溶液(Hank's solution)、林格氏溶液(Ringer's solution)或者如以物理的形式缓冲的盐水一样的缓冲溶液。水溶性注入(injection)悬浮剂可添加如羧甲基纤维素钠、山梨醇(sorbitol)或者葡聚糖(dextran)一样能够使得悬浮液的粘度增加的基质。
本发明的组合物可以用药于全身或者局部,为了如上所述的用药,可以用公知的技术制剂化为适当的剂型。例如,在口服给药(oral administration)时,可以通过与惰性稀释剂或者食用载体混合,或者密封于硬质或软质胶囊(gelatin capsule)或者以片剂形式压制成型来投入。在用于口服给药的情况下,活性化合物与赋形剂(excipient)混合后可以以吸收型锭剂、颊侧锭剂、片剂(troche)、胶囊(capsule)、酏剂(elixir)、混悬剂(suspension)、糖浆(syrup)、薄片等形态使用。
用于注射、肠胃外用药等的各种剂型可以根据所属技术领域公知的方法或者通用的方法制造。MFG-E8容易溶解于食盐水或者缓冲溶液,因此在以冷冻干燥状态保管后,将有效剂量的MFG-E8以适于静脉内注入、皮下注入、肌肉注入、腹腔注入、经皮给药(dermal administration)等的形态投入食盐水或者缓冲液之前,也可以制成溶液后用药。
本发明的组合物的适当的用药量根据如制剂化方法、用药方式、患者年龄、体重、性别、病状、饮食、用药时间、用药路径、排泄速度以及反应灵敏性一样的因素可不同地进行处方。例如,就本发明的组合物的投入量而言,成人一日可投入0.1至1000mg/㎏的量,优选地,一日一次至数次可投入10至100mg/㎏的用量。
本发明还提供一种包括将药学中有效剂量的MFG-E8投入至个体的步骤的组织纤维化的治疗方法。
此外,本发明提供一种包括将从间充质干细胞中得到诱导分化的肝细胞的分泌蛋白质组投入至个体的步骤的组织纤维化的治疗方法。
在所述组织纤维化的治疗方法中所使用的MFG-E8或者从间充质干细胞中得到诱导分化的肝细胞的分泌蛋白质组以及投入方法遵循如上所述的药学组合物的基准和投入方法,因此为了避免本说明书的不必要的复杂性,省略它们两个之间的共同内容。
所述个体可以是狗、猫、老鼠、人等,但是并非限于此。
所述组织纤维化可以是在肺、肾、肝、脑、心脏或者横隔膜中任意一个组织中产生的纤维化。
本发明还涉及一种包括MFG-E8以及
肝细胞的用于治疗组织纤维化的细胞治疗剂。
所述细胞治疗剂在通过肝细胞的细胞移植来治疗组织纤维化时,可更加提高治疗效果。
就这个方面来说,所述肝细胞可以是从间充质干细胞得到诱导分化的肝细胞,但并非特别限于此。
所述从间充质干细胞得到诱导分化的肝细胞可以与“肝细胞-类似细胞”或者“类似肝细胞”术语混合而使用。
由此,可用作通过利用MFG-E8和肝细胞的细胞治疗疗法来治疗肝、肺或者肾纤维化的细胞治疗剂。并且,在脑、心脏、横隔膜等中产生纤维化症也是因为通过TGF-β而活性化的星状细胞(myofibroblast,成肌纤维细胞)而引起的,因此也可以通过利用所述MFG-E8和肝细胞的细胞治疗疗法来使用于脑、心脏、横隔膜等纤维化治疗中。
本发明还涉及一种用于预防或者治疗组织纤维化的医药筛选方法,其包括如下步骤:使得从间充质干细胞得到诱导分化的肝细胞的分泌蛋白质组或者MFG-E8与候选药物接触;以及对所述候选药物是否使得MFG-E8的表达或者分泌水平增加进行测量,从而将所述候选药物判定为用于预防或者治疗组织纤维化的医药。
所述候选药物可根据通常的选定方式推定为在MFG-E8基因序列中促进或者抑制向mRNA(Messenger RNA,信使核糖核酸)、蛋白质的转录、转译的物质或者具有作为增进或者抑制MFG-E8蛋白质的功能或者活性的医药的可能性的物质或者可以是任意被选定的个别核酸、蛋白质、肽(peptide)、其他提取物或者天然物、化合物等。
此后,在得到候选药物处理的细胞中可测量MFG-E8基因的表达量、蛋白质的量或者蛋白质的活性,测量结果为,如果测量到所述MFG-E8基因的表达量、蛋白质的量或者蛋白质的活性得到增加,则可判断所述候选药物为能够治疗或者预防组织纤维化的物质。
在以上测量基因的表达量、蛋白质的量或者蛋白质的活性的方法可以通过公知于所属领域的各种方法来执行,但是,例如,并非限于此,可以利用逆转录聚合酶链反应(reverse transcriptase-polymerase chain reaction)、实时聚合酶链反应(real time-polymerase chain reaction)、蛋白质印迹(western blot)、诺瑟杂交(northern blot)、酶联免疫吸附测定(ELISA,enzyme linked immunosorbent assay)、放射免疫分析(RIA:radioimmunoassay)、放射免疫扩散法(radioimmunodiffusion)以及免疫沉淀分析法(immunoprecipitation assay)等来执行。
如上所述的组织纤维化治疗剂候选物质在以后的组织纤维化治疗剂开发过程中起作为先导物质(leading compound)的作用,先导物质使其结构变形并进行最佳化以便能够产生促进MFG-E8基因或者从其中表达的蛋白质的功能的效果,从而可开发新的组织纤维化治疗剂。
在本发明中,与基因工程技术相关的事项通过公开于Sambrook等的文献(Sambrook等,Molecular Cloning,A Laboratory Manual,Cold Spring Harbor laboratory Press,Cold Spring Harbor,N.Y.(2001))以及Frederick等的文献(Frederick M.Ausubel等,Current protocols in molecular biology volume 1,2,3,John Wiley&Sons,Inc.(1994))的内容变得更加清楚。
本发明还涉及一种组织纤维化治疗效能得到改善的间充质干细胞的筛选方法,其包括如下步骤:相比于正常间充质干细胞,对任意的间充质干细胞的MFG-E8的表达或者分泌水平的增加与否进行测量或决定。
本发明首次公开治疗组织纤维化的间充质干细胞的有效成分是从其中分泌的MFG-E8,MFG-E8的表达或者分泌水平增加的间充质干细胞可视为组织纤维化治疗效能得到了改善。
由此,间充质干细胞内MFG-E8的表达或者分泌水平可以以用于改善使用于组织纤维化的治疗的间充质干细胞的药理治疗效果的基准起作用。
以下,通过根据本发明的实施例对本发明进行更加详细说明,但是本发明的范围并非受以下提出的实施例的限制。
<实施例1>制造从间充质干细胞得到分化的肝细胞的培养液
在本实验中使用的间充质干细胞来源于脐带血,为了向肝细胞的分化,以3×104cell/cm2的形式附着于涂覆有胶原的培养皿。
作为基本培养基使用了MesenPro RSTM培养基(medium)(Gibco)。如果培养皿填充了70-80%,则将表皮生长因子(Epidermal growth factor)(EGF;Peprotech EC Ltd,London,England,20ng/mL)和碱性成纤维生长因子(basic fibroblast growth factor)(bFGF;Peprotech EC Ltd,10ng/mL)放入作为第一个分化培养基的基础培养基Iscove氏改良的Dulbecco氏培养基(Iscove's modified Dulbecco's medium)(IMDM;Invitrogen,Carlsbad,CA,USA)并培养两天。
此后,将肝细胞生长因子(hepatocyte growth factor)(HGF;Peprotech EC Ltd,20ng/mL)、bFGF(10ng/mL)、烟酰胺(nicotinamide)(Sigma,0.61g/L)、1%胰岛素-转铁蛋白-硒(ITS)预混剂(insulin-transferrin-selenium(ITS)premix)(Invitrogen)添加于作为第二个分化培养基的基础培养基IMDM,并培养十天。
最后,将抑癌蛋白M(oncostatin M)(Peprotech EC Ltd,20ng/mL)、地塞米松(dexamethasone)(Sigma,1μmol/L)、1%ITS放入基础培养基IMDM并重新培养十天。
为了获得被分化的间充质干细胞的分泌蛋白质组,将0.05%的FBS(胎牛血清,fetal calf serum)添加于基础培养基IMDM并培养24小时后,利用3-kDa截止滤光片超滤装置(3-kDa cut off filter ultrafiltration units)(Millipore)浓缩了25倍。
<实施例2>在慢性肝病模型以及肝纤维化模型中MFG-E8的效果实验
为了诱发慢性肝病,将硫代乙酰胺(Thioacetamide)(TAA)以200mg/kg体重的形式稀释于食盐水后对5~6周大的老鼠(C57BL/C)进行腹腔注射。1周3次共8周反复进行了腹腔注射。经过8周后,通过Bradford分析(Bradford assay)对浓缩的分泌蛋白质组的蛋白质进行定量,之后,腹腔注射了500μg的量。在注入分泌蛋白质组后,经过3日和7日后,对老鼠的肝纤维化程度进行了分析。将160μg/kg体重作为基本投入了MFG-E8蛋白质(R&D systems,试剂盒),为了确认不同浓度的效果,将32μg/kg体重设定为低浓度,将160μg/kg体重设定为中间浓度,将800μg/kg体重设定为高浓度,并投入于腹腔。在投入MFG-E8蛋白质后,经过3日后,对肝纤维化程度进行了分析。
其次,为了诱发肝纤维化,将四氯化碳(CCl4)在橄榄油中稀释为10%后,对5~6周大的老鼠(BALB/c)以100μg/20g体重的形式进行了腹腔注射。1周2次共6周反复进行了腹腔注射。此后,分泌蛋白质组注入和MFG-E8蛋白质投入利用如通过TAA而确立的慢性肝病模型一样的方法来执行。
此外,为了确认肝组织的纤维化程度,使得肝组织固定于4%的多聚甲醛(paraformaldehyde)。将所述肝组织固定于石蜡(paraffin)并以组织切片的形式获得后,执行H&E(苏木精—伊红染色法,hematoxylin-eosin staining)、马松三色(Masson's trichrome)、天狼星红(sirius red)染色,并在光学显微镜下进行了观察。
为了马松三色(Masson's trichrome)染色,在使得通过石蜡(paraffin)固定而获得的组织切片经过清蜡(deparaffin)过程而重新固定于布安(Bouin)液后,在魏格特苏木精/比布列西猩红-酸性复红-苯胺蓝(Weigert hematoxylin/Biebrich scarlet-acid fuchsin-aniline blue)液或者2%淡绿(light green)染色后进行了观察。被纤维化的组织显示为蓝色,细胞质、肌肉、角蛋白(keratin)显示为红色,细胞核显示为黑褐色。
为了天狼星红染色,使得通过石蜡固定而获得的组织切片经过清蜡过程并用苏木精(hematoxylin)对核进行染色后,用苦酸味-天狼星红(picro-sirius red)染色剂进行了1小时染色。肝纤维化被诱发的部分显示为红色。
为了免疫荧光染色,使得通过石蜡固定而获得的组织切片经过清蜡过程并用10%驴血清(donkey serum)进行阻滞(blocking)后,放入α-SMA(α-平滑肌肌动蛋白,α-smooth muscle actin)和F4/80抗体进行了反应。此后,放入附着有荧光标记的二次抗体并进行反应后,用荧光显微镜进行了观察。
染色结果为,在组织中可以确认到由于胶原积累而产生的纤维化。
此外,使用hpUCMSC分泌蛋白质组、用MFG-E8抗体对hpUCMSC分泌蛋白质组进行处理的分泌蛋白质组以及MFG-E8合成蛋白质来分别对利用TAA而制造的慢性肝病小鼠模型进行处理,并通过H&E、天狼星红(Sirius Red)以及MT进行染色来对肝组织的结构以及纤维化程度进行比较,其结果为,用hpUCMSC分泌蛋白质组和MFG-E8蛋白质进行处理的组中纤维化显著减少了。用MFG-E8抗体进行处理的组进行了比假模组(sham)更加严重的纤维化。α-SMA的表达也是相比于假模组在用hpUCMSC分泌蛋白质组和MFG-E8蛋白质进行处理的组中减少了(图1a以及1b)。此时,通过对照组确认了作为巨噬细胞的标志物(maker)的F4/80,但是没有显示各个组的差异。
用MFG-E8蛋白质以不同的浓度对所述慢性肝病小鼠模型进行处理,并用天狼星红对胶原积累进行了确认,其结果为,与假模组相比纤维化减少了(图1c)。
并且,在肝纤维化小鼠模型投入分泌蛋白质组和MFG-E8蛋白质的实验结果为,如图1d以及1e所示,与假模组相比纤维化减少了。
<实施例3>在肝星状细胞株(hTert-HSCs)以及初代培养肝星状细胞(primary HSCs)中MFG-E8的效果实验
利用肝星状细胞株以及初代培养的肝星状细胞对分泌蛋白质组的体外(In-vitro)效果进行了实验。为此,肝星状细胞株在基础培养基DMEM(dulbecco's modified eagle medium)添加10%FBS和100单位的盘尼西林(penicillin)、100μg的链霉素(streptomycin)的培养液中进行了培养。在进行实验时,为了制作去活化的肝星状细胞株,在基础培养基DMEM添加0.2%FBS的培养液中培养了24小时后,在相同的培养基中以10ng/mL的形式用TGFβ1蛋白质进行处理,从而使得肝星状细胞株活性化。在实验中使用的MFG-E8蛋白质以基本上达到500ng/mL的形式与TGFβ1蛋白质一起进行处理并培养了48小时。当以不同的浓度进行处理时,以成为100ng/mL、250ng/mL、500ng/mL、1μg/mL、5μg/mL的形式进行了培养。为了使得分泌蛋白质组内蛋白质中和,以使得抗体的浓度成为20μg/mL的形式与分泌蛋白质组混合后在常温下放置1小时后进行了使用。
在初代培养的肝星状细胞的情况下在SteCM(ScienCell)培养液中进行基本培养,此后,进行实验,在与肝星状细胞株相同的条件下进行了培养。
图2a是用TGFβ1使得hTert-HSCs活性化后,用三种合成蛋白质进行处理,其结果为,在无血清状态下肝星状细胞株被去活化,从而观察到薄又细形状的细胞,但是用TGFβ1进行处理,则以宽扁的形状被活性化,从而α-SMA表达变高。此时,当用饰胶蛋白聚糖、PEDF以及MFG-E8进行处理时,均使得α-SMA的表达减少。在蛋白质印迹结果中也确认到类似的结果(图2b)。
此外,用各个蛋白质的抗体对hpUCMSC分泌蛋白质组进行处理并使得蛋白质的活性减少后,对HSCs的活性进行确认,其结果为,与没有用抗体进行处理的hpUCMSC分泌蛋白质组相比,α-SMA的表达变高(图2c)。对在人类初代培养的HSCs中是否也显示如3种蛋白质一样的效果进行确认,其结果为,用MFG-E8进行处理的组中α-SMA的表达得到显著减少(图2d)。
用MFG-E8以不同的浓度对hTert-HSCs进行处理,其结果为,出现了浓度依赖性减少的现象(图2e),用MFG-E8以不同的浓度对人类初代培养的HSCs进行处理,其结果为,确认到出现了浓度依赖性减少的现象(图2f)。
<实施例4>利用蛋白质印迹以及ELISA(酶联免疫吸附测定,enzyme-linked immuno sorbent assay)来确认MFG-E8蛋白质表达
为了确认肝星状细胞株的活性化程度,提取蛋白质并进行了蛋白质印迹。利用含有蛋白酶抑制剂(proteinase inhibitor)的RIPA缓冲液来提取了细胞的蛋白质。利用SDS-PAGE凝胶(gel)来对各个组的40μg蛋白质进行分离后,转移到聚偏二氟乙烯转移膜(polyvinylidene fluoride transfer membrane)。利用丽春红S(Ponceau S)溶液来确认了蛋白质是否成功地转移到膜。此后,在TBS-T缓冲液添加5%脱脂乳(skimmilk)的溶液中在常温下进行阻滞后,将膜在含有α-SMA以及MFG-E8、GAPDH的各个抗体的溶液中冷藏放置一个晚上。此后,将符合各个抗体的二次抗体在常温下进行1个小时反应后,利用化学发光试剂盒(chemiluminescence kit)来确认了相应蛋白质的表达。
在MFG-E8蛋白质的ELISA实验的情况下,使用了在Cusabio销售的人类MFG-E8酶联免疫试剂盒(ELISA kit)。
如图2g所示,MFG-E8蛋白质在各种干细胞(脐血间充质干细胞(UCMSC)、脱落乳牙干细胞(SHED)、骨髓干细胞(BMSC))和从所述干细胞中得到诱导分化的肝细胞(hpUCMSCs、hpSHEDs、hpBMSCs)的分泌蛋白质组中得到表达,但是胚胎干细胞中没有得到表达。酶联免疫吸附(ELISA)分析结果也显示了与此相同的结果(图2h)。
产业上利用可能性
本发明可在预防或者治疗组织纤维化的领域使用。
- 还没有人留言评论。精彩留言会获得点赞!