长效药物递送装置及其在避孕中的用途的制作方法
本发明进一步涉及此类具有降低的初期“突释”的长效药物递送装置的制造方法,改变含有两种药用活性药物(A)和(B)的长效药物递送装置的释放特性的方法,以及此类药物递送装置在避孕和妇科治疗中的用途。
引言
由于易于使用且避孕可靠性高,激素类避孕药被使用者广泛接受。其中,口服避孕(口服避孕药)在许多国家是最常用的避孕方法。但是,需要开发新的长效可逆避孕药(LARC),其与口服避孕药相比需要最少的医学指导和患者依从性。新的LARC如宫内避孕器(IUD)(例如Mirena®;EP 0652738 B1和EP 0652737 B1)或皮下放置的基于聚合物的植入物(例如Norplant®、Jadelle®)与口服避孕药相比需要较少的患者依从性。
阴道内环(IVR)如Nuvaring®是进一步被广泛接受的长效避孕方法,因为阴道环可以由使用者自己插入阴道内,因此与植入物相比侵入性较低。
术语阴道内环、阴道环和IVR在本申请的上下文中同义使用。阴道内环是基本环形的聚合物剂型,其在长时间内提供活性成分(一种或多种)向阴道的受控释放,其中经由绕行胃肠道发生药物的吸收。
在IVR中的应用提供了方便的制剂,其在药物释放速率方面变化较小,避免了药物物质的肝脏首过代谢,并且因为不需要每天(定期)回顾药物摄取而改善了治疗依从性。
环在几周到一年的时间内提供活性成分(一种或多种)的连续释放。
阴道内环在过去45年一直进行临床研究。此类阴道内环是由含有活性药物的柔性和药物可透性聚合物(在本发明的上下文中也称为基质或芯材料)如乙炔基乙酸乙烯酯(EVA)或硅酮弹性体制成的装置,所述装置以规定的速率在一段时间内由聚合物基质材料向阴道粘膜释放活性药物(一种或多种)[细节参见例如Brache等人, Contraception, 2013; 87: 264-273;Harwood等人, Semin Reprod Med 2001; 19: 381-390]。
对释放醋酸甲羟孕酮(MPA)的IVR的第一例研究已经由Mishell和Lumkin在1970年发表[Mishell和Lumkin. Fertil Steril 1970; 21: 99-103]。自此之后,发表了对采用释放不同孕激素如黄体酮、醋酸烯诺孕酮、左炔诺孕酮和其它孕激素的IVR的几项临床试验。
阴道内环还描述在几项专利中,如EP 0 050 867、US 3,920,805A和US 4,292,965。文献中描述的一些IVR包含聚合物基质但不包含包封所述基质的膜或壁(整体剂型)。
虽然在文献中描述了不具有膜的阴道内环,大多数阴道环(包括Nuvaring®)以及植入物(如Norplant®1)包封在膜(也称为外层)内,因为膜确保在佩戴期间药物从聚合物芯节段中更恒定的释放。
释放炔雌醇与依托孕烯的组合的IVR(NuvaRing®;EP00876815)由Organon开发并在20世纪90年代早期引入市场。Nuvaring®基质由乙炔基乙酸乙烯酯(EVA)组成,其覆盖有非常薄的膜(这里,在文献中也使用术语“皮”),所述膜基本上也由EVA组成。在Nuvaring®中,两种活性成分混合并同等地分布在整个环(基质)上。由此,在Nuvaring®中不存在含有单个药物的不同的芯节段。
在欧洲专利申请号EP 13397533.4、EP2313084和EP1427390中描述了含有至少两种不同药物的宫内避孕器(也称为宫内系统;IUS)。但是,在这些申请中,活性药物包含在不同的节段(储器)内,所述节段被开放的空间(例如通过在IUD的T型框架的不同位置处安装该储器)或被分隔膜分开。由此在这里不可能发生药物A从节段(储器)A’向节段B’中的扩散(反之亦然)。
在本发明的上下文中,应当注意的是字母A(B)用于药物,而字母A’(B’)用于含有药物A或B的芯节段。
虽然所有长效避孕方法,包括IVR得到了充分的发展并在市场上被很好地接受,它们仍然要面对共同的问题——在整个佩戴期内,特别是在佩戴期的初始阶段(其中观察到提高的药物释放(所谓“突释效应”))中恒定的药物释放。这导致了对患者的活性药剂的不合理负担。因此,对于难溶于聚合物膜材料的药物来说,这个问题是微不足道的,这对于在膜材料中具有提高的溶解度的药物来说是关系重大的问题。
由此该膜材料不仅在佩戴期内调节药物释放,还起到了药库的作用。这里,在储存与运输期间,药物从芯材料扩散到膜中并浓缩在该膜中。
“积聚的药物”从膜中释放,特别是在插入后的头1至3天,这导致了更高的药物释放(所谓“初期突释”效应)。在一些情况下,这种初期突释可能持续长达7天。
为了抵消在膜内的药物积聚,因此在将其用于使用者之前,需要将Nuvaring®储存在2-8℃的温度下(参见Nuvaring®在“储存”下的包装说明书)。但是对于在温暖气候区域中的最终使用者储存而言,在冰箱中也是可取的,在25℃下的最大储存时间应不超过4个月。
由于在较低温度下的储存和运输意味着制造商和药房需要额外的努力,需要发现一种替代长效药物递送系统与阴道内环,其能够在环境温度下储存而不会导致在佩戴期的初始阶段中提高的“突释速率”。
当在本申请的上下文中使用术语“初期突释”时,意味着插入后长达7天的药物释放。“初期突释”在该装置插入后的第一天特别显著,并在长达7天的时间内降低,直到达到基本恒定(稳态)的释放。初期突释阶段的长度取决于用于芯节段和膜的聚合物、该药物递送装置的设计(例如膜厚度)以及该药物的物理化学性质。因此,在本发明的上下文中,术语“初期释放”指的是在达到稳态(基本恒定)释放前提高的释放。
发明目的
本发明的目的因此是提供含有两种药用活性药物(A)和(B)的长效药物递送装置,其具有改善的释放行为,即具有降低的“初期突释”和与储存条件无关的在整个佩戴期内基本恒定的药物释放。
本发明的另一目的是提供此类含有两种药用活性药物(A)和(B)的具有改善的释放行为的长效药物递送装置的制造方法。
本发明的另一目的是改变含有两种活性药物(A)和(B)的长效药物递送装置的释放特性的方法。
本发明中的术语“释放特性”是指在插入该装置后的初始阶段中药物(一种或多种)的释放行为。
本发明的另一目的是此类具有改善的释放行为的药物递送装置在避孕和妇科治疗中,特别是在子宫内膜异位的治疗中的用途。
背景信息
在含有超过一种活性药物的长效药物递送装置中,原则上可以使用不同的装置设计/结构。因此,不同的药物以药物混合物形式包含在聚合物芯基质中是一种选择,如在Nuvaring®中的情况,其中药物(依托孕烯和炔雌醇)同等地(均匀地)分布在阴道环的整个聚合物基质(芯区域)中。但是,(尽管在Nuvaring中对特定的药物/聚合物组合起作用),这通常会导致过高的药物释放,因为药物释放与表面积成线性关系2。因此,在阴道内环中增加由相同的聚合物基质材料制得但不含药物(一种或多种)的通常非活性的节段。
与Nuvaring®(其中两种药物同等地分布在聚合物基质中)相反,在文献中描述的大多数阴道环中,不同的药物(A)和(B)位于不同的(基质)节段中,所述节段相连以构成该药物递送装置。
如果两种不同的药物包含在不同的基质节段中,该基质节段可以以不同的顺序组装,例如以简单的AB次序。
除了简单的A/B设计之外,更复杂的设计如A/B/A或B/A/B顺序也是可能的。在这种设计中,药物B(A)分别被两个含A(B)的节段包围。
如果该长效药物递送装置是阴道内环,向该装置添加通常非活性的节段。该非活性节段(在下文中也称为“惰性节段”或“间隔节段”)通常由相同的聚合物基质材料制成但不含药物。非活性节段的一个目的是获得足够的环尺寸,这是在使用者阴道内可靠地锚定该IVR所必需的。
如下文中更详细地描述的那样,惰性节段的另一目的是在含药物节段之间提供空间分隔,以便在含药物节段之间产生屏障。该非活性节段优选由与邻接的含药物节段相同的材料制成。
在不具有膜的特定IVR系统中,非活性节段的另一目的是调节释放剂量,因为释放剂量取决于相应节段的表面积。与此相反,在含膜系统中,除了(膜的)表面积之外,释放还受该膜的物理化学性质的影响。
不用说,添加非活性节段就节段的次序而言扩展了变化的数量,例如,在IVR中,节段的次序可以是(1)非活性节段,(2)后接节段A’,(3)后接节段B’,(4)后接连接至非活性节段(1)的节段A’。
另一种顺序可以是(1)非活性/(2)药物A/(3)非活性/(4)药物B/连接至非活性节段(1)。原则上可能存在许多其它排列,因此上述顺序仅用于说明可能的结构。
发明描述
已经发现,节段的顺序令人惊讶地影响药物释放,特别是在插入该长效药物递送装置后的初始阶段中。
由此,通过以特定顺序/次序排列不同的节段解决了本发明的问题(降低初期突释)。
已经发现,当在相应的基质聚合物中具有更好的溶解性的化合物(B)放置在两个含有与化合物(B)相比在基质聚合物中溶解度较低的药物(A)的节段之间时,在较低的初期释放方面改善了插入后的初始阶段中长效药物递送装置的药物释放。
如果包封在两个含有溶解度较低的药物(A)的节段之间的含有在聚合物基质材料中具有更好溶解性的药物(B)的节段除了药物(B)之外还含有溶解度较低的药物(A),由此在含有两种药物的节段(AB’)中低溶解度药物(A)与高溶解度药物(B)之间的比率为5/95至30/70,则在“初期突释”方面获得了甚至更好的结果。
对于阴道内环,需要添加非活性节段,其不含药物,并通常由与含有药物(A)、(B)或(AB)的周围节段相同的聚合物材料制成。这种非活性节段位于两个A’节段之间并连接两个A’节段以构成环。该非活性节段造成了两个含有药物(A)的芯节段的空间分隔。在没有此类非活性芯节段的情况下,由于环形状,A/B/A顺序实际上将导致A/B顺序。
前述关于阴道内环的排序,基本上也分别适用于皮下植入的插入物和宫内避孕器,如果这些装置含有两种不同药物的话。尽管在理论上是可能的,在宫内避孕器(IUD)或植入物的情况下非活性节段不是必需的,因为惰性节段不会对该装置增加额外的益处。
可以根据现有技术中描述的标准技术进行环节段的制造与组装,例如EP 652738、US 3,920,805、US 4,888,074、US 4,215,691或WO2010/058070。但是,为了获得具有降低的初期突释的IVR,不用说的是当使用文献中描述的制造方法时,必须考虑根据本发明的教导的不同节段的正确组装。
本发明的具有降低的初期突释的长效递送装置通过两步法制得。在第一步骤(i)中,制备含有活性药物(A)或分别为活性药物(B)和药物(A)与(B)的药物混合物的聚合物基质材料的所需长度的单个芯节段。在步骤(ii)中,以次序A/B/A或A/AB/A组装备好的节段A’、B’或AB’,其中药物(B)在所选聚合物基质中比药物(A)溶解性更好。
如果该长效药物递送系统是IVR的话,将不含药物的非活性节段添加到组装步骤(ii)中,并将该非活性节段的“开放端” 与含有药物(A)的节段的“开放端”组合以构成具有顺序A/B/A/非活性或A/AB/A/非活性的环。示例性IVR的设计与制造描述在实施例中。
本发明进一步涉及改变含有两种药用活性药物的长效药物递送系统的释放特性的方法。
该方法包括通过包括以下步骤的过程来制备药物递送装置:
(i)制造聚合物基质材料的单个芯节段,其中所述单个芯节段含有活性药物(A)、活性药物(B)或药物(A)与(B)的药物混合物以便制备具有降低的初期释放的药物递送装置,和
(ii)以次序A/B/A或A/AB/A组装所述单个芯节段,
其中药物B在所选聚合物基质中比药物A溶解性更好。
如果该药物递送装置是阴道内环的话,将不含药物的非活性节段添加到该方法中,所述非活性节段连接两个节段A’以构成具有顺序A/B/A/非活性或A/AB/A/非活性的IVR。
在本发明的上下文中可以使用多种药物。由此,用于治疗女性疾病的药物和避孕活性药剂是适用的,由此孕激素和雌激素在避孕方面是优选的,并且芳香酶抑制剂和非甾体抗炎药(NSAID)在治疗中是优选的。
由此,本发明还涉及具有改善的初期释放速率的含有两种不同药物的长效药物递送装置在避孕和治疗中的用途。
作为孕激素,醋酸氯地孕酮(CMA)、炔诺肟酯(NGM)、甲基孕酮(NGMN)、炔诺酮(NET)/醋酸炔诺酮(NETA)、依托孕烯(3-酮-地索高诺酮)、醋酸诺美孕酮(NOMAc)、地美孕酮、普罗孕酮、屈螺酮(DRSP)、醋酸甲羟孕酮(MPA)、醋酸环丙氯地孕酮(CPA)、曲美孕酮(TMG)、左炔诺孕酮(LNG)、甲基炔诺酮(NG)、地索高诺酮(DSG)、孕二烯酮(GSD)或地诺孕素(DNG)是优选的,其中左炔诺孕酮(LNG)、地索高诺酮(DSG)、孕二烯酮(GSD)和地诺孕素(DNG)是优选的。特别优选的是左炔诺孕酮。
作为雌激素,天然和合成雌激素是可能的,尤其是雌二醇或其酯,例如戊酸雌二醇或结合雌激素(CEE = 马结合雌激素)是优选的。特别优选的是炔雌醇和雌激素或它们的酯,如戊酸雌二醇或苯甲酸雌二醇。
作为芳香酶抑制剂,选择性芳香酶抑制剂如阿那曲唑(Arimidex®)、依西美坦(Aromasin®)、法倔唑(Afema®)、福美坦(Lentaron®)、来曲唑(Femara®)、pentrozole、伏氯唑(Rivizor®)以及芳香酶抑制剂的药学上可接受的盐是合适的,而阿那曲唑(AI)是优选的。
作为NSAID,非选择性Cox抑制剂以及选择性Cox 2抑制剂在本发明的上下文中同样合适。优选的是美洛昔康、吡罗昔康、萘普生、塞来考昔、双氯芬酸、替诺昔康、尼美舒利、氯诺昔康和吲哚美辛,其中吲哚美辛是特别优选的。
取决于所选药物,该药物在聚合物基质中的浓度为5至40%,其中10-30%的范围是优选的。
为了设定含药物节段的正确排序,首先需要测定所选药物(A)和(B)在相应的基质聚合物中的溶解度。
在这方面,必须注意的是,药物的溶解度不仅仅取决于所选药物的物理化学性质,还取决于所选基质聚合物。对于基于硅酮-弹性体的基质而言,作为经验法则,疏水性药物比亲水性药物溶解性更好。
原则上,在本发明的上下文中也有可能对不同的节段使用不同的聚合物基质材料(与药物相关)。但是,如果芯基质材料对于所有节段(包括非活性节段)而言相同,这是有利的。
但是,在本发明的上下文中,所选药物在相应的聚合物中的具体溶解度并不重要。相反重要的是在药物(A)与(B)之间存在溶解度的差异,并且含有溶解度更高的物质B的节段总是位于两个溶解度较差的物质A的节段之间。如果含有溶解度更高的药物B的节段还含有5至30重量%的药物A的话(涉及含有药物混合物A和B的节段),这是特别优选的。
药物(API = 活性药物成分)在不同聚合物中的溶解度可以如下测定:
(a)API在聚硅氧烷中的溶解度
用于测量API的溶解度的聚硅氧烷(聚环氧乙烷嵌段-聚二甲基硅氧烷共聚物、聚(3,3,3-三氟丙基甲基硅氧烷)或聚(二甲基硅氧烷))具有低粘度,大约1000 cSt(mm²/s)。
称重15-20毫克API并添加到含有10毫升聚硅氧烷的离心管中,在磁力搅拌器上搅拌3天。如果需要的话添加API。通过离心分离未溶解的API。采取澄清溶液的等分试样,或用注射器过滤该等分试样。将0.2克该溶液添加到5.0毫升容量瓶中,用THF(四氢呋喃)填充并充分混合。根据API的溶解度,通过HPLC分析原样或经稀释的样品溶液。
(b)API在热塑性聚合物中的溶解度
根据A. Mahieu在Mol Pharm 2013, 10, 560-566中,R. A. Bellantone等人在J Pharm Sci 2012, 101, 4549-4558中,Y. Sun等人在J Pharm Sci 2012, 99, 4023-4031中或P. Marsac等人在Pharm Res 2006, 23, 2417-2426中描述的标准方法测量API在热塑性聚合物中的溶解度。
本发明的药物递送装置通常覆盖有基于聚合物的膜。根据已知方法将该膜置于芯节段上,例如在环己烷中溶胀该膜并在插入芯节段后除去溶剂。也可以施加加压空气或真空以使该膜膨胀并随后插入芯节段。相应的方法例如描述在EP 065273881 B1中。
膜材料可以与芯节段材料相同或不同,而在本发明的上下文中优选的是该材料不同,并且药物在基质(芯节段)中的溶解度高于在膜中的溶解度。不同不一定意味着膜聚合物选自不同的化合物类别,相反如果所选聚合物通过向硅弹性体添加官能团如3,3,3-三氟丙基甲基基团以改变该材料的疏水性来改性的话就已足够。药物在各种聚合物中的溶解度可以如上所述测定。
作为基质/芯节段材料,热塑性聚合物如EVA(乙炔基-乙酸乙烯酯)或弹性体硅酮如聚硅氧烷是合适的。
在本发明的上下文中,此类材料也可以用作膜材料。聚硅氧烷调节药物的渗透速率。它们是生理学惰性的,并且许多治疗活性物质能够渗透聚硅氧烷膜。此外,硅氧烷还具有所需的强度性质。
其中取代基为低级烷基(优选1至6个碳原子的烷基)或苯基(其中所述烷基或苯基可以取代或未取代)的聚(二取代)硅氧烷优选作为芯节段和膜材料。广泛使用和优选的这种类型的聚合物是聚(二甲基硅氧烷)(PDMS)。其它优选的聚合物是包含连接到硅氧烷单元的硅原子上的3,3,3-三氟丙基基团(氟改性聚硅氧烷)或聚(环氧烷)基团的基于硅氧烷的聚合物,其中所述聚(环氧烷)基团以烷氧基封端的接枝物或通过硅-碳键连接到聚硅氧烷单元的嵌段或这些形式的混合物的形式存在。聚硅氧烷和改性聚硅氧烷聚合物例如描述在EP 0652738 B1、WO 00/29464和WO 00/00550中。在包含聚(环氧烷)基团的基于硅氧烷的聚合物中,聚环氧乙烷嵌段-聚二甲基硅氧烷共聚物(PEO-b-PDMS)是优选的。
不具有取代基的聚硅氧烷是单极性聚合物,由此亲水性药物难溶于此类硅氧烷弹性体。但是,如果在硅氧烷中存在极性基团如聚(环氧烷)基团的话,亲水性API的溶解度可以提高。由此,单极性聚合物用于疏水性药物,而极性硅氧烷对亲水性药物是优选的。
本发明的优选实施方案涉及含有左炔诺孕酮(LNG)和炔雌醇(EE)的基于聚硅氧烷的节育环,其中在该药物组合中,EE是具有较高溶解度的药物,由此节段的次序为(1)非活性、(2)LNG、(3)EE、(4)连接到非活性材料节段(1)以构成环的LNG。
特别优选的是该EE节段(3)还含有左炔诺孕酮。这里含有该药物混合物的节段(3)中LNG/EE之间的比率为5/95至30/70 w/w%。
本发明的进一步的优选实施方案涉及基于含有阿那曲唑和左炔诺孕酮的硅弹性体的IVR,其中含有左炔诺孕酮的节段(B’)位于两个含有阿那曲唑的节段(A’)之间,因为在该组合中,阿那曲唑是在硅弹性体中溶解度较低的药物。如果左炔诺孕酮节段还含有阿那曲唑的话,这是特别优选的,由此含有药物混合物的节段中阿那曲唑对LNG的比率为5/95至40/60 w/w%。
本发明的IVR可以连续使用大约一个月至一年,优选一至六个月。连续使用包括该IVR可以间歇地取出1至4小时以便例如清洁或在性交过程中。或者根据本发明,该IVR可以以模仿女性自然周期的方式(例如21、22、23或24天或至多一个月)使用,随后取出以开始出血,并在7、6、5、4或3天后重新插入(佩戴天数和非佩戴天数总计应当为至少28天)。 或者可以在这段时间后插入新的未使用的IVR。
通过释放速率描述药物从该递送装置(特别是IVR)中的释放。释放速率是指24小时内从该装置中释放的可供周围组织吸收的活性药物物质的平均量。
该芯节段和/或该膜的聚合物组成、膜厚度以及膜表面积是影响释放速率的主要参数。在本领域中常规使用体外释放速率测试来表征含有激素的递送装置如IVR。在该测试中,通过分析例如在振荡水浴中在环糊精水溶液中在37℃下在该装置体内使用的预期时间内该药物的体外释放量来测定该释放速率。在各采样时间点处的体外释放速率计算为每天(24小时)的释放量(µg)[µg/天或µg/d]。术语剂量和释放速率在本专利申请中同义使用。
下面的实施例用于说明本发明。
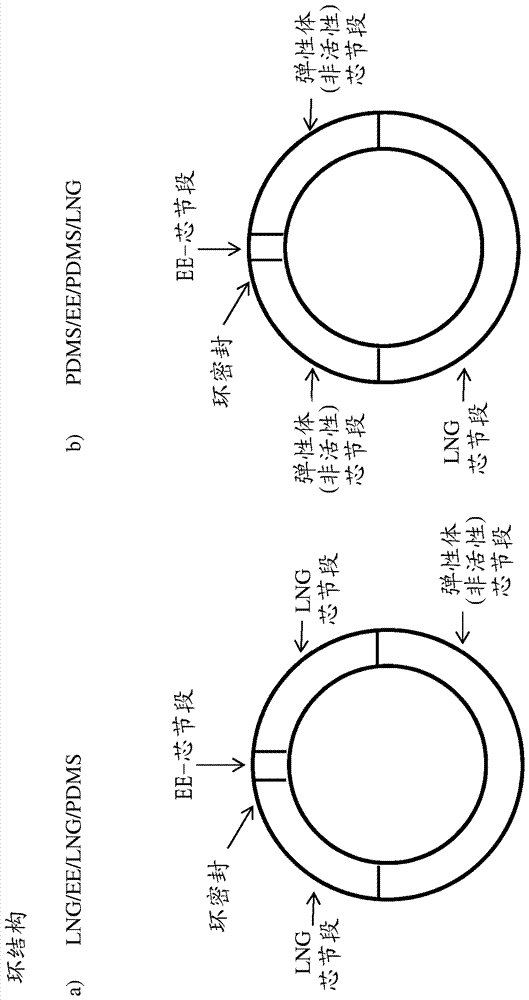
实施例1a)涉及具有节段顺序LNG/EE/LNG/非活性的环。该实施例中的非活性或惰性材料是PDMS弹性体。为了比较,已经制备了具有顺序非活性/EE/非活性/LNG的阴道环(实施例1b)。相应的环结构显示在图1中(左侧为LNG/EE/LNG/PDMS;右侧为PDMS/EE/PDMS/LNG)。
在实施例1的表1中给出了不同节段的尺寸。表2涉及对不同组合件测得的EE的释放速率——本发明的LNG/EE/LNG/非活性和现有技术的非活性/EE/非活性/LNG。已经如上所述在环糊精水溶液中在37℃下在体外测试中测量了释放速率。
在表1中给出的与时间(天数)相关的EE的释放速率还绘制在算术图表中(参见图2)。在25℃下在2个月的储存时间后,对比较组合件弹性体(非活性)/EE/弹性体(非活性)/LNG观察到最高的初期突释。这里,在该初期突释阶段中,在第一天的释放超过55 µg(紫色交叉曲线)。该图还清楚地显示与储存时间相关的EE在膜中的积聚,因为对于相同的组合件而言,在0个月的储存时间后,该初期释放仅为35 µg(红色方块曲线)。
与此相反,对于本发明的组合件LNG/EE/LNG/弹性体(非活性)而言,在0个月的储存时间后在第一天的释放速率仅为27 µg(蓝色菱形曲线),并在25℃下在2个月的储存时间后仅观察到略微的提高。在第1天观察到35 µg的值(绿色三角曲线)。
实施例2涉及本发明的LNG/EE+LNG/LNG/PDMS组合件(PDMS节段= 非活性节段),其与根据本发明的第二实施方案的LNG/EE/LNG/PDMS组合件进行比较。比较显示,如果EE节段(B)还含有LNG的话,在“初期突释”的降低方面可以得到进一步的改善。该环结构显示在图3中。在表3中给出了节段的尺寸。已经如上所述测得了释放速率并在表3中给出。在图4中绘制了EE的经时释放。如从数据和图4中看到的那样,当向含EE节段中添加LNG时,进一步降低了“初期突释”。由此在第一天的EE释放从第1天的~ 45 µg(蓝色“菱形”曲线)降低至第一天的~30 µg(绿色三角和红色方块曲线)。
实施例1:
制造释放EE和LNG的环
芯
制备三种芯组合物,一种惰性芯,一种包含EE的芯和一种包含LNG的芯。包含EE和LNG的芯的基质由硅酮弹性体(聚二甲基硅氧烷)制成,惰性芯也由硅酮弹性体(聚二甲基硅氧烷)制成。通过在混合机中混合微粉化的EE和硅酮弹性体来制造含EE的芯。该混合物的EE含量为10重量%。该混合物在模具中成型,并固化以获得外径为大约4.5毫米的小圆盘。通过在混合机中混合微粉化的LNG和硅酮弹性体来制造含LNG的芯。该混合物的LNG含量为50重量%。将LNG芯挤出成内径为大约2.0毫米和外径为大约4.5毫米的管。也将惰性硅酮弹性体挤出以获得内径为大约1.4毫米和外径为大约4.5毫米的弹性管。
膜
通过挤出制造药物释放控制膜管。该膜由硅酮弹性体(聚二甲基硅氧烷)制成。膜管的内径为大约4.3毫米,外径为大约5.0毫米。
环的组装
a)LNG/EE/LNG/PDMS
将LNG芯切成两个37毫米的片段(下面也称为芯节段)。为了填充整个环,在环芯中使用PDMS芯管作为惰性节段。将惰性PDMS弹性体芯切成80毫米长度,使得总芯长度达到157毫米。将膜管切割至165毫米的长度并在环己烷中溶胀。通过以下列次序将芯节段推入溶胀的膜管中来装配该环:第一LNG-芯节段,弹性体-芯节段,第二LNG-芯节段,和EE-芯节段。通过叠置和胶粘将该管成型为环。为了封闭环接头,使用少量PDMS胶水。在溶剂蒸发后,该管收缩并将部件紧密地压紧。
b)PDMS/EE/PDMS/LNG(比较实施例)
将LNG芯切成74毫米片段(芯节段)。为了填充整个环,在环芯中使用PDMS芯管作为惰性节段。将惰性PDMS弹性体芯切成两个40毫米的片段,获得157毫米的总芯长度(芯节段)。将膜管切割至165毫米的长度并在环己烷中溶胀。通过以下列次序将芯节段推入溶胀的膜管中来装配该环:第一弹性体-芯节段,LNG-芯节段,第二弹性体-芯节段和EE-芯节段。通过叠置和胶粘将该管成型为环。为了封闭环接头,使用少量PDMS胶水。在溶剂蒸发后,该管收缩并将部件紧密地压紧。环结构显示在图1中,不同节段的尺寸在下表1中给出。
表1. 释放炔雌醇与左炔诺孕酮的IVR的性质与材料
ID (膜管的内径);OD (膜管的外径)
* 环结构a)图1左侧
** 环结构b)图1右侧。
表2. 炔雌醇(EE)从具有不同结构与储存的IVR中的体外释放速率
0mth = 无储存时间,在制造后立即测量释放。
实施例2:
制造释放EE和LNG的环
芯
制备四种芯组合物,一种惰性芯,一种包含EE的芯,一种包含EE+LNG的芯和一种包含LNG的芯。包含EE、EE+LNG和LNG的芯的基质由硅酮弹性体(聚二甲基硅氧烷)制成,惰性芯也由硅酮弹性体(聚二甲基硅氧烷)制成。通过在混合机中混合微粉化的EE和硅酮弹性体来制造含EE的芯。该混合物的EE含量为20重量%。通过在混合机中混合微粉化的EE、微粉化的LNG和硅酮弹性体来制造含EE+LNG的芯。该混合物的EE含量为20重量%且LNG含量为10重量%。EE+弹性体和EE+LNG+弹性体混合物在模具中成型,并固化以获得外径为大约4.5毫米的小圆盘。通过在混合机中混合微粉化的LNG和硅酮弹性体来制造含LNG的芯。该混合物的LNG含量为50重量%。将LNG芯挤出成内径为大约2.0毫米和外径为大约4.5毫米的管。也将惰性硅酮弹性体挤出以获得内径为大约1.4毫米和外径为大约4.5毫米的弹性管。
膜
通过挤出制造药物释放控制膜管。该膜由硅酮弹性体(聚二甲基硅氧烷)制成。膜管的内径为大约4.3毫米,外径为大约5.0毫米。
环的组装
将LNG芯切成两个43-46毫米的片段(芯节段)。为了填充整个环,在环芯中使用PDMS芯管作为惰性节段。将惰性PDMS弹性体芯切成65-71毫米长度(芯节段),使得总芯长度达到160毫米。将膜管切割至160毫米的长度并在环己烷中溶胀。通过以下列次序将芯节段推入溶胀的膜管中来装配该环:第一LNG-芯节段,EE-芯节段或EE+LNG-芯节段、第二LNG-芯节段和弹性体-芯节段。通过胶粘将该管成型为环。为了封闭环接头,使用少量PDMS胶水。在溶剂蒸发后,该管收缩并将部件紧密地压紧。
表3. 释放炔雌醇与左炔诺孕酮的IVR的性质与材料
ID (膜管的内径);OD (膜管的外径)
。
表4. 炔雌醇从EE芯中含有或不含有LNG的IVR中的体外释放速率
。
- 还没有人留言评论。精彩留言会获得点赞!