用于诊断成像的纳米颗粒造影剂的制作方法
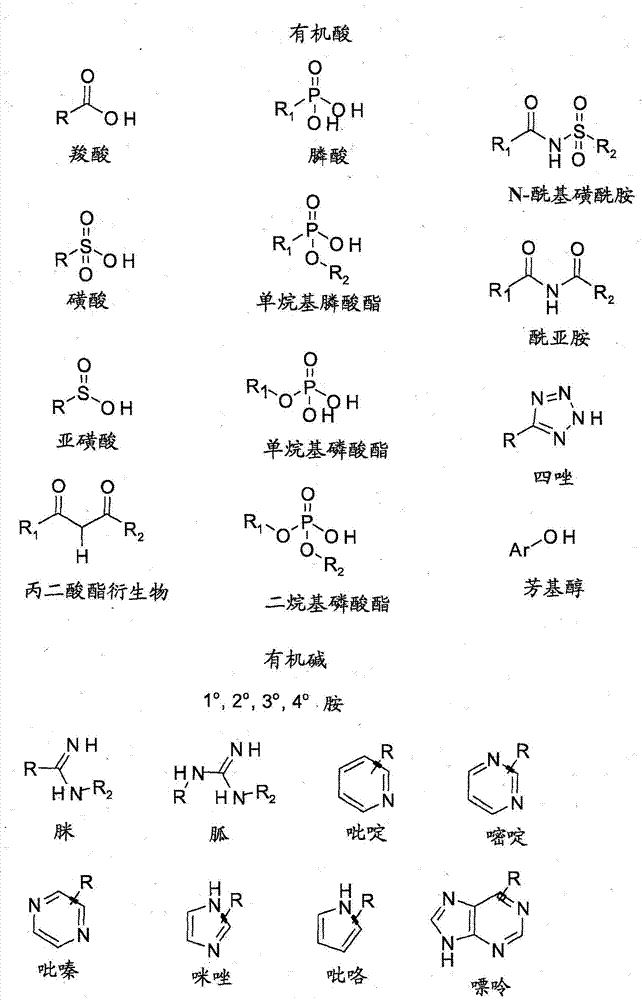
本申请是申请日为2009年12月18日,申请号为200980157705.1,发明名称为“用于诊断成像的纳米颗粒造影剂”的发明专利申请的分案申请。发明背景本申请总的涉及用于诊断成像(例如,用于x射线/计算机断层摄影(ct)或磁共振成像(mri))的造影剂(contrastagent)。更具体地讲,本申请涉及基于纳米颗粒的造影剂和制备及使用这些剂的方法。几乎所有经临床批准的诊断造影剂都是基于小分子的。碘化芳族化合物已作为标准x射线或ct造影剂,而gd-螯合物用于磁共振成像。虽然常用于诊断成像,但小分子造影剂可能有某些缺点,例如,从血管壁渗漏,导致短血液循环时间、较低灵敏性、高粘度和高同渗重摩(osmolality)。这些化合物一般与一些患者群体的肾并发症相关。已知这类小分子剂快速从身体清除,这限制它们能够用于使血管系统有效成像的时间,并且关于其它适应症,使之难以将这些剂靶向疾病部位。因此,需要新种类的造影剂。现在,正广泛研究纳米颗粒用于医疗应用,包括诊断和治疗两者。虽然只有几种基于纳米颗粒的药剂经临床批准用于磁共振成像应用和用于药物输送应用,但数百种这样的药剂仍在研发中。有充分证据表明,纳米颗粒在诊断和治疗功效方面具有超过目前使用的基于小分子药剂的益处。然而,粒径、结构和表面性质对体内生物分布和纳米颗粒剂清除率的影响尚未充分了解。根据其粒径,纳米颗粒与小分子相比倾向于在体内停留较长时间。在造影剂的情况下,优选具有最大的药剂从身体的肾清除率,而不对任何器官产生短期或长期的毒性。鉴于上面所述,需要具有改善性质(特别是涉及肾清除率和毒性作用的性质)的基于纳米颗粒的造影剂或成像剂。发明概述本发明提供用于x射线、ct和mri的新类型的基于纳米颗粒的造影剂。发明人已发现,用两性离子基团官能化的纳米颗粒与小分子造影剂相比意外地具有改善的成像特征。本发明的纳米颗粒具有相比于其它颗粒在体内产生最小颗粒保留的特征。这些纳米颗粒可在一个或多个以下方面提供改善的性能和益处:稳健合成,减小成本,图像造影增强,增大血液半衰期,并减小毒性。本发明涉及纳米颗粒和包含所述纳米颗粒的组合物。本发明还涉及制备所述纳米颗粒的方法及其使用方法和用途。因此,本发明的一个方面涉及纳米颗粒。所述纳米颗粒包含芯,所述芯具有基本不含二氧化硅的芯表面;和结合到芯表面的壳。壳包含至少一个硅烷官能化两性离子部分。在一个实施方案中,芯包含过渡金属。在另一个实施方案中,芯包括选自氧化物、碳化物、硫化物、氮化物、磷化物、硼化物、卤化物、硒化物、碲化物的过渡金属化合物或它们的组合。在一个实施方案中,芯包括原子序数≥34的金属。在一些实施方案中,纳米颗粒包含氧化钽芯,所述芯具有基本不含二氧化硅的芯表面;和结合到芯表面的壳,其中壳包含至少一个硅烷官能化两性离子部分。所述纳米颗粒具有最大约6nm的平均粒径。在一些其它实施方案中,纳米颗粒包含超顺磁性氧化铁(ironoxide)芯,所述芯具有基本不含二氧化硅的芯表面;和结合到芯表面的壳,其中壳包含至少一个硅烷官能化两性离子部分。纳米颗粒具有最大约50nm的平均粒径。在一个或多个实施方案中,本发明涉及诊断剂组合物。所述组合物包含多种纳米颗粒,其中所述多种中的至少一种纳米颗粒包含芯,所述芯具有基本不含二氧化硅的芯表面;和结合到芯表面的壳。壳包含至少一个硅烷官能化两性离子部分。在一些实施方案中,组合物进一步包含药学上可接受的载体和任选的一种或多种辅料。本发明的一个方面涉及制备纳米颗粒的方法。所述方法包括(a)提供芯,所述芯具有基本不含二氧化硅的芯表面;和(b)布置壳结合到芯表面,其中壳包含硅烷官能化两性离子部分。本发明的另一方面涉及一种方法,所述方法包括向受试者给予诊断剂组合物,并用x射线装置对受试者成像。所述诊断剂组合物包含多种纳米颗粒,其中所述多种中的至少一种纳米颗粒包含芯和壳。壳包含至少一个硅烷官能化两性离子部分。在一个或多个实施方案中,芯包括氧化钽。在一些实施方案中,所述方法包括向受试者给予诊断剂组合物,并用诊断装置对受试者成像。所述诊断剂组合物包含多种纳米颗粒。所述多种中的至少一种纳米颗粒包含芯,所述芯具有基本不含二氧化硅的芯表面;和结合到芯表面的壳。壳包含至少一个硅烷官能化两性离子部分。在一个或多个实施方案中,所述使用方法进一步包括用诊断装置监测诊断剂组合物到受试者的输送,并诊断受试者。在一些实施方案中,诊断装置采用选自磁共振成像、光学成像、光学相干断层摄影、x射线、计算机断层摄影、正电子发射断层摄影或它们的组合的成像方法。本发明的另一方面涉及前述纳米颗粒10用于制造用作诊断剂组合物的组合物的用途。附图简述通过阅读以下详述并参考附图,本发明的这些和其它特征、方面和优点将变得更好理解,其中在全部附图中相似的符号代表相似的部件,其中:图1描绘本发明的一些实施方案的包含芯和壳的纳米颗粒的横截面图。图2描述可用于生成两性离子官能团的有机酸和有机碱。图3a、3b、3c和3d描述硅烷官能化两性离子部分,这些部分可与芯反应,以产生包含硅烷官能化两性离子部分的壳。发明详述以下详述为示例性,不旨在限制本申请的发明或本发明的用途。另外,不意在受限于前述发明背景或以下详细描述所提出的任何理论。在以下说明书和权利要求书中将引用具有以下含义的一些术语。除非上下文清楚地指明,否则单数形式“一”和“所述”包括复数个讨论对象。如在整个说明书和权利要求中所用,近似语言可用于修饰任何定量表达,这些表达可容许改变,而不引起所涉及的基本功能的改变。因此,由术语例如“约”修饰的数值不限于所指定的精确值。在一些情况下,近似语言可相当于仪器用于测定数值的精确度。类似地,“不含”可与术语结合使用,并可包括非实在(insubstantial)的数字或痕量,尽管仍可认为不含所修饰的术语。例如,不含溶剂或无溶剂及类似术语和短语可以指其中已从溶剂化物质去除显著部分、一些或全部溶剂的情况。本发明的一个或多个实施方案涉及图1所述的纳米颗粒。纳米颗粒10包含芯20,所述芯具有基本不含二氧化硅的芯表面30。在一个或多个实施方案中,芯20包含过渡金属,例如,过渡金属元素的化合物。纳米颗粒10进一步包含结合到芯表面30的壳40,也称为涂层。壳40包含至少一个硅烷官能化两性离子部分。由于芯表面30基本不含二氧化硅,因此,硅烷官能化两性离子部分不结合到二氧化硅,但在没有任何中间二氧化硅层下在芯表面30结合到芯20。硅烷官能化两性离子部分包含硅烷部分和两性离子部分。本文所用术语“两性离子部分”是指电中性但在不同原子上带形式正电荷和负电荷的部分。两性离子为极性,并且通常在水中具有高溶解性,而在大多数有机溶剂中具有差溶解性。在一些实施方案中,“两性离子部分”是指两性离子部分的前体。在这些实施方案中,前体经过二级或后续化学反应,以生成两性离子部分。本文所用“纳米颗粒”是指具有纳米尺度粒径的颗粒,一般小于1微米。在一个实施方案中,纳米颗粒具有最大约50nm的粒径。在另一个实施方案中,纳米颗粒具有最大约10nm的粒径。在另一个实施方案中,纳米颗粒具有最大约6nm的粒径。本发明的一个或多个实施方案涉及包含多种纳米颗粒的组合物。多种纳米颗粒可表征为中值粒径、平均直径或粒径、粒径分布、平均颗粒表面积、颗粒形状或颗粒横截面几何形状的一种或多种。另外,多种纳米颗粒可具有可表征为数均尺寸和重均粒径两者的粒径分布。数均粒径可由sn=σ(sini)/σni表示,其中ni为具有粒径si的颗粒数。重均粒径可由sw=σ(sini2)/σ(sini)表示。在所有颗粒具有相同尺寸时,sn和sw可相等。在一个实施方案中,可具有尺寸分布,并且sn可不同于sw。重均与数均之比可定义为多分散指数(spdi)。在一个实施方案中,spdi可等于约1。在其它实施方案中,spdi可分别在约1至约1.2、约1.2至约1.4、约1.4至约1.6或约1.6至约2.0的范围内。在一个实施方案中,spdi可在大于约2.0的范围内。在一个实施方案中,多种纳米颗粒可具有选自正态分布、单峰分布和双峰分布的粒径分布。某些粒径分布可用于提供某些益处。单峰分布可以指围绕单一模式分布的粒径分布。在另一个实施方案中,可在组合物中包含具有两个不同亚群尺寸范围(双峰分布)的粒群。纳米颗粒可具有多种形状和横截面几何形状,这可部分取决于制备颗粒使用的方法。在一个实施方案中,纳米颗粒可具有球、棒、管、薄片、纤维、板、线、立方体或须的形状。纳米颗粒可包括具有两个或更多个前述形状的颗粒。在一个实施方案中,颗粒的横截面几何形状可以为一个或多个圆形、椭圆形、三角形、长方形或多边形的形状。在一个实施方案中,纳米颗粒可基本由非球形颗粒组成。例如,这些颗粒可具有椭圆体形状,这些椭圆体可具有不同长度的所有三个主轴,或者可以为旋转的扁椭球或长椭球。或者,非球形纳米颗粒可以为层状形式,其中层状是指沿着一个轴的最大尺寸显著小于沿着其它两轴各自的最大尺寸的颗粒。非球形纳米颗粒也可具有金字塔或锥体的截头体或伸长的棒的形状。在一个实施方案中,纳米结构可以为不规则形状。在一个实施方案中,多种纳米颗粒可基本由球形纳米颗粒组成。纳米颗粒群体可具有高表面-体积比。纳米颗粒可以为晶体或非晶。在一个实施方案中,可使用单一类型(粒径、形状等)纳米颗粒,或者可使用不同类型纳米颗粒的混合物。如果使用纳米颗粒的混合物,它们可均匀或不均匀分布于组合物中。在一个实施方案中,纳米颗粒可对生成聚集体或附聚物稳定。聚集体可包括相互物理接触的多于一种纳米颗粒,而附聚物可包括相互物理接触的多于一种聚集体。在一些实施方案中,纳米颗粒可不强烈附聚和/或聚集,使得这些颗粒可相对容易地分散于组合物中。在一个实施方案中,芯包含过渡金属。如本文所用,“过渡金属”是指周期表第3-12族的元素。在某些实施方案中,芯包含一种或多种过渡金属化合物,如包含一种或多种这些过渡金属元素的氧化物、碳化物、硫化物、氮化物、磷化物、硼化物、卤化物、硒化物和碲化物。因此,在本说明书中,术语“金属”不一定指存在零价金属,而是,使用此术语表示存在包含过渡金属元素作为成分的金属物质或非金属物质。在一些实施方案中,纳米颗粒可包含单一芯。在一些其它实施方案中,纳米颗粒可包含多个芯。在纳米颗粒包含多个芯的实施方案中,这些芯可相同或不同。在一些实施方案中,纳米颗粒组合物包含至少两个芯。在其它实施方案中,各个纳米颗粒组合物只包含一个芯。在一些实施方案中,芯包含单一过渡金属化合物。在另一个实施方案中,芯包含两种或更多种过渡金属化合物。在芯包含两种或更多种过渡金属化合物的实施方案中,过渡金属元素或过渡金属阳离子可以为相同元素,或两种或更多种不同元素。例如,在一个实施方案中,芯可包含单一金属化合物,如氧化钽或氧化铁。在另一个实施方案中,芯可包含两种或更多种不同的金属元素,例如氧化钽和氧化铪或氧化钽和氮化铪或铁和锰的氧化物。在另一个实施方案中,芯可包含相同金属元素的两种或更多种化合物,例如氧化钽和硫化钽。在一个实施方案中,芯在x射线或计算机断层摄影(ct)成像中产生造影增强。常规ct扫描器使用约10kev和约150kev之间的宽谱x射线能量。本领域的技术人员应认识到,每单位长度通过特定物质的x射线衰减量表示为线性衰减系数。在ct成像的典型x射线能谱中,物质的衰减由光电吸收效应和康普顿散射效应主导。另外,公知线性衰减系数为入射x射线的能量、物质的密度(与摩尔浓度相关)和物质的原子序数(z)的函数。对于分子化合物或不同原子的混合物,“有效原子序数”zeff可计算为组成元素的原子序数的函数。已知化学式的化合物的有效原子序数由以下关系确定:(等式1)其中zk为金属元素的原子序数,p为金属元素的总量,为金属元素相对于分子总分子量的重量分数(与摩尔浓度相关)。用于ct成像的入射x射线能量的最佳选择为要成像的物体的尺寸的函数,并且预料和名义值变化不大。也公知造影剂物质的线性衰减系数与物质的密度线性相关,即,如果物质密度增大,或者造影物质的摩尔浓度增大,则线性衰减系数可增大。然而,造影剂物质注入患者的实际方面和相关毒性作用限制可以达到的摩尔浓度。因此,根据其有效原子序数分离潜在的造影剂物质是合理的。根据对摩尔浓度约50mm的一般ct能谱的一般物质ct造影增强的模拟,估计有效原子序数大于或等于34的物质得到约30亨斯菲尔德单位(hu)或对比度比水高3%的适当的造影增强。因此,在某些实施方案中,芯包含有效原子序数大于或等于34的物质。参见,例如handbookofmedicalimaging,volume1中的chapter1.physicsandpsychophysics,编辑j.beutel,h.l.kundel,r.l.vanmetter,spiepress,2000。包含上述相对高原子序数的过渡金属的芯可提供具有某些期望特征的实施方案。在这些实施方案中,芯基本为辐射不透明的,这意味芯物质和一般在活有机体中发现的物质相比阻止显著更少的x射线辐射通过,因此,潜在地产生作为x射线成像应用(比如计算机断层摄影(ct))中的造影剂的颗粒用途。可提供此性质的过渡金属元素的实例包括钨、钽、铪、锆、钼、银和锌。氧化钽为用于x射线成像应用的适合的芯组合物的一个具体实例。在一个或多个实施方案中,纳米颗粒的芯包含氧化钽,并且纳米颗粒具有最大约6nm的粒径。由于含钽的芯的高辐射不透明度和例如帮助快速肾清除的小尺寸,此实施方案对于应用于采用x射线产生成像数据的成像技术特别有吸引力。在一些实施方案中,纳米颗粒的芯包含至少约30%重量过渡金属物质。在某些实施方案中,芯包含至少约50%重量过渡金属物质。在更进一步的实施方案中,芯包含至少约75%重量过渡金属物质。在芯中具有高过渡金属物质含量使纳米颗粒具有较高的每单位体积辐射不透明度,从而赋予作为造影剂的更有效的性能。在另一个实施方案中,芯包含显示磁性(包括例如超顺磁性)的物质。本文所用“超顺磁性物质”是指甚至在低于curie或néel温度的温度也可显示类似于顺磁性的性质的物质。潜在磁性或超顺磁性物质的实例包括含铁、锰、铜、钴或镍的一种或多种的物质。在一个实施方案中,超顺磁性物质包括超顺磁性氧化铁。在一些实施方案中,本发明的纳米颗粒可用作磁共振(mr)造影剂。在暴露于磁场时,这些纳米颗粒可产生t2*、t2或t1磁共振信号。在一个或多个实施方案中,纳米颗粒的芯包含超顺磁性氧化铁,并且纳米颗粒具有最大约50nm的粒径。在一个实施方案中,纳米颗粒10包含基本覆盖芯20的壳40。此壳40可用于使芯20稳定,即,壳40可防止一个芯20接触相邻的芯20,从而防止多个这样的纳米颗粒10如本文所述聚集或附聚,或者防止金属或金属氧化物在例如体内成像试验的时间尺度内浸出。在一个实施方案中,壳40可以足够厚以使芯20稳定并防止此类接触。在一个实施方案中,壳40具有最大约50nm的平均厚度。在另一个实施方案中,壳40具有最大约3nm的平均厚度。本文所用术语“基本覆盖”是指纳米颗粒的表面覆盖百分数大于约20%。表面覆盖百分数是指被壳覆盖的纳米颗粒表面与未被壳覆盖的表面积之比。在一些实施方案中,纳米颗粒的表面覆盖百分数可大于约40%。在一些实施方案中,壳可促进提高水溶解性,减少聚集体生成,减少附聚物生成,防止纳米颗粒氧化,保持芯-壳实体的均匀性,或为纳米颗粒提供生物相容性。在另一个实施方案中,含壳的物质可进一步包含适应特定应用(例如但不限于诊断应用)的其它物质。例如,在一个实施方案中,纳米颗粒可进一步用靶向配体官能化。靶向配体可以是分子或结构,其提供纳米颗粒向期望的器官、组织或细胞的靶向。靶向配体可包括但不限于蛋白质、肽、抗体、核酸、糖衍生物或它们的组合。在一些实施方案中,纳米颗粒进一步包含靶向剂,使得在用作造影剂时,颗粒可靶向受试者身体的具体患病区域。在一些实施方案中,纳米颗粒可用作血池造影剂(bloodpoolagent)。芯可用一个或多个壳覆盖。在一些实施方案中,多个芯可用相同的壳覆盖。在一个实施方案中,单个壳可覆盖纳米颗粒组合物中存在的所有芯。在一些实施方案中,个体的芯可用一个或多个壳覆盖。在另一个实施方案中,纳米颗粒中存在的所有芯可用两个或更多个壳覆盖。个体的壳可包含相同物质,或者可包含两种或更多种不同物质。在芯可用多于一个壳覆盖的实施方案中,壳可以为相同或不同物质。在一个实施方案中,壳包含至少一个硅烷官能化两性离子部分,其中硅烷官能化两性离子部分包含硅烷部分和两性离子部分。在一些实施方案中,硅烷官能化两性离子壳的硅烷部分直接结合到芯。在一个实施方案中,壳包含多个硅烷部分,其中所述多个硅烷部分的至少一个用至少一个两性离子部分官能化。在一些实施方案中,壳包含硅烷官能化两性离子部分和硅烷官能化非两性离子部分。在这些实施方案中,硅烷官能化两性离子部分与硅烷官能化非两性离子部分之比为约0.01至约100。在一些其它实施方案中,硅烷官能化两性离子部分与硅烷官能化非两性离子部分之比为约0.1至约20。在一些实施方案中,壳包含多个硅烷官能化两性离子部分。术语“多个硅烷官能化两性离子部分”是指一个特定硅烷部分用至少一个两性离子部分官能化的多个情况。硅烷部分可相同或不同。在一个实施方案中,各个芯被多个硅烷官能化两性离子部分围绕,其中所有硅烷部分为相同类型。在另一个实施方案中,各个芯被多个硅烷官能化两性离子部分围绕,其中硅烷部分为不同类型。在一个实施方案中,所述多个硅烷部分的每一个用至少一个两性离子部分官能化。在一个实施方案中,所述多个硅烷部分的至少一个用两性离子部分官能化,使得每个纳米颗粒平均包含至少一个两性离子部分。在一个或多个实施方案中,各个纳米颗粒包含多个两性离子部分。在其中壳包含多个硅烷官能化两性离子部分的实施方案中,硅烷部分和两性离子部分可相同或不同。例如,在一个实施方案中,所有的硅烷部分可相同,并且所有的两性离子部分可相同。在另一个实施方案中,硅烷部分相同,但两性离子部分不同。例如,壳可包含两个不同的硅烷官能化两性离子部分。第一个包括类型1硅烷部分和类型1两性离子部分。第二个包括类型1硅烷部分和类型2两性离子部分,或者类型2硅烷部分和类型1两性离子部分,或者类型2硅烷部分和类型2两性离子部分。在一个或多个实施方案中,硅烷官能化两性离子部分可包含两个或更多个两性离子部分。在其中硅烷官能化两性离子部分包含两个或更多个两性离子部分的实施方案中,两性离子部分可相同或不同。在一些实施方案中,硅烷官能化两性离子部分包含带正电荷部分、带负电荷部分和在带正电荷部分和带负电荷部分之间的第一间隔基。带正电荷部分可产生于有机碱,带负电荷部分可产生于有机酸。图2显示可产生带负电荷部分和带正电荷部分的示例性有机酸和碱的列表。在一些实施方案中,带正电荷部分包括质子化伯胺、质子化仲胺、质子化叔烷基胺、质子化脒、质子化胍、质子化吡啶、质子化嘧啶、质子化吡嗪、质子化嘌呤、质子化咪唑、质子化吡咯、季烷基胺或它们的组合。在一些实施方案中,带负电荷部分包括去质子化羧酸、去质子化磺酸、去质子化亚磺酸、去质子化膦酸、去质子化磷酸、去质子化次膦酸或它们的组合。在一个或多个实施方案中,第一间隔基包括烷基、芳基、经取代的烷基和芳基、杂烷基、杂芳基、羧基、醚、酰胺、酯、氨基甲酸酯、脲、1至10个碳原子长度的直链烷基或它们的组合。在一些实施方案中,硅烷官能化两性离子部分的一个硅原子通过第二间隔基连接到带正电荷或负电荷部分。在一些实施方案中,第二间隔基包括烷基、芳基、经取代的烷基和芳基、杂烷基、杂芳基、羧基、醚、酰胺、酯、氨基甲酸酯、脲、1至10个碳原子长度的直链烷基或它们的组合。在一些实施方案中,硅烷官能化两性离子部分包括前体三烷氧基硅烷的水解产物,如图3a-3d中所示的那些。在一些实施方案中,前体三烷氧基硅烷包括n,n-二甲基-3-磺基-n-(3-(三甲氧基甲硅烷基)丙基)丙-1-铵、3-(甲基(3-(三甲氧基甲硅烷基)丙基)氨基)丙烷-1-磺酸、3-(3-(三甲氧基甲硅烷基)丙基氨基)丙烷-1-磺酸、2-(2-(三甲基甲硅烷基)乙氧基(羟基)磷酰基氧基)-n,n,n-三甲基乙铵、2-(2-(三甲氧基甲硅烷基)乙基(羟基)磷酰基氧基)-n,n,n-三甲基乙铵、n,n,n-三甲基-3-(n-3-(三甲氧基甲硅烷基)丙酰基氨磺酰基)丙-1-铵、n-((2h-四唑-5-基)甲基)-n,n-二甲基-3-(三甲氧基甲硅烷基)丙-1-铵、n-(2-羧基乙基)-n,n-二甲基-3-(三甲氧基甲硅烷基)丙-1-铵、3-(甲基(3-(三甲氧基甲硅烷基)丙基)氨基)丙酸、3-(3-(三甲氧基甲硅烷基)丙基氨基)丙酸、n-(羧基甲基)-n,n-二甲基-3-(三甲氧基甲硅烷基)丙-1-铵、2-(甲基(3-(三甲氧基甲硅烷基)丙基)氨基)乙酸、2-(3-(三甲氧基甲硅烷基)丙基氨基)乙酸、2-(4-(3-(三甲氧基甲硅烷基)丙基氨基甲酰基)哌嗪-1-基)乙酸、3-(4-(3-(三甲氧基甲硅烷基)丙基氨基甲酰基)哌嗪-1-基)丙酸、2-(甲基(2-(3-(三甲氧基甲硅烷基)丙基脲基)乙基)氨基)乙酸、2-(2-(3-(三甲氧基甲硅烷基)丙基脲基)乙基)氨基乙酸或它们的组合。包含多种纳米颗粒的组合物可用作诊断剂组合物。因此,本发明的另一方面涉及诊断剂组合物。诊断剂组合物包含多种前述纳米颗粒10。在一个实施方案中,诊断剂组合物进一步包含药学上可接受的载体和任选的一种或多种辅料。在一个实施方案中,药学上可接受的载体可基本为水。任选的辅料可包括盐、崩解剂、粘合剂、填料或润滑剂的一种或多种。小粒径可有利地促进从例如肾和其它器官清除。在一个实施方案中,所述多种纳米颗粒可具有最大约50nm的中值粒径。在另一个实施方案中,所述多种纳米颗粒可具有最大约10nm的中值粒径。在另一个实施方案中,所述多种纳米颗粒可具有最大约6nm的中值粒径。本发明的一个方面涉及制备纳米颗粒的方法。一般,一种方法包括(a)提供芯,所述芯具有基本不含二氧化硅的芯表面;和(b)布置壳结合到芯表面,其中壳包含硅烷官能化两性离子部分。在一个或多个实施方案中,提供芯的步骤包括提供第一前体物质,其中第一前体物质包含至少一种过渡金属。在一个实施方案中,第一前体物质反应产生包含至少一种过渡金属的芯。在一个实施方案中,第一前体物质分解产生芯。在另一个实施方案中,第一前体物质水解产生芯。在另一个实施方案中,第一前体物质反应生成芯。纳米颗粒合成方法在本领域是公知的,任何制备适合物质的纳米颗粒芯的适合方法均适用于此方法。在一个或多个实施方案中,布置壳的步骤包括提供第二前体物质,例如,包含硅烷部分或硅烷部分的前体的物质。硅烷部分可与芯反应,以形成包含硅烷部分的壳。在一些实施方案中,在与芯反应前,前体可经过水解反应。在一些实施方案中,硅烷部分可用至少一个两性离子部分或至少一个两性离子部分的前体而官能化。在其中硅烷部分用至少一个两性离子部分官能化的实施方案中,如此形成的壳包括硅烷官能化两性离子部分。在其中硅烷部分用两性离子部分的前体官能化的实施方案中,如此产生的壳可以不是两性离子性质,但可随后与适合试剂反应,以使前体转化成两性离子部分。在一个或多个实施方案中,第二前体物质包括硅烷官能化两性离子部分或硅烷官能化两性离子部分的前体,例如上述前体三烷氧基硅烷的一种或多种。可以理解,步骤的次序和/或组合可以改变。因此,根据一些实施方案,步骤(a)和(b)作为相继步骤进行,以从芯和第二前体物质形成纳米颗粒。举例来说但非限制,在一些实施方案中,第一前体物质包含至少一种过渡金属,其中芯包含至少一种过渡金属的氧化物,并且(a)步骤进一步包含第一前体物质的水解。根据一些实施方案,第一前体物质为过渡金属的醇盐或卤化物,并且水解过程包括使第一前体物质与酸和水在醇溶剂中结合。在一些实施方案中,硅烷可包含可聚合基团。聚合可通过酸催化的缩聚进行。在一些其它实施方案中,硅烷部分可物理吸附于芯上。在一些实施方案中,硅烷部分可进一步用其它聚合物官能化。所述聚合物可以为水溶性和生物相容性的。在一个实施方案中,所述聚合物包括但不限于聚乙二醇(peg)、聚乙烯亚胺(pei)、聚甲基丙烯酸酯、聚硫酸乙烯酯、聚乙烯吡咯烷酮或它们的组合。在一些实施方案中,芯包括金属氧化物。在一个实施方案中,金属氧化物芯可在有机酸存在下在金属醇盐水解时合成。在一些实施方案中,所述金属醇盐可以为醇钽,如乙醇钽,所述有机酸可以为羧酸,如异丁酸、丙酸或乙酸,所述水解反应可在醇溶剂如1-丙醇或甲醇的存在下进行。在另一个实施方案中,可使芯和第二前体物质相互接触。在一个实施方案中,第二前体物质可包括含硅物种,如有机官能化三烷氧基硅烷或有机官能化三烷氧基硅烷的混合物。至少一种有机官能化三烷氧基硅烷可包含至少一个两性离子基团或两性离子基团的前体,使得各个纳米颗粒可平均包含至少一个两性离子部分或两性离子部分的前体。在一个实施方案中,各个纳米颗粒可平均包含多个两性离子部分或两性离子部分的前体。在其它实施方案中,芯可用含至少两个硅烷部分的混合物处理。在一个实施方案中,一个硅烷部分用两性离子部分或两性离子部分的前体官能化,第二硅烷部分可不用任何两性离子部分官能化。带电荷的硅烷部分可同时或依次加入。在一些实施方案中,用两性离子部分或两性离子部分的前体官能化的一个或多个硅烷部分可同时或依次加到用非两性离子硅烷部分官能化的芯。在一个实施方案中,可使氧化钽芯与含季氮和磺酸盐基或羧基(例如,磺基甜菜碱基或甜菜碱基)两者的烷氧基硅烷反应,。在一个实施方案中,可使氧化钽芯与(ro)3si(ch2)xnr'2(ch2)yso3反应,其中r为烷基或芳基,x为1-10,y为1-10,r'为h、烷基或芳基。在一个实施方案中,r为烷基,如甲基或乙基,x为3,y为2-5之间,r'为h或烷基如甲基。在一个实施方案中,可在烷基磺内酯或烷基磺内酯混合物与胺取代的硅烷的开环反应时合成磺基甜菜碱官能化硅烷。在另一个实施方案中,可用烷基内脂或烷基内脂混合物代替烷基磺内酯。在某些实施方案中,壳包含磺基甜菜碱和甜菜碱官能化硅烷的混合物。在另一个实施方案中,金属氧化物芯可与磺基甜菜碱或甜菜碱官能化硅烷部分反应,其中可化学保护磺酸盐基或羧基。在另一个实施方案中,可使氧化钽芯与含胺的硅烷(如氨基官能化三烷氧基硅烷)反应,以生成用含胺硅烷官能化的氧化钽芯。在第二步骤中,可分离用硅烷官能化的芯。在一个替代实施方案中,可原位使用用硅烷官能化的芯。用硅烷官能化的芯可与烷基磺内酯、烷基内酯、卤代烷基羧酸或酯、烷基磺内酯的混合物、烷基内酯的混合物、卤代烷基羧酸或酯的混合物或烷基磺内酯和烷基内酯两者的混合物反应,以生成两性离子部分。磺内酯、内酯或磺内酯和/或内酯的混合物的量可足以提供平均每个纳米颗粒至少一个两性离子部分。烷基磺内酯的非限制实例包括丙磺内酯和丁磺内酯。内酯的非限制实例包括丙内酯和丁内酯。在一个实施方案中,所述方法进一步包括使多种纳米颗粒官能化。官能化步骤可包括过滤纳米颗粒。在另一个实施方案中,所述方法可进一步包括纯化多种纳米颗粒。纯化步骤可包括使用渗析、切向流过滤、渗滤或它们的组合。在另一个实施方案中,所述方法进一步包括分离经纯化的纳米颗粒。与任何上述实施方案组合,一些实施方案涉及制备用于x射线/计算机断层摄影或mri的诊断剂组合物的方法。诊断剂组合物包含多种纳米颗粒。在一些实施方案中,所述多种纳米颗粒的中值粒径可不大于约10nm,例如不大于约7nm,在特定实施方案中不大于约6nm。可以理解,根据一些实施方案,可选择所述多种纳米颗粒的粒径,以使纳米颗粒可基本由哺乳动物的肾(例如人肾)以微粒形式清除。在一些实施方案中,本发明涉及使用包含本文所述多种纳米颗粒的诊断剂组合物的方法。在一些实施方案中,所述方法包括向受试者(在一些情况下可以为活受试者,例如哺乳动物)体内或体外给予诊断剂组合物,随后用x射线/ct装置对受试者成像。上述纳米颗粒包含芯和壳,其中壳包含至少一个硅烷官能化两性离子部分。在一个实施方案中,芯包括氧化钽。纳米颗粒可通过多种已知方法引入受试者。将纳米颗粒引入受试者的非限制实例包括静脉内、动脉内或口服给药、皮部应用或直接注入肌肉、皮肤、腹膜腔或其它组织或身体隔室。在另一个实施方案中,所述方法包括向受试者给予诊断剂组合物,并用诊断装置对受试者成像。诊断装置利用成像方法,其实例包括但不限于mri、光学成像、光学相干断层摄影、x射线、计算机断层摄影、正电子发射断层摄影或它们的组合。在使用方法中,身体也可用诊断剂组合物预给药。上述诊断剂组合物包含多种纳米颗粒10。在一个实施方案中,使用诊断造影剂的上述方法进一步包括用诊断装置监测诊断剂组合物到受试者的输送,并诊断受试者,在此方法中,通常在保持医疗诊断成像设备的一般操作中可对数据进行编译和分析。诊断剂组合物可以是x射线或ct造影剂,例如包含氧化钽芯的组合物。诊断剂组合物可提供约100至约5000亨斯菲尔德单位范围内的ct信号。在另一个实例中,诊断剂组合物可以为mri造影剂,例如包含超顺磁性氧化铁芯的造影剂。本发明的一个实施方案提供测定本文所述纳米颗粒10(如具有氧化钽或氧化铁芯的纳米颗粒在受试者中分布的程度的方法。受试者可以为哺乳动物或包含组织样品或细胞的生物物质。所述方法可以是体内或体外方法。纳米颗粒可通过多种已知方法引入受试者。将纳米颗粒引入受试者的非限制实例包括任何上述已知方法。在一个实施方案中,所述方法包括(a)将纳米颗粒引入受试者,和(b)测定纳米颗粒在受试者中的分布。在受试者内的分布可用诊断成像技术确定,如前述那些技术。或者,纳米颗粒在生物物质中的分布可通过元素分析确定。在一个实施方案中,可用电感偶合等离子质谱(icp-ms)测定生物物质中纳米颗粒的浓度。本发明的另一方面涉及前述纳米颗粒10用于制造用作诊断剂组合物的组合物的用途。以下实施例被包括在内用于说明本发明的特定实施方案。本领域技术人员应了解,以下实施例中公开的方法仅代表本发明的示例性实施方案。然而,本领域技术人员鉴于本公开应理解,在不脱离本发明的精神和范围下,在所述具体实施方案中可作出许多变化而仍然得到相似或类似的结果。实施例通过以下实施例可更完全地理解本发明的实施,这些实施例仅为说明而在本文中提供,不应解释为以任何方式限制本发明。在实施例部分使用的缩略语阐释如下:“mg”:毫克;“ml”:毫升;“mg/ml”:毫克每毫升;“mmol”:毫摩尔;“μl”:微升;“lc”:液相色谱;“dls”:动态光散射;“di”:去离子水;“icp”:电感耦合等离子。除非另外提到,所有试剂级化学品按收到的使用,在所有水溶液制备中使用millipore水。合成基于氧化钽的纳米颗粒步骤1:合成n,n-二甲基-3-磺基-n-(3-(三甲氧基甲硅烷基)丙基)丙-1-铵将甲苯(无水,250ml)、n,n-二甲基氨基三甲氧基硅烷(25g,121mmol)和1,3-丙磺内酯(13.4g,110mmol)加入到含搅拌棒的500ml圆底烧瓶。在室温搅拌混合物4天。然后过滤混合物,以分离沉淀产物,随后用新的无水甲苯(2×60ml)洗涤。在真空下干燥后白色粉末的产量为23.6g。步骤2:n,n-二甲基-3-磺基-n-(3-(三甲氧基甲硅烷基)丙基)丙-1-铵与基于氧化钽的芯的反应方法-1:1-丙醇作为溶剂向含搅拌棒的250ml三颈圆底烧瓶加入1-丙醇(73ml),随后加入异丁酸(1.16ml,12.51mmol,相对于ta1.27eq)和di水(1.08ml,59.95mmol,相对于ta6.09eq),以形成反应混合物。使氮鼓泡通过反应混合物20分钟,随后在室温向反应混合物逐滴加入乙醇钽(ta(oet)5)(2.55ml,4g,9.84mmol),同时搅拌超过15分钟。在加入ta(oet)5期间,继续使氮鼓泡通过反应混合物。在加入ta(oet)5完成后,在氮下室温搅拌上述反应混合物16小时。在室温搅拌反应混合物16小时,然后从反应混合物取出等分试样(1.5ml),通过20nm滤膜过滤,并在过滤步骤后立即通过dls在水中测量粒径(作为流体动力学半径)。经测量,平均粒径为约3.6nm。使n,n-二甲基-3-磺基-n-(3-(三甲氧基甲硅烷基)丙基)丙-1-铵(4.03g,12.23mmol,相对于ta1.24eq)溶于50mldi水。经几分钟逐滴将此溶液加入上述反应混合物。无色均匀反应混合物立即变成混浊白色溶液,并且到硅烷官能化两性离子部分加入结束最终变成乳白色溶液。在加入完成后,将冷凝器连接到烧瓶,并将反应混合物保持在氮气覆盖层下。将烧瓶放入预热到75℃的油浴中,并搅拌反应混合物6小时。反应混合物变得更澄清。6小时后,在空气覆盖层下使反应混合物冷却到室温。不均匀反应混合物用1(m)nh4oh中和到ph6-7。在空气覆盖层下将反应混合物转移到第二圆底烧瓶。在将反应混合物转移到第二烧瓶期间,一定量白色物质保留在烧瓶中,并且不转移到第二烧瓶(粗产物a)。此粗产物a在氮气流下干燥过夜。同时,用旋转式蒸发器在50℃蒸发第二烧瓶的溶液。将溶液蒸发后得到的干燥白色残余物(粗产物b)在氮气流下放置过夜。使粗产物a干燥过夜。使此固体完全溶于di水。也使粗产物b完全溶于di水,将两个溶液(粗产物a和粗产物b)合并(总体积为60ml)。使水溶液依次通过450nm,200nm和100nm滤膜过滤,最后通过20nm滤膜过滤。然后,溶液首先用磷酸钠缓冲剂(10k分子量截断蛇皮再生纤维素管)在ph7.0渗析,然后在di水中渗析三次。最后,通过冻干分离纳米颗粒。白色粉末的产量=1.748g(38%基于ta的产率)。ζ-电势:(-)8.18mv。元素分析:38.3±0.3%ta,4.8±0.1%si。通过dls测量,平均粒径为8.9nm。纳米颗粒的纯度通过液相色谱(lc)/电感耦合等离子(icp)测量。方法-2:三氟乙醇作为溶剂向含搅拌棒的100ml三颈圆底烧瓶加入三氟乙醇(42ml)。在溶剂用氮鼓泡的同时,用注射器加入异丁酸(0.53ml,5.7mmol),随后加入水(0.13ml,7.4mmol)。利用连续氮鼓泡,将溶液搅拌另外15分钟。用注射器逐滴加入乙醇钽(ta(oet)5)(2g,4.9mmol)。将略微混浊的溶液在氮下室温搅拌17小时。使n,n-二甲基-3-磺基-n-(3-(三甲氧基甲硅烷基)丙基)丙-1-铵(实施例1,3.2g,9.8mmol)溶于水(15ml)。在空气下随着搅拌将此均匀无色溶液逐滴但快速加入含钽的反应混合物。烧瓶装上冷凝器,然后放入预热到78℃的油浴。在此温度搅拌6小时后,使无色均匀反应混合物冷却到室温。加水(20ml)后,在旋转式蒸发器中基本上去除三氟乙醇。将水溶液用浓氢氧化铵中和,然后依次通过200nm,100nm和20nm过滤器过滤。然后用3500mw截断再生纤维素蛇皮渗析管渗析溶液4次。第一渗析在di水和ph7.0磷酸盐缓冲剂之比为50:50进行。随后的渗析在di水中进行。经纯化的纳米颗粒产物不从水分离。用对等分试样的固体百分数试验测定,经涂布的纳米颗粒的产量为1.55g。通过动态光散射测定平均粒径为1.6nm。合成基于氧化钽的纳米颗粒步骤-1:合成2(4(3(三甲氧基甲硅烷基)丙基氨基甲酰基)哌嗪-1-基)乙酸乙酯将(3-异氰酸基丙基)三甲氧基硅烷(4.106g)加入到乙基乙酰氧基哌嗪(3.789g)在二氯甲烷(20ml)中的溶液。将溶液搅拌16小时,然后在减压下去除溶剂,得到8.37g物质,此物质无需进一步纯化而使用。步骤-2:2-(4-(3-(三甲氧基甲硅烷基)丙基氨基甲酰基)哌嗪-1-基)乙酸乙酯与基于氧化钽的芯的反应向500ml圆底烧瓶加入正丙醇(99ml)、异丁酸(1.4ml)和水(1.2ml)。将溶液搅拌5分钟,然后向溶液逐滴加入ta(oet)5(5.37g)。在氮气下室温搅拌溶液18小时。然后将总共60ml此溶液加入到2-(4-(3-(三甲氧基甲硅烷基)丙基氨基甲酰基)哌嗪-1-基)乙酸乙酯(6.37g),并在氮气下在100℃搅拌溶液2小时。然后使混合物冷却到室温,加入水(20ml),并将此混合物室温搅拌18小时。然后加入总共75ml0.33n盐酸水溶液,并将溶液加热到60℃经历6小时。然后使混合物冷却到室温,加入250ml28%氨水,并搅拌混合物5天。在减压下去除氨和丙醇,然后将物质倒入3,000分子量截断再生纤维素渗析管,并对蒸馏水渗析48小时,每12小时改变渗析缓冲剂。然后使溶液通过30,000分子量截断离心过滤器过滤,得到通过dls测量具有4.5nm平均粒径的颗粒。合成基于氧化铁的纳米颗粒合成超顺磁性氧化铁纳米颗粒向100ml三颈圆底烧瓶加入706mgfe(acac)3和20ml无水苯甲醇。将溶液用氮气鼓泡,然后在氮气氛下加热到165℃经历2小时。然后将溶液冷却到室温,并在室温储存。2-(4-(3-(三甲氧基甲硅烷基)丙基氨基甲酰基)哌嗪-1-基)乙酸乙酯与超顺磁性氧化铁的反应用50ml四氢呋喃稀释超顺磁性氧化铁纳米颗粒在苯甲醇中的10ml等分试样(5.58mgfe/ml)。加入2.00g2-(4-(3-(三甲氧基甲硅烷基)丙基氨基甲酰基)哌嗪-1-基)乙酸乙酯,随着搅拌将混合物加热到60℃经历2小时,然后冷却至室温。加入50ml1.0m含水碳酸钾,随后将烧瓶密封,并在搅拌下加热到60℃经历18小时。然后使混合物冷却,离心,将含水层倒入10,000分子量截断再生纤维素渗析管,对4升10mm柠檬酸钠渗析48小时,每12小时改变渗析缓冲剂。最终体积为94ml,每ml溶液总共0.416mg铁。通过动态光散射测量,物质具有在150mm含水氯化钠中8.4nm的平均粒径。n,n-二甲基-3-磺基-n-(3-(三甲氧基甲硅烷基)丙基)丙-1-铵与超顺磁性氧化铁的反应将超顺磁性氧化铁纳米颗粒在苯甲醇中的16.75ml等分试样(5.58mgfe/ml)加到四氢呋喃,总体积为94.5ml。然后,将此溶液与3.1gn,n-二甲基-3-磺基-n-(3-(三甲氧基甲硅烷基)丙基)丙-1-铵加到压力烧瓶,并在搅拌下将混合物加热到50℃经历2小时。在冷却到室温后,加入总共31ml异丙醇和76ml浓含水氢氧化铵(28%nh3,在水中),然后将烧瓶密封,并在搅拌下加热到50℃经历18小时。使混合物冷却,并用己烷(100ml×3)洗涤。将含水层倒入10,000分子量截断再生纤维素渗析管,对4升10mm柠檬酸钠渗析18小时。最终溶液具有总共0.67mg铁/ml溶液。此物质具有9.2nm粒径。测定水中纳米颗粒的粒径和稳定性使来自方法1的纳米颗粒(36.2mg)溶于2mldi水。使溶液通过20nm滤膜过滤。在过滤步骤后立即通过动态光散射(dls)测量平均粒径,作为流体动力学半径。将样品在37℃储存15天,同时通过dls定期监测。结果显示于表1中。表-1时间(t)平均粒径*010.1nm5天12.8nm15天12.2nm*平均粒径在37℃用dls测量。纳米颗粒生物分布研究用大小范围在150和500克体重之间的雄性lewis大鼠进行体内研究。将大鼠饲养于随意地具有食物和水并具有12小时昼夜光照循环的标准箱中。用于生物分布的所有动物在其它方面为未处理的正常受试者。纳米颗粒作为在水或盐水中的过滤除菌溶液给予。通过插入侧尾静脉的26g导管,在异氟烷麻醉(4%诱导,2%维持)下进行给药。注射体积根据注射液中纳米颗粒的浓度和大鼠的大小确定,但一般小于啮齿动物血液体积的10%。目标剂量为100mg芯金属(例如,钽)/kg体重。一旦注射,就使动物脱离麻醉,在观察负作用阶段后,回到标准箱。在短到几分钟至长达6个月的后一阶段,使大鼠安乐死,获得关注的器官,称重,并通过icp分析法分析它们的总金属(例如钽)含量。与器官一起,提交经注射物质的样品,以测定注射液的精确浓度。这些组合数据确定关注的组织中保留的注射剂量的百分数(“%id”)。将这些数据报告为%id/器官或%id/克组织。一般在各时间点用四只完全相同的大鼠进行试验,从而允许测定试验误差(±标准偏差)。表-2涂层肾(%id/器官)肝(%id/器官)脾(%id/器官)二乙基磷酰基乙基三乙氧基硅烷(phs)4.2±0.432.57±0.640.16±0.05n,n-二甲基-3-磺基-n-(3-(三甲氧基甲硅烷基)丙基)丙-1-铵(szwis)0.29±0.050.24±0.02ndn-(2-羧基乙基)-n,n-二甲基-3-(三甲氧基甲硅烷基)丙-1-铵(czwis)0.70±0.470.33±0.030.04±0.01表2描述在iv注射后1星期,在主清除器官中,经分级的具有非两性离子涂层(phs)和两性离子涂层(szwis和czwis)的纳米颗粒的生物分布。“nd”代表“未检测”。每器官保留的钽量在表2中表示为注射剂量的分数。和试验的两性离子涂层的任何一个相比,可比地经过大小分类的非两性离子涂布的纳米颗粒以高得多的水平得到保持(几乎一个数量级)。虽然本文说明和描述了本发明的仅仅某些特征,但本领域技术人员会想到很多修改和变化。因此应理解,权利要求旨在覆盖落入本发明真实精神之内的所有这些修改和变化。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1