脑部引经药修饰的脑靶向纳米给药系统及其制备方法与流程
本发明属于生物医药领域,涉及一种脑靶向纳米给药系统,具体来说是一种脑部引经药修饰的脑靶向纳米给药系统及其制备方法。
背景技术:
由于血脑屏障(blood-brainbarrier,bbb)的存在,98%以上的药物难以入脑,药物的脑内递送技术已成为当今药剂学研究的热点。常用的脑靶向策略主要有以下几种:①内源性转运蛋白介导、②纳米系统包载、③通过鼻腔给药绕过bbb、④bbb外排抑制、⑤短暂开放bbb。由于单一靶向策略提高药物脑内递送的能力有限,还远远不能达到脑部疾病治疗的要求,目前越来越多的脑靶向研究趋于将多种靶向策略相结合以进一步提高脑部疾病的治疗效果。
中医引经理论认为,通过引经可以改变其它药物的作用方向或部位,或使其作用侧重于或集中于特定的方向和部位,这种具有可以改变其它药物的作用方向或部位的药物称为引经药。中药的引经理论与西药的靶向理论有着异曲同工之妙,即都是把药物送到病变部位,提高药物的选择性作用。药物动力学实验证实脑部引经药冰片可增强川芎、顺铂等多种药物在脑内的浓度,体现靶向作用,为引经与靶向的相似性关系提供了现代依据。冰片、石菖蒲等芳香开窍中药是常见的脑部引经药。
技术实现要素:
针对现有脑内药物递送技术中的上述技术问题,本发明提供了一种脑部引经药修饰的脑靶向纳米给药系统及其制备方法,所述的这种脑部引经药修饰的脑靶向纳米给药系统及其制备方法要解决现有技术中的治疗脑部疾病的药物效果不佳的技术问题。
本发明提供了一种脑部引经药修饰的脑靶向纳米粒给药系统,由脑部引经药,纳米递药系统和脑部疾病治疗药物组成,所述的脑部引经药为冰片或β-细辛醚中的任意一种或者两种的组合,所述的纳米递药系统为聚合物纳米粒或者固体脂质纳米粒。
进一步的,所述的聚合物纳米粒为聚乙二醇化的聚酯类共聚物,其中,聚乙二醇的分子量为2000-5000,聚乙二醇化的聚酯类共聚物的分子量为20000-55000。
进一步的,所述的固体脂质纳米粒为硬脂酸和磷脂制成的固体脂质纳米粒。
具体的,所述的固体脂质纳米粒可以由三酰甘油酯(如三硬脂酸),部分甘油酯(如单硬脂酸甘油酯,甾体类(胆固醇等)等经高压乳匀法、乳化-溶剂挥发法、薄膜分散法或乳化蒸发-低温固化法制备。
进一步的,所述的脑部疾病治疗药物为止痛药,脑血管病治疗药物或抗肿瘤药物。
进一步的,所述的止痛药可以是延胡索乙素、青藤碱或冬凌草甲素;脑血管病治疗药物可以是丹参酮或葛根素;抗肿瘤药物可以是多烯紫杉醇或阿霉素。
进一步的,所述的脑部引经药的质量为脑靶向纳米粒给药系统总质量的2%-20%。
本发明还提供了上述的一种脑部引经药修饰的脑靶向纳米粒给药系统的制备方法,脑部引经药通过物理包载或化学共价连接的方法修饰到聚乙二醇聚酯纳米粒或固体脂质纳米粒上,脑部疾病治疗药物包载于脑部引经药修饰的脑靶向纳米粒给药系统中。
进一步的,将冰片/氨基修饰的冰片或β-细辛醚/氨基修饰的β-细辛醚,通过氨基-nhs或羟基-羧基共价键连接到聚乙二醇化的聚酯类共聚物或者硬脂酸上,得到引经药修饰的聚合物材料及脂质材料。
进一步的,采用单乳法或复乳法制备脑部引经药修饰的脑靶向纳米粒给药系统。
进一步的,所述的脑部引经药通过物理包载或化学共价连接的方法修饰到聚乙二醇化的聚酯纳米粒或固体脂质纳米粒上。
进一步的,物理包载法将引经药与脑部疾病治疗药物一起加入到油相中制备纳米粒。
进一步的,化学修饰法中引经药修饰的聚合物材料或脂质材料可以但不限于:冰片硬脂酸酯,冰片接枝聚乙二醇聚乳酸,β-细辛醚接枝聚乙二醇聚乳酸。
进一步的,氨基修饰的β-细辛醚通过以下方法制备:β-细辛醚先通过碳链上的双键与溴化氢加成,反应产物通过gabriel反应将碳链上的溴转成氨基。即通过邻苯二甲酰亚胺和氢氧化钾的乙醇溶液作用发生反应转变为邻苯二甲酰亚胺盐,该盐和β-细辛醚溴代产物生成了n-烷基领苯二甲酰亚胺,然后在碱性的条件下水解得到了氨基修饰的β-细辛醚。
进一步的,冰片接枝聚乙二醇聚乳酸,β-细辛醚接枝聚乙二醇聚乳酸通过以下方法制备:nhs-peg-plga与(r)-(+)莰胺或氨基修饰的β-细辛醚及n,n-二异丙基乙胺,在室温下反应即得。
进一步的,将未修饰聚合物材料或脂质材料,引经药修饰聚合物材料或脂质材料溶解于含有脑部疾病治疗药物的有机溶剂溶液形成有机相,逐滴和水相混合,搅拌后旋转蒸发,浓缩、固化即得化学修饰法制备的脑部引经药修饰的脑靶向纳米粒给药系统。
进一步的,将未修饰聚合物材料或脂质材料,引经药溶解于含有脑部疾病治疗药物的有机溶剂溶液形成有机相,逐滴和水相混合,搅拌后旋转蒸发,浓缩、固化即得物理包载法修饰的脑部引经药修饰的脑靶向纳米粒给药系统。
进一步的,将未修饰聚合物材料或脂质材料,引经药修饰聚合物材料或脂质材料加至含有脑部疾病治疗药物的有机溶液中,溶解完全后加入水相混合,探针超声形成初乳,再加入表面活性剂溶液,探针超声,分散,磁力搅拌,旋蒸除去有机溶剂,即得化学修饰法制备的脑部引经药修饰的脑靶向纳米粒给药系统。
进一步的,将未修饰聚合物材料或脂质材料,引经药加至含有脑部疾病治疗药物的有机溶液中,溶解完全后加入水相混合,探针超声形成初乳,再加入表面活性剂溶液,探针超声,分散,磁力搅拌,旋蒸除去有机溶剂,即得物理包载法修饰的脑部引经药修饰的脑靶向纳米粒给药系统。
本发明制备的脑部引经药修饰的脑靶向纳米给药系统可用于静脉或鼻腔给药,用于止痛、治疗脑肿瘤和脑血管疾病(如脑缺血再灌注损伤)。并可进一步进行rgd等其他二级靶向分子修饰。
本发明采用的冰片或β-细辛醚为分子量小的脂溶性物质,它们不仅本身易透过bbb,还可引药上行,通过抑制p-糖蛋白的活性,抑制一氧化氮合成等多种机制促进其它药物透过bbb。此外还具有调节bbb通透性,改善bbb功能和保护脑组织的作用。
本发明的递药系统由聚合物纳米粒或固体脂质纳米粒组成,通过修饰的引经药促进纳米粒跨越血脑屏障转运。本发明将引经理论应用于靶向给药系统,以脑部引经药修饰微粒表面,或包载于纳米粒中与治疗药物同时给药,提供一种新型脑部引经药修饰的脑靶向纳米给药系统,由于引经药对脑部组织细胞的选择性生理性改变,增加给药系统对靶器官脑的识别能力,直接增强治疗药物在靶器官的浓集,从而降低毒性,增强治疗效果。
本发明利用具有鼻腔粘膜和血脑屏障促透性能的脑部引经药为脑靶向头基,修饰聚合物材料或脂质材料制备的纳米粒,构建得到脑部引经药修饰的脑靶向纳米给药系统。本发明利用引经药促进纳米粒在鼻腔粘膜和血脑屏障的转运,提供一种安全有效的提高药物脑内递送的方法,具有良好的应用前景。
本发明和已有技术相比,其技术进步是显著的。本发明以安全有效的中医脑部引经药为脑靶向功能分子,提高纳米系统的脑内递送能力,安全性高,且该脑靶向功能分子为小分子化合物,与多肽蛋白类靶向功能分子相比,具有制备简单,稳定性高的特点,具有较好的应用前景。
附图说明
图1为中医脑部引经药修饰脑靶向纳米给药系统的tem图;其中,a为物理包载法制备的冰片修饰载葛根总黄酮固体脂质纳米粒;b为化学修饰法制备的冰片修饰载葛根总黄酮固体脂质纳米粒;c为化学修饰法制备的冰片修饰载丹参酮iia聚乙二醇聚乳酸纳米粒;d为化学修饰法制备的β-细辛醚修饰载丹参酮iia聚乙二醇聚乳酸纳米粒;e为物理包载法制备的冰片修饰载丹参酮iia聚乙二醇聚乳酸纳米粒;f为物理包载法制备的β-细辛醚修饰载丹参酮iia聚乙二醇聚乳酸纳米粒;g为化学修饰法制备的冰片,rgd肽共修饰载多西紫杉醇聚乙二醇聚乳酸纳米粒;h为化学修饰法制备的冰片修饰载多西紫杉醇聚乙二醇聚乳酸纳米粒。
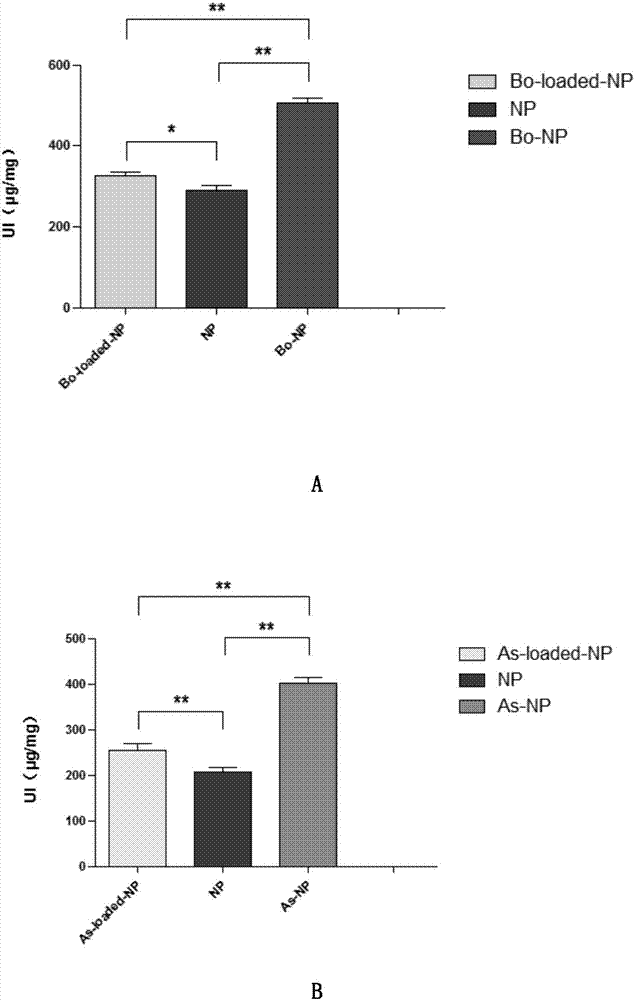
图2为冰片(bo)和β-细辛醚(as)不同修饰方法对16hbe细胞摄取载coumarin-6聚乙二醇聚乳酸纳米粒的影响*p<0.05,**p<0.01。
图3鼻腔给予物理包载(ptf-bo-sln)和化学修饰法(ptf-bo-sa-sln)制备冰片修饰载葛根总黄酮固体脂质纳米粒后,脑内葛根总黄酮的药时曲线。
图4是几种修饰后slns的体外释放曲线图。
图5显示了,大鼠鼻腔给予含同等剂量的coumarin-6纳米粒1h后,脑组织切片中coumarin-6荧光信号情况,coumarin-6-bo-sa-slns较强(a),其次是coumarin-6-bo-slns组(b)和coumarin-6-np组(c),原料药组最弱(d)。
图6显示了包载丹参酮ⅱa纳米粒对于缺血再灌注损伤的预防作用,模型组较普通纳米粒组脑内mda含量明显升高,(p<0.05)。而与tsa-np组比较,冰片修饰bo-tsa-np组和β-细辛醚修饰as-tsa-np组的脑组织mda含量均显著下降(p<0.01)。
具体实施方式
实施例1
冰片硬脂酸酯通过以下方法制备:精密称取56.8g硬脂酸于250ml三颈烧瓶中于,加入28.6mgsocl2,70℃反应2h后升温至90℃反应2h,冷却,加50mlch2cl2备用。精密称取30.9gbo溶于100mlch2cl2冰浴下加入上述制备的酰氯室温搅拌反应48h,加入三乙胺,抽滤,干燥。滤液加入乙醇沉淀,抽滤干燥即得。
实施例2
以30ml0.5%poloxamer188为水相;以30ml甲醇溶解硬脂酸、冰片硬脂酸酯、磷脂e80和葛根总黄酮,作为有机相。两相均预热至(75±2)℃。搅拌下,用5#针头将有机相缓慢地注入水相中,继续搅拌,将体系浓缩至10ml,将该体系迅速倾入1000rpm搅拌的0~2℃固化水相中,固化0.5h,定容至15ml,即得冰片化学修饰载葛根总黄酮固体脂质纳米粒(ptf-bo-sa-slns),见图1b。
实施例3
以30ml0.1%poloxamer188水溶液为水相,硬脂酸(75mg)、bo(30mg)、磷脂e80(225mg)和ptf(60mg)溶解于10ml甲醇为有机相,将两相均置于(75±2)℃条件下预热。在1200rpm搅拌下,用5#针头将有机相缓慢地注入水相中,继续搅拌,将体系浓缩至10ml,将该体系迅速倾入1200rpm搅拌的0~2℃固化水相(2ml0.5%poloxamer188水溶液)中,固化0.5h,定容至15ml,即得冰片物理修饰载葛根总黄酮固体脂质纳米粒ptf-bo-slns,见图1a。
实施例4
将28mg材料(bo-plga-mpeg:plga-mpeg=1:20,w/w)加至1ml含有丹参酮(1.4mg)的二氯甲烷溶液中溶解完全后,加入50μl的超纯水,探针超声30s(210w),再加入1%的胆酸钠2ml,探针超声1min(间断2s)(210w),最后加至20ml的0.5%胆酸钠中,磁力搅拌30min,旋蒸除去有机溶剂,即得冰片化学修饰载丹参酮iia聚乙二醇聚乳酸纳米粒,见图1c。
实施例5
将28mg材料(as-plga-mpeg:plga-mpeg=1:20,w/w)加至1ml含有丹参酮(1.4mg)的二氯甲烷溶液中溶解完全后,加入50μl的超纯水,探针超声30s(210w),再加入1%的胆酸钠2ml,探针超声1min(间断2s)(210w),最后加至20ml的0.5%胆酸钠中,磁力搅拌30min,旋蒸除去有机溶剂,即得β-细辛醚化学修饰载丹参酮iia聚乙二醇聚乳酸纳米粒,见图1d。
实施例6
将材料(28mgas-plga-mpeg和5.0μg冰片氨)加至1ml含有丹参酮(1.4mg)的二氯甲烷溶液中溶解完全后,加入50μl的超纯水,探针超声30s(210w),再加入1%胆酸钠2ml,探针超声1min(间断2s)(210w),最后加至20ml的0.5%胆酸钠中,磁力搅拌30min,旋蒸除去有机溶剂,即得物理修饰法制备的冰片修饰载丹参酮iia聚乙二醇聚乳酸纳米粒,见图1e。
实施例7
将材料(28mgbo-plga-mpeg和6.0μg氨基细辛醚)加至1ml含有丹参酮(1.4mg)的二氯甲烷溶液中溶解完全后,加入50μl的超纯水,探针超声30s(210w),再加入1%胆酸钠2ml,探针超声1min(间断2s)(210w),最后加至20ml的0.5%胆酸钠中,磁力搅拌30min,旋蒸除去有机溶剂,即得物理修饰法制备的β-细辛醚修饰载丹参酮iia聚乙二醇聚乳酸纳米粒,见图1f。
实施例8
将聚合物材料以bo-peg-plga:nhs-peg-plga:mpeg-plga=1:1:8(w/w)的比例溶解于含有0.75mg/ml多西紫杉醇的乙腈溶液,逐滴加入2ml双蒸水,1200rpm搅拌1h后旋转蒸发即得化学修饰法制备的冰片修饰载多西紫杉醇聚乙二醇聚乳酸纳米粒,见图1h。
实施例9
将聚合物材料以bo-peg-plga:nhs-peg-plga:mpeg-plga=1:1:8(w/w)的比例溶解于含有0.75mg/ml多西紫杉醇的乙腈溶液,逐滴加入2ml双蒸水,1200rpm搅拌1h后旋转蒸发,加入1mg/mlrgd30μl,搅拌9h,即得化学修饰法制备的冰片,rgd肽共修饰载多西紫杉醇聚乙二醇聚乳酸纳米粒,见图1g。
实施例10
将ptf-bo-sa-slns、ptf-bo-slns、ptf-slns和ptf原料药(含ptf3mg/ml),在漏槽条件下,分别加入50ml37℃anf和5%血浆,将介质提前在50rpm下预热。三种制剂(ptf-bo-sa-slns、ptf-bo-slns、ptf-slns)和ptf原料药,每种分为6份,分别装入透析袋中,其中3份加入人工鼻液中、另外3份加入5%血浆中,于37℃、50rpm的恒温水浴振荡器中。在设定时间点(0.083h、0.25h、0.5h、1h、2h、4h、8h和12h)取样,每次取出1ml样品,并且补充1ml的37℃同种新鲜介质。用hplc测定样品中pue的峰面积,通过标准曲线计算出ptf浓度,得到几种修饰后slns的体外释放曲线图,见图4。
通过图4可以看出,引经药修饰后并不改变纳米粒的缓释特性,修饰后的纳米粒依然具有较好的缓释效果。
实施例11
16hbe细胞,按照105个/ml的密度接种至24孔板中,培养一天,吸去培养液,加入hbss平衡液(37℃,1ml/孔)预先孵育15min后,弃去hbss平衡液后,加入用hbss稀释后的载香豆素的未修饰(coumarin-6-np),物理修饰(bo-loaded-coumarin-6-np,as-loaded-coumarin-6-np)和化学修饰(bo-coumarin-6-np、as-coumarin-6-np)的纳米粒,考察不同修饰方法、对16hbe摄取纳米粒的影响。以“摄取指数(uptakeindex)”作为评价指标,即药物浓度与细胞蛋白浓度的比值,表示单位浓度细胞蛋白中所含有的药物浓度,结果见图2。
图2表明,不同修饰方法修饰后的纳米粒可以显著提高16hbe细胞对其的摄取。
实施例12
sd大鼠鼻腔给予载ptfslns(100μl,含ptf317.5μg)。给药后,于0.5h、1h、2h、4h和8h处理取脑以质谱测定脑内ptf含量,考察不同修饰方法纳米递药系统的脑内递药特性,结果见图3。
图3表明,冰片修饰后的纳米粒可以显著提高其所包载葛根总黄酮的入脑量。
实施例13
取雄性sd大鼠,鼻腔给予40μg/ml游离coumarin-6(图5,d)或含同等剂量coumarin-6的未修饰(图5,c),物理(图5,b)及化学(图5,a)修饰bo的纳米粒50μl。于给药后1h处死大鼠,分离大脑,4%多聚甲醛固定。经pbs漂洗,蔗糖溶液脱水,经o.c.t.包埋后,冰冻切片(片厚10μm),用1μg/mldapi进行染色,再用pbs漂洗,磷酸甘油封片。激光共聚焦显微镜观察切片中coumarin-6荧光信号,并拍照记录。由图5可知,给药1h后,脑组织切片中coumarin-6荧光信号以coumarin-6-bo-sa-slns较强,其次是coumarin-6-bo-slns组,原料药组最弱。冰片修饰后的纳米粒可以显著提高其所包载药物的入脑量。
实施例14
大鼠在脑缺血2h再灌注24h后,进行麻醉,直接取脑,自大脑纵裂将脑切开。将左半脑秤重,按照1∶9(w/v)比例加入冰冷的生理盐水,从而制备成10%的脑组织匀浆液,以2500rpm,离心10min后,取其上清液,于-20℃低温冰箱保存,用作mda含量测定。结果(见图6)表明模型组和tsa-np组相比差异有统计学意义(p<0.05)。与tsa-np组比较,bo-tsa-np组和as-tsa-np组的脑组织mda含量均显著下降(p<0.01),提示引经药修饰纳米粒能促进丹参酮ⅱa使脑缺血再灌注大鼠的脑组织过氧化程度受到明显抑制,对于大鼠脑缺血再灌注损伤具有很好的保护作用。
- 还没有人留言评论。精彩留言会获得点赞!
- 靶向脑胶质瘤的双重修饰脂质体给药系统的制备和应用的制作方法与工艺
- 一种基于强电荷修饰的靶向基团作为药物包覆剂的设计方法与流程
- 用于靶向遗传修饰的方法和组合物,以及这些组合物的使用方法与流程
- DUOX2修饰的DC疫苗及其靶向杀伤胰腺癌起始细胞的应用的制造方法与工艺
- 用于猪APN基因编辑的靶向sgRNA、修饰载体及其制备方法和应用与流程
- 脑部引经药修饰的脑靶向纳米给药系统及其制备方法与流程
- 肿瘤抑制基因的杂合修饰和1型神经纤维瘤病的猪模型的制造方法与工艺
- 修饰的人类U1snRNA分子、编码修饰的人类U1snRNA分子的基因、包括该基因的表达载体及其在基因治疗中的用途的制造方法与工艺
- 用于通过单步多重靶向进行靶向遗传修饰的方法和组合物与流程
- 导致单性结实坐果的经修饰的基因的制造方法与工艺
- 靶向PD-1的多肽及其应用的制造方法与工艺
- 靶向同位素生产系统的制造方法与工艺
- 在制备68GA‑螯合物官能化的靶向剂中用作金属抑制剂的单糖、二糖或多糖的制造方法与工艺
- 用于引导和靶向按需物质递送的纳米结构的载体的制造方法与工艺
- 通过PROSTRATIN靶向K‑RAS介导的信号转导通路和恶性肿瘤的制造方法与工艺
- 肿瘤靶向核磁共振/荧光双模态成像造影剂及其制备和应用的制造方法与工艺
- pH氧化还原双敏感的PAMAM靶向纳米给药载体及其制备方法与制造工艺
- 具有卵巢肿瘤靶向D构型多肽及其基因递释系统的制造方法与工艺
- 靶向survivin纳米抗体及其制备方法和应用与制造工艺
- 用于PSMA靶向的成像和放射疗法的金属/放射性金属标记的PSMA抑制物的制造方法与工艺
- 阻断UBE2M介导Neddylation修饰在肾细胞癌治疗中的应用的制造方法与工艺
- 无载体共组装肿瘤靶向抗癌纳米药物及其制备方法与应用与流程
- 一种用于判断靶向单克隆抗体治疗肿瘤疗效的预测分子的制造方法与工艺
- 一种靶向CD47的免疫检查点抑制剂药物组合物及其制备方法与流程
- 具有淋巴靶向功能的生物自组装纳米晶注射剂及制备方法与流程
- 用于检测肝癌的基因标志物及其用途的制造方法与工艺
- 特异性shRNA筛选及其靶向Ang‑2基因抑制肺癌细胞的验证方法与流程
- 一种多功能自动化生物细胞提取分离控制系统及采用该系统实现的细胞提取分离方法与流程
- 一种融合蛋白及光敏剂复合物及其制备方法和应用与流程
- 具有可视化和显示光斑边界功能的光动力治疗系统的制造方法与工艺
- 肿瘤靶向核磁共振/荧光双模态成像造影剂及其制备和应用的制造方法与工艺
- pH氧化还原双敏感的PAMAM靶向纳米给药载体及其制备方法与制造工艺
- 具有卵巢肿瘤靶向D构型多肽及其基因递释系统的制造方法与工艺
- 靶向survivin纳米抗体及其制备方法和应用与制造工艺
- 用于PSMA靶向的成像和放射疗法的金属/放射性金属标记的PSMA抑制物的制造方法与工艺
- 一种线粒体靶向的粘度荧光探针及其制备方法和应用与制造工艺
- 一种兼具荧光可视、磁靶向和pH敏多功能的复合空心微球药物载体及其制备方法与制造工艺
- 一种用于修饰微泡的多肽以及靶向GBM的药物制剂的制造方法与工艺
- 白果内酯作为脑靶向增效剂在制备防治脑肿瘤药物的应用的制造方法与工艺
- 机器人辅助精确靶向穿刺软组织目标柔性针夹紧固定装置的制造方法
- 一种用于判断靶向单克隆抗体治疗肿瘤疗效的预测分子的制造方法与工艺
- 一种检测肺癌相关基因热点突变的试剂盒及其应用的制造方法与工艺
- 一种为肺癌提供离体个体化药物测试的方法及培养基与流程
- 一种谷胱甘肽/超声双重刺激响应纳米聚合物囊泡、其制备方法及应用与流程
- 一种多重刺激响应交联型聚合物纳米水凝胶、其制备方法及应用与流程
- 一种靶向CD47的免疫检查点抑制剂药物组合物及其制备方法与流程
- 具有淋巴靶向功能的生物自组装纳米晶注射剂及制备方法与流程
- 用于检测肝癌的基因标志物及其用途的制造方法与工艺
- 特异性shRNA筛选及其靶向Ang‑2基因抑制肺癌细胞的验证方法与流程
- 一种具有靶向功能仿病毒结构高分子囊泡及其制备与应用的制造方法与工艺