一种用于治疗恶性肿瘤的纳米药物缓释制剂及其制备方法与流程
本发明涉及医药技术领域,涉及一种用于治疗恶性肿瘤的纳米药物缓释制剂及其制备方法
背景技术:
近年来,我国恶性肿瘤发病率和死亡率居高不下,形式越来越严峻,特别是肺癌发病率及死亡率逐年攀升,已居于恶性肿瘤的首位,严重威胁着人类的健康。对于肺癌的治疗,主要有手术治疗、化疗、放疗、靶向治疗等,在各种治疗方法中,靶向治疗是治疗肺腺癌的重要手段。近年来,基于对肿瘤病灶部位的分子水平的研究,发现了许多新的治疗靶点,为开发新型的高效低毒的新药提供了可能。表皮生长因子受体(egfr)是一种膜受体,在多种恶性肿瘤如肺癌、肝癌、胃癌、肠癌、食管癌、乳腺癌、神经胶质瘤、卵巢癌、前列腺癌等中都有过度表达,激活egfr会加快肿瘤细胞增殖,促进肿瘤血管生成,加速肿瘤转移。因此,针对egfr的酪氨酸激酶抑制剂,可选择性阻断egfr信号转导系统,显示出良好的抗肿瘤活性。吉非替尼就是表皮生长因子受体酪氨酸激酶抑制剂的代表之一,它可以抑制肿瘤细胞的增殖,加速凋亡,减少肿瘤血管生成和抑制转移。但是随着吉非替尼的广泛应用和越来越多的研究表明,吉非替尼口服制剂存在着以下一些缺陷:水溶性差,溶解度受ph的影响较大;最大生物利用度仅为59%;口服吸收慢,tmax约为3-7小时;患者需长期用药,依耐性差;口服分布广泛,不良反应多,这样很难使药物在肿瘤局部发挥更好的治疗作用。因此,研究者们开始探索新的给药途径。在这个过程中,得益于化学和纳米技术的发展,各种抗肿瘤药物传输体系被开发出来,特别是能够通过静脉输注的具有靶向能力的纳米载药体系在肿瘤治疗中展现出广阔的运用前景。这种体系的优点在于药物能靶向富集到肿瘤部位,并且能克服口服药物的生物利用度低的弊端,增加药物在肿瘤部位的集聚,因而能够尽量减少药物的毒副作用,从而达到更好的疗效。
作为可生物降解的聚酯类聚合物是通过化学合成的高分子聚合物大家族中的重要一员,其中聚乳酸、聚己内酯、聚乳酸-羟基乙酸均聚合物,包括它们与聚乙二醇,或与泊洛沙姆形成的嵌段共聚物,其负载药物的高效性、优良的药物缓释特性、良好的生物相容性使它们都是具有广泛应用前景的药物载体。
技术实现要素:
本发明的目的在于提供一种用于恶性实体肿瘤靶向治疗的纳米药物缓释制剂及其制备方法,以及该药物制剂在恶性实体肿瘤治疗中的应用。该药物制剂采用高分子聚合物负载表皮生长因子受体酪氨酸激酶抑制剂纳米药物,通过静脉注射到体内,产生缓释、抗癌的作用;加之该制剂相对较小的全身毒副作用,从而达到更好的持续治疗效果。
本发明的技术方案如下:
一种用于治疗恶性肿瘤的纳米药物缓释制剂,该制剂由具有肿瘤生长抑制效应的表皮生长因子受体酪氨酸激酶抑制剂、高分子聚合物和冻干保护剂组成,其各组成成分的重量百分比为:
(1)表皮生长因子受体酪氨酸激酶抑制剂占1%-30%;
(2)高分子聚合物占70%-99%;
(3)冻干保护剂占0-15%。
所述的表皮生长因子受体酪氨酸激酶抑制剂(egfr-tki)选自吉非替尼、埃克替尼、厄洛替尼中的一种或几种。
所述的表皮生长因子受体酪氨酸激酶抑制剂(egfr-tki)选自吉非替尼盐酸盐、埃克替尼盐酸盐、厄洛替尼盐酸盐中的一种或几种。
所述的高分子聚合物为聚酯类高分子均聚物时,选自聚乳酸(pla)、聚己内酯(pcl)、聚乳酸-羟基乙酸(plga)中的一种或几种。
所述的高分子聚合物为聚醚-聚酯类高分子聚合物时,选自聚乙二醇与聚己内酯的聚合物(peg-pcl)、聚乙二醇与聚乳酸的聚合物(peg-pla)、聚乙二醇与-聚乳酸-羟基乙酸的聚合物(peg-plga)、泊洛沙姆与聚己内酯的聚合物(pluronic-pcl)、泊洛沙姆与聚乳酸的聚合物(pluronic-pla)、泊洛沙姆与聚乳酸-羟基乙酸聚合物(pluronic-plga)中的一种或几种。
所述的冻干保护剂选自于聚乙二醇、甘露醇、山梨醇、泊洛沙姆、葡萄糖、果糖、低聚糖、氨基酸、血清蛋白、胶原蛋白、明胶、钾盐、钠盐、磷酸盐缓冲液中的一种或几种。
所述高分子聚合物为均聚物、共聚物或嵌段聚合物,当高分子聚合物含有聚乙二醇嵌段时,聚乙二醇嵌段的分子量为500-20000,当高分子聚合物含有泊洛沙姆嵌段时,该泊洛沙姆嵌段分子量为1000-10000,高分子聚合物含有的聚己内酯,聚乳酸、聚乳酸-羟基乙酸嵌段分子量为1000-100000,各嵌段之间分子摩尔比为1-100:100-1,当高分子聚合物为均聚物时,聚己内酯、聚乳酸、聚乳酸-羟基乙酸的分子量为1000-100000。
一种根据上述用于治疗恶性肿瘤的纳米药物缓释制剂的制备方法,其特征在于:包括以下步骤:
(1)采用复乳法、透析法、薄膜乳化法、沉淀法、乳化挥发法或自组装法制得由高分子聚合物作为载体材料包裹抗肿瘤活性物质的纳米粒溶液;
(2)向纳米粒溶液中加入冻干保护剂冻干中,再复溶于生理盐水或葡萄糖注射液中,即制得纳米药物缓释制剂。
该缓释制剂可用于静脉注射、或口服、或瘤内注射,用于治疗除各类淋巴细胞白血病之外的各种恶性实体肿瘤。
有益效果
本发明所述的纳米药物缓释制剂是以高分子聚合物为载体负载一种或几种表皮生长因子受体酪氨酸激酶抑制剂制作而成,表皮生长因子受体酪氨酸激酶抑制剂以缓释纳米药物的形式存在,即将有抗癌作用的表皮生长因子受体酪氨酸激酶抑制剂包裹在聚合物为基质的纳米粒中,再加入冻干保护剂后制成纳米冻干粉剂,加入冻干保护剂使纳米药物溶液在冻干成粉末的过程中有效保护纳米药物颗粒的结构和稳定性,防止冻干过程中各种应力变化导致的药物稳定性下降或活性降低,有效阻止纳米药物颗粒团聚析出,有利于形成质量均一稳定的药物冻干粉,形成具有药物缓释特性的药物制剂。
本发明的表皮生长因子受体酪氨酸激酶抑制剂纳米药物缓释制剂通过静脉注射到鼠肺癌模型中,通过研究其体内外抗肿瘤作用,并观察动物的生存时间,研究结果表明该制剂通过静脉注射到动物模型后,起到持续抗肿瘤的作用,并且显著的延长了动物的生存时间,同时减少了口服给药途径引起的全身毒副作用,因此,该药物制剂是一种具有临床应用前景的,可用于肺癌靶向治疗的新制剂,其在临床运用中具有重要意义。
本发明制备方法简单,适宜于规模化生产,特别适应于制备可用于具有血液循环时间长、可体内生物降解、药物缓慢释放、被动靶向特征的抗肿瘤药物纳米制剂。采用本发明的方法制备的抗肿瘤纳米药物缓释制剂适合于采用静脉注射、肌肉注射、瘤内注射、瘤旁注射等方式管理,可应用于肺癌、肝癌、胃癌、肠癌、食道癌、鼻咽癌、子宫癌、乳腺癌、神经胶质瘤、卵巢癌、前列腺癌等恶性实体肿瘤的治疗,具有良好的应用前景。
附图说明
图1:吉非替尼纳米粒的粒径分析结果及电镜分析结果;
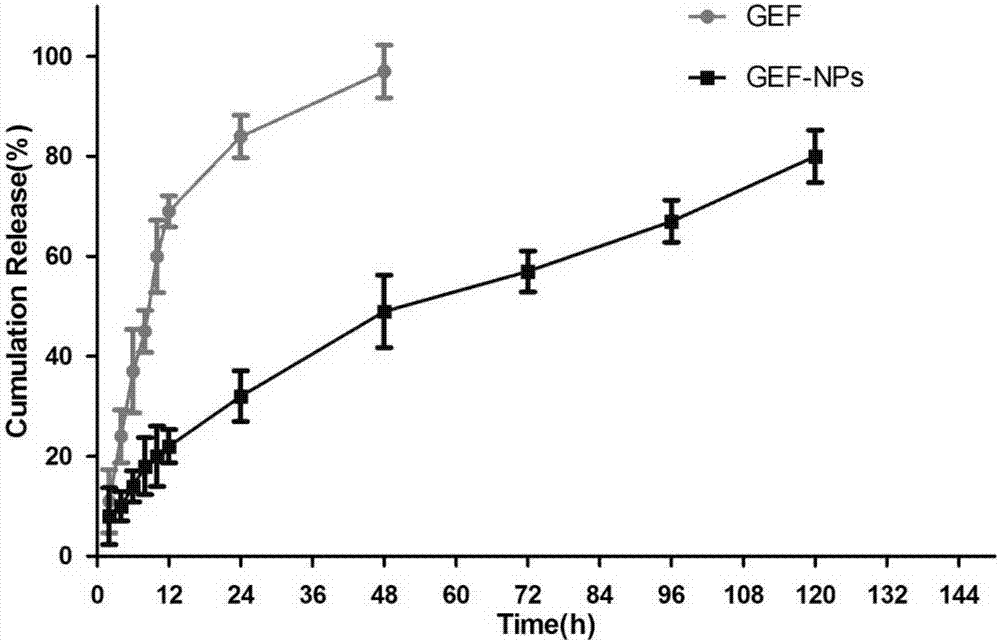
图2:吉非替尼纳米粒子和吉非替尼的体外药物释放。
具体实施方式
下面结合具体实施例,进一步阐述本发明,应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。
实施例1:
制备和应用负载吉非替尼的pla(聚乳酸)纳米缓释制剂:
采用乳化挥发法制备:称取10毫克吉非替尼和90毫克pla(聚乳酸)聚合物溶于5毫升二氯甲烷,再加入50毫升1%的泊洛沙姆f68水溶液中,在高速均质机于6000-15000转/分速度下剪切5-20分钟,然后在室温下减压旋转蒸发1小时除去有机溶剂,即得纳米粒混悬液,上述制得的纳米粒过滤及离心洗涤数次后,加入冻干保护剂冻干保存,上述制得的纳米粒子粒径控制在10-1000纳米范围内。
将冻干后的上述吉非替尼纳米药物粉剂复溶于生理盐水或葡萄糖注射液中,即制得吉非替尼纳米药物缓释注射剂,建立鼠肺癌模型,将制备的吉非替尼纳米药物注射剂通过尾静脉注射于荷瘤小鼠体内,检测肿瘤生长变化趋势及小鼠一般状况反应。
实施例2:
制备和应用负载吉非替尼的peg-pcl(聚乙二醇与聚己内酯的聚合物)纳米缓释制剂:
采用薄膜乳化法制备:称取10毫克吉非替尼和90毫克peg-pcl聚合物溶于5毫升无水乙醇,然后在室温下减压旋转蒸发1小时除去有机溶剂,加入温度为10-65℃的去离子水振荡、复溶即得纳米粒悬液,上述制得的纳米粒过滤后,加入冻干保护剂冻干保存,上述制得的纳米粒子粒径控制在10-1000纳米范围内。
将上述制备的吉非替尼纳米药物冻干粉复溶于生理盐水或葡萄糖注射液中,即制得吉非替尼纳米药物缓释注射剂,建立鼠肝癌模型,将制备的吉非替尼纳米药物注射剂通过尾静脉注射于荷瘤小鼠体内,检测肿瘤生长变化趋势及小鼠一般状况反应。
实施例3:
制备和应用负载埃克替尼的pluronic-plga(泊洛沙姆与聚乳酸-羟基乙酸的聚合物)纳米缓释制剂:
采用自组装法制备:称取20毫克埃克替尼和80毫克pluronic-plga聚合物溶于5毫升丙酮,再缓慢滴加入50毫升1%的泊洛沙姆f68水溶液中,然后在室温下减压旋转蒸发1小时除去有机溶剂,即得纳米粒混悬液,上述制得的纳米粒过滤及离心洗涤数次后,加入冻干保护剂冻干保存,上述制得的纳米粒子粒径控制在10-1000纳米范围内。
将冻干后的上述埃克替尼纳米药物粉剂复溶于生理盐水或葡萄糖注射液中,即制得吉非替尼纳米药物缓释注射剂,建立鼠胃癌模型,将制备的埃克替尼纳米药物注射剂通过尾静脉注射于荷瘤小鼠体内,检测肿瘤生长变化趋势及小鼠一般状况反应。
实施例4:
制备和应用负载盐酸厄洛替尼的plga(聚乳酸-羟基乙酸)纳米缓释制剂:
采用复乳法制备:称取15毫克盐酸厄洛替尼溶于1毫升去离子水中,称取85毫克plga聚合物溶于3毫升二氯甲烷,将盐酸厄洛替尼溶液加入plga的溶液中,搅拌并超声乳化,再在高速均质机的剪切下将乳化后的乳液滴加入50毫升1%的泊洛沙姆f68水溶液中,于6000-15000转/分速度下剪切5-20分钟,然后在室温下减压旋转蒸发1小时除去有机溶剂,即得纳米粒混悬液,上述制得的纳米粒粒径控制待过滤及离心洗涤数次后,加入冻干保护剂冻干保存,上述制得的纳米粒子粒径控制在10-1000纳米范围内。
将冻干后的上述盐酸厄洛替尼纳米药物粉剂复溶于生理盐水或葡萄糖注射液中,即制得盐酸厄洛替尼纳米药物缓释注射剂,建立鼠胰腺癌模型,将制备的盐酸厄洛替尼纳米药物注射剂通过尾静脉注射于荷瘤小鼠体内,检测肿瘤生长变化趋势及小鼠一般状况反应。
实施例5:
制备和应用埃克替尼的pluronic-pcl(泊洛沙姆与聚己内酯的聚合物)纳米缓释制剂:
采用透析法制备:称取10毫克埃克替尼和90毫克pluronic-pcl聚合物溶于5毫升dmso中,将该混合溶液装入透析袋(截留分子量为2000-20000),将透析袋放入含有1%的泊洛沙姆f68的水溶液中,于100转/分速度下搅拌透析,然后将上述经透析后的悬液取出,经过滤及离心洗涤数次后,加入冻干保护剂冻干保存,上述制得的纳米粒子粒径控制在10-1000纳米范围内。
将冻干后的上述埃克替尼纳米药物粉剂复溶于生理盐水或葡萄糖注射液中,即制得埃克替尼纳米药物缓释注射剂,建立鼠肺癌模型,将制备的埃克替尼纳米药物注射剂射于荷瘤小鼠肿瘤组织内,检测肿瘤生长变化趋势及小鼠一般状况反应。
实施例6:
制备和应用厄洛替尼的peg-pla(聚乙二醇与聚乳酸的聚合物)纳米缓释制剂:
采用沉淀法制备:称取15毫克厄洛替尼和85毫克peg-pla聚合物溶于1毫升dmso中,待药物和高分子聚合物完全溶解后,迅速滴加到含有10毫升去离子水中。待溶液中溶剂完全挥发后,将所得溶液过滤,并离心洗涤数次后,加入冻干保护剂冻干保存,上述制得的纳米粒子粒径控制在10-1000纳米范围内。
将冻干后的上述厄洛替尼纳米药物粉剂复溶于生理盐水或葡萄糖注射液中,即制得厄洛替尼纳米药物缓释注射剂,建立鼠乳腺癌模型,将制备的厄洛替尼纳米药物注射剂通过尾静脉注射于荷瘤小鼠体内,检测肿瘤生长变化趋势及小鼠一般状况反应。
- 还没有人留言评论。精彩留言会获得点赞!