攀登鱼藤异黄酮在制备预防和/或治疗宫颈癌药物中的应用的制作方法
本发明属于化合物应用技术领域,更具体地,涉及攀登鱼藤异黄酮在制备预防和/或治疗宫颈癌药物中的应用。
背景技术:
宫颈癌是危害女性健康的主要恶性肿瘤之一,在女性肿瘤中的发病率仅次于乳腺癌,而现有的抗肿瘤药物仍然存在毒性大、疗效较低等弊端,因此开发一种疗效好且毒副作用小的抗宫颈癌药物具有非常重要的意义。
一直以来植物天然产物在开发新的治疗恶性肿瘤药物中一直占有重要的地位,攀登鱼藤异黄酮(英文名称为warangalone)为柘树果实(fructusmacluraetricuspidatae)中分离得到的异黄酮类化合物,前期研究发现其具有较好的抗氧化活性,且对乳腺癌细胞mda-mb-231和mcf-7具有较好的抑制作用,但对抑制肿瘤细胞的分子机制并不清楚。且并不清楚其是否对其他肿瘤细胞存在较好的效果。
技术实现要素:
本发明提供了攀登鱼藤异黄酮在制备预防和/或治疗宫颈癌药物中的应用。
为了实现上述目的,本发明采用如下技术方案:
攀登鱼藤异黄酮在制备预防和/或治疗宫颈癌药物中的应用,所述攀登鱼藤异黄酮的结构式如下:
优选地,所述药物包括药学上可接受的盐或载体。
本发明针对warangalone选择性地抑制宫颈癌细胞进行了相关的抑制机制研究,其可通过抑制肿瘤细胞的侵袭和迁移来抑制肿瘤的转移能力,1μμ的warangalone的与阳性对照组顺铂(1μμ)的抑制效果相当。验证了warangalone是通过线粒体途径来诱导hela细胞凋亡。同时,ros的积累在warangalone诱导hela细胞凋亡通路中起着非常重要的作用,warangalone处理hela细胞后可能导致细胞内抗氧化剂或抗氧化酶系被氧化,使得ros不能被及时清除而大量积累,最终激活了线粒体凋亡通路和mapk信号通路。
与现有技术相比,本发明具有如下优点及有益效果:
本发明提供了攀登鱼藤异黄酮在制备预防和/或治疗宫颈癌药物中的新应用,本发明提供的攀登鱼藤异黄酮选择性的抑制宫颈癌细胞,并且呈时间-剂量依赖性,成分安全可靠,在药物开发方面具备较大的应用前景。
附图说明
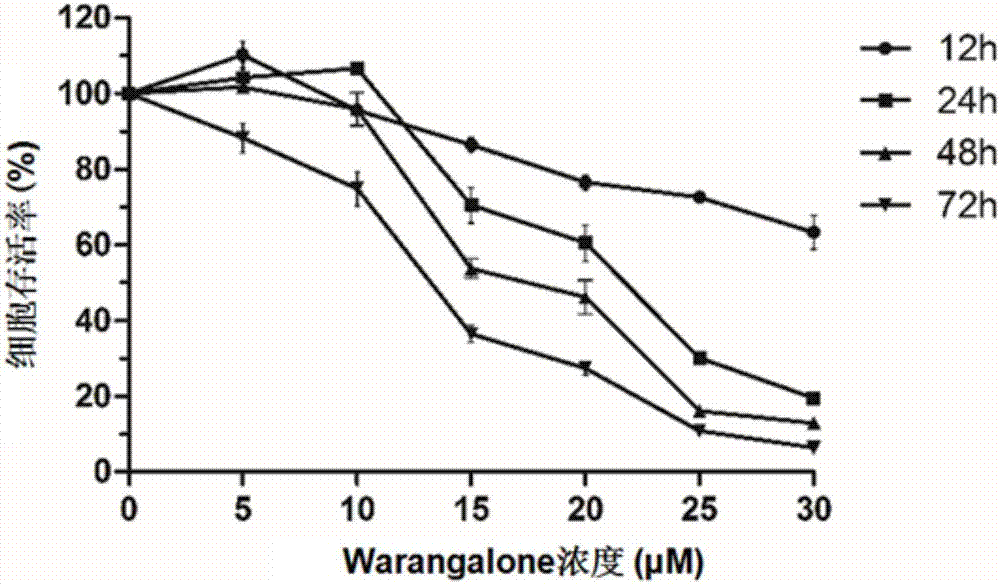
图1为攀登鱼藤异黄酮(warangalone)呈时间和剂量依赖性的抑制hela细胞的生长。
图2为warangalone处理24h和48h后hela细胞的细胞形态改变(200×)。
图3为hoechst33342染色观察warangalone对hela细胞核形态的影响(200×)。
图4为warangalone对hela细胞侵袭和迁移的抑制作用。
图5为warangalone对hela细胞划痕实验结果。
图6为流式细胞术检测warangalone对hela细胞周期分布的影响。
图7为annexinv-fitc/pi双染检测warangalone诱导hela细胞凋亡的作用。
图8为流式细胞术检测不同浓度warangalone处理hela细胞24h和48h后,对细胞线粒体膜电位的影响。
图9为warangalone对hela细胞ros影响。
图10为westernblot法检测warangalone对bcl-2家族蛋白表达和胞浆细胞色素c的影响。
图11为warangalone诱导hela细胞内caspases-3,caspase-8和caspase-9的活化。
图12为不同浓度warangalone处理hela细胞48h后,westernbolting检测细胞caspases-3,caspase-8,caspase-9和parp的表达水平。
图13为warangalone对宫颈癌细胞内凋亡相关蛋白的影响。mapk信号通路中erk,akt去磷酸化和p38,jnk磷酸化的影响(a-c);p53的磷酸化(d)。
具体实施方式
以下结合具体实施例和附图进一步说明本发明,其实施例在附图中图示并在后面加以说明,给出了部分详细的实施方式和具体的操作过程。除非特别说明,本发明采用的试剂、方法和设备为本技术领域常规试剂、方法和设备。
实施例1warangalone体外抗肿瘤活性
细胞的半抑制浓度(ic50)是用于评估药物抑制肿瘤增殖能力的常用方法之一。本发明选用了不同组织来源的人正常细胞和肿瘤细胞共8种细胞检测warangalone的抗肿瘤能力,采用mtt法测定warangalone对细胞增殖的影响,药物作用时间为72h,结果如表1所示:hela为人宫颈癌细胞,hepg2为人肝癌细胞,m321和mcf-7为人乳腺癌细胞,lo2人正常肝细胞,chem-5为正常脑胶质细胞。经warangalone处理后的肿瘤细胞的生长都受到不同程度的抑制,通过分析可以看出warangalone对宫颈癌、乳腺癌、肝癌子几种不同肿瘤细胞的ic50范围在13.3-29.6μμ之间,显著低于正常肝细胞lo2(ic50=69.5+5.63μμ)和脑胶质细胞chem-5(76.9+5.64μμ)。其中hela的ic50值最小,为13.3+1.36μμ。结果表明warangalone选择性的抑制肿瘤细胞,并且是选择性的抑制人宫颈癌细胞。
表1warangalone对不同组织肿来源瘤细胞和正常细胞的增殖的抑制作用
实施例2warangalone对hela细胞增殖抑制作用时效
采用mtt法分别评估不同浓度warangalone(0、5、10、15、20、25、30μm)对hela细胞作用12h,24h,48h和72h后细胞生长情况。结果如图1所示,warangalone对hela细胞的生长抑制作用呈剂量依赖性,作用12h,24h,48h和72h对hela细胞增殖抑制作用的ic50值分别为37.82±0.42μm、20.97±0.55μm、17.38±0.44μm、13.31±0.26μm,而warangalone对hela细胞作用48h对细胞引起的凋亡现象比较为明显。
实施例3warangalone对hela细胞形态的改变
将对数期的hela铺于6孔板内,细胞贴壁后加入不同浓度的药物分别作用24h和48h后,倒置显微镜下观察细胞的形态并拍照。如图2所示,与空白对照组细胞相比较,随着warangalone药物浓度的增加,hela的细胞除了数量随浓度的增加而减少外,形状也随浓度的增加而发生了明显变化。低浓度10μm细胞的形状变化并不明显只是细胞数量有所减少;20μm时大多数细胞形态发生变化,由菱形逐渐变成梭形和圆形,贴壁能力下降;30μm时,细胞大多呈圆形,透光度增加,逐渐从壁上脱落。结果表明warangalone显著性的抑制细胞的增殖,并改变细胞形态,且呈时间剂量依赖性。
实施例4warangalone对hela细胞核形态的影响
由于凋亡的细胞膜的通透性增加,故相比正常的细胞hoechst3342更容易进入。其次凋亡细胞染色结构发生变化dna与染料的结合能力较正常细胞要强更易被hoechst3342染色,因此凋亡的细胞被hoechst3342染色后细胞核呈现亮蓝色。检测结果如图3所示,不同浓度的warangalone作用于hela细胞24h后对其进行hoechst3342染色,用荧光显微镜观察hela细胞核形态的变化,结果显示随着药物浓度的增加可观察到细胞数量逐渐减少,细胞核碎裂、核解体及染色质固缩的现象越加明显,并呈剂量依赖性。
实施例5warangalone对hela细胞侵袭和迁移能力的抑制作用
恶性肿瘤细胞的侵袭和迁移能力比正常细胞要更强是其重要的特征之一,高转移的肿瘤细胞具有更强的细胞运动能力。因此寻找能够抑制肿瘤细胞侵袭和迁移能力的药物对肿瘤的治疗具有重要的意义。为了探究warangalone对hela细胞侵袭和迁移能力是否有抑制作用,我们通过细胞划痕实验和transwell实验来评估warangalone对hela细胞迁移能力和侵袭能力的影响。为了排除不是因为药物作用使得细胞致死而导致迁移和侵袭能力下降,本实验将warangalone作用浓度调为1μm、2μm、4μm,以1μm的顺铂作为阳性对照,药物处理时间为24h。warangalone对hela细胞对细胞侵袭能力的影响如图4-a所示,随着药物作用浓度增加,从transwell小室上面穿到下室的细胞数量逐渐减少,并呈剂量依赖性;1μm、2μm、4μm和阳性对照组处理后细胞侵袭抑制率分别为88.33%,49.48%,35.59%,86.76%如图4-b所示。
划痕实验结果如图5所示与空白相比随着药物作用浓度的增加细胞向划痕区域迁移的能力逐渐减弱,在药物作用浓度为2μm和4μm时对细胞的迁移的抑制作用与对照组相比具有显著性差异,且药物作用浓度为1μm时对细胞迁移的抑制作用与阳性对照组顺铂(1μm)相当;结果表明warangalone可显著抑制hela细胞的侵袭和迁移。
实施例6warangalone对hela细胞周期的影响
哺乳动物的细胞周期可分为:g0/g1期(dna合成前期)、s期(dna合成期)、g2/m期(dna合成后期和分裂期)。而研究发现许多抗肿瘤药物是通过周期阻滞来抑制肿瘤细胞的生长,为了验证warangalone对hela细胞的抑制作用是否也与细胞周期的阻滞有关。我们采用了流式细胞术检测warangalone对hela细胞周期的影响。本实验检测了不同药物浓度(10μm、20μm、30μm)处理hela细胞48h后,对其周期分布的影响。结果如图6-a所示,与对照组相比,随着药物浓度的增加,凋亡峰sub-g1也急剧增加,低浓度组为17.23%,中浓度组为36.32%,高浓度组为58.18%,统计学分析发现与对照组相比,均具有统计学意义(p<0.05)见图6-b。而warangalone对g0/g1和g2/m影响不大,无统计学意义。综上结果表明,warangalone对宫颈癌细胞的抑制作用主要通过细胞凋亡途径而并非细胞周期阻滞作用。
实施例7流式细胞术分析warangalone对hela细胞凋亡的影响
荧光素fitc标记annexinv与pi联用是常用于区分早凋与晚凋的凋亡检测方法。本实验通过流式细胞术检测了不同浓度warangalone(10μm、20μm、30μm)处理hela细胞48h后对细胞凋亡的影响。检测结果如图7-a,与对照组相比较10μm,20μm和30μm的warangalone处理hela细胞48h后,凋亡率分别为6.63%,22.2%,31.5%。统计分析发现如图7-b所示,中浓度和高浓度组与对照组相比具有显著性差异。结果表明warangalone能够诱导hela细胞凋亡,并且随着浓度的增加呈剂量依赖性。
实施例8warangalone诱导hela细胞线粒体膜电位下降
细胞发生凋亡时往往伴随着线粒体膜电位的下降,在凋亡刺激下,线粒体膜电位的耗散容易激活线粒体凋亡途径发起凋亡级联反应。而jc-1染色是检测线粒体膜电位变化的常用方法。因此本实验通过jc-1染色流式细胞术检测了不同浓度warangalone(10μm、20μm、30μm)作用于hela细胞24h和48h后对hela细胞线粒体膜电位的变化的影响。实验结果如图8所示,药物作用24h时对照组,低剂量组10μm,中剂量组20μm,高剂量组30μm对应的绿色荧光所占比例分别为0.50%,2.31%,12.99%,48.72%。药物作用48h对应的绿色荧光所占比例分别为0.96%,3.80%,25.17%,79.71%。同对照组相比,随着warangalone浓度的增加,绿色荧光所占的比例也逐渐增加,即线粒体膜电位的耗散增加。并且药物处理48h对线粒体膜电位的耗散比24h药明显,说明呈一定的时间依赖性。结果表明warangalone处理细胞后破坏了线粒体的膜电位,并且呈剂量时间依赖性的降低了hela细胞的线粒体膜电位,由此说明warangalone诱导hela细胞凋亡的过程线粒体也参与到其中。
实施例9warangalone促进hela细胞内ros的产生
活性氧(ros)在细胞代谢过程中起着非常重要的作用,是许多疾病发生的原因之一。活性氧是体内有氧代谢的产物,主要包括o2-、no、h2o2等。研究表明ros的上调是黄酮类化合物诱导肿瘤细胞凋亡的原因之一,ros可以作为信号分子介导细胞凋亡是多种凋亡途径的共同介质。为了探究warangalone是否能够引起细胞内的ros水平的变化来介导细胞凋亡,我们采用dcfh-da荧光探针来检测hela细胞中ros的水平。结果如图9所示用不同浓度的warangalone处理hela细胞,选用5个时间点检测,与对照组相比ros含量上升,处理组0到60min时ros水平逐渐上升,之后则逐渐趋于平缓。当ros含量最大时,即60min时间点不同剂量warangalone处理hela细胞后,ros水平随药物作用浓度增加而升高。结果表明warangalone作用于hela细胞后,会显著提高细胞内ros水平。而过多的ros积聚会引起细胞损伤,如蛋白质的过氧化,体内酶的失活,dna的氧化损伤甚至导致细胞的凋亡。
实施例10warangalone通过调节bcl-2家族蛋白诱导hela细胞凋亡
根据jc-1线粒体膜电位的检测结果发现warangalone处理hela细胞后线粒体膜电位随warangalone的浓度呈剂量依赖性地降低,因此推测warangalone主要通过线粒体途径来诱导hela细胞凋亡。而bcl-2家族在细胞凋亡的线粒体途径调控中担任着非常重要的角色,粒体膜电位的改变受bcl-2家族蛋白的表达的调控。bcl-2家族蛋白包括两类:一类是促凋亡蛋白,如bad、bax、bid等另一类是抗凋亡蛋白,如bcl-2、bcl-xl等。bcl-2家族蛋白中的抗凋亡蛋白作用和促凋亡蛋白作用能够互相制衡,一旦平衡破坏细胞将会通过线粒体介导的信号通路来启动细胞凋亡。为了进一步阐明warangalone诱导细胞凋亡的机制,我们通过westernbloting检测warangalone作用48h后,bcl-2家族各蛋白表达情况结果表明warangalone作用细胞后,促凋亡蛋白bad、bax的表达上调;抗凋亡蛋白bcl-2、bcl-xl的表达也下调,如图10-a所示。同时我们也检测细胞色素c的释放,结果发现胞质中色素c的释放量呈剂量依赖性增加,如图10-b所示。以上结果表明warangalone通过调控bcl-2家族蛋白的表达来激活线粒体损伤,促进凋亡因子细胞色素c的释放,进而诱导hela细胞的凋亡。
实施例11warangalone通过激活caspase家族蛋白表达诱导hela细胞凋亡
半胱氨酸天冬氨酸蛋白酶(cysteine-asparticproteases,caspases)是一类存在于细胞质中蛋白酶。多数情况下,细胞调亡的最终执行都要依赖caspases级联反应的激活。caspase-8和caspase-9是细胞凋亡的起始者,他们分别介导死亡受体细胞凋亡信号通路和线粒体凋亡信号通路,而caspase-3是caspase家族蛋白中细胞凋亡最终执行者。为了验证warangalone是否激活了caspase-3,caspase-8和caspase-9,我们采用荧光法检测其活性,不同浓度的warangalone处理hela细胞warangalone后,caspase的活化情况如图11所示,结果显示caspase-3,caspase-8和caspase-9的活性与warangalone浓度呈剂量依赖性。浓度为10μμ的warangalone处理细胞后caspase-3,caspase-8,caspase-9活性无显著变化,当处理浓度为20μμ和30μμ时caspase-3和caspase-9的活性程度与对照组相比显著提高,但caspase-8只有在30μμ有显著性提高。进一步表明了warangalone主要是通过线粒体介导的内源途径来诱导hela细胞凋亡。
parp全称聚腺苷酸二磷酸核糖转移酶,是一种dna蛋白修复酶,是细胞凋亡核心成员caspase-3最主要的切割底物,在凋亡过程中发挥着重要的作用。warangalone处细胞hela细胞48h后,药物处理组出现明显的parp切割条带(89kda),并且随着warangalone浓度的增加parp的切割程度也逐渐增多,如图12-a所示。结果表明warangalone诱导了细胞内parp进行切割,进而促使细胞凋亡。为了进一步佐证warangalone主要通过线粒体途径来诱导细胞凋亡,我们进一步通过westernbloting检测了caspase-3,caspase-8和caspase-9的表达量,结果显示caspase-3和caspase-9的表达量呈下降趋势,而caspase-8变化无显著性差异;image统计分析,以β-actin蛋白表达灰度值为标准,计算出caspase-3蛋白表达与对照组的相对量如图12-b所示。随着warangalone浓度增加呈剂量依赖性地降低了caspase-3,caspase-9的表达量,又因加药后caspase-8的表达量无显著性变化,说明warangalone主要是通过线粒体介导的内源凋亡信号通路来诱导细胞凋亡。
实施例12warangalone诱导hela细胞p53的磷酸化,激活了mapk信号通路
细胞凋亡信号通路主要有死亡受体介导的外源凋亡途径线粒体介导的内源凋亡途径,但无论哪一种凋亡途径都受到p53的调控,其活化与dna的氧化损伤密切相关。由前面westernbloting实验结果发现bcl-2家族蛋白在warangalone作用后发生改变,而bcl-2家族蛋白的表达受p53的调控。又根据前面ros水平检测的实验中我们发现warangalone作用于hela细胞后能够引起ros产生。研究表明ros的产生,能够激活p53蛋白的磷酸化,而p53的激活能够进一步激活下游的信号通路蛋白,包括线粒体家族蛋白以及死亡受体家族等。akt和erk已确认在细胞凋亡和药物抵抗中起着重要的作用,erk能够调控细胞的增殖分化和转移等,通过激活抗凋亡蛋白和抑制caspase的激活来抑制细胞凋亡的发生,与erk相似akt通过抑制促凋亡蛋白如p53,bad等的表达来促进细胞凋亡。与erk和akt相反,mapk家族蛋白在外界刺激作用下,通过促进jnk,p38的磷酸化来促进细胞凋亡。
因此我们通过westernbloting检测了p53,以及p53介导的mapk和akt信号通路相关蛋白的激活情况。结果如图13所示,不同浓度warangalone处理hela细胞呈剂量依赖性上抑制了erk的磷酸化水平,同时能够促进p38和p53的磷酸化,而总的erk和p38的表达量基本不变,但对akt和jnk的表达量无显著影响。结果表明warangalone可能通过激活p53介导的mapk信号通路来诱导宫颈癌细胞hela细胞凋亡。
- 还没有人留言评论。精彩留言会获得点赞!